2021-2022学年上学期高一化学人教版(2019)必修第一册第四章《物质结构元素周期律》测试题(word版 含解析)
文档属性
| 名称 | 2021-2022学年上学期高一化学人教版(2019)必修第一册第四章《物质结构元素周期律》测试题(word版 含解析) |  | |
| 格式 | docx | ||
| 文件大小 | 558.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-06-29 22:51:38 | ||
图片预览



文档简介
第四章《物质结构元素周期律》测试题
一、单选题(共12题)
1.X、Y均为短周期元素,且X为第ⅠA族元素,Y为第ⅥA族元素,下列说法正确的是
A.X的原子半径一定大于Y的原子半径
B.由X、Y形成的共价化合物中所有原子都满足最外层为8电子结构
C.X2Y既可能是离子化合物,也可能是共价化合物
D.由X、Y组成的化合物中,X、Y的原子个数比不可能是1∶1
2.W、X、Y、Z是周期表中前20号的主族元素,原子序数依次增大。W、X、Y的原子最外层电子数之和为13,X与Z同主族,实验室可用Z的最高价氧化物的水化物稀溶液检验W的最高价氧化物。下列说法正确的是
A.失去电子能力:X>Z>W
B.原子半径:Z>Y>X
C.W、X、Y、Z的最高正化合价依次为+4、+2、+7、+2
D.W与Y形成的化合物含有极性键,不含有非极性键
3.下列比较不正确的是
A.酸性:H2SO4>H3PO4 B.碱性:KOH>NaOH
C.稳定性:NH3>CH4 D.离子半径:Na+>Cl-
4.如图是部分短周期元素的原子序数与其某种常见化合价的关系图,若用原子序数代表所对应的元素,则下列说法正确的是
A.31d和33d属于同种核素
B.气态氢化物的稳定性:a>d>e
C.b和c的最高价氧化物对应的水化物可以反应
D.a和b只能形成一种化合物
5.下列每组两种物质中,都既含离子键又含共价键的是( )
A.SiO2和CO2 B.NaOH和CH4 C.Na2O2和NH4Cl D.NaCl和HCl
6.元素周期律为人类推测元素性质提供了依据。根据周期律推测下列结论正确的是
A.原子半径大小: B.酸性强弱:
C.碱性强弱: D.金属性:
7.下列说法不正确的是( )
A.化学变化中,原子的原子核不发生变化,核外电子可能会发生变化
B.同一主族中,相邻周期元素原子的核电荷数相差8、18或者32
C.目前第七周期元素已经排满,该周期一共有32种元素
D.同主族元素,从上往下非金属性减弱,相应最高价含氧酸的酸性减弱
8.下列有关II A族元素的叙述错误的是( )
A.在医疗中常用作钡餐
B.钙单质燃烧时其焰色呈砖红色
C.随着原子序数的递增,元素原子失电子能力增强
D.由难溶于水,可推断也难溶于水
9.超重水()是生化实验的重要原料,下列说法不正确的是
A.与互为同位素 B.、、是不同的核素
C.氚()原子核外有1个电子 D.与的相对分子质量相同
10.NaH2PO2可用于化学镀镍,常通过反应“P4+3NaOH+3H2O==3NaH2PO2+PH3↑”制得,产物PH3中P的化合价为-3。下列说法正确的是
A.P4分子中含有的共价键是极性键
B.31g P4中所含P-P键的物质的量为6 mol
C.反应中还原剂和氧化剂的物质的量之比为1∶3
D.反应生成2.24 L PH3(标准状况),转移电子数目为0.3×6.02×1023
11.有关化学键和晶体的说法正确的是
A.干冰是共价分子,其升华破坏了共价键
B.氯化铵属于离子化合物,其加热仅破坏了共价键
C.汞是金属晶体,其气化破坏了共价键
D.二氧化硅属于共价化合物,其熔化破坏了共价键
12.NA为阿伏伽德罗常数,以下说法正确的是
A.18gT2O中含有的质子数为10NA
B.0.5mol/LBa(OH)2溶液中含有的OH-的数目为NA
C.25℃,101kPa,3.4克硫化氢中含有原子总数为0.3NA
D.常温常压下,20mLNH3和60mLO2所含分子个数比不等于1∶3
二、非选择题(共10题)
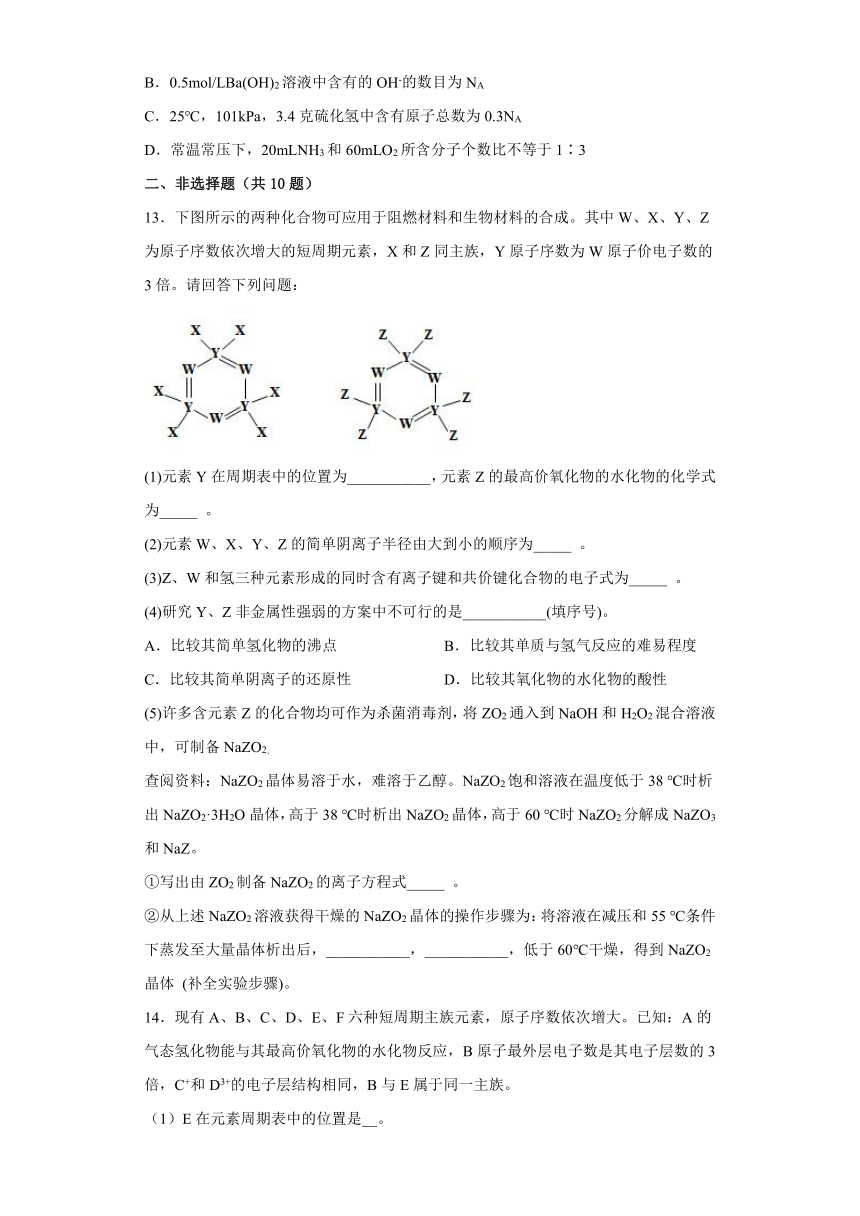
13.下图所示的两种化合物可应用于阻燃材料和生物材料的合成。其中W、X、Y、Z为原子序数依次增大的短周期元素,X和Z同主族,Y原子序数为W原子价电子数的3倍。请回答下列问题:
(1)元素Y在周期表中的位置为___________,元素Z的最高价氧化物的水化物的化学式为_____ 。
(2)元素W、X、Y、Z的简单阴离子半径由大到小的顺序为_____ 。
(3)Z、W和氢三种元素形成的同时含有离子键和共价键化合物的电子式为_____ 。
(4)研究Y、Z非金属性强弱的方案中不可行的是___________(填序号)。
A.比较其简单氢化物的沸点 B.比较其单质与氢气反应的难易程度
C.比较其简单阴离子的还原性 D.比较其氧化物的水化物的酸性
(5)许多含元素Z的化合物均可作为杀菌消毒剂,将ZO2通入到NaOH和H2O2混合溶液中,可制备NaZO2。
查阅资料:NaZO2晶体易溶于水,难溶于乙醇。NaZO2饱和溶液在温度低于38 ℃时析出NaZO2·3H2O晶体,高于38 ℃时析出NaZO2晶体,高于60 ℃时NaZO2分解成NaZO3和NaZ。
①写出由ZO2制备NaZO2的离子方程式_____ 。
②从上述NaZO2溶液获得干燥的NaZO2晶体的操作步骤为:将溶液在减压和55 ℃条件下蒸发至大量晶体析出后,___________,___________,低于60℃干燥,得到NaZO2晶体 (补全实验步骤)。
14.现有A、B、C、D、E、F六种短周期主族元素,原子序数依次增大。已知:A的气态氢化物能与其最高价氧化物的水化物反应,B原子最外层电子数是其电子层数的3倍,C+和D3+的电子层结构相同,B与E属于同一主族。
(1)E在元素周期表中的位置是__。
(2)上述元素形成的简单离子中,半径最小的是__(填离子符号)。
(3)下列事实能说明C元素的金属性比D元素的金属性强的是__。
a.C单质常温能与水反应,D单质不能与水反应
b.在氧化还原反应中,1molD单质比1molC得电子多
c.C和D两元素的最高价氧化物的水化物,前者的碱性更强
(4)写出由B和C形成的化合物C2B2的电子式为__。
(5)工业上用电解法制备D的单质,反应的化学方程式为__。
(6)写出实验室制备F单质的离子方程式__。
15.A、B、C、D、E是核电荷数依次增大的五种短周期主族元素。A元素的原子核内只有1个质子;B元素的原子半径是其所在主族中最小的,B的最高价氧化物对应的水化物的化学式为HBO3;C元素原子的最外层电子数比次外层电子数多4;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C;C、E元素同主族。
(1)B在元素周期表中的位置是_______。
(2)由A、B、C三种元素形成的离子化合物溶于水的电离方程式为_______。
(3)C、D、E形成的简单离子的半径大小关系是_______(用离子符号表示)。
(4)用电子式表示化合物D2E的形成过程:_______,化合物D2C2的电子式_______。
(5)化合物D2C2与A2C反应的化学方程式_______。
16.近年来,科学家通过粒子加速器进行了一周的实验,获得了6个非常罕见的Fe原子,接着,科学家又使用特制的测量仪器观测到,这6个原子中有4个发生了衰变,这一实验证实了曾经预言的双质子衰变方式,即有一个原子同时放出两个质子的衰变方式。回答下列问题:
(1)Fe原子的核内中子数为___________,该原子的核外电子数为___________。
(2)以下关于Fe的叙述正确的是___________(填序号)。
A.Fe与Fe是两种核素
B.科学家获得了一种新元素
C.Fe的衰变不是化学变化
D.这种铁原子衰变放出两个质子后变成Fe
(3)某同学认为Fe在一定条件下也可与氧气反应,他的判断依据是___________。
17.根据下列微粒回答问题:1H、2H、3H、14C、14N、16O、35Cl2、37Cl2
(1)以上8种微粒共有___________种核素,共___________种元素。
(2)互为同位素的是___________(填8种微粒中合理的微粒)。
(3)质量数相等的是___________,中子数相等的是___________。(填8种微粒中合理的微粒)。
(4)相同物质的量的14CO2与S18O2的质量之比为___________;质子数之比为___________。
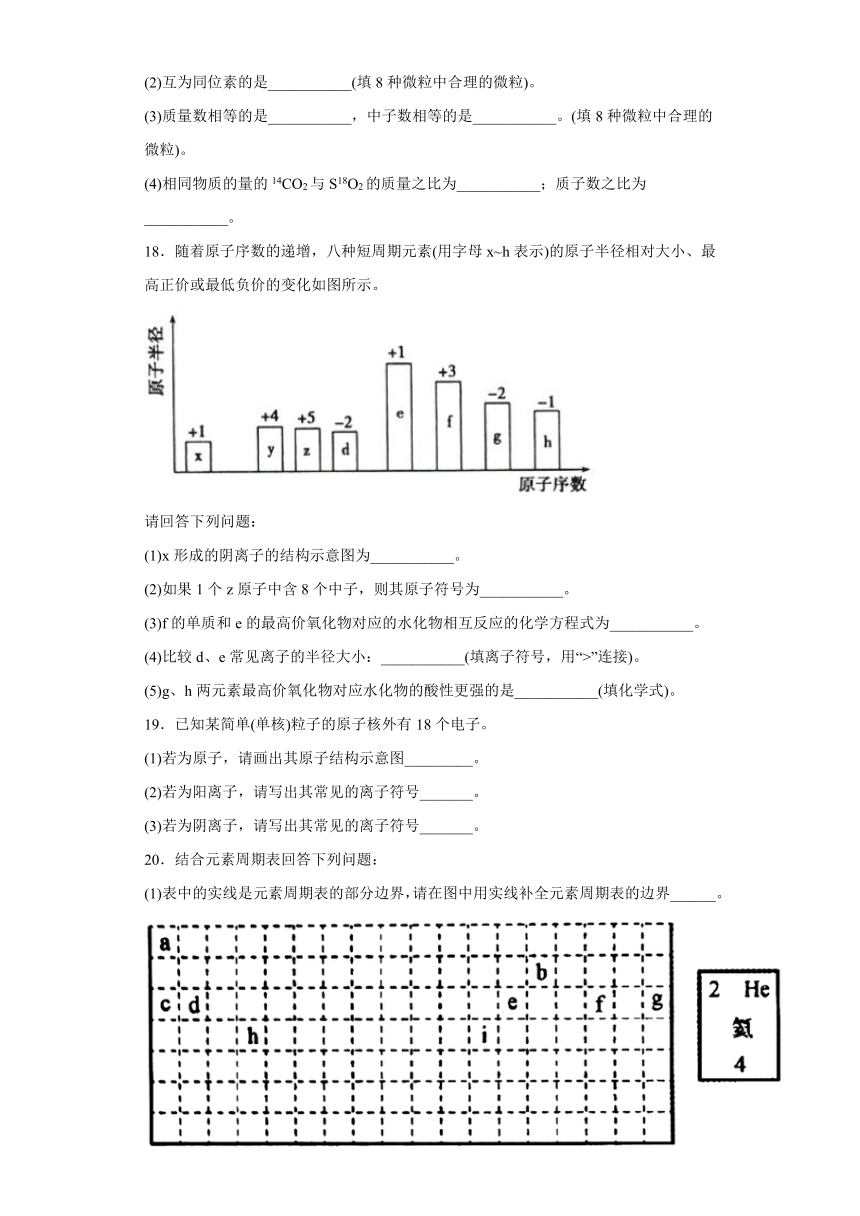
18.随着原子序数的递增,八种短周期元素(用字母x~h表示)的原子半径相对大小、最高正价或最低负价的变化如图所示。
请回答下列问题:
(1)x形成的阴离子的结构示意图为___________。
(2)如果1个z原子中含8个中子,则其原子符号为___________。
(3)f的单质和e的最高价氧化物对应的水化物相互反应的化学方程式为___________。
(4)比较d、e常见离子的半径大小:___________(填离子符号,用“>”连接)。
(5)g、h两元素最高价氧化物对应水化物的酸性更强的是___________(填化学式)。
19.已知某简单(单核)粒子的原子核外有18个电子。
(1)若为原子,请画出其原子结构示意图_________。
(2)若为阳离子,请写出其常见的离子符号_______。
(3)若为阴离子,请写出其常见的离子符号_______。
20.结合元素周期表回答下列问题:
(1)表中的实线是元素周期表的部分边界,请在图中用实线补全元素周期表的边界______。
(2)表中所列元素,属于短周期元素的有______,属于主族元素的有______;g元素位于第______周期______族;i元素位于第______周期______族。
(3)元素f是第______周期______族元素,请在下边方框中按氦元素的式样写出该元素的原子序数、元素符号、元素名称、相对原子质量______。
21.用表示原子:
(1)中性原子的中子数N=___________。
(2)共有x个电子,则该阳离子的中子数N=___________。
(3)共有x个电子,则该阴离子的中子数N=___________。
22.将氧化镁、氧化铝的混合物完全溶于200mL盐酸,而后逐滴加入1.0mol·L-1NaOH溶液。溶液中生成沉淀的物质的量随加入NaOH溶液体积的变化如图所示。
(1)最初加入20mLNaOH溶液所发生反应的离子方程式为_______。
(2)写出加入520mL-620mLNaOH溶液所发生反应的化学方程式为_______。
(3)混合物中氧化镁、氧化铝的物质的量之比为_______。
(4)所用盐酸的物质的量浓度为_______。
试卷第1页,共6页
参考答案:
1.C
【解析】
X、Y为短周期元素,X为第ⅠA族元素,Y为ⅥA族元素,则X可能为H、Li、Na三种元素,Y可能为O、S两种元素,据此分析判断。
X、Y为短周期元素,X为第ⅠA族元素,Y为ⅥA族元素,则X可能为H、Li、Na三种元素,Y可能为O、S两种元素。
A.当X为H,Y为O、S时,X的原子半径小于Y的原子半径,故A错误;
B.当X为H时,由X、Y形成的共价化合物中所有原子不可能都满足最外层为8电子结构,H原子满足最外层2个电子的稳定结构,故B错误;
C.化学式为X2Y的有H2O或Na2O或Li2O,可能是离子化合物,也可能是共价化合物,故C正确;
D.X、Y两元素形成的化合物中,原子个数为1∶1的有H2O2或Na2O2,故D错误;
故选C。
2.C
【解析】
实验室可用Z的最高价氧化物的水化物稀溶液检验W的最高价氧化物,则Z是Ca,W是C;X与Z同主族,则X是Mg,W、X、Y的原子最外层电子数之和为13,则Y的最外层电子数为7,因此Y是Cl。
A. 同一主族,电子层数越大,失电子能力越强,因此失电子能力Z>X,A错误;
B. 电子层数越大,半径越大,电子层数相同时,核电荷数越大,半径越小,因此原子半径Z>X>Y,B错误;
C. 最高正价等于最外层电子数,W、X、Y、Z的最高正化合价依次为+4、+2、+7、+2,C正确;
D. W与Y能形成化合物CCl4,只含有极性键,W与Y还可以形成化合物CCl3CCl3,既含有极性键也含有非极性键,D错误;
答案选C。
3.D
【解析】
A.非金属性S>P,则最高价含氧酸的酸性:H2SO4>H3PO4,A正确;
B.金属性K>Na,则最高价氧化物水化物的碱性:KOH>NaOH,B正确;
C.非金属性N>C,则简单氢化物的稳定性:NH3>CH4,C正确;
D.核外电子层数越多,离子半径越大,则离子半径:Na+<Cl-,D错误;
答案选D。
4.C
【解析】
短周期元素中,a为-2价、e为+6价,处于VI族,可推知a为O、e为S,b有+1价,原子序数大于氧,则b为Na,由原子序数可知c、d处于第三周期,化合价分别为+3、+5,则c为Al、d为P,据此分析解答。
A.31d和33d质子数相同,中子数不同,是不同的核素,故A错误;
B.非金属性a(O)>e(S)>d(P),故氢化物稳定性:a>e>d,故B错误;
C.b和c的最高价氧化物对应的水化物分别为NaOH和Al(OH)3,故C正确;
D.a和b可形成Na2O和Na2O2,故D错误;
故选C。
5.C
【解析】
A.SiO2为共价化合物,只含有共价键,CO2为共价化合物,只含有共价键,故A不符合题意;
B.NaOH为离子化合物,其中Na+与OH-之间通过离子键连接,OH-中O原子与H原子之间通过共价键连接,NaOH中含有离子键、共价键,CH4为共价化合物,只含有共价键,故B不符合题意;
C.Na2O2为离子化合物,其中Na+与之间通过离子键连接,中O原子通过共价键连接,Na2O2中含有离子键、共价键,NH4Cl为离子化合物,其中与Cl-通过离子键连接,中N原子与H原子之间通过共价键连接,NH4Cl中含有离子键、共价键,故C符合题意;
D.NaCl为离子化合物,其中只含有离子键,HCl为共价化合物,其中只含有共价键,故D不符合题意;
综上所述,两种物质中,都既含离子键又含共价键的是C,故答案为:C。
6.C
【解析】
A.同周期自左向右逐渐减小,则原子半径大小:,A错误;
B.非金属性越强,最高价含氧酸的酸性越强,则酸性强弱:,B错误;
C.同主族从上到下金属性逐渐增强,最高价氧化物的水化物的碱性越强,碱性强弱:,C正确;
D.同主族从上到下金属性逐渐增强,金属性:,D错误;
答案选C。
7.B
【解析】
A.原子是化学变化中的最小粒子,化学反应时,原子核一定不发生变化,核外电子可能会转移,A正确;
B.同一主族中,相邻周期元素原子的核电荷数相差2、8、18或者32,B错误;
C.目前第七周期元素已经排满,该周期一共有32种元素,C正确;
D.同主族元素,从上往下非金属性减弱,所以,相应最高价含氧酸的酸性减弱,D正确。
答案选B。
8.A
【解析】
A.在医疗中常用作钡餐,A项错误。
B.钙单质或含钙元素的化合物在灼烧时焰色为砖红色,B项正确。
C.主族元素的原子最外层电子数相同时,电子层数越多,最外层电子离核越远,越容易失去电子,C项正确。
D.由、、均难溶于水,可推断也难溶于水,D项正确。
故选A。
9.A
【解析】
A.质子数相同的核素互为同位素,而与均为单质,A错误;
B.、、质子数相同,但中子数不同,故三者为不同的核素,B正确;
C.原子的核外电子数等于质子数,氚()质子数为1,故其核外有1个电子,C正确;
D.与的相对分子质量均为20,D正确;
故选A。
10.D
【解析】
A. P4分子中存在P P键,为非极性键,A项错误;
B. 1个P4分子含有6个P P键,则31g即0.25mol P4,所含P P键的物质的量为1.5 mol,B项错误;
C. 反应生成NaH2PO2,P的元素化合价从0价变为+1价,生成PH3,P元素化合价由0价降低为 3价,可知NaH2PO2为氧化产物,PH3为还原产物,则反应中还原剂和氧化剂的物质的量之比为3:1,C项错误;
D. 生成PH3,P元素化合价由0价降低为 3价,则反应生成2.24 L PH3(标准状况),即0.1mol,转移电子数目为0.3×6.02×1023,D项正确;
答案选D。
11.D
【解析】
A.干冰是固态的二氧化碳,由二氧化碳分子构成,属于分子晶体,升华时破坏分子间作用力,A错误;
B.氯化铵固体是由氯离子和铵根离子通过离子键结合而成的离子晶体,加热氯化铵破坏了氯离子和铵根离子之间的离子键,同时加热氯化铵分解为氨气和HCl,破坏了H和N之间的共价键,B错误;
C.汞是常温下呈液态的金属,是由金属离子和自由电子通过金属键结合而成的金属晶体,其气化破坏了金属键,C错误;
D.二氧化硅只含有共价键,属于共价化合物,固体熔化时,破坏共价键,D正确;
答案选:D。
12.C
【解析】
A.18gT2O的物质的量为=mol,每个T2O分子含有10个质子,所以共含NA个质子,A错误;
B.溶液体积未知,无法确定所含离子数目,B错误;
C.3.4克硫化氢的物质的量为=0.1mol,每个H2S含有3个原子,所以原子总数为0.3NA,C正确;
D.同温同压下,气体的体积比等于物质的量之比,所以20mLNH3和60mLO2所含分子个数比等于1∶3,D错误;
综上所述答案为C。
13.(1) 第三周期 ⅤA族 HClO4
(2)P3->Cl->N3->F-
(3)
(4)AD
(5) 2ClO2 + H2O2 + 2OH- = 2ClO+ O2 + 2H2O 趁热过滤(或高于38℃过滤) 乙醇洗涤
【解析】
由题干信息可知,W、X、Y、Z为原子序数依次增大的短周期元素,X和Z同主族,结合结构式可知,X和Z应分别为F和Cl元素,Y的最高价为+5价,其原子序数为W原子价电子数的3倍,可知Y为P元素,W为N元素,据此分析解题。
(1)
由分析可知,元素Y为P元素,故在周期表中的位置为第三周期ⅤA族,元素Z为Cl,故其最高价氧化物的水化物的化学式为HClO4,故答案为:第三周期ⅤA族;HClO4;
(2)
微粒半径大小比较一般为:电子层数越多,半径越大,电子层数相同时,核电荷数越大,半径越小,故元素W、X、Y、Z的简单阴离子半径由大到小的顺序为P3->Cl->N3->F-,故答案为:P3->Cl->N3->F-;
(3)
由分析可知,Z为Cl、W为N和氢三种元素形成的同时含有离子键和共价键化合物为NH4Cl,其电子式为,故答案为:;
(4)
A.非金属元素简单氢化物的沸点的高低与其非金属性强弱无关,A符合题意;
B.非金属单质与氢气反应的难易程度与其非金属性强弱一致,B不合题意;
C.非金属元素的非金属越强,其单质的氧化性越强,对应简单阴离子的还原性则越弱,故通过比较其简单阴离子的还原性可以推出其非金属性强弱,C不合题意;
D.非金属性强弱与其最高价氧化物的水化物的酸性一致,但是不是最高价氧化物对应水化物的酸性则不能比较其非金属性强弱,D符合题意;
故答案为AD;
(5)
①由分析可知,Z为Cl,将ZO2即ClO2通入到NaOH和H2O2混合溶液中,可制备NaZO2即NaClO2,故由ZO2制备NaZO2的离子方程式为2ClO2 + H2O2 + 2OH- = 2ClO+ O2 + 2H2O,故答案为:2ClO2 + H2O2 + 2OH- = 2ClO+ O2 + 2H2O;
②由题干资料:NaZO2晶体易溶于水,难溶于乙醇;NaZO2饱和溶液在温度低于38 ℃时析出NaZO2·3H2O晶体,高于38 ℃时析出NaZO2晶体,高于60 ℃时NaZO2分解成NaZO3和NaZ,故从上述NaZO2溶液获得干燥的NaZO2晶体的操作步骤为:将溶液在减压和55 ℃条件下蒸发至大量晶体析出后,趁热过滤(或高于38℃过滤),乙醇洗涤,低于60℃干燥,得到NaZO2晶体,故答案为:趁热过滤(或高于38℃过滤);乙醇洗涤。
14. 第三周期第ⅥA族 Al3+ ac 2Al2O3(熔融)4Al+3O2↑ MnO2+4H++2Cl-Mn2++Cl2+2H2O
【解析】
A、B、C、D、E、F六种短周期主族元素,原子序数依次增大,A的气态氢化物能与其最高价氧化物的水化物反应,则A是N元素;B原子最外层电子数是电子层数的3倍,B为O元素;B与E属于同一主族,则E是S元素,F为短周期主族元素且原子序数大于E,则F为Cl元素;C+和D3+离子的电子层结构相同,为第三周期元素,C、D分别为Na、Al元素;以此解答。
(1)E是S元素,S原子核外电子层数等于其周期数、最外层电子数等于其族序数,S原子核外有3个电子层、最外层电子数是6,所以S位于第三周期第VIA族,故答案为:第三周期第VIA族;
(2)上述元素形成的简单离子中,电子层数越少的原子半径越小,电子层结构相同的离子,离子半径随着原子序数增大而减小,这几种元素形成的离子半径大小顺序是S2 >Cl >N3 >O2 >Na+>Al3+,所以离子半径最小的是Al3+,故答案为:Al3+;
(3) Na的金属性比Al的金属性强,
a. Na单质常温能与水反应,Al单质不能与水反应,可以说明;
b. 在氧化还原反应中,得电子多少不能说明金属性强弱,错误;
c. Na和Al两元素的最高价氧化物的水化物,前者NaOH碱性更强,可以说明;
故选ac;
(4)B和C形成的化合物C2B2是Na2O2,电子式为:;
(5)工业上用电解法制备D的单质Al,反应的化学方程式为2Al2O3(熔融)4Al+3O2↑;
(6)写出实验室制备F单质Cl2的离子方程式为:MnO2+4H++2Cl-Mn2++Cl2+2H2O。
15. 第二周期 ⅤA族 NH4NO3=; O2->Na+>S2- 2Na2O2+2H2O=4NaOH+O2↑
【解析】
A、B、C、D、E是核电荷数依次增大的五种短周期主族元素。A元素的原子核内只有1个质子,A是H元素;B的最高价氧化物对应的水化物的化学式为HBO3,B的最高价是+5,B元素的原子半径是其所在主族中最小的,B是N元素;C元素原子的最外层电子数比次外层电子数多4,C是O元素;O2-与D的阳离子具有相同的电子排布,两元素可形成化合物D2C,D为+1价,D是Na元素;C、E元素同主族,E是S元素。
(1)B是N元素,在元素周期表中的位置是第二周期 ⅤA族。
(2)由H、N、O三种元素形成的离子化合物是NH4NO3,溶于水电离出铵根离子和硝酸根离子,电离方程式为NH4NO3=;
(3)电子层数相同,质子数越多半径越小,O2-、Na+、S2-半径大小关系是O2->Na+>S2-;
(4)Na2S是离子化合物,用电子式表示化合物Na2S的形成过程为, Na2O2是离子化合物,电子式为;
(5) Na2O2与H2O反应生成氢氧化钠和氧气,反应的化学方程式是 2Na2O2+2H2O=4NaOH+O2↑。
16.(1) 19 26
(2)AC
(3)Fe与Fe的核外电子数相同,化学性质几乎完全相同
【解析】
(1)
Fe的中子数=质量数-质子数=45-26=19,电子数=质子数=26。
(2)
Fe与Fe的质子数相同,属同一元素Fe元素,但中子数不同,是两种不同的核素,A正确;Fe元素不是一种新元素,B错误;Fe衰变后变为质子数为24的新原子,原子核发生了变化,不是化学变化,因为化学的范畴是在原子、分子水平上研究物质的,C正确;Fe衰变放出两个质子后变为Fe,D错误;故选AC。
(3)
Fe与Fe的核外电子数相同,化学性质几乎完全相同
17. 6 5 1H、2H、3H 14C、14N 14C、16O 23∶34 11∶16
【解析】
核素指的是原子;质子数和中子数只要其一不相同就属于不同核素;元素的种类由质子数决定,质子数不同,元素的种类就不同;质子数相同,而中子数不同的原子,互称为同位素;中子数=质量数-质子数。
(1)核素指的是原子,故共有6种核素;1H、2H、3H均属于氢元素,14C属于碳元素14N属于氮元素,16O属于氧元素,35Cl2、37Cl2都属于氯元素,一共有5种元素,故答案为:6;5;
(2)1H、2H、3H都属于氢元素,质子数相同,而中子数不同互为同位素,故答案为:1H、2H、3H;
(3)核素符号左上角的数字表示质量数,则质量数相等的是14C、14N;14C中中子数=14-6=8,16O 的中子数=16-8=8,所以二者中子数相同,故答案为:14C、14N ;14C、16O;
(4)相同物质的量的14CO2与S18O2的质量之比等于相对分子质量之比,相对原子质量近似等于质量数,则相同物质的量的14CO2与S18O2的质量之比为(14+16+16):(32+18+18)=23∶34;质子数之比为(6+8+8):(16+8+8)=11∶16;故答案为:23∶34;11∶16。
18. O2->Na+ HClO4
【解析】
根据图中的化合价和原子半径的大小,可以推出x是H,y是C,z是N,d是O,e是Na,f是Al,g是S,h是Cl。
(1)x是H,H形成的阴离子为H-,H的结构示意图为;
(2)z是N,N原子的质子数为7,如果1个N原子中含8个中子,则质量数为7+8=15,其原子符号为;
(3)f是Al,e是Na,Na的最高价氧化物对应的水化物为NaOH,Al与NaOH溶液反应生成偏铝酸钠和氢气,反应的化学方程式为;
(4)d是O,e是Na,d、e形成的简单离子分别为O2-、Na+,电子层结构相同的离子,核电荷数越大,离子半径越小,故r(O2-)>r(Na+);
(5)g是S,h是Cl,元素的非金属性越强,最高价氧化物对应的水化物的酸性越强,非金属性:Cl>S,则最高价氧化物对应的水化物的酸性:HClO4>H2SO4。
19. K+、Ca2+ Cl-、S2-
【解析】
原子核外有18个电子的简单(单核)粒子:
(1)原子的核外电子数=核电荷数=质子数=18;
(2)阳离子的核电荷数=阳离子核外电子数+阳离子电荷数=18+n(n=1,2),离子核电荷数可为19、20;
(3)阴离子的核电荷数=阴离子核外电子数-阴离子电荷数=18-n(n=1,2),离子的核电荷数可为17、16;
原子核外有18个电子的简单(单核)粒子:
(1)原子的核外电子数=核电荷数=质子数=18,为氩原子,其原子结构示意图,
故答案为:;
(2)阳离子的核电荷数=阳离子核外电子数+阳离子电荷数=18+n(n=1,2),离子核电荷数可为19、20,其离子符号为K+、Ca2+,
故答案为:K+、Ca2+;
(3)阴离子的核电荷数=阴离子核外电子数-阴离子电荷数=18-n(n=1,2),离子的核电荷数可为17、16,其离子符号为Cl-、S2-,
故答案为:Cl-、S2-
20. a、b、c、d、e、f、g a、b、c、d、e、f 三 0 四 ⅡB 三 ⅥA
【解析】
(1)根据元素周期表的结构可知,第一周期有2种元素,第二、三周期各有8种元素,分列于第1、2、13~18纵列,第四、五、六、七周期为长周期,包括1~18纵列,则周期表的边界为:,故答案为:;
(2)由各元素在周期表中的位置可知,a、b、c、d、e、f、g属于短周期元素;a、b、c、d、e、f属于主族元素;g元素位于元素周期表第三周期0族;i元素位于元素周期表第四周期ⅡB族,故答案为:a、b、c、d、e、f、g;a、b、c、d、e、f;三;0;四;ⅡB;
(3)元素f位于元素周期表第三周期ⅥA族,该元素为硫元素,原子序数为16、相对原子质量为32,按氦元素的式样可得如下方格:,故答案为:三;ⅥA ;。
21. A-Z A-x-n A-x+n
【解析】
(1)在表示原子组成时元素符号的左下角表示质子数,左上角表示质量数,又因为中子数+质子数=质量数,据此可知中性原子的中子数N=A-Z;
(2)中性原子的核外电子数=质子数,所以如果AXn+共有x个电子,则质子数=X+n,因此该阳离子的中子数N=A-x-n;
(3)同(2)分析可知,如果AXn-共有x个电子,则质子数=X-n,因此该阴离子的中子数N=A-x+n。
22. H++OH-=H2O Al(OH)3+NaOH=NaAlO2+2H2O 2∶1 2.6mol·L-1
【解析】
由图可知,从开始至加入NaOH溶液20mL,没有沉淀生成,说明原溶液中盐酸溶解Mg、Al后盐酸有剩余,此时发生的反应为:HCl+NaOH=NaCl+H2O;继续滴加NaOH溶液,到氢氧化钠溶液为520mL时,沉淀量最大,此时为Mg(OH)2和Al(OH)3,溶液为氯化钠溶液。再继续滴加NaOH溶液,氢氧化铝与氢氧化钠反应生成偏铝酸钠与水,发生反应Al(OH)3+NaOH=NaAlO2+2H2O,据此进行解答。
(1)根据分析可知该阶段发生的是剩余的盐酸和NaOH的反应,反应的离子方程式为:H++OH =H2O;
(2)根据分析可知加入520mL-620mLNaOH溶液时沉淀质量减少是因为氢氧化铝溶液NaOH溶液,化学方程式为Al(OH)3+NaOH=NaAlO2+2H2O;
(3)据图以及分析可知Al(OH)3消耗的NaOH为620mL-520mL=100mL,根据反应方程式可知n[Al(OH)3]=1mol/L×0.1L=0.1mol,则混合物中n(Al2O3)=0.05mol;生成Mg(OH)2和Al(OH)3沉淀总共消耗氢氧化钠溶液的体积为:520mL-20mL=500mL,含有氢氧化钠的物质的量为:1.0mol/L×0.5L=0.5mol,n[Al(OH)3]=0.1mol,则n[Mg(OH)2]==0.1mol,则n(MgO)=0.1mol,所以原混合物中氧化镁、氧化铝的物质的量之比为:0.1mol:0.05mol=2:1;
(4)根据图象可知,加入520mL1.0mol/L的氢氧化钠溶液时,此时沉淀达到最大,溶质为氯化钠,n(NaCl)=n(HCl)=n(NaOH)=1.0mol/L×0.52L=0.52mol,该盐酸的浓度为:0.52mol÷0.2L=2.6mol/L。
答案第1页,共2页
一、单选题(共12题)
1.X、Y均为短周期元素,且X为第ⅠA族元素,Y为第ⅥA族元素,下列说法正确的是
A.X的原子半径一定大于Y的原子半径
B.由X、Y形成的共价化合物中所有原子都满足最外层为8电子结构
C.X2Y既可能是离子化合物,也可能是共价化合物
D.由X、Y组成的化合物中,X、Y的原子个数比不可能是1∶1
2.W、X、Y、Z是周期表中前20号的主族元素,原子序数依次增大。W、X、Y的原子最外层电子数之和为13,X与Z同主族,实验室可用Z的最高价氧化物的水化物稀溶液检验W的最高价氧化物。下列说法正确的是
A.失去电子能力:X>Z>W
B.原子半径:Z>Y>X
C.W、X、Y、Z的最高正化合价依次为+4、+2、+7、+2
D.W与Y形成的化合物含有极性键,不含有非极性键
3.下列比较不正确的是
A.酸性:H2SO4>H3PO4 B.碱性:KOH>NaOH
C.稳定性:NH3>CH4 D.离子半径:Na+>Cl-
4.如图是部分短周期元素的原子序数与其某种常见化合价的关系图,若用原子序数代表所对应的元素,则下列说法正确的是
A.31d和33d属于同种核素
B.气态氢化物的稳定性:a>d>e
C.b和c的最高价氧化物对应的水化物可以反应
D.a和b只能形成一种化合物
5.下列每组两种物质中,都既含离子键又含共价键的是( )
A.SiO2和CO2 B.NaOH和CH4 C.Na2O2和NH4Cl D.NaCl和HCl
6.元素周期律为人类推测元素性质提供了依据。根据周期律推测下列结论正确的是
A.原子半径大小: B.酸性强弱:
C.碱性强弱: D.金属性:
7.下列说法不正确的是( )
A.化学变化中,原子的原子核不发生变化,核外电子可能会发生变化
B.同一主族中,相邻周期元素原子的核电荷数相差8、18或者32
C.目前第七周期元素已经排满,该周期一共有32种元素
D.同主族元素,从上往下非金属性减弱,相应最高价含氧酸的酸性减弱
8.下列有关II A族元素的叙述错误的是( )
A.在医疗中常用作钡餐
B.钙单质燃烧时其焰色呈砖红色
C.随着原子序数的递增,元素原子失电子能力增强
D.由难溶于水,可推断也难溶于水
9.超重水()是生化实验的重要原料,下列说法不正确的是
A.与互为同位素 B.、、是不同的核素
C.氚()原子核外有1个电子 D.与的相对分子质量相同
10.NaH2PO2可用于化学镀镍,常通过反应“P4+3NaOH+3H2O==3NaH2PO2+PH3↑”制得,产物PH3中P的化合价为-3。下列说法正确的是
A.P4分子中含有的共价键是极性键
B.31g P4中所含P-P键的物质的量为6 mol
C.反应中还原剂和氧化剂的物质的量之比为1∶3
D.反应生成2.24 L PH3(标准状况),转移电子数目为0.3×6.02×1023
11.有关化学键和晶体的说法正确的是
A.干冰是共价分子,其升华破坏了共价键
B.氯化铵属于离子化合物,其加热仅破坏了共价键
C.汞是金属晶体,其气化破坏了共价键
D.二氧化硅属于共价化合物,其熔化破坏了共价键
12.NA为阿伏伽德罗常数,以下说法正确的是
A.18gT2O中含有的质子数为10NA
B.0.5mol/LBa(OH)2溶液中含有的OH-的数目为NA
C.25℃,101kPa,3.4克硫化氢中含有原子总数为0.3NA
D.常温常压下,20mLNH3和60mLO2所含分子个数比不等于1∶3
二、非选择题(共10题)
13.下图所示的两种化合物可应用于阻燃材料和生物材料的合成。其中W、X、Y、Z为原子序数依次增大的短周期元素,X和Z同主族,Y原子序数为W原子价电子数的3倍。请回答下列问题:
(1)元素Y在周期表中的位置为___________,元素Z的最高价氧化物的水化物的化学式为_____ 。
(2)元素W、X、Y、Z的简单阴离子半径由大到小的顺序为_____ 。
(3)Z、W和氢三种元素形成的同时含有离子键和共价键化合物的电子式为_____ 。
(4)研究Y、Z非金属性强弱的方案中不可行的是___________(填序号)。
A.比较其简单氢化物的沸点 B.比较其单质与氢气反应的难易程度
C.比较其简单阴离子的还原性 D.比较其氧化物的水化物的酸性
(5)许多含元素Z的化合物均可作为杀菌消毒剂,将ZO2通入到NaOH和H2O2混合溶液中,可制备NaZO2。
查阅资料:NaZO2晶体易溶于水,难溶于乙醇。NaZO2饱和溶液在温度低于38 ℃时析出NaZO2·3H2O晶体,高于38 ℃时析出NaZO2晶体,高于60 ℃时NaZO2分解成NaZO3和NaZ。
①写出由ZO2制备NaZO2的离子方程式_____ 。
②从上述NaZO2溶液获得干燥的NaZO2晶体的操作步骤为:将溶液在减压和55 ℃条件下蒸发至大量晶体析出后,___________,___________,低于60℃干燥,得到NaZO2晶体 (补全实验步骤)。
14.现有A、B、C、D、E、F六种短周期主族元素,原子序数依次增大。已知:A的气态氢化物能与其最高价氧化物的水化物反应,B原子最外层电子数是其电子层数的3倍,C+和D3+的电子层结构相同,B与E属于同一主族。
(1)E在元素周期表中的位置是__。
(2)上述元素形成的简单离子中,半径最小的是__(填离子符号)。
(3)下列事实能说明C元素的金属性比D元素的金属性强的是__。
a.C单质常温能与水反应,D单质不能与水反应
b.在氧化还原反应中,1molD单质比1molC得电子多
c.C和D两元素的最高价氧化物的水化物,前者的碱性更强
(4)写出由B和C形成的化合物C2B2的电子式为__。
(5)工业上用电解法制备D的单质,反应的化学方程式为__。
(6)写出实验室制备F单质的离子方程式__。
15.A、B、C、D、E是核电荷数依次增大的五种短周期主族元素。A元素的原子核内只有1个质子;B元素的原子半径是其所在主族中最小的,B的最高价氧化物对应的水化物的化学式为HBO3;C元素原子的最外层电子数比次外层电子数多4;C的阴离子与D的阳离子具有相同的电子排布,两元素可形成化合物D2C;C、E元素同主族。
(1)B在元素周期表中的位置是_______。
(2)由A、B、C三种元素形成的离子化合物溶于水的电离方程式为_______。
(3)C、D、E形成的简单离子的半径大小关系是_______(用离子符号表示)。
(4)用电子式表示化合物D2E的形成过程:_______,化合物D2C2的电子式_______。
(5)化合物D2C2与A2C反应的化学方程式_______。
16.近年来,科学家通过粒子加速器进行了一周的实验,获得了6个非常罕见的Fe原子,接着,科学家又使用特制的测量仪器观测到,这6个原子中有4个发生了衰变,这一实验证实了曾经预言的双质子衰变方式,即有一个原子同时放出两个质子的衰变方式。回答下列问题:
(1)Fe原子的核内中子数为___________,该原子的核外电子数为___________。
(2)以下关于Fe的叙述正确的是___________(填序号)。
A.Fe与Fe是两种核素
B.科学家获得了一种新元素
C.Fe的衰变不是化学变化
D.这种铁原子衰变放出两个质子后变成Fe
(3)某同学认为Fe在一定条件下也可与氧气反应,他的判断依据是___________。
17.根据下列微粒回答问题:1H、2H、3H、14C、14N、16O、35Cl2、37Cl2
(1)以上8种微粒共有___________种核素,共___________种元素。
(2)互为同位素的是___________(填8种微粒中合理的微粒)。
(3)质量数相等的是___________,中子数相等的是___________。(填8种微粒中合理的微粒)。
(4)相同物质的量的14CO2与S18O2的质量之比为___________;质子数之比为___________。
18.随着原子序数的递增,八种短周期元素(用字母x~h表示)的原子半径相对大小、最高正价或最低负价的变化如图所示。
请回答下列问题:
(1)x形成的阴离子的结构示意图为___________。
(2)如果1个z原子中含8个中子,则其原子符号为___________。
(3)f的单质和e的最高价氧化物对应的水化物相互反应的化学方程式为___________。
(4)比较d、e常见离子的半径大小:___________(填离子符号,用“>”连接)。
(5)g、h两元素最高价氧化物对应水化物的酸性更强的是___________(填化学式)。
19.已知某简单(单核)粒子的原子核外有18个电子。
(1)若为原子,请画出其原子结构示意图_________。
(2)若为阳离子,请写出其常见的离子符号_______。
(3)若为阴离子,请写出其常见的离子符号_______。
20.结合元素周期表回答下列问题:
(1)表中的实线是元素周期表的部分边界,请在图中用实线补全元素周期表的边界______。
(2)表中所列元素,属于短周期元素的有______,属于主族元素的有______;g元素位于第______周期______族;i元素位于第______周期______族。
(3)元素f是第______周期______族元素,请在下边方框中按氦元素的式样写出该元素的原子序数、元素符号、元素名称、相对原子质量______。
21.用表示原子:
(1)中性原子的中子数N=___________。
(2)共有x个电子,则该阳离子的中子数N=___________。
(3)共有x个电子,则该阴离子的中子数N=___________。
22.将氧化镁、氧化铝的混合物完全溶于200mL盐酸,而后逐滴加入1.0mol·L-1NaOH溶液。溶液中生成沉淀的物质的量随加入NaOH溶液体积的变化如图所示。
(1)最初加入20mLNaOH溶液所发生反应的离子方程式为_______。
(2)写出加入520mL-620mLNaOH溶液所发生反应的化学方程式为_______。
(3)混合物中氧化镁、氧化铝的物质的量之比为_______。
(4)所用盐酸的物质的量浓度为_______。
试卷第1页,共6页
参考答案:
1.C
【解析】
X、Y为短周期元素,X为第ⅠA族元素,Y为ⅥA族元素,则X可能为H、Li、Na三种元素,Y可能为O、S两种元素,据此分析判断。
X、Y为短周期元素,X为第ⅠA族元素,Y为ⅥA族元素,则X可能为H、Li、Na三种元素,Y可能为O、S两种元素。
A.当X为H,Y为O、S时,X的原子半径小于Y的原子半径,故A错误;
B.当X为H时,由X、Y形成的共价化合物中所有原子不可能都满足最外层为8电子结构,H原子满足最外层2个电子的稳定结构,故B错误;
C.化学式为X2Y的有H2O或Na2O或Li2O,可能是离子化合物,也可能是共价化合物,故C正确;
D.X、Y两元素形成的化合物中,原子个数为1∶1的有H2O2或Na2O2,故D错误;
故选C。
2.C
【解析】
实验室可用Z的最高价氧化物的水化物稀溶液检验W的最高价氧化物,则Z是Ca,W是C;X与Z同主族,则X是Mg,W、X、Y的原子最外层电子数之和为13,则Y的最外层电子数为7,因此Y是Cl。
A. 同一主族,电子层数越大,失电子能力越强,因此失电子能力Z>X,A错误;
B. 电子层数越大,半径越大,电子层数相同时,核电荷数越大,半径越小,因此原子半径Z>X>Y,B错误;
C. 最高正价等于最外层电子数,W、X、Y、Z的最高正化合价依次为+4、+2、+7、+2,C正确;
D. W与Y能形成化合物CCl4,只含有极性键,W与Y还可以形成化合物CCl3CCl3,既含有极性键也含有非极性键,D错误;
答案选C。
3.D
【解析】
A.非金属性S>P,则最高价含氧酸的酸性:H2SO4>H3PO4,A正确;
B.金属性K>Na,则最高价氧化物水化物的碱性:KOH>NaOH,B正确;
C.非金属性N>C,则简单氢化物的稳定性:NH3>CH4,C正确;
D.核外电子层数越多,离子半径越大,则离子半径:Na+<Cl-,D错误;
答案选D。
4.C
【解析】
短周期元素中,a为-2价、e为+6价,处于VI族,可推知a为O、e为S,b有+1价,原子序数大于氧,则b为Na,由原子序数可知c、d处于第三周期,化合价分别为+3、+5,则c为Al、d为P,据此分析解答。
A.31d和33d质子数相同,中子数不同,是不同的核素,故A错误;
B.非金属性a(O)>e(S)>d(P),故氢化物稳定性:a>e>d,故B错误;
C.b和c的最高价氧化物对应的水化物分别为NaOH和Al(OH)3,故C正确;
D.a和b可形成Na2O和Na2O2,故D错误;
故选C。
5.C
【解析】
A.SiO2为共价化合物,只含有共价键,CO2为共价化合物,只含有共价键,故A不符合题意;
B.NaOH为离子化合物,其中Na+与OH-之间通过离子键连接,OH-中O原子与H原子之间通过共价键连接,NaOH中含有离子键、共价键,CH4为共价化合物,只含有共价键,故B不符合题意;
C.Na2O2为离子化合物,其中Na+与之间通过离子键连接,中O原子通过共价键连接,Na2O2中含有离子键、共价键,NH4Cl为离子化合物,其中与Cl-通过离子键连接,中N原子与H原子之间通过共价键连接,NH4Cl中含有离子键、共价键,故C符合题意;
D.NaCl为离子化合物,其中只含有离子键,HCl为共价化合物,其中只含有共价键,故D不符合题意;
综上所述,两种物质中,都既含离子键又含共价键的是C,故答案为:C。
6.C
【解析】
A.同周期自左向右逐渐减小,则原子半径大小:,A错误;
B.非金属性越强,最高价含氧酸的酸性越强,则酸性强弱:,B错误;
C.同主族从上到下金属性逐渐增强,最高价氧化物的水化物的碱性越强,碱性强弱:,C正确;
D.同主族从上到下金属性逐渐增强,金属性:,D错误;
答案选C。
7.B
【解析】
A.原子是化学变化中的最小粒子,化学反应时,原子核一定不发生变化,核外电子可能会转移,A正确;
B.同一主族中,相邻周期元素原子的核电荷数相差2、8、18或者32,B错误;
C.目前第七周期元素已经排满,该周期一共有32种元素,C正确;
D.同主族元素,从上往下非金属性减弱,所以,相应最高价含氧酸的酸性减弱,D正确。
答案选B。
8.A
【解析】
A.在医疗中常用作钡餐,A项错误。
B.钙单质或含钙元素的化合物在灼烧时焰色为砖红色,B项正确。
C.主族元素的原子最外层电子数相同时,电子层数越多,最外层电子离核越远,越容易失去电子,C项正确。
D.由、、均难溶于水,可推断也难溶于水,D项正确。
故选A。
9.A
【解析】
A.质子数相同的核素互为同位素,而与均为单质,A错误;
B.、、质子数相同,但中子数不同,故三者为不同的核素,B正确;
C.原子的核外电子数等于质子数,氚()质子数为1,故其核外有1个电子,C正确;
D.与的相对分子质量均为20,D正确;
故选A。
10.D
【解析】
A. P4分子中存在P P键,为非极性键,A项错误;
B. 1个P4分子含有6个P P键,则31g即0.25mol P4,所含P P键的物质的量为1.5 mol,B项错误;
C. 反应生成NaH2PO2,P的元素化合价从0价变为+1价,生成PH3,P元素化合价由0价降低为 3价,可知NaH2PO2为氧化产物,PH3为还原产物,则反应中还原剂和氧化剂的物质的量之比为3:1,C项错误;
D. 生成PH3,P元素化合价由0价降低为 3价,则反应生成2.24 L PH3(标准状况),即0.1mol,转移电子数目为0.3×6.02×1023,D项正确;
答案选D。
11.D
【解析】
A.干冰是固态的二氧化碳,由二氧化碳分子构成,属于分子晶体,升华时破坏分子间作用力,A错误;
B.氯化铵固体是由氯离子和铵根离子通过离子键结合而成的离子晶体,加热氯化铵破坏了氯离子和铵根离子之间的离子键,同时加热氯化铵分解为氨气和HCl,破坏了H和N之间的共价键,B错误;
C.汞是常温下呈液态的金属,是由金属离子和自由电子通过金属键结合而成的金属晶体,其气化破坏了金属键,C错误;
D.二氧化硅只含有共价键,属于共价化合物,固体熔化时,破坏共价键,D正确;
答案选:D。
12.C
【解析】
A.18gT2O的物质的量为=mol,每个T2O分子含有10个质子,所以共含NA个质子,A错误;
B.溶液体积未知,无法确定所含离子数目,B错误;
C.3.4克硫化氢的物质的量为=0.1mol,每个H2S含有3个原子,所以原子总数为0.3NA,C正确;
D.同温同压下,气体的体积比等于物质的量之比,所以20mLNH3和60mLO2所含分子个数比等于1∶3,D错误;
综上所述答案为C。
13.(1) 第三周期 ⅤA族 HClO4
(2)P3->Cl->N3->F-
(3)
(4)AD
(5) 2ClO2 + H2O2 + 2OH- = 2ClO+ O2 + 2H2O 趁热过滤(或高于38℃过滤) 乙醇洗涤
【解析】
由题干信息可知,W、X、Y、Z为原子序数依次增大的短周期元素,X和Z同主族,结合结构式可知,X和Z应分别为F和Cl元素,Y的最高价为+5价,其原子序数为W原子价电子数的3倍,可知Y为P元素,W为N元素,据此分析解题。
(1)
由分析可知,元素Y为P元素,故在周期表中的位置为第三周期ⅤA族,元素Z为Cl,故其最高价氧化物的水化物的化学式为HClO4,故答案为:第三周期ⅤA族;HClO4;
(2)
微粒半径大小比较一般为:电子层数越多,半径越大,电子层数相同时,核电荷数越大,半径越小,故元素W、X、Y、Z的简单阴离子半径由大到小的顺序为P3->Cl->N3->F-,故答案为:P3->Cl->N3->F-;
(3)
由分析可知,Z为Cl、W为N和氢三种元素形成的同时含有离子键和共价键化合物为NH4Cl,其电子式为,故答案为:;
(4)
A.非金属元素简单氢化物的沸点的高低与其非金属性强弱无关,A符合题意;
B.非金属单质与氢气反应的难易程度与其非金属性强弱一致,B不合题意;
C.非金属元素的非金属越强,其单质的氧化性越强,对应简单阴离子的还原性则越弱,故通过比较其简单阴离子的还原性可以推出其非金属性强弱,C不合题意;
D.非金属性强弱与其最高价氧化物的水化物的酸性一致,但是不是最高价氧化物对应水化物的酸性则不能比较其非金属性强弱,D符合题意;
故答案为AD;
(5)
①由分析可知,Z为Cl,将ZO2即ClO2通入到NaOH和H2O2混合溶液中,可制备NaZO2即NaClO2,故由ZO2制备NaZO2的离子方程式为2ClO2 + H2O2 + 2OH- = 2ClO+ O2 + 2H2O,故答案为:2ClO2 + H2O2 + 2OH- = 2ClO+ O2 + 2H2O;
②由题干资料:NaZO2晶体易溶于水,难溶于乙醇;NaZO2饱和溶液在温度低于38 ℃时析出NaZO2·3H2O晶体,高于38 ℃时析出NaZO2晶体,高于60 ℃时NaZO2分解成NaZO3和NaZ,故从上述NaZO2溶液获得干燥的NaZO2晶体的操作步骤为:将溶液在减压和55 ℃条件下蒸发至大量晶体析出后,趁热过滤(或高于38℃过滤),乙醇洗涤,低于60℃干燥,得到NaZO2晶体,故答案为:趁热过滤(或高于38℃过滤);乙醇洗涤。
14. 第三周期第ⅥA族 Al3+ ac 2Al2O3(熔融)4Al+3O2↑ MnO2+4H++2Cl-Mn2++Cl2+2H2O
【解析】
A、B、C、D、E、F六种短周期主族元素,原子序数依次增大,A的气态氢化物能与其最高价氧化物的水化物反应,则A是N元素;B原子最外层电子数是电子层数的3倍,B为O元素;B与E属于同一主族,则E是S元素,F为短周期主族元素且原子序数大于E,则F为Cl元素;C+和D3+离子的电子层结构相同,为第三周期元素,C、D分别为Na、Al元素;以此解答。
(1)E是S元素,S原子核外电子层数等于其周期数、最外层电子数等于其族序数,S原子核外有3个电子层、最外层电子数是6,所以S位于第三周期第VIA族,故答案为:第三周期第VIA族;
(2)上述元素形成的简单离子中,电子层数越少的原子半径越小,电子层结构相同的离子,离子半径随着原子序数增大而减小,这几种元素形成的离子半径大小顺序是S2 >Cl >N3 >O2 >Na+>Al3+,所以离子半径最小的是Al3+,故答案为:Al3+;
(3) Na的金属性比Al的金属性强,
a. Na单质常温能与水反应,Al单质不能与水反应,可以说明;
b. 在氧化还原反应中,得电子多少不能说明金属性强弱,错误;
c. Na和Al两元素的最高价氧化物的水化物,前者NaOH碱性更强,可以说明;
故选ac;
(4)B和C形成的化合物C2B2是Na2O2,电子式为:;
(5)工业上用电解法制备D的单质Al,反应的化学方程式为2Al2O3(熔融)4Al+3O2↑;
(6)写出实验室制备F单质Cl2的离子方程式为:MnO2+4H++2Cl-Mn2++Cl2+2H2O。
15. 第二周期 ⅤA族 NH4NO3=; O2->Na+>S2- 2Na2O2+2H2O=4NaOH+O2↑
【解析】
A、B、C、D、E是核电荷数依次增大的五种短周期主族元素。A元素的原子核内只有1个质子,A是H元素;B的最高价氧化物对应的水化物的化学式为HBO3,B的最高价是+5,B元素的原子半径是其所在主族中最小的,B是N元素;C元素原子的最外层电子数比次外层电子数多4,C是O元素;O2-与D的阳离子具有相同的电子排布,两元素可形成化合物D2C,D为+1价,D是Na元素;C、E元素同主族,E是S元素。
(1)B是N元素,在元素周期表中的位置是第二周期 ⅤA族。
(2)由H、N、O三种元素形成的离子化合物是NH4NO3,溶于水电离出铵根离子和硝酸根离子,电离方程式为NH4NO3=;
(3)电子层数相同,质子数越多半径越小,O2-、Na+、S2-半径大小关系是O2->Na+>S2-;
(4)Na2S是离子化合物,用电子式表示化合物Na2S的形成过程为, Na2O2是离子化合物,电子式为;
(5) Na2O2与H2O反应生成氢氧化钠和氧气,反应的化学方程式是 2Na2O2+2H2O=4NaOH+O2↑。
16.(1) 19 26
(2)AC
(3)Fe与Fe的核外电子数相同,化学性质几乎完全相同
【解析】
(1)
Fe的中子数=质量数-质子数=45-26=19,电子数=质子数=26。
(2)
Fe与Fe的质子数相同,属同一元素Fe元素,但中子数不同,是两种不同的核素,A正确;Fe元素不是一种新元素,B错误;Fe衰变后变为质子数为24的新原子,原子核发生了变化,不是化学变化,因为化学的范畴是在原子、分子水平上研究物质的,C正确;Fe衰变放出两个质子后变为Fe,D错误;故选AC。
(3)
Fe与Fe的核外电子数相同,化学性质几乎完全相同
17. 6 5 1H、2H、3H 14C、14N 14C、16O 23∶34 11∶16
【解析】
核素指的是原子;质子数和中子数只要其一不相同就属于不同核素;元素的种类由质子数决定,质子数不同,元素的种类就不同;质子数相同,而中子数不同的原子,互称为同位素;中子数=质量数-质子数。
(1)核素指的是原子,故共有6种核素;1H、2H、3H均属于氢元素,14C属于碳元素14N属于氮元素,16O属于氧元素,35Cl2、37Cl2都属于氯元素,一共有5种元素,故答案为:6;5;
(2)1H、2H、3H都属于氢元素,质子数相同,而中子数不同互为同位素,故答案为:1H、2H、3H;
(3)核素符号左上角的数字表示质量数,则质量数相等的是14C、14N;14C中中子数=14-6=8,16O 的中子数=16-8=8,所以二者中子数相同,故答案为:14C、14N ;14C、16O;
(4)相同物质的量的14CO2与S18O2的质量之比等于相对分子质量之比,相对原子质量近似等于质量数,则相同物质的量的14CO2与S18O2的质量之比为(14+16+16):(32+18+18)=23∶34;质子数之比为(6+8+8):(16+8+8)=11∶16;故答案为:23∶34;11∶16。
18. O2->Na+ HClO4
【解析】
根据图中的化合价和原子半径的大小,可以推出x是H,y是C,z是N,d是O,e是Na,f是Al,g是S,h是Cl。
(1)x是H,H形成的阴离子为H-,H的结构示意图为;
(2)z是N,N原子的质子数为7,如果1个N原子中含8个中子,则质量数为7+8=15,其原子符号为;
(3)f是Al,e是Na,Na的最高价氧化物对应的水化物为NaOH,Al与NaOH溶液反应生成偏铝酸钠和氢气,反应的化学方程式为;
(4)d是O,e是Na,d、e形成的简单离子分别为O2-、Na+,电子层结构相同的离子,核电荷数越大,离子半径越小,故r(O2-)>r(Na+);
(5)g是S,h是Cl,元素的非金属性越强,最高价氧化物对应的水化物的酸性越强,非金属性:Cl>S,则最高价氧化物对应的水化物的酸性:HClO4>H2SO4。
19. K+、Ca2+ Cl-、S2-
【解析】
原子核外有18个电子的简单(单核)粒子:
(1)原子的核外电子数=核电荷数=质子数=18;
(2)阳离子的核电荷数=阳离子核外电子数+阳离子电荷数=18+n(n=1,2),离子核电荷数可为19、20;
(3)阴离子的核电荷数=阴离子核外电子数-阴离子电荷数=18-n(n=1,2),离子的核电荷数可为17、16;
原子核外有18个电子的简单(单核)粒子:
(1)原子的核外电子数=核电荷数=质子数=18,为氩原子,其原子结构示意图,
故答案为:;
(2)阳离子的核电荷数=阳离子核外电子数+阳离子电荷数=18+n(n=1,2),离子核电荷数可为19、20,其离子符号为K+、Ca2+,
故答案为:K+、Ca2+;
(3)阴离子的核电荷数=阴离子核外电子数-阴离子电荷数=18-n(n=1,2),离子的核电荷数可为17、16,其离子符号为Cl-、S2-,
故答案为:Cl-、S2-
20. a、b、c、d、e、f、g a、b、c、d、e、f 三 0 四 ⅡB 三 ⅥA
【解析】
(1)根据元素周期表的结构可知,第一周期有2种元素,第二、三周期各有8种元素,分列于第1、2、13~18纵列,第四、五、六、七周期为长周期,包括1~18纵列,则周期表的边界为:,故答案为:;
(2)由各元素在周期表中的位置可知,a、b、c、d、e、f、g属于短周期元素;a、b、c、d、e、f属于主族元素;g元素位于元素周期表第三周期0族;i元素位于元素周期表第四周期ⅡB族,故答案为:a、b、c、d、e、f、g;a、b、c、d、e、f;三;0;四;ⅡB;
(3)元素f位于元素周期表第三周期ⅥA族,该元素为硫元素,原子序数为16、相对原子质量为32,按氦元素的式样可得如下方格:,故答案为:三;ⅥA ;。
21. A-Z A-x-n A-x+n
【解析】
(1)在表示原子组成时元素符号的左下角表示质子数,左上角表示质量数,又因为中子数+质子数=质量数,据此可知中性原子的中子数N=A-Z;
(2)中性原子的核外电子数=质子数,所以如果AXn+共有x个电子,则质子数=X+n,因此该阳离子的中子数N=A-x-n;
(3)同(2)分析可知,如果AXn-共有x个电子,则质子数=X-n,因此该阴离子的中子数N=A-x+n。
22. H++OH-=H2O Al(OH)3+NaOH=NaAlO2+2H2O 2∶1 2.6mol·L-1
【解析】
由图可知,从开始至加入NaOH溶液20mL,没有沉淀生成,说明原溶液中盐酸溶解Mg、Al后盐酸有剩余,此时发生的反应为:HCl+NaOH=NaCl+H2O;继续滴加NaOH溶液,到氢氧化钠溶液为520mL时,沉淀量最大,此时为Mg(OH)2和Al(OH)3,溶液为氯化钠溶液。再继续滴加NaOH溶液,氢氧化铝与氢氧化钠反应生成偏铝酸钠与水,发生反应Al(OH)3+NaOH=NaAlO2+2H2O,据此进行解答。
(1)根据分析可知该阶段发生的是剩余的盐酸和NaOH的反应,反应的离子方程式为:H++OH =H2O;
(2)根据分析可知加入520mL-620mLNaOH溶液时沉淀质量减少是因为氢氧化铝溶液NaOH溶液,化学方程式为Al(OH)3+NaOH=NaAlO2+2H2O;
(3)据图以及分析可知Al(OH)3消耗的NaOH为620mL-520mL=100mL,根据反应方程式可知n[Al(OH)3]=1mol/L×0.1L=0.1mol,则混合物中n(Al2O3)=0.05mol;生成Mg(OH)2和Al(OH)3沉淀总共消耗氢氧化钠溶液的体积为:520mL-20mL=500mL,含有氢氧化钠的物质的量为:1.0mol/L×0.5L=0.5mol,n[Al(OH)3]=0.1mol,则n[Mg(OH)2]==0.1mol,则n(MgO)=0.1mol,所以原混合物中氧化镁、氧化铝的物质的量之比为:0.1mol:0.05mol=2:1;
(4)根据图象可知,加入520mL1.0mol/L的氢氧化钠溶液时,此时沉淀达到最大,溶质为氯化钠,n(NaCl)=n(HCl)=n(NaOH)=1.0mol/L×0.52L=0.52mol,该盐酸的浓度为:0.52mol÷0.2L=2.6mol/L。
答案第1页,共2页
