化学人教版2019选择性必修1 2.1.3活化能(共28张ppt)
文档属性
| 名称 | 化学人教版2019选择性必修1 2.1.3活化能(共28张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-06-30 08:51:01 | ||
图片预览






文档简介
(共28张PPT)
第一节 化学反应速率
第三课时
活化能
第二章 化学反应速率与化学平衡
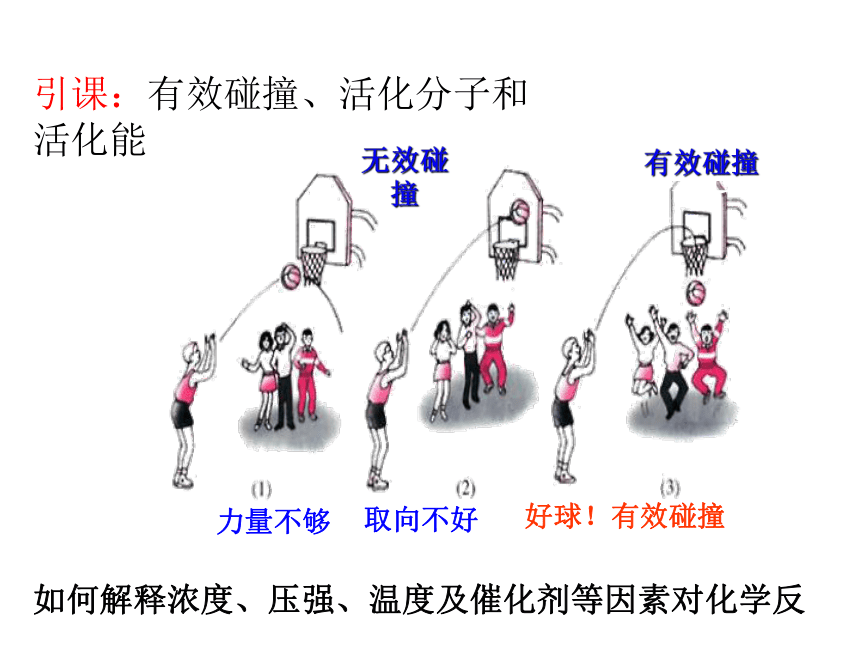
引课:有效碰撞、活化分子和活化能
如何解释浓度、压强、温度及催化剂等因素对化学反应速率的影响呢
无效碰撞
有效碰撞
力量不够
取向不好
好球!有效碰撞
学习目标
1.知道化学反应是有历程的;认识基元反应活化能对化学反应速率的影响;知道催化剂可以改变反应历程,能从控制化学反应速率的角度分析和选择反应条件。
2.能根据简单的碰撞理论说明温度、浓度、催化剂等是如何影响化学反应速率的。体会理论模型的构建过程,强化模型认知意识。
一、有效碰撞理论
基元反应
大多数的化学反应往往经过多个反应步骤才能实现,每一步反应都称为基元反应。
反应机理
先后进行的基元反应反映了化学反应的反应历程,反应历程又称反应机理。
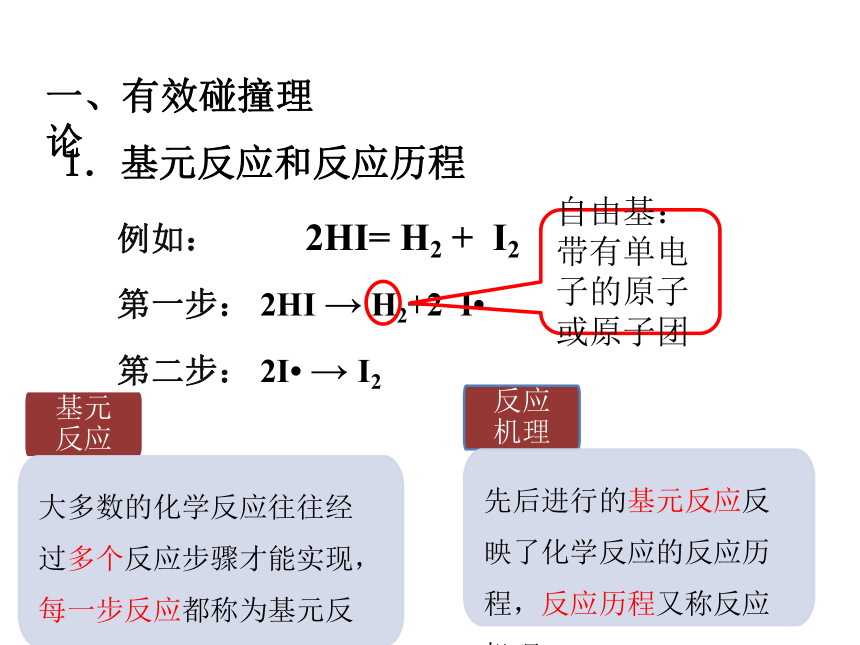
1.基元反应和反应历程
例如: 2HI= H2 + I2
第一步: 2HI → H2+2 I
第二步: 2I → I2
自由基:带有单电子的原子或原子团
基元反应发生的条件
※ 先决条件是反应物的分子必须发生碰撞 。
反应分子的每一次碰撞都能发生化学反应吗?
※ 反应物分子必须具有一定的能量;
※ 碰撞时有合适的取向。
通常情况下,当气体的浓度为1 mol/L时,在每立方厘米、每秒内反应物分子间的碰撞可达到1028次。如果反应物分子间的任何一次碰撞都能发生反应的话,反应只需10-5 s就可以完成。换言之,任何气体的反应均可以瞬间完成。但实际并非如此。
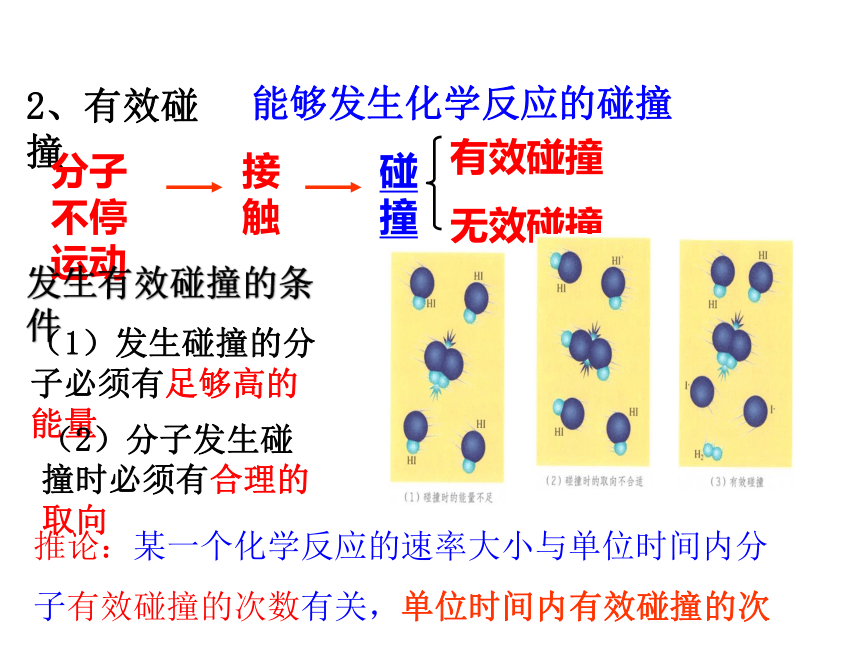
2、有效碰撞
分子不停运动
接触
碰撞
有效碰撞
无效碰撞
能够发生化学反应的碰撞
发生有效碰撞的条件
(1)发生碰撞的分子必须有足够高的能量
(2)分子发生碰撞时必须有合理的取向
推论:某一个化学反应的速率大小与单位时间内分子有效碰撞的次数有关,单位时间内有效碰撞的次数越多,该反应的速率越快。
3、活化分子和活化能
①活化分子:能够发生有效碰撞的分子
思考:活化分子具有的高能量从何来
吸收外界能量 (如加热、光照等)
分子间碰撞时,能量交换不均衡而出现较高能量的分子。
活化分子百分数=
活化分子数
反应物分子数
×100%
其他条件不变时,同一反应活化分子在反应物中所占的百分数是一定的。
②活化能:活化分子具有的平均能量与反应物分子具有的平均能量之差
能量
反应过程
E1
E2
反应物
生成物
活化分子
活化能
反应热
E1:反应的活化能
E2:活化分子变成生成物分子放出的能量
E1-E2:反应热
③反应物、生成物的能量与活化能的关系
特别提示:活化能越小,普通分子就越容易变成活化分子。
也可认为逆反应的活化能
④化学反应速率与活化分子、有效碰撞的关系
反应物分子中活化分子的百分数越大、单位体积内活化分子数越多,
单位时间内有效碰撞的次数越多,化学反应速率越快。
不发生化学反应
无效碰撞
普通分子
发生化学反应
有效碰撞
活化分子
取向合适
取向不合适
活
化
能
单位体积内
活化分子数
单位体积内
分子总数
活化分子
百分数
=
×
小结1:有效碰撞理论
有效碰撞次数的多少与单位体积内反应物中活化分子的多少有关
课堂练习1:下列说法正确的是( )
①活化分子间的碰撞一定能发生化学反应
②普通分子间的碰撞有时也能发生化学反应
③活化分子比普通分子具有较高的能量
④化学反应的实质是原子的重新组合
⑤化学反应的实质是旧化学键的断裂和新化学键的形成过程
⑥化学反应的实质是活化分子有合适取向的有效碰撞
③④⑤
二:用有效碰撞理论解释外界条件对化学反应速率的影响
课本P26思考与讨论
反应物浓度增大,即单位体积内反应物分子总数增大
单位体积内活化分子数增加
有效碰撞次数增多
反应速率加快
1、浓度(压强)对反应速率的影响
注意:活化分子百分数没变
温度升高
单位体积内活化分子数增多(活化分子百分数增大)
有效碰撞次数增多
反应速率加快
分子活得更高能量
2、温度对反应速率的影响
另一原因:温度升高,分子热运动加快,碰撞频率提高。
3、催化剂对反应速率的影响
使用催化剂
降低活化能
活化分子百分数增大(活化分子数目增多)
有效碰撞次数增多
化学反应速率加快
未使用催化剂时:反应A+B=AB的活化能为Ea
使用催化剂K后:反应分两步(历程改变)
第一步:A+K=AK, 活化能为Eal
K是催化剂,前后质量不变;AK是中间产物
第二步:AK+B=AB+K 活化能为Ea2
总反应:A+B=AB
这两个分步反应的活化能都比原来的Ea要小,因此反应速率加快。
又因为Ea1>Ea2,所以第一步是慢反应,第二步是快反应。而整个反应的速率是由慢反应决定的,也叫“决速步骤”。所以第一步的活化能Eal就是在催化剂条件下,整个反应的活化能。
2021诺贝尔化学奖公布,
发明新催化剂2学者获奖
表彰两人在构建分子领域的贡献,促成
开发第三类催化剂“不对称有机催化剂(asymmetric organocatalysis)”
生活中环绕有许多催化剂。
通过汽车排气管中的金属催化剂——可以将废气中的有害物质转换成无害分子,又或是我们人体内的各种酶——帮助我们分解消化食物、新陈代谢等等。在这些过程中“催化剂”是控制与改变化学反应重要物质。
单位时间内、单位体积内有效碰撞次数增多
单位体积内
活化分子数增大
增大反应物浓度
升高温度
增大化学反应速率
增大气体压强
催化剂
单位体积内活化分子百分数增大
小结2:有效碰撞理论解释反应条件对化学反应速率的影响
课堂练习2:下列说法不正确的是( )
A.增加反应物浓度可增大单位体积内活化分子数,活化分子百分数保持不变
B.升高温度可以增大活化分子百分数,从而加快化学反应速率
C.压缩容器的容积,增大压强,活化分子百分数增大,从而加快任一反应的化学反应速率
D.催化剂可以降低反应所需的活化能,活化分子百分数增大
C
课堂练习3: 已知温度不同,NO2和CO之间发生反应的机理不同。
①673K时,NO2和CO发生基元反应(即一步完成):
NO2+CO = NO+CO2,其反应过程如图所示:
②473K时,则经过两步反应,反应机理是:NO2+NO2→NO+ NO3(慢),CO+ NO3→NO2+CO2(快)。下列有关说法错误的是( )
A.相同条件下,活化分子的能量比对应反应物分子的能量高
B.473K时,总反应速率由第一步决定
C.使用催化剂可增加活化分子百分数,加快反应速率改变反应热
D.温度不同反应机理不同,但都经历氮氧键断裂和碳氧键生成的过程
C
课堂练习4(2021全国):卤代烃与端基炔(R‘C≡CH)催化偶联反应的一种机理如图所示。下列说法错误的是( )
A.偶联反应中起催化作用的是M和CuI
B.R'C≡CCu为该催化过程的中间产物
C.该偶联反应的原理为R'C≡CH+RI→R'C≡CR+HI
D.该催化机理改变了反应路径和反应热
D
4、影响化学反应速率的其他因素
光辐射、放射线辐照、超声波、电弧、强磁场、高速研磨等
总之,向反应体系输入能量,都有可能影响化学反应速率
艾哈迈德·泽维尔( ,Ahmed Hassan Zewail),埃及化学家,飞秒化学专家。他研究的技术能将研究化学反应的时间尺度缩减至飞秒,透过摄影将化学反应中每个微细变化忠实地纪录。
飞秒化学 —— 参照课本 P28
影响化学反应速率因素的解释
单位时间内、单位体积内有效碰撞次数改变
改变化学反应速率
课堂小结
有效碰撞理论
单位体积内活化分子数改变
浓度、压强
活化分子百分数数改变
温度、催化剂
1.下列说法正确的是( )
A、一定条件下,增大反应物的量会加快化学反应速率。
B、增大压强,肯定会加快化学反应速率。
C、活化分子间所发生的碰撞为有效碰撞。
D、能够发生有效碰撞的分子叫活化分子。
D
课堂达标
随堂练习
2.下列说法错误的是( )
A.当碰撞的分子具有足够的能量和适当的取向时,才能发生化学反应
B.发生有效碰撞的分子一定是活化分子
C.活化分子间的碰撞一定是有效碰撞
D.活化分子间每次碰撞都发生化学反应
E.能发生有效碰撞的分子必须具有相当高的能量
F.活化能指活化分子多出反应物分子平均能量的那部分能量
G.使用催化剂能改变分子的活化能
H.催化剂能使不起反应的物质间发生反应
CDH
3.在有气体参加的反应中,能使反应物中活化分子总数和活化分子百分数都增大的措施有( )
①增大反应物浓度 ②增大压强 ③升高温度 ④加入催化剂
A.①②
B.②④
C.①③
D.③④
D
4.某温度下,体积一定的密闭容器中进行如下反应:
2X(g)+Y(g) Z(g)+W(s) ΔH>0,下列叙述正确的是 ( )
A.在容器中通入氩气,反应速率不变
B.加入少量W,逆反应速率增大
C.升高温度,正反应速率增大,逆反应速率减小
D.将容器的体积缩小,可增大活化分子的百分数,有效碰撞次数增大
A
5、已知Cl2(g)+CO(g) COCl2(g)的速率方程 [k为速率常数,只受温度影响],该反应可认为经过以下反应历程:
第一步:Cl2 2Cl 快速平衡
第二步:Cl+CO COCl 快速平衡
第三步:COCl+Cl2→COCl2+Cl 慢反应
下列说法正确的是( )
A.第一步反应和第二步反应的活化能较高
B.c(CO)、c(Cl2)分别增大相同的倍数,对总反应速率的影响程度相同
C.该总反应的速率主要取决于第三步反应
D.第三步反应的有效碰撞频率较大
C
第一节 化学反应速率
第三课时
活化能
第二章 化学反应速率与化学平衡
引课:有效碰撞、活化分子和活化能
如何解释浓度、压强、温度及催化剂等因素对化学反应速率的影响呢
无效碰撞
有效碰撞
力量不够
取向不好
好球!有效碰撞
学习目标
1.知道化学反应是有历程的;认识基元反应活化能对化学反应速率的影响;知道催化剂可以改变反应历程,能从控制化学反应速率的角度分析和选择反应条件。
2.能根据简单的碰撞理论说明温度、浓度、催化剂等是如何影响化学反应速率的。体会理论模型的构建过程,强化模型认知意识。
一、有效碰撞理论
基元反应
大多数的化学反应往往经过多个反应步骤才能实现,每一步反应都称为基元反应。
反应机理
先后进行的基元反应反映了化学反应的反应历程,反应历程又称反应机理。
1.基元反应和反应历程
例如: 2HI= H2 + I2
第一步: 2HI → H2+2 I
第二步: 2I → I2
自由基:带有单电子的原子或原子团
基元反应发生的条件
※ 先决条件是反应物的分子必须发生碰撞 。
反应分子的每一次碰撞都能发生化学反应吗?
※ 反应物分子必须具有一定的能量;
※ 碰撞时有合适的取向。
通常情况下,当气体的浓度为1 mol/L时,在每立方厘米、每秒内反应物分子间的碰撞可达到1028次。如果反应物分子间的任何一次碰撞都能发生反应的话,反应只需10-5 s就可以完成。换言之,任何气体的反应均可以瞬间完成。但实际并非如此。
2、有效碰撞
分子不停运动
接触
碰撞
有效碰撞
无效碰撞
能够发生化学反应的碰撞
发生有效碰撞的条件
(1)发生碰撞的分子必须有足够高的能量
(2)分子发生碰撞时必须有合理的取向
推论:某一个化学反应的速率大小与单位时间内分子有效碰撞的次数有关,单位时间内有效碰撞的次数越多,该反应的速率越快。
3、活化分子和活化能
①活化分子:能够发生有效碰撞的分子
思考:活化分子具有的高能量从何来
吸收外界能量 (如加热、光照等)
分子间碰撞时,能量交换不均衡而出现较高能量的分子。
活化分子百分数=
活化分子数
反应物分子数
×100%
其他条件不变时,同一反应活化分子在反应物中所占的百分数是一定的。
②活化能:活化分子具有的平均能量与反应物分子具有的平均能量之差
能量
反应过程
E1
E2
反应物
生成物
活化分子
活化能
反应热
E1:反应的活化能
E2:活化分子变成生成物分子放出的能量
E1-E2:反应热
③反应物、生成物的能量与活化能的关系
特别提示:活化能越小,普通分子就越容易变成活化分子。
也可认为逆反应的活化能
④化学反应速率与活化分子、有效碰撞的关系
反应物分子中活化分子的百分数越大、单位体积内活化分子数越多,
单位时间内有效碰撞的次数越多,化学反应速率越快。
不发生化学反应
无效碰撞
普通分子
发生化学反应
有效碰撞
活化分子
取向合适
取向不合适
活
化
能
单位体积内
活化分子数
单位体积内
分子总数
活化分子
百分数
=
×
小结1:有效碰撞理论
有效碰撞次数的多少与单位体积内反应物中活化分子的多少有关
课堂练习1:下列说法正确的是( )
①活化分子间的碰撞一定能发生化学反应
②普通分子间的碰撞有时也能发生化学反应
③活化分子比普通分子具有较高的能量
④化学反应的实质是原子的重新组合
⑤化学反应的实质是旧化学键的断裂和新化学键的形成过程
⑥化学反应的实质是活化分子有合适取向的有效碰撞
③④⑤
二:用有效碰撞理论解释外界条件对化学反应速率的影响
课本P26思考与讨论
反应物浓度增大,即单位体积内反应物分子总数增大
单位体积内活化分子数增加
有效碰撞次数增多
反应速率加快
1、浓度(压强)对反应速率的影响
注意:活化分子百分数没变
温度升高
单位体积内活化分子数增多(活化分子百分数增大)
有效碰撞次数增多
反应速率加快
分子活得更高能量
2、温度对反应速率的影响
另一原因:温度升高,分子热运动加快,碰撞频率提高。
3、催化剂对反应速率的影响
使用催化剂
降低活化能
活化分子百分数增大(活化分子数目增多)
有效碰撞次数增多
化学反应速率加快
未使用催化剂时:反应A+B=AB的活化能为Ea
使用催化剂K后:反应分两步(历程改变)
第一步:A+K=AK, 活化能为Eal
K是催化剂,前后质量不变;AK是中间产物
第二步:AK+B=AB+K 活化能为Ea2
总反应:A+B=AB
这两个分步反应的活化能都比原来的Ea要小,因此反应速率加快。
又因为Ea1>Ea2,所以第一步是慢反应,第二步是快反应。而整个反应的速率是由慢反应决定的,也叫“决速步骤”。所以第一步的活化能Eal就是在催化剂条件下,整个反应的活化能。
2021诺贝尔化学奖公布,
发明新催化剂2学者获奖
表彰两人在构建分子领域的贡献,促成
开发第三类催化剂“不对称有机催化剂(asymmetric organocatalysis)”
生活中环绕有许多催化剂。
通过汽车排气管中的金属催化剂——可以将废气中的有害物质转换成无害分子,又或是我们人体内的各种酶——帮助我们分解消化食物、新陈代谢等等。在这些过程中“催化剂”是控制与改变化学反应重要物质。
单位时间内、单位体积内有效碰撞次数增多
单位体积内
活化分子数增大
增大反应物浓度
升高温度
增大化学反应速率
增大气体压强
催化剂
单位体积内活化分子百分数增大
小结2:有效碰撞理论解释反应条件对化学反应速率的影响
课堂练习2:下列说法不正确的是( )
A.增加反应物浓度可增大单位体积内活化分子数,活化分子百分数保持不变
B.升高温度可以增大活化分子百分数,从而加快化学反应速率
C.压缩容器的容积,增大压强,活化分子百分数增大,从而加快任一反应的化学反应速率
D.催化剂可以降低反应所需的活化能,活化分子百分数增大
C
课堂练习3: 已知温度不同,NO2和CO之间发生反应的机理不同。
①673K时,NO2和CO发生基元反应(即一步完成):
NO2+CO = NO+CO2,其反应过程如图所示:
②473K时,则经过两步反应,反应机理是:NO2+NO2→NO+ NO3(慢),CO+ NO3→NO2+CO2(快)。下列有关说法错误的是( )
A.相同条件下,活化分子的能量比对应反应物分子的能量高
B.473K时,总反应速率由第一步决定
C.使用催化剂可增加活化分子百分数,加快反应速率改变反应热
D.温度不同反应机理不同,但都经历氮氧键断裂和碳氧键生成的过程
C
课堂练习4(2021全国):卤代烃与端基炔(R‘C≡CH)催化偶联反应的一种机理如图所示。下列说法错误的是( )
A.偶联反应中起催化作用的是M和CuI
B.R'C≡CCu为该催化过程的中间产物
C.该偶联反应的原理为R'C≡CH+RI→R'C≡CR+HI
D.该催化机理改变了反应路径和反应热
D
4、影响化学反应速率的其他因素
光辐射、放射线辐照、超声波、电弧、强磁场、高速研磨等
总之,向反应体系输入能量,都有可能影响化学反应速率
艾哈迈德·泽维尔( ,Ahmed Hassan Zewail),埃及化学家,飞秒化学专家。他研究的技术能将研究化学反应的时间尺度缩减至飞秒,透过摄影将化学反应中每个微细变化忠实地纪录。
飞秒化学 —— 参照课本 P28
影响化学反应速率因素的解释
单位时间内、单位体积内有效碰撞次数改变
改变化学反应速率
课堂小结
有效碰撞理论
单位体积内活化分子数改变
浓度、压强
活化分子百分数数改变
温度、催化剂
1.下列说法正确的是( )
A、一定条件下,增大反应物的量会加快化学反应速率。
B、增大压强,肯定会加快化学反应速率。
C、活化分子间所发生的碰撞为有效碰撞。
D、能够发生有效碰撞的分子叫活化分子。
D
课堂达标
随堂练习
2.下列说法错误的是( )
A.当碰撞的分子具有足够的能量和适当的取向时,才能发生化学反应
B.发生有效碰撞的分子一定是活化分子
C.活化分子间的碰撞一定是有效碰撞
D.活化分子间每次碰撞都发生化学反应
E.能发生有效碰撞的分子必须具有相当高的能量
F.活化能指活化分子多出反应物分子平均能量的那部分能量
G.使用催化剂能改变分子的活化能
H.催化剂能使不起反应的物质间发生反应
CDH
3.在有气体参加的反应中,能使反应物中活化分子总数和活化分子百分数都增大的措施有( )
①增大反应物浓度 ②增大压强 ③升高温度 ④加入催化剂
A.①②
B.②④
C.①③
D.③④
D
4.某温度下,体积一定的密闭容器中进行如下反应:
2X(g)+Y(g) Z(g)+W(s) ΔH>0,下列叙述正确的是 ( )
A.在容器中通入氩气,反应速率不变
B.加入少量W,逆反应速率增大
C.升高温度,正反应速率增大,逆反应速率减小
D.将容器的体积缩小,可增大活化分子的百分数,有效碰撞次数增大
A
5、已知Cl2(g)+CO(g) COCl2(g)的速率方程 [k为速率常数,只受温度影响],该反应可认为经过以下反应历程:
第一步:Cl2 2Cl 快速平衡
第二步:Cl+CO COCl 快速平衡
第三步:COCl+Cl2→COCl2+Cl 慢反应
下列说法正确的是( )
A.第一步反应和第二步反应的活化能较高
B.c(CO)、c(Cl2)分别增大相同的倍数,对总反应速率的影响程度相同
C.该总反应的速率主要取决于第三步反应
D.第三步反应的有效碰撞频率较大
C
