高中化学人教版(2019)必修第一册1.2.1.电解质的电离(共18张ppt)
文档属性
| 名称 | 高中化学人教版(2019)必修第一册1.2.1.电解质的电离(共18张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 71.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-06-29 22:52:46 | ||
图片预览


文档简介
(共18张PPT)
第二节 离子反应
2.1 电解质的电离
第1课时
第一章 物质及其变化
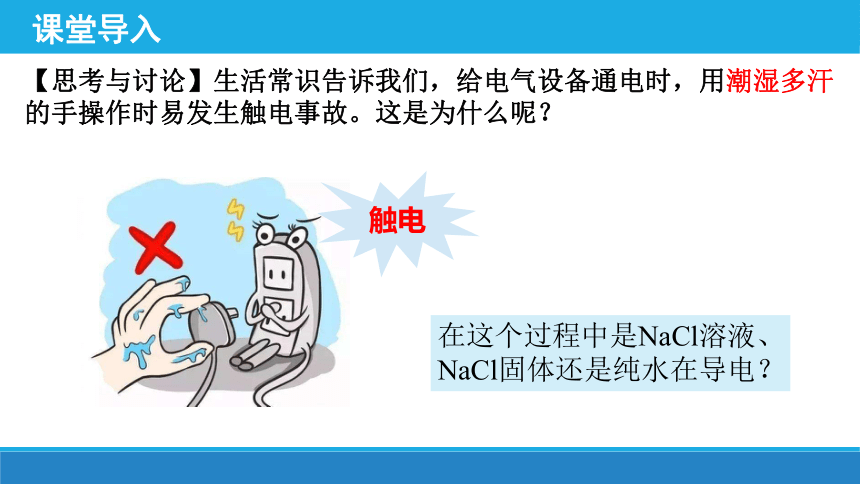
课堂导入
【思考与讨论】生活常识告诉我们,给电气设备通电时,用潮湿多汗的手操作时易发生触电事故。这是为什么呢?
在这个过程中是NaCl溶液、NaCl固体还是纯水在导电?
触电
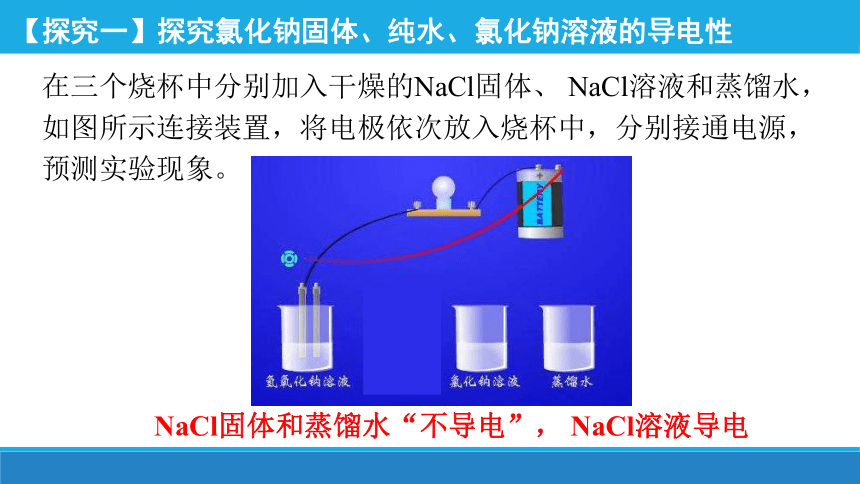
在三个烧杯中分别加入干燥的NaCl固体、 NaCl溶液和蒸馏水,如图所示连接装置,将电极依次放入烧杯中,分别接通电源,预测实验现象。
【探究一】探究氯化钠固体、纯水、氯化钠溶液的导电性
NaCl固体和蒸馏水“不导电”, NaCl溶液导电
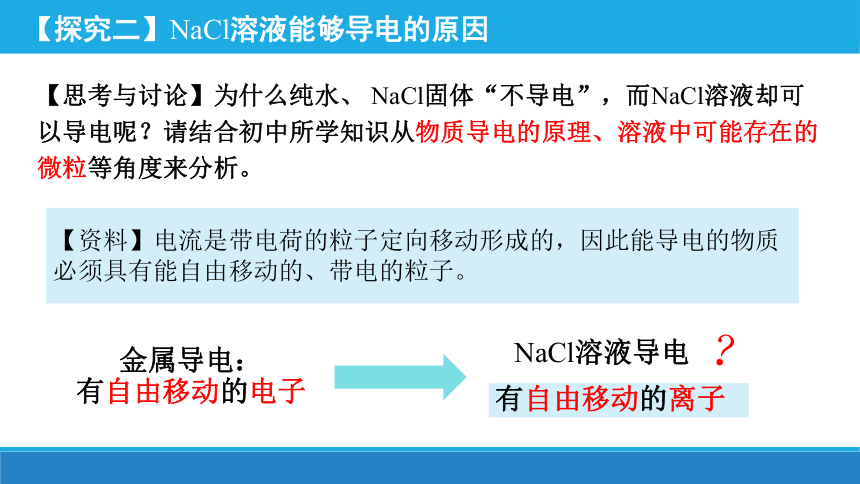
【资料】电流是带电荷的粒子定向移动形成的,因此能导电的物质必须具有能自由移动的、带电的粒子。
【思考与讨论】为什么纯水、 NaCl固体“不导电”,而NaCl溶液却可以导电呢?请结合初中所学知识从物质导电的原理、溶液中可能存在的微粒等角度来分析。
【探究二】NaCl溶液能够导电的原因
金属导电:
有自由移动的电子
?
NaCl溶液导电
有自由移动的离子
英国物理学家法拉第将从电堆两极引出的导线插入到澄清的MgSO4溶液中,他发现不但溶液能够导电,而且还能看到金属镁悬浮在溶液中,他把这种电流使化合物分解的现象称为电离,把电解以前未分解的物质叫做电解质,把分解后得到的能够输送电流的带电物质称为离子。
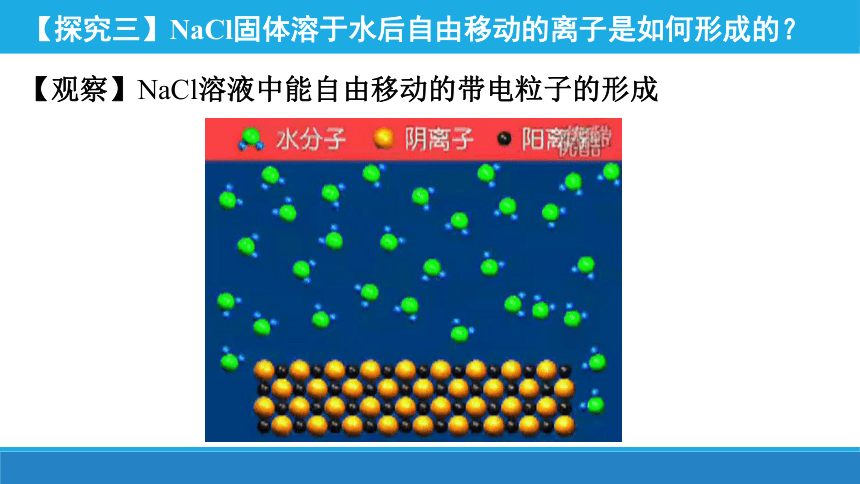
【探究三】NaCl固体溶于水后自由移动的离子是如何形成的?
离子是在通电之后才产生的
?
阿伦尼乌斯在1883年时,提出:电解质在水溶液中自动解离成离子,提出了电离模型。
【观察】NaCl溶液中能自由移动的带电粒子的形成
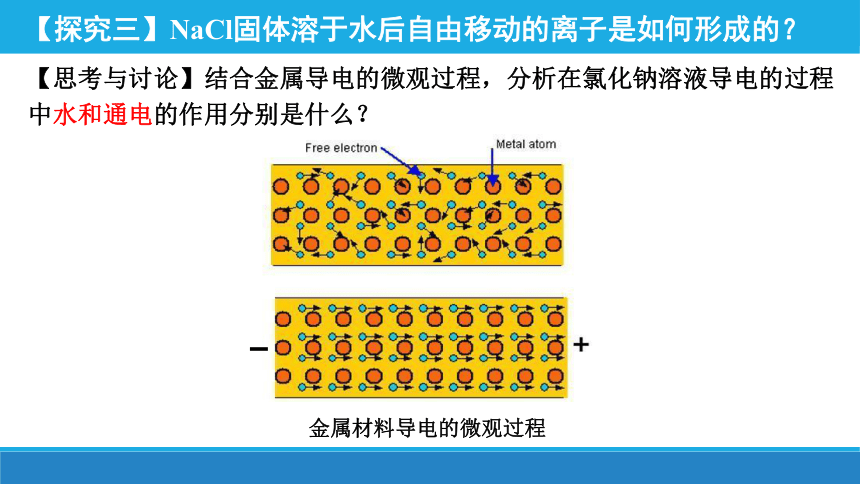
【探究三】NaCl固体溶于水后自由移动的离子是如何形成的?
【思考与讨论】结合金属导电的微观过程,分析在氯化钠溶液导电的过程中水和通电的作用分别是什么?
金属材料导电的微观过程
【探究三】NaCl固体溶于水后自由移动的离子是如何形成的?
【观察】氯化钠溶液导电的微观示意图
【思考】氯化钠固体里是否有钠离子和氯离子?为什么干燥的氯化钠固体不导电?
NaCl晶体的结构模型
通 电
【思考与讨论】还有什么方法可以使氯化钠固体里的钠离子和氯离子自由移动?
提供能量
加热至熔融
加热至熔化的NaCl固体能导电
熔融的KNO3固体、NaOH固体等也能导电
氯化钠固体
不能导电
氯化钠溶液
熔融
氯化钠
能导电
加水溶解
加热融化
宏
观
微
观
Na+、Cl-不能自由移动
Na+、Cl-能自由移动
电解质
电离
加水溶解或
加热融化
【实验探究】探究硝酸钾溶液、氢氧化钠溶液、稀盐酸溶液、蔗糖溶液、酒精溶液是否导电
稀硫酸溶液
蔗糖溶液
酒精溶液
氯化钠溶液
硝酸钾溶液
氢氧化钠溶液
非电解质
电解质
导电
加水溶解
加热融化
宏
观
微
观
产生自由移动的离子
电离
OR
【小结】
(化合物)
常见的电解质
(1)酸;
(2)碱;
(3)盐;
(4)水;
(5)金属氧化物(熔融状态下导电)
常见的电解质和非电解质
常见的非电解质
(1)大多数有机物;
(2)多数非金属氧化物;
(3)部分非金属氢化物(如NH3)
概念辨析
1.铜丝、盐酸能导电,它们是电解质还是非电解质?
既不是电解质也不是非电解质
2.BaSO4、AgCl、CaCO3的溶液几乎不导电,它们是电解质吗?
是;难溶盐在熔融状态时可导电,且溶于水的部分可电离
3.(1)电解质本身一定能导电;
(2)纯硫酸在熔融状态下不导电,所以硫酸不是电解质,这两种说法正确吗?
(1)不正确,电解质导电是有条件的
(2)不正确,H2SO4溶于水可导电
概念辨析
4.SO2、NH3、CO2等气体溶于水形成的溶液能够导电,因此SO2、NH3、CO2是电解质。这种说法正确吗?
不正确, SO2、NH3、CO2等气体溶于水分别与水反应生成了H2SO3、NH3 H2O、H2CO3,
H2SO3、NH3 H2O、H2CO3是电解质
.
.
概念辨析
物
质
混合物
纯净物
单 质
化合物
均不能电离
能够电离
非电解质
电解质
既不是电解质也不是非电解质
水溶液
熔融状态
酸、碱、盐、水、金属氧化物
大多数有机物、多数非金属氧化物、部分非金属氢化物
第二节 离子反应
2.1 电解质的电离
第1课时
第一章 物质及其变化
课堂导入
【思考与讨论】生活常识告诉我们,给电气设备通电时,用潮湿多汗的手操作时易发生触电事故。这是为什么呢?
在这个过程中是NaCl溶液、NaCl固体还是纯水在导电?
触电
在三个烧杯中分别加入干燥的NaCl固体、 NaCl溶液和蒸馏水,如图所示连接装置,将电极依次放入烧杯中,分别接通电源,预测实验现象。
【探究一】探究氯化钠固体、纯水、氯化钠溶液的导电性
NaCl固体和蒸馏水“不导电”, NaCl溶液导电
【资料】电流是带电荷的粒子定向移动形成的,因此能导电的物质必须具有能自由移动的、带电的粒子。
【思考与讨论】为什么纯水、 NaCl固体“不导电”,而NaCl溶液却可以导电呢?请结合初中所学知识从物质导电的原理、溶液中可能存在的微粒等角度来分析。
【探究二】NaCl溶液能够导电的原因
金属导电:
有自由移动的电子
?
NaCl溶液导电
有自由移动的离子
英国物理学家法拉第将从电堆两极引出的导线插入到澄清的MgSO4溶液中,他发现不但溶液能够导电,而且还能看到金属镁悬浮在溶液中,他把这种电流使化合物分解的现象称为电离,把电解以前未分解的物质叫做电解质,把分解后得到的能够输送电流的带电物质称为离子。
【探究三】NaCl固体溶于水后自由移动的离子是如何形成的?
离子是在通电之后才产生的
?
阿伦尼乌斯在1883年时,提出:电解质在水溶液中自动解离成离子,提出了电离模型。
【观察】NaCl溶液中能自由移动的带电粒子的形成
【探究三】NaCl固体溶于水后自由移动的离子是如何形成的?
【思考与讨论】结合金属导电的微观过程,分析在氯化钠溶液导电的过程中水和通电的作用分别是什么?
金属材料导电的微观过程
【探究三】NaCl固体溶于水后自由移动的离子是如何形成的?
【观察】氯化钠溶液导电的微观示意图
【思考】氯化钠固体里是否有钠离子和氯离子?为什么干燥的氯化钠固体不导电?
NaCl晶体的结构模型
通 电
【思考与讨论】还有什么方法可以使氯化钠固体里的钠离子和氯离子自由移动?
提供能量
加热至熔融
加热至熔化的NaCl固体能导电
熔融的KNO3固体、NaOH固体等也能导电
氯化钠固体
不能导电
氯化钠溶液
熔融
氯化钠
能导电
加水溶解
加热融化
宏
观
微
观
Na+、Cl-不能自由移动
Na+、Cl-能自由移动
电解质
电离
加水溶解或
加热融化
【实验探究】探究硝酸钾溶液、氢氧化钠溶液、稀盐酸溶液、蔗糖溶液、酒精溶液是否导电
稀硫酸溶液
蔗糖溶液
酒精溶液
氯化钠溶液
硝酸钾溶液
氢氧化钠溶液
非电解质
电解质
导电
加水溶解
加热融化
宏
观
微
观
产生自由移动的离子
电离
OR
【小结】
(化合物)
常见的电解质
(1)酸;
(2)碱;
(3)盐;
(4)水;
(5)金属氧化物(熔融状态下导电)
常见的电解质和非电解质
常见的非电解质
(1)大多数有机物;
(2)多数非金属氧化物;
(3)部分非金属氢化物(如NH3)
概念辨析
1.铜丝、盐酸能导电,它们是电解质还是非电解质?
既不是电解质也不是非电解质
2.BaSO4、AgCl、CaCO3的溶液几乎不导电,它们是电解质吗?
是;难溶盐在熔融状态时可导电,且溶于水的部分可电离
3.(1)电解质本身一定能导电;
(2)纯硫酸在熔融状态下不导电,所以硫酸不是电解质,这两种说法正确吗?
(1)不正确,电解质导电是有条件的
(2)不正确,H2SO4溶于水可导电
概念辨析
4.SO2、NH3、CO2等气体溶于水形成的溶液能够导电,因此SO2、NH3、CO2是电解质。这种说法正确吗?
不正确, SO2、NH3、CO2等气体溶于水分别与水反应生成了H2SO3、NH3 H2O、H2CO3,
H2SO3、NH3 H2O、H2CO3是电解质
.
.
概念辨析
物
质
混合物
纯净物
单 质
化合物
均不能电离
能够电离
非电解质
电解质
既不是电解质也不是非电解质
水溶液
熔融状态
酸、碱、盐、水、金属氧化物
大多数有机物、多数非金属氧化物、部分非金属氢化物
