高中化学人教版(2019)选择性必修1 2.2.5等效平衡(共29张ppt)
文档属性
| 名称 | 高中化学人教版(2019)选择性必修1 2.2.5等效平衡(共29张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 7.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-06-29 22:53:36 | ||
图片预览





文档简介
(共29张PPT)
走进奇妙的化学世界
选择性必修1
第二章 化学反应速率
与化学平衡
第二节 化学平衡
第5课时 等效平衡
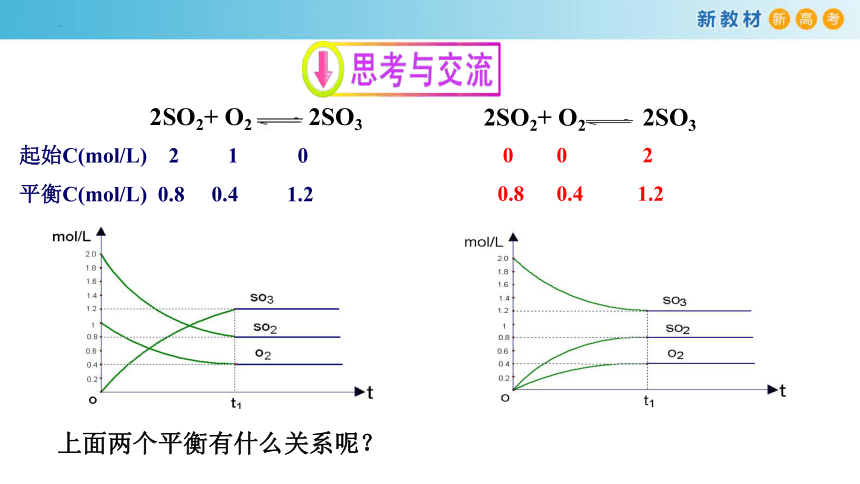
2SO2+ O2 2SO3
起始C(mol/L) 2 1 0
平衡C(mol/L) 0.8 0.4 1.2
2SO2+ O2 2SO3
0 0 2
0.8 0.4 1.2
上面两个平衡有什么关系呢?
学习
目标
第5课时
等效平衡
PART
01
PART
02
PART
02
了解等效平衡的定义
理解常见的平衡等效类型
掌握分析平衡问题的几种方法
1. 在相同的条件下,对同一个可逆反应,反应无论从正反应方向开始进行还是从逆方向开始进行,在达到同一化学平衡状态时,同一种组分的百分含量(体积分数,物质的量分数等)均相同,这样的平衡互称为等效平衡。
若各物质的量也相同,则称为等同平衡。
①恒T恒V,②恒T恒P
一. 等效平衡的概念和分析
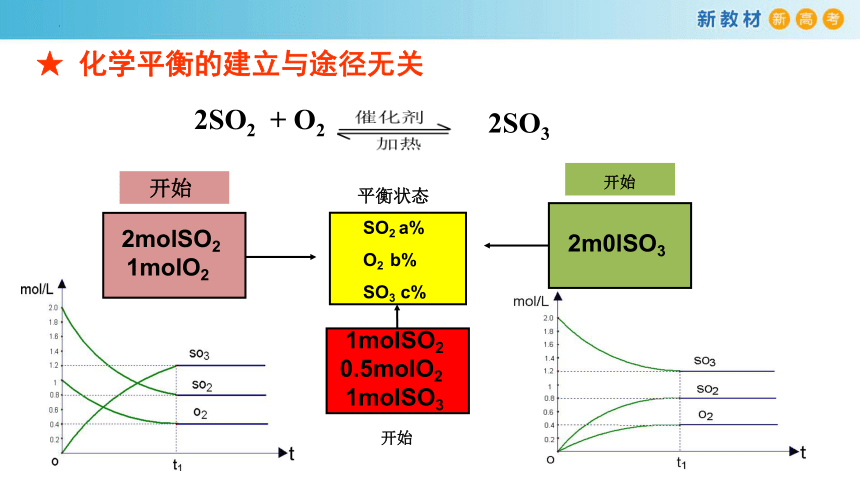
2SO2 + O2
2SO3
★ 化学平衡的建立与途径无关
SO2 a%
O2 b%
SO3 c%
平衡状态
2molSO2
1molO2
开始
2m0lSO3
开始
1molSO2
0.5molO2
1molSO3
开始
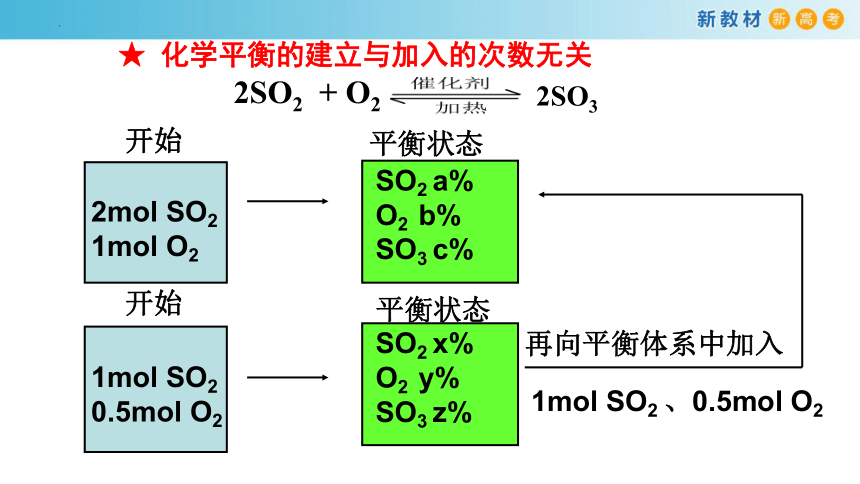
★ 化学平衡的建立与加入的次数无关
再向平衡体系中加入
1mol SO2 、0.5mol O2
2SO2 + O2
2SO3
2mol SO2 1mol O2
开始
SO2 a%
O2 b%
SO3 c%
平衡状态
1mol SO2 0.5mol O2
开始
平衡状态
SO2 x%
O2 y%
SO3 z%
2、等效平衡的类型和判断方法
①反应前后气体分子数发生变化的可逆反应
恒温恒容: 2SO2 (g) + O2(g) 2SO3 (g)
途径1起始 2mol 1mol 0
途径2起始 0mol 0mol 2mol
途径3起始 0.5mol
途径4起始 amol bmol cmol
思考:
(1)途径3 中O2(g)和SO3(g)的起始量为多少,到达平衡时可与途径1等效
(2)途径4中a、b、c符合怎样的关系达到平衡状态时与途径1等效
1.5mol
0.25mol
a+c=2
2b+c=2
恒温恒容条件下等效平衡的条件
也就是△n(g)≠0的可逆反应
处理方法
把不同的起始状态,通过化学方程式中的计量数,换算成同一边物质(反应物一边或生成物一边),如果各反应物或生成物的物质的量相等,则是等效平衡。
等效平衡的分类及判断方法
1、恒温、恒容条件下的等效平衡(T、V)
① mA(g)+nB(g) pC(g)+ qD(g)
m+n ≠p+q
判断方法:
使用极限换算法,把各体系的起始物质的量换算成同一反应物或生成物,若各物质起始物质的量相同,则两平衡等效。
特点:
两次平衡时各组分百分量、n、c均相同
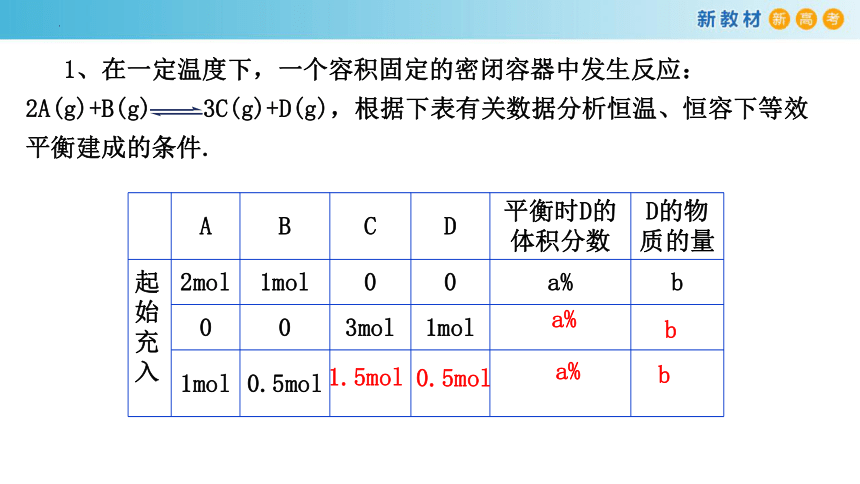
1、在一定温度下,一个容积固定的密闭容器中发生反应:2A(g)+B(g) 3C(g)+D(g),根据下表有关数据分析恒温、恒容下等效平衡建成的条件.
A B C D 平衡时D的体积分数 D的物质的量
2mol 1mol 0 0 a% b
0 0 3mol 1mol
1mol 0.5mol
起始
充入
a%
a%
1.5mol
0.5mol
b
b
2、在一个1L的密闭容器中,加入2molA和1molB ,发生下述反应:
达到平衡时,C的浓度为1.2mol/L , C的体积分数为a% 。
(1)维持容器的体积和温度不变,按下列配比作为起始物质,达到平衡后,C的浓度仍是1.2mol/L的是( )
A、3mol C+1mol D
B、1mol A+0.5mol B+1.5mol C+0.5mol D
C、1mol A+0.5mol B+1.5mol C
D、4mol A+2mol B
A、B
2molH2 1molI2
500℃
2molH2 1molI2
1L
1L
恒温恒容下,H2 (g)+I2 (g) 2HI(g)
途径1起始 2 mol 1mol 0
途径2起始 1mol 0 1mol
途径3起始 4mol 2mol 0
途径4起始 3mol 1mol 2mol
2molH2
1molI2
1
500℃ 1L
2molH2 1molI2
2molH2 1molI2
4molH2
2molI2
3
500℃ 1L
途径2、
3、4与
途径1
等效吗?
2
平衡不移动
加压
等效
②反应前后气体分子数不发生变化的可逆反应
也就是△n(g)=0的可逆反应
2molH2
1molI2
1
500℃ 1L
平衡状态
HI%= a
n( H2) =b
4molH2
2molI2
3
500℃ 1L
平衡状态
HI%= a
n( H2) =2b
一边倒,等比例;
ω%对应相等
n、c成倍数关系
等效平衡的分类及判断方法
1、恒温、恒容条件下的等效平衡(T、V)
mA(g)+nB(g) pC(g)+ qD(g)
m+n=p+q
判断方法:
使用极限换算法,把各体系的起始物质的量换算成同一反应物或生成物,若各物质起始的物质的量比值相同,则两平衡等效。
特点:
两次平衡时各组分百分量相同,n、c同比例变化
1、对于H2+I2(g) 2HI,在恒温、恒容下,按下列不同量反应等效的有 。
1.8
0.1
0.1
4 起始物质的量
2
1
1
3 起始物质的量
a
0
0
5 起始物质的量
1
1.5
0
2 起始物质的量
0
4
1
1 起始物质的量
HI
I2
H2
编号
1、2
3、4、5
2mol SO2
1mol O2
途径1
SO2 a%
O2 b%
SO3 c%
2mol SO2
1mol O2
2mol SO2
1mol O2
SO2 a%
O2 b%
SO3 c%
SO2 a%
O2 b%
SO3 c%
SO2 a%
O2 b%
SO3 c%
4mol SO2
2mol O2
途径2
平衡状态
平衡状态
恒温恒压条件下等效平衡的条件
2SO2(g)+O2(g) 2SO3(g)
途径1起始 2mol 1mol 0
途径2起始 4 mol 2 mol 0
途径1和2是否为等效平衡?
一一边倒,等比例;
ω% 、c对应相等
n成倍数关系
等效平衡的分类及判断方法
2、恒温、恒压条件下的等效平衡(T、P)
判断方法:
使用极限换算法,把各体系的起始物质的量换算成同一反应物或生成物,若各物质起始的物质的量比值相同,则两平衡等效。
特点:
两次平衡时各组分百分量、 c相同, n同比例变化
1、在一个1L的密闭容器中,加入2molA和1molB ,发生下述反应:
达到平衡时,C的浓度为1.2mol/L , (C的体积分数为a%) ,维持容器的压强和温度不变,按下列配比作为起始物质,达到平衡后,C的浓度仍是1.2mol/L(或C的体积分数仍是a%)的是( )
A、3molC + 1molD
B、1molA + 0.5molB + 1.5molC + 0.5molD
C、1molA + 0.5molB + 1.5molC
D、4molA + 2molB
A、B、D
条件 等效条件 结果
恒温恒压 投料换算成相同物质表示时等比例 两次平衡时各组分百分量相同、c相同,n同比例变化
恒温恒容 m+n=p+q
恒温恒容 m+n ≠p+q 投料换算成相同物质表示时量相等 两次平衡时各组分百分量、 c 、 n均相同
投料换算成相同物质表示时等比例
两次平衡时各组分百分量相同, c 、 n同比例变化
mA(g)+nB(g) pC(g)+ qD(g)
1.在恒温恒容条件下,按下列四种情况分别建立平衡,其中为等效平衡的是-----------。
N2(g)+3H2(g) 2NH3
① 1 mol 3 mol 0 mol
② 0 mol 0 mol 2 mol
③ 0.5 mol 1.5 mol 1 mol
④ 1 mol 3 mol 2 mol
①②③
2.有一个固定体积的密闭容器中,加入2molA和1molB发生反应,2A(g) + B(g) 3C(g) + D(g)达到平衡时,C的浓度为Wmol/L,若维持容器体积和温度不变,按下列四种方法改变起始物质,达平衡时C的浓度仍为Wmol/L的是( )
A.4mol A + 2mol B B.2mol A + 1mol B + 3mol C + 1mol D
C.3mol C + 1mol D +1mol B D.3mol C + 1mol D
E、1molA+0.5molB+1.5molC+0.5molD
恒温恒容
(2+2)molA+(1+1)molB
2molA
+(1+1)molB
2molA+1molB
(1+1)molA+
(0.5+0.5)molB
DE
3、某温度下,在一个容积恒定的密闭容器中发生如下可逆反应:
CO(g)+H2O(g) CO2(g)+H2(g) △H<0 , 反应达到平衡时,测得容器中各物质均为nmol,现欲使H2的平衡浓度增大一倍,在其他条件不变时,下列措施可以采用的是(
A、升高温度 B、加入催化剂
C、再加入nmolCO和nmolH2O D、再加入2nmolCO2和2nmolH2
D
4、在固定体积的密闭容器内,加入2mol A、1mol B,发生反应:A(气)+B(气) 2C(气)达 到平衡时,C的质量分数为W。在相同(T、V)条件下,按下列情况充入物质达到平衡时C的质量分数仍为W的是
A.2mol C
B.3mol C
C.4mol A、2mol B
D.1mol A、2mol C
CD
5. 在恒温、恒压的条件下,向可变容积的密闭容器中充入3L A和2L B,发生如下反应:3A(气)+2B(气) xC(气)+yD(气),达到平衡时,
C的体积分数为m%。若维持温度压强不变,以0.6L A , 0.4L B,4L C ,0.8L D作为起始物质充入密闭容器中,达到平衡时C的体积分数仍为m%,则x、y的值分别为( )
A x=3 y=1 B x=4 y=1
C x=5 y =1 D x=5 y=2
C
起始量 转化量(同侧物质)
新起始量→与原标准量对照→符合条件,互为等效平衡
解题方法
1molNO2
a%
1molNO2
a%
不考虑化学平衡的移动
NO2的百分含量a%
化学平衡:2NO2 N2O4
NO2的百分含量减小
分次投料和
一次投料效果相同
2molNO2
二. 利用等效平衡的方法解决不等效平衡问题
1、在一恒温恒容的密闭容器中加入1molNO2发生反应,达到化学平衡后,NO2的百分含量a%,再加入1molNO2,达到新的化学平衡后,NO2的百分含量增大还是减小?
2、在相同的A、B密闭容器中分别充入2molSO2和1molO2,使它们在一定温度下反应,并达新平衡:
2SO2+O2 2SO3(g)。若A容器保持体积不变,B容器保持压强不变。当A中SO2的转化率为25%时,B中SO2的转化率为:
A、25% B、大于25%
C、小于25% D、无法判断
B
相比较恒压相当于加压
2SO2 + O2
2SO3
2mol SO2
1mol O2
开始
SO2 a%
O2 b%
SO3 c%
2mol SO2
1mol O2
2mol SO2
1mol O2
SO2 a%
O2 b%
SO3 c%
SO2 a%
O2 b%
SO3 c%
SO2 a%
O2 b%
SO3 c%
加压
4mol SO2
2mol O2
开始
SO2O2 SO3 >c%
平衡状态
平衡状态
3.等量的反应物在两个容积相等的容器中发生:N2(g)+3H2(g) 2NH3(g),并达到平衡。在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中NH3的百分含量p%,则乙容器中NH3的百分含量( )
A.等于p% B.大于p% C.小于p% D.无法判断
B
先假定甲、乙的体积都不变,达到平衡后两容器中的平衡时全等效平衡,NH3的百分含量相等。
而实际上乙容器的压强不变,可逆反应是向气体体积减小的方向建立平衡,因此达平衡后,欲保持乙的压强不变,就需要缩小乙容器的体积。
因此乙相对于甲,相当于甲平衡后,缩小容器体积加压,平衡向气体体积减小的方向移动。若甲容器中NH3的百分含量为P%,则乙的NH3的百分含量将大于甲,大于p%
练1.一定温度下,将a mol PCl5通入一个容积固定不变的密闭容器中,发生反应:PCl5(g) PCl3(g)+Cl2(g),反应达到平衡时,测得混合气体的压强为p1,此时再向容器中通入a mol PCl5,同样温度下再达到平衡时,测得压强为p2,下列判断正确的是( )
A.2p1>p2 B.PCl5的分解率增大
C.p1>p2 D.Cl2的体积分数增大
a mol
PCl5
原开始
平衡压强为p1
平衡状态
2a mol
PCl5
后开始
平衡压强为p2
平衡状态
A
练2.将1 mol SO2和1 mol O2通入体积不变的密闭容器中,在一定条件下发生反应,达到平衡时SO3为0.3 mol,此时若移走0.5 molO2和0.5 molSO2,相同温度下再次达到新平衡时SO3的物质的量为( )
A.0.3 mol B.0.15 mol
C.小于0.15 mol D.大于0.15 mol,小于0.3 mol
1mol SO2
1mol O2
原开始
平衡SO3为0.3 mol
平衡状态
0.5molSO2
0.5mol O2
后开始
平衡SO3为?
平衡状态
C
2 SO2(g)+ O2(g) 2SO3(g)
练3.如图所示,向A中充入1mol X和lmo1 Y,向B中充入2molX和2molY,起始Va=Vb=a L,在相同温度和有催化剂的条件下,两容器中各自发生下列反应:X(g)+Y(g) 2Z(g)+W (g); △H >0,达到平衡时,VA=1.2aL。则:
(1)反应开始时,B容器中化学反应速率_______A容器中的化学反应速率(填“大于”、“小于”或“等于”);
(2)A容器中X的转化率为__________,且B容器中X的转化率__________A容器中X的转化率;(填“大于”、“小于”或“等于”);
(3)打开K一段时间达到新平衡时,A的体积为____________(连通管中气体体积不计) 。
大于
A
B
X(g)+Y(g) 2Z(g)+W (g); △H >0
起始:
1molX,1molY
2molX,2molY
平衡:
A
B
1.2aL
(2)A容器中X的转化率为__________,且B容器中X的转化率__________A容器中X的转化率;(填“大于”、“小于”或“等于”);
40%
大于
A
B
X(g)+Y(g) 2Z(g)+W (g); △H >0,
起始:
1molX,1molY
2molX,2molY
平衡:
A
B
3.6aL
(3)打开K一段时间达到新平衡时,A的体积为____________(连通管中气体体积不计) 。
2.6L
走进奇妙的化学世界
选择性必修1
第二章 化学反应速率
与化学平衡
第二节 化学平衡
第5课时 等效平衡
2SO2+ O2 2SO3
起始C(mol/L) 2 1 0
平衡C(mol/L) 0.8 0.4 1.2
2SO2+ O2 2SO3
0 0 2
0.8 0.4 1.2
上面两个平衡有什么关系呢?
学习
目标
第5课时
等效平衡
PART
01
PART
02
PART
02
了解等效平衡的定义
理解常见的平衡等效类型
掌握分析平衡问题的几种方法
1. 在相同的条件下,对同一个可逆反应,反应无论从正反应方向开始进行还是从逆方向开始进行,在达到同一化学平衡状态时,同一种组分的百分含量(体积分数,物质的量分数等)均相同,这样的平衡互称为等效平衡。
若各物质的量也相同,则称为等同平衡。
①恒T恒V,②恒T恒P
一. 等效平衡的概念和分析
2SO2 + O2
2SO3
★ 化学平衡的建立与途径无关
SO2 a%
O2 b%
SO3 c%
平衡状态
2molSO2
1molO2
开始
2m0lSO3
开始
1molSO2
0.5molO2
1molSO3
开始
★ 化学平衡的建立与加入的次数无关
再向平衡体系中加入
1mol SO2 、0.5mol O2
2SO2 + O2
2SO3
2mol SO2 1mol O2
开始
SO2 a%
O2 b%
SO3 c%
平衡状态
1mol SO2 0.5mol O2
开始
平衡状态
SO2 x%
O2 y%
SO3 z%
2、等效平衡的类型和判断方法
①反应前后气体分子数发生变化的可逆反应
恒温恒容: 2SO2 (g) + O2(g) 2SO3 (g)
途径1起始 2mol 1mol 0
途径2起始 0mol 0mol 2mol
途径3起始 0.5mol
途径4起始 amol bmol cmol
思考:
(1)途径3 中O2(g)和SO3(g)的起始量为多少,到达平衡时可与途径1等效
(2)途径4中a、b、c符合怎样的关系达到平衡状态时与途径1等效
1.5mol
0.25mol
a+c=2
2b+c=2
恒温恒容条件下等效平衡的条件
也就是△n(g)≠0的可逆反应
处理方法
把不同的起始状态,通过化学方程式中的计量数,换算成同一边物质(反应物一边或生成物一边),如果各反应物或生成物的物质的量相等,则是等效平衡。
等效平衡的分类及判断方法
1、恒温、恒容条件下的等效平衡(T、V)
① mA(g)+nB(g) pC(g)+ qD(g)
m+n ≠p+q
判断方法:
使用极限换算法,把各体系的起始物质的量换算成同一反应物或生成物,若各物质起始物质的量相同,则两平衡等效。
特点:
两次平衡时各组分百分量、n、c均相同
1、在一定温度下,一个容积固定的密闭容器中发生反应:2A(g)+B(g) 3C(g)+D(g),根据下表有关数据分析恒温、恒容下等效平衡建成的条件.
A B C D 平衡时D的体积分数 D的物质的量
2mol 1mol 0 0 a% b
0 0 3mol 1mol
1mol 0.5mol
起始
充入
a%
a%
1.5mol
0.5mol
b
b
2、在一个1L的密闭容器中,加入2molA和1molB ,发生下述反应:
达到平衡时,C的浓度为1.2mol/L , C的体积分数为a% 。
(1)维持容器的体积和温度不变,按下列配比作为起始物质,达到平衡后,C的浓度仍是1.2mol/L的是( )
A、3mol C+1mol D
B、1mol A+0.5mol B+1.5mol C+0.5mol D
C、1mol A+0.5mol B+1.5mol C
D、4mol A+2mol B
A、B
2molH2 1molI2
500℃
2molH2 1molI2
1L
1L
恒温恒容下,H2 (g)+I2 (g) 2HI(g)
途径1起始 2 mol 1mol 0
途径2起始 1mol 0 1mol
途径3起始 4mol 2mol 0
途径4起始 3mol 1mol 2mol
2molH2
1molI2
1
500℃ 1L
2molH2 1molI2
2molH2 1molI2
4molH2
2molI2
3
500℃ 1L
途径2、
3、4与
途径1
等效吗?
2
平衡不移动
加压
等效
②反应前后气体分子数不发生变化的可逆反应
也就是△n(g)=0的可逆反应
2molH2
1molI2
1
500℃ 1L
平衡状态
HI%= a
n( H2) =b
4molH2
2molI2
3
500℃ 1L
平衡状态
HI%= a
n( H2) =2b
一边倒,等比例;
ω%对应相等
n、c成倍数关系
等效平衡的分类及判断方法
1、恒温、恒容条件下的等效平衡(T、V)
mA(g)+nB(g) pC(g)+ qD(g)
m+n=p+q
判断方法:
使用极限换算法,把各体系的起始物质的量换算成同一反应物或生成物,若各物质起始的物质的量比值相同,则两平衡等效。
特点:
两次平衡时各组分百分量相同,n、c同比例变化
1、对于H2+I2(g) 2HI,在恒温、恒容下,按下列不同量反应等效的有 。
1.8
0.1
0.1
4 起始物质的量
2
1
1
3 起始物质的量
a
0
0
5 起始物质的量
1
1.5
0
2 起始物质的量
0
4
1
1 起始物质的量
HI
I2
H2
编号
1、2
3、4、5
2mol SO2
1mol O2
途径1
SO2 a%
O2 b%
SO3 c%
2mol SO2
1mol O2
2mol SO2
1mol O2
SO2 a%
O2 b%
SO3 c%
SO2 a%
O2 b%
SO3 c%
SO2 a%
O2 b%
SO3 c%
4mol SO2
2mol O2
途径2
平衡状态
平衡状态
恒温恒压条件下等效平衡的条件
2SO2(g)+O2(g) 2SO3(g)
途径1起始 2mol 1mol 0
途径2起始 4 mol 2 mol 0
途径1和2是否为等效平衡?
一一边倒,等比例;
ω% 、c对应相等
n成倍数关系
等效平衡的分类及判断方法
2、恒温、恒压条件下的等效平衡(T、P)
判断方法:
使用极限换算法,把各体系的起始物质的量换算成同一反应物或生成物,若各物质起始的物质的量比值相同,则两平衡等效。
特点:
两次平衡时各组分百分量、 c相同, n同比例变化
1、在一个1L的密闭容器中,加入2molA和1molB ,发生下述反应:
达到平衡时,C的浓度为1.2mol/L , (C的体积分数为a%) ,维持容器的压强和温度不变,按下列配比作为起始物质,达到平衡后,C的浓度仍是1.2mol/L(或C的体积分数仍是a%)的是( )
A、3molC + 1molD
B、1molA + 0.5molB + 1.5molC + 0.5molD
C、1molA + 0.5molB + 1.5molC
D、4molA + 2molB
A、B、D
条件 等效条件 结果
恒温恒压 投料换算成相同物质表示时等比例 两次平衡时各组分百分量相同、c相同,n同比例变化
恒温恒容 m+n=p+q
恒温恒容 m+n ≠p+q 投料换算成相同物质表示时量相等 两次平衡时各组分百分量、 c 、 n均相同
投料换算成相同物质表示时等比例
两次平衡时各组分百分量相同, c 、 n同比例变化
mA(g)+nB(g) pC(g)+ qD(g)
1.在恒温恒容条件下,按下列四种情况分别建立平衡,其中为等效平衡的是-----------。
N2(g)+3H2(g) 2NH3
① 1 mol 3 mol 0 mol
② 0 mol 0 mol 2 mol
③ 0.5 mol 1.5 mol 1 mol
④ 1 mol 3 mol 2 mol
①②③
2.有一个固定体积的密闭容器中,加入2molA和1molB发生反应,2A(g) + B(g) 3C(g) + D(g)达到平衡时,C的浓度为Wmol/L,若维持容器体积和温度不变,按下列四种方法改变起始物质,达平衡时C的浓度仍为Wmol/L的是( )
A.4mol A + 2mol B B.2mol A + 1mol B + 3mol C + 1mol D
C.3mol C + 1mol D +1mol B D.3mol C + 1mol D
E、1molA+0.5molB+1.5molC+0.5molD
恒温恒容
(2+2)molA+(1+1)molB
2molA
+(1+1)molB
2molA+1molB
(1+1)molA+
(0.5+0.5)molB
DE
3、某温度下,在一个容积恒定的密闭容器中发生如下可逆反应:
CO(g)+H2O(g) CO2(g)+H2(g) △H<0 , 反应达到平衡时,测得容器中各物质均为nmol,现欲使H2的平衡浓度增大一倍,在其他条件不变时,下列措施可以采用的是(
A、升高温度 B、加入催化剂
C、再加入nmolCO和nmolH2O D、再加入2nmolCO2和2nmolH2
D
4、在固定体积的密闭容器内,加入2mol A、1mol B,发生反应:A(气)+B(气) 2C(气)达 到平衡时,C的质量分数为W。在相同(T、V)条件下,按下列情况充入物质达到平衡时C的质量分数仍为W的是
A.2mol C
B.3mol C
C.4mol A、2mol B
D.1mol A、2mol C
CD
5. 在恒温、恒压的条件下,向可变容积的密闭容器中充入3L A和2L B,发生如下反应:3A(气)+2B(气) xC(气)+yD(气),达到平衡时,
C的体积分数为m%。若维持温度压强不变,以0.6L A , 0.4L B,4L C ,0.8L D作为起始物质充入密闭容器中,达到平衡时C的体积分数仍为m%,则x、y的值分别为( )
A x=3 y=1 B x=4 y=1
C x=5 y =1 D x=5 y=2
C
起始量 转化量(同侧物质)
新起始量→与原标准量对照→符合条件,互为等效平衡
解题方法
1molNO2
a%
1molNO2
a%
不考虑化学平衡的移动
NO2的百分含量a%
化学平衡:2NO2 N2O4
NO2的百分含量减小
分次投料和
一次投料效果相同
2molNO2
二. 利用等效平衡的方法解决不等效平衡问题
1、在一恒温恒容的密闭容器中加入1molNO2发生反应,达到化学平衡后,NO2的百分含量a%,再加入1molNO2,达到新的化学平衡后,NO2的百分含量增大还是减小?
2、在相同的A、B密闭容器中分别充入2molSO2和1molO2,使它们在一定温度下反应,并达新平衡:
2SO2+O2 2SO3(g)。若A容器保持体积不变,B容器保持压强不变。当A中SO2的转化率为25%时,B中SO2的转化率为:
A、25% B、大于25%
C、小于25% D、无法判断
B
相比较恒压相当于加压
2SO2 + O2
2SO3
2mol SO2
1mol O2
开始
SO2 a%
O2 b%
SO3 c%
2mol SO2
1mol O2
2mol SO2
1mol O2
SO2 a%
O2 b%
SO3 c%
SO2 a%
O2 b%
SO3 c%
SO2 a%
O2 b%
SO3 c%
加压
4mol SO2
2mol O2
开始
SO2
平衡状态
平衡状态
3.等量的反应物在两个容积相等的容器中发生:N2(g)+3H2(g) 2NH3(g),并达到平衡。在这过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中NH3的百分含量p%,则乙容器中NH3的百分含量( )
A.等于p% B.大于p% C.小于p% D.无法判断
B
先假定甲、乙的体积都不变,达到平衡后两容器中的平衡时全等效平衡,NH3的百分含量相等。
而实际上乙容器的压强不变,可逆反应是向气体体积减小的方向建立平衡,因此达平衡后,欲保持乙的压强不变,就需要缩小乙容器的体积。
因此乙相对于甲,相当于甲平衡后,缩小容器体积加压,平衡向气体体积减小的方向移动。若甲容器中NH3的百分含量为P%,则乙的NH3的百分含量将大于甲,大于p%
练1.一定温度下,将a mol PCl5通入一个容积固定不变的密闭容器中,发生反应:PCl5(g) PCl3(g)+Cl2(g),反应达到平衡时,测得混合气体的压强为p1,此时再向容器中通入a mol PCl5,同样温度下再达到平衡时,测得压强为p2,下列判断正确的是( )
A.2p1>p2 B.PCl5的分解率增大
C.p1>p2 D.Cl2的体积分数增大
a mol
PCl5
原开始
平衡压强为p1
平衡状态
2a mol
PCl5
后开始
平衡压强为p2
平衡状态
A
练2.将1 mol SO2和1 mol O2通入体积不变的密闭容器中,在一定条件下发生反应,达到平衡时SO3为0.3 mol,此时若移走0.5 molO2和0.5 molSO2,相同温度下再次达到新平衡时SO3的物质的量为( )
A.0.3 mol B.0.15 mol
C.小于0.15 mol D.大于0.15 mol,小于0.3 mol
1mol SO2
1mol O2
原开始
平衡SO3为0.3 mol
平衡状态
0.5molSO2
0.5mol O2
后开始
平衡SO3为?
平衡状态
C
2 SO2(g)+ O2(g) 2SO3(g)
练3.如图所示,向A中充入1mol X和lmo1 Y,向B中充入2molX和2molY,起始Va=Vb=a L,在相同温度和有催化剂的条件下,两容器中各自发生下列反应:X(g)+Y(g) 2Z(g)+W (g); △H >0,达到平衡时,VA=1.2aL。则:
(1)反应开始时,B容器中化学反应速率_______A容器中的化学反应速率(填“大于”、“小于”或“等于”);
(2)A容器中X的转化率为__________,且B容器中X的转化率__________A容器中X的转化率;(填“大于”、“小于”或“等于”);
(3)打开K一段时间达到新平衡时,A的体积为____________(连通管中气体体积不计) 。
大于
A
B
X(g)+Y(g) 2Z(g)+W (g); △H >0
起始:
1molX,1molY
2molX,2molY
平衡:
A
B
1.2aL
(2)A容器中X的转化率为__________,且B容器中X的转化率__________A容器中X的转化率;(填“大于”、“小于”或“等于”);
40%
大于
A
B
X(g)+Y(g) 2Z(g)+W (g); △H >0,
起始:
1molX,1molY
2molX,2molY
平衡:
A
B
3.6aL
(3)打开K一段时间达到新平衡时,A的体积为____________(连通管中气体体积不计) 。
2.6L
