化学人教版(2019)必修第一册2.3.3物质的量浓度(共37张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册2.3.3物质的量浓度(共37张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 4.2MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-07-04 16:45:26 | ||
图片预览









文档简介
(共37张PPT)
2.3.3物质的量浓度
1
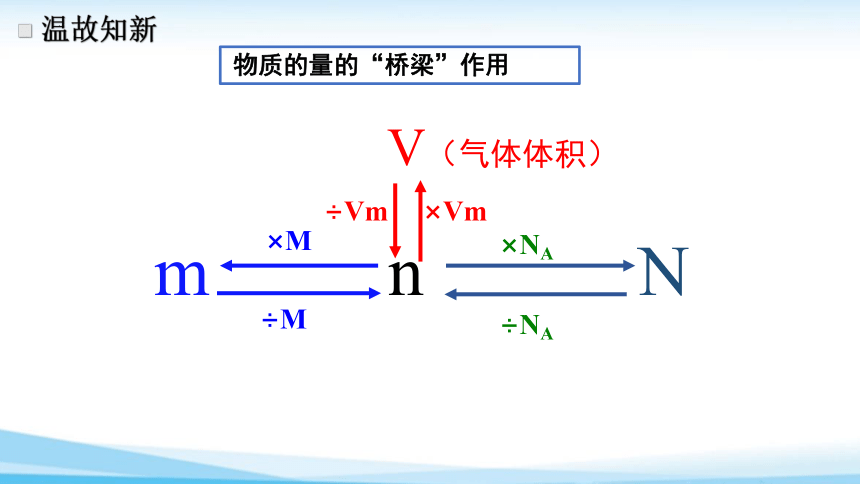
温故知新
物质的量的“桥梁”作用
÷NA
m n N
÷M
×M
×NA
V(气体体积)
÷Vm
×Vm
浓 or 稀 ?
3
导入新课
生理盐水
(氯化钠0.9%)
海鲜酱油
(氨基酸态氮≥0.40 g/100 mL)
白酒
(酒精度 53% vol)
血中微量元素含量
(血钾 4.1 mmol/L)
溶质质量
溶液质量
溶质质量
溶液体积
溶质体积
溶液体积
溶质的物质的量
溶液体积
4
1. 什么叫溶液?
一种或几种物质分散到另一种物质形成均一、稳定的混合物,叫做溶液。
2. 溶液由什么组成,有什么特点 ?
溶液的组成:
溶质
溶剂
溶液的特点:
均一性
稳定性
思考:初中学过哪种表示溶液浓度的方法?
复习回顾
5
6
溶质的质量分数=
溶质的质量
溶液的质量
× 100%
=
溶质的质量
溶质的质量 + 溶剂的质量
×100%
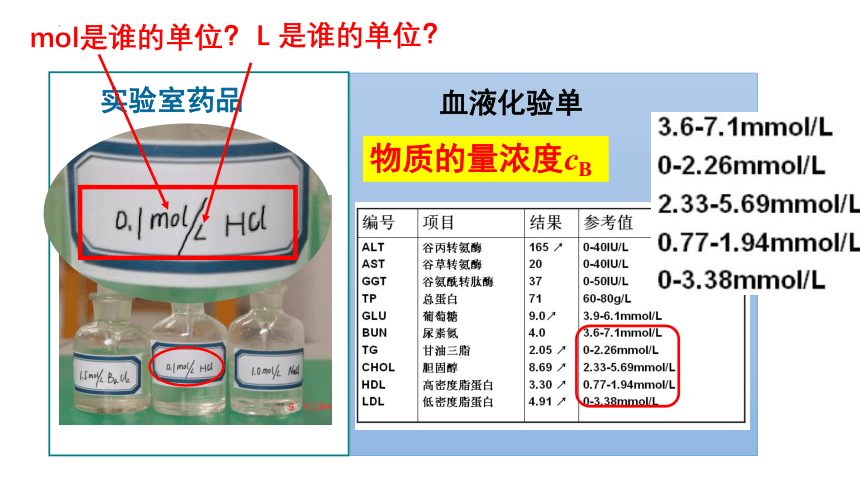
【思考交流】
实验室药品
血液化验单
mol是谁的单位?
L 是谁的单位?
物质的量浓度cB
思考:1mol/L NaOH溶液的含义?
一.物质的量浓度
1L氢氧化钠溶液中含有1mol氢氧化钠
8
定义:
以单位体积溶液中含溶质 B 的物质的量来表示的溶液组成的物理量,叫做溶质 B 的物质的量浓度。
2. 符号: 。
cB
3. 表达式: 。
cB=
nB
V
4. 单位: 。
mol/L或 mol·L-1
科
nB=
×V(溶液)
cB
nB
V(溶液) =
——
cB
9
9
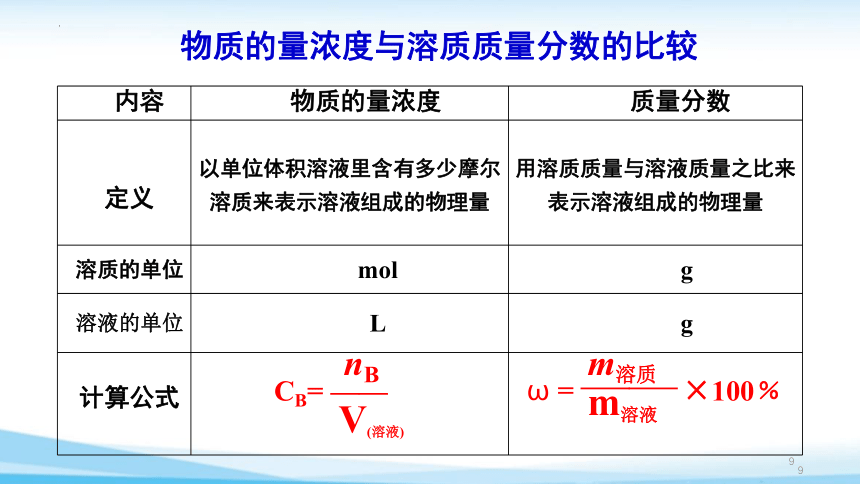
内容 物质的量浓度 质量分数
定义 以单位体积溶液里含有多少摩尔溶质来表示溶液组成的物理量 用溶质质量与溶液质量之比来表示溶液组成的物理量
溶质的单位 mol g
溶液的单位 L g
计算公式
物质的量浓度与溶质质量分数的比较
nB
V(溶液)
CB= ——
m溶质
m溶液
ω = ——
×100﹪
小组讨论
已知:0.9%的医用生理盐水的物质的量浓度为0.154mol/L,请判断正误,并分析原因。
1、表示0.154mol NaCl溶于1L水,则NaCl的物质的量浓度为1mol/L。
2、表示0.154g NaCl溶于1 L溶液,所得溶液中NaCl的物质的量浓度为0.154 mol/L。
3、从1L 0.154 mol / L的NaCl溶液中取出100 mL,溶质的物质的量浓度为0.154 mol/L。
概念辨析:
×
×
√
体积指溶液体积,不是溶剂体积;
溶质用“物质的量”,不是质量;
同一溶液,无论取出多少体积,物质的量浓度不变。
10
11
将62gNa2O溶于水中,配成1L溶液,所得溶质的物质的量浓度为1 mol·L-1
注意:
分析溶质时要注意有关的化学变化
① 与水发生反应生成的新的物质为溶质,
如Na、Na2O、Na2O2 NaOH,SO3 H2SO4等。
②含结晶水的物质如CuSO4·5H2O溶于水,CuSO4为溶质。
思考与交流
×
配制 500 mL 0.1 mol/L 的NaOH 溶液所需NaOH的质量是多少?
例题1
n (NaOH) =c(NaOH)· V[NaOH(aq)]
=0. 1 mol/L × 0. 5 L
= 0. 05 mol
m (NaOH) = n (NaOH) · M(NaOH)
= 0.05 mol × 40 g/mol
= 2g
解:
500ml0.1mol/LNaOH溶液中NaOH的物质的量为:
0.05molNaOH的质量为:
答: 配制 500mL 0.1mol/L NaOH溶液需NaOH 2 g 。
二.有关物质的量浓度的简单计算
12
aq 表示某种物质的水溶液
(1)将1L NaOH溶液中含有40g NaOH,其物质的量浓度为 _________;
(2)0.2mol/L Al2(SO4)3溶液中含有c(Al3+)= ______ , c(SO42-)= ________;
1mol/L
0.4mol/L
0.6mol/L
填空题:
13
启超牌
透心凉
心飞扬
启超工厂
1、自制雪碧 10 L
溶液配制车间
配料1: 0.02 mol/L 醋(乙酸CH3COOH, M= 60 g/mol)
(2)需要醋酸的物质的量为_______ mol,质量为_______g。
n (CH3COOH) =
c (CH3COOH ) × V
= 0.02 mol/L × 10 L
= 0.2 mol
m (CH3COOH) =
n (CH3COOH ) × M
= 0. 2 mol ×60 g/mol
= 12 g
0.2
12
配料2: 0.05 mol/L 小苏打,(NaHCO3, M= 84 g/mol)。
(3)需要碳酸氢钠的物质的量为_______ mol,质量为_______g。
n (NaHCO3) =
c (NaHCO3) × V
= 0.05 mol/L × 10 L
m (NaHCO3) =
n (NaHCO3) × M
= 0. 5 mol ×84 g/mol
= 42 g
0.5
42
= 0.5 mol
14
2.溶液稀释的有关计算
家里只有一瓶蔗糖水,但是小明偏要喝两瓶,于是妈妈把蔗糖水稀释成两瓶,请问,小明吃到的糖有没有变多?
稀释浓溶液时,溶液的质量或体积要发生变化,
溶质的量(质量或物质的量)均不变 。
对于所有的溶液稀释都有:m(溶液稀释前) = m(溶液稀释后)
n(溶液稀释前) = n(溶液稀释后)
m(浓)w(浓)=m(稀)w(稀) 或m1w1=m2w2
c(浓)V(浓)=c(稀)V(稀) 或c1V1=c2V2
15
思考与交流
启超工厂
2、除锈剂的稀释
配方:用18 mol·L-1浓硫酸配制500 mL 1.80 mol·L-1 稀硫酸溶液,需要浓硫酸的体积为多少?
启超牌
除锈剂
溶液稀释车间
V浓 = 50.0 mL
18 mol·L-1 × V浓 = 1.80 mol·L-1 × 0.5 L
16
C浓×V浓 = C稀×V稀
2mol/L的盐酸溶液200L和4mol/L的盐酸溶液100L混合,求混合后溶液中盐酸的物质的量浓度 。
例题3
17
3.溶液混合的有关计算
18
计算并写出计算过程
CNaCl=0.7mol/L
nFeCl3=2mol
VCa(ClO)2= 2L
导学案
如何精确配制1.00 mol·L-1NaCl溶液 ?
19
仪器:
托盘天平、药匙
烧杯、量筒、
玻璃棒、胶头滴管。
步骤:
计算、称量、溶解、装瓶贴标签。
配制100g 5% 的NaCl溶液,需要哪些仪器?如何操作?
粗配制
三、配制一定物质的量浓度的溶液
配制 100mL 1.0mol·L-1NaCl 溶液,该如何配制?
精确配制
1、构造:细颈、平底玻璃瓶,瓶口配有磨口玻璃塞。
2、特点:容量瓶上标有温度、容积、刻度线。
3、常用规格:50ml、100mL、250 mL、500mL、1000mL
4、用途:准确配制一定物质的量浓度的溶液。
认识容量瓶
(2)容量瓶的选择与使用:容量瓶的使用——“一查五忌一原则”
三步查漏:
向容量瓶注入一定量水,盖好瓶塞。用食指摁住瓶塞,另一只手托住瓶底,把容量瓶倒立,观察瓶塞周围是否漏水。如不漏,将容量瓶正立并将瓶塞旋转180°后塞紧,再检查是否漏水。如不漏水,该容量瓶才能使用。
注水→盖塞→倒立→观察→正立→旋180°→倒立→观察
一查
五忌
一、忌用容量瓶溶解固体;
二、忌用容量瓶稀释浓溶液;
三、忌给容量瓶加热;
四、忌把容量瓶当作反应容器;
五、忌用容量瓶长期存放溶液。
因为容量瓶的规格是固定的,所以配制溶液时要根据所配溶液的体积选择合适的容量瓶,例如配制950 mL 1 mol·L-1NaCl溶液,需要用1 000 mL的容量瓶,计算NaCl的质量时也应按1 000 mL溶液来计算。
一原则
选用原则:
等大或稍大。
三、一定物质的量浓度溶液的配制
3、 主要的仪器:
烧杯
分析天平
胶头滴管
100mL容量瓶
量筒
玻璃棒
托盘天平
1.计算
计算所需氯化钠的质量:
m(NaCl)= n(NaCl) ×M(NaCl)
= V(NaCl) ×c(NaCl)×M(NaCl)
=0.1L×1.0mol·L-1×58.5 g·mol-1
= 5.85 g
2.称 量
用托盘天平称取所需溶质的质量
注意事项:
①称量物不能直接放在称量盘内,根据称量物的不同性质,可放在纸片、表面皿或称量瓶内。不能称超过天平最大载重量的物体。
②用浓硫酸配稀硫酸或用浓盐酸配稀盐酸时,应用量筒量取药品。
③同一称量过程中不能更换天平,以免产生相对误差。
注意事项:
应在烧杯中溶解,不能在容量瓶中溶解。
因为在容量瓶上标有温度和体积,这说明容量瓶的体积受温度影响。而物质的溶解往往伴随着一定的热效应,如果用容量瓶进行此项操作,会因热胀冷缩使它的体积不准确,严重时还可能导致容量瓶炸裂。
3.溶解、冷却
将称取量准确的溶质固体放在烧杯中,加适量蒸馏水溶解。用玻璃棒搅拌加速溶解,冷却至室温。
注意事项:由于容量瓶瓶颈较细,为避免液体洒在外面,应用玻璃棒引流。
4.转 移
将冷却至室温的溶液全部转移到容量瓶中。
引流时“两靠一不靠”
烧杯嘴靠在玻璃棒上
玻璃棒靠在刻度线以下的容量瓶内壁上
玻璃棒不要靠在容量瓶瓶口
【思考】将烧杯中的氯化钠溶液倒入到容量瓶中,此时溶质是否完全被转移到容量瓶中?应如何处理?
还有残留在烧杯壁和玻璃棒上的NaCl未被转移。因此要用蒸馏水洗涤用过的烧杯和玻璃棒。
5.洗 涤
用少量蒸馏水洗涤玻璃棒与烧杯 2 ~3 次,洗涤液也要全部转移到100mL容量瓶,用玻璃棒引流
(注意:洗涤液与原溶液总量必须小于容量瓶容量)
思考:
若定容时不小心液面超过了刻度线,怎么办?能用胶头滴管把多余的液体取出吗?
必须重新配制
6.定 容
向容量瓶中加入蒸馏水,在距刻度线 1~2cm时,改用胶头滴管滴加蒸馏水至凹液面最低点与刻度线相切。(视线应与溶液凹液面的最低点相切)
将容量瓶盖好塞子,如图所示,把容量瓶反复上下颠倒摇匀,使得溶液混合均匀,然后竖直放置。
思考:
摇匀后发现液面低于刻线,能否补充水?
不能。摇匀后液面低于刻线是正常现象,因为部分溶液在润湿容量瓶瓶口磨砂处会有所损失所致。
7.摇匀
容量瓶中不能长时间存放溶液,因此要把配制好的溶液转移到试剂瓶中,贴好标签,注明溶液的名称和浓度。
8.装瓶贴签
三、配制一定物质的量浓度溶液步骤
计算
称量
溶解
转移
洗涤
振荡
定容
摇匀
装瓶
【构建认知模型】
÷NA
m n N
÷M
×M
×NA
质量
粒子数目
V(气体体积)
÷Vm
×Vm
cB(溶液)
×V(aq)
÷V(aq)
课堂小结
36
物质的量浓度
物质的量浓度
概念:单位体积的溶液里所含溶质B的物质的量,也称B的物质的量浓度
符号:CB
常用单位:mol/L(或 mol·L-1)
物质的量浓度的相关计算
1.已知溶液的体积和物质的量浓度,求解溶质的质量
2.有关溶液稀释的计算:
n(溶质)= V(浓)×c(浓)= V(稀)×c(稀)
课堂小结
3.有关溶液混合的计算:
2.3.3物质的量浓度
1
温故知新
物质的量的“桥梁”作用
÷NA
m n N
÷M
×M
×NA
V(气体体积)
÷Vm
×Vm
浓 or 稀 ?
3
导入新课
生理盐水
(氯化钠0.9%)
海鲜酱油
(氨基酸态氮≥0.40 g/100 mL)
白酒
(酒精度 53% vol)
血中微量元素含量
(血钾 4.1 mmol/L)
溶质质量
溶液质量
溶质质量
溶液体积
溶质体积
溶液体积
溶质的物质的量
溶液体积
4
1. 什么叫溶液?
一种或几种物质分散到另一种物质形成均一、稳定的混合物,叫做溶液。
2. 溶液由什么组成,有什么特点 ?
溶液的组成:
溶质
溶剂
溶液的特点:
均一性
稳定性
思考:初中学过哪种表示溶液浓度的方法?
复习回顾
5
6
溶质的质量分数=
溶质的质量
溶液的质量
× 100%
=
溶质的质量
溶质的质量 + 溶剂的质量
×100%
【思考交流】
实验室药品
血液化验单
mol是谁的单位?
L 是谁的单位?
物质的量浓度cB
思考:1mol/L NaOH溶液的含义?
一.物质的量浓度
1L氢氧化钠溶液中含有1mol氢氧化钠
8
定义:
以单位体积溶液中含溶质 B 的物质的量来表示的溶液组成的物理量,叫做溶质 B 的物质的量浓度。
2. 符号: 。
cB
3. 表达式: 。
cB=
nB
V
4. 单位: 。
mol/L或 mol·L-1
科
nB=
×V(溶液)
cB
nB
V(溶液) =
——
cB
9
9
内容 物质的量浓度 质量分数
定义 以单位体积溶液里含有多少摩尔溶质来表示溶液组成的物理量 用溶质质量与溶液质量之比来表示溶液组成的物理量
溶质的单位 mol g
溶液的单位 L g
计算公式
物质的量浓度与溶质质量分数的比较
nB
V(溶液)
CB= ——
m溶质
m溶液
ω = ——
×100﹪
小组讨论
已知:0.9%的医用生理盐水的物质的量浓度为0.154mol/L,请判断正误,并分析原因。
1、表示0.154mol NaCl溶于1L水,则NaCl的物质的量浓度为1mol/L。
2、表示0.154g NaCl溶于1 L溶液,所得溶液中NaCl的物质的量浓度为0.154 mol/L。
3、从1L 0.154 mol / L的NaCl溶液中取出100 mL,溶质的物质的量浓度为0.154 mol/L。
概念辨析:
×
×
√
体积指溶液体积,不是溶剂体积;
溶质用“物质的量”,不是质量;
同一溶液,无论取出多少体积,物质的量浓度不变。
10
11
将62gNa2O溶于水中,配成1L溶液,所得溶质的物质的量浓度为1 mol·L-1
注意:
分析溶质时要注意有关的化学变化
① 与水发生反应生成的新的物质为溶质,
如Na、Na2O、Na2O2 NaOH,SO3 H2SO4等。
②含结晶水的物质如CuSO4·5H2O溶于水,CuSO4为溶质。
思考与交流
×
配制 500 mL 0.1 mol/L 的NaOH 溶液所需NaOH的质量是多少?
例题1
n (NaOH) =c(NaOH)· V[NaOH(aq)]
=0. 1 mol/L × 0. 5 L
= 0. 05 mol
m (NaOH) = n (NaOH) · M(NaOH)
= 0.05 mol × 40 g/mol
= 2g
解:
500ml0.1mol/LNaOH溶液中NaOH的物质的量为:
0.05molNaOH的质量为:
答: 配制 500mL 0.1mol/L NaOH溶液需NaOH 2 g 。
二.有关物质的量浓度的简单计算
12
aq 表示某种物质的水溶液
(1)将1L NaOH溶液中含有40g NaOH,其物质的量浓度为 _________;
(2)0.2mol/L Al2(SO4)3溶液中含有c(Al3+)= ______ , c(SO42-)= ________;
1mol/L
0.4mol/L
0.6mol/L
填空题:
13
启超牌
透心凉
心飞扬
启超工厂
1、自制雪碧 10 L
溶液配制车间
配料1: 0.02 mol/L 醋(乙酸CH3COOH, M= 60 g/mol)
(2)需要醋酸的物质的量为_______ mol,质量为_______g。
n (CH3COOH) =
c (CH3COOH ) × V
= 0.02 mol/L × 10 L
= 0.2 mol
m (CH3COOH) =
n (CH3COOH ) × M
= 0. 2 mol ×60 g/mol
= 12 g
0.2
12
配料2: 0.05 mol/L 小苏打,(NaHCO3, M= 84 g/mol)。
(3)需要碳酸氢钠的物质的量为_______ mol,质量为_______g。
n (NaHCO3) =
c (NaHCO3) × V
= 0.05 mol/L × 10 L
m (NaHCO3) =
n (NaHCO3) × M
= 0. 5 mol ×84 g/mol
= 42 g
0.5
42
= 0.5 mol
14
2.溶液稀释的有关计算
家里只有一瓶蔗糖水,但是小明偏要喝两瓶,于是妈妈把蔗糖水稀释成两瓶,请问,小明吃到的糖有没有变多?
稀释浓溶液时,溶液的质量或体积要发生变化,
溶质的量(质量或物质的量)均不变 。
对于所有的溶液稀释都有:m(溶液稀释前) = m(溶液稀释后)
n(溶液稀释前) = n(溶液稀释后)
m(浓)w(浓)=m(稀)w(稀) 或m1w1=m2w2
c(浓)V(浓)=c(稀)V(稀) 或c1V1=c2V2
15
思考与交流
启超工厂
2、除锈剂的稀释
配方:用18 mol·L-1浓硫酸配制500 mL 1.80 mol·L-1 稀硫酸溶液,需要浓硫酸的体积为多少?
启超牌
除锈剂
溶液稀释车间
V浓 = 50.0 mL
18 mol·L-1 × V浓 = 1.80 mol·L-1 × 0.5 L
16
C浓×V浓 = C稀×V稀
2mol/L的盐酸溶液200L和4mol/L的盐酸溶液100L混合,求混合后溶液中盐酸的物质的量浓度 。
例题3
17
3.溶液混合的有关计算
18
计算并写出计算过程
CNaCl=0.7mol/L
nFeCl3=2mol
VCa(ClO)2= 2L
导学案
如何精确配制1.00 mol·L-1NaCl溶液 ?
19
仪器:
托盘天平、药匙
烧杯、量筒、
玻璃棒、胶头滴管。
步骤:
计算、称量、溶解、装瓶贴标签。
配制100g 5% 的NaCl溶液,需要哪些仪器?如何操作?
粗配制
三、配制一定物质的量浓度的溶液
配制 100mL 1.0mol·L-1NaCl 溶液,该如何配制?
精确配制
1、构造:细颈、平底玻璃瓶,瓶口配有磨口玻璃塞。
2、特点:容量瓶上标有温度、容积、刻度线。
3、常用规格:50ml、100mL、250 mL、500mL、1000mL
4、用途:准确配制一定物质的量浓度的溶液。
认识容量瓶
(2)容量瓶的选择与使用:容量瓶的使用——“一查五忌一原则”
三步查漏:
向容量瓶注入一定量水,盖好瓶塞。用食指摁住瓶塞,另一只手托住瓶底,把容量瓶倒立,观察瓶塞周围是否漏水。如不漏,将容量瓶正立并将瓶塞旋转180°后塞紧,再检查是否漏水。如不漏水,该容量瓶才能使用。
注水→盖塞→倒立→观察→正立→旋180°→倒立→观察
一查
五忌
一、忌用容量瓶溶解固体;
二、忌用容量瓶稀释浓溶液;
三、忌给容量瓶加热;
四、忌把容量瓶当作反应容器;
五、忌用容量瓶长期存放溶液。
因为容量瓶的规格是固定的,所以配制溶液时要根据所配溶液的体积选择合适的容量瓶,例如配制950 mL 1 mol·L-1NaCl溶液,需要用1 000 mL的容量瓶,计算NaCl的质量时也应按1 000 mL溶液来计算。
一原则
选用原则:
等大或稍大。
三、一定物质的量浓度溶液的配制
3、 主要的仪器:
烧杯
分析天平
胶头滴管
100mL容量瓶
量筒
玻璃棒
托盘天平
1.计算
计算所需氯化钠的质量:
m(NaCl)= n(NaCl) ×M(NaCl)
= V(NaCl) ×c(NaCl)×M(NaCl)
=0.1L×1.0mol·L-1×58.5 g·mol-1
= 5.85 g
2.称 量
用托盘天平称取所需溶质的质量
注意事项:
①称量物不能直接放在称量盘内,根据称量物的不同性质,可放在纸片、表面皿或称量瓶内。不能称超过天平最大载重量的物体。
②用浓硫酸配稀硫酸或用浓盐酸配稀盐酸时,应用量筒量取药品。
③同一称量过程中不能更换天平,以免产生相对误差。
注意事项:
应在烧杯中溶解,不能在容量瓶中溶解。
因为在容量瓶上标有温度和体积,这说明容量瓶的体积受温度影响。而物质的溶解往往伴随着一定的热效应,如果用容量瓶进行此项操作,会因热胀冷缩使它的体积不准确,严重时还可能导致容量瓶炸裂。
3.溶解、冷却
将称取量准确的溶质固体放在烧杯中,加适量蒸馏水溶解。用玻璃棒搅拌加速溶解,冷却至室温。
注意事项:由于容量瓶瓶颈较细,为避免液体洒在外面,应用玻璃棒引流。
4.转 移
将冷却至室温的溶液全部转移到容量瓶中。
引流时“两靠一不靠”
烧杯嘴靠在玻璃棒上
玻璃棒靠在刻度线以下的容量瓶内壁上
玻璃棒不要靠在容量瓶瓶口
【思考】将烧杯中的氯化钠溶液倒入到容量瓶中,此时溶质是否完全被转移到容量瓶中?应如何处理?
还有残留在烧杯壁和玻璃棒上的NaCl未被转移。因此要用蒸馏水洗涤用过的烧杯和玻璃棒。
5.洗 涤
用少量蒸馏水洗涤玻璃棒与烧杯 2 ~3 次,洗涤液也要全部转移到100mL容量瓶,用玻璃棒引流
(注意:洗涤液与原溶液总量必须小于容量瓶容量)
思考:
若定容时不小心液面超过了刻度线,怎么办?能用胶头滴管把多余的液体取出吗?
必须重新配制
6.定 容
向容量瓶中加入蒸馏水,在距刻度线 1~2cm时,改用胶头滴管滴加蒸馏水至凹液面最低点与刻度线相切。(视线应与溶液凹液面的最低点相切)
将容量瓶盖好塞子,如图所示,把容量瓶反复上下颠倒摇匀,使得溶液混合均匀,然后竖直放置。
思考:
摇匀后发现液面低于刻线,能否补充水?
不能。摇匀后液面低于刻线是正常现象,因为部分溶液在润湿容量瓶瓶口磨砂处会有所损失所致。
7.摇匀
容量瓶中不能长时间存放溶液,因此要把配制好的溶液转移到试剂瓶中,贴好标签,注明溶液的名称和浓度。
8.装瓶贴签
三、配制一定物质的量浓度溶液步骤
计算
称量
溶解
转移
洗涤
振荡
定容
摇匀
装瓶
【构建认知模型】
÷NA
m n N
÷M
×M
×NA
质量
粒子数目
V(气体体积)
÷Vm
×Vm
cB(溶液)
×V(aq)
÷V(aq)
课堂小结
36
物质的量浓度
物质的量浓度
概念:单位体积的溶液里所含溶质B的物质的量,也称B的物质的量浓度
符号:CB
常用单位:mol/L(或 mol·L-1)
物质的量浓度的相关计算
1.已知溶液的体积和物质的量浓度,求解溶质的质量
2.有关溶液稀释的计算:
n(溶质)= V(浓)×c(浓)= V(稀)×c(稀)
课堂小结
3.有关溶液混合的计算:
