化学人教版(2019)必修第一册1.3.2氧化剂还原剂(共38张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册1.3.2氧化剂还原剂(共38张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 502.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-07-04 06:31:05 | ||
图片预览










文档简介
(共38张PPT)
复习
1、氧化还原反应的实质
2、氧化还原反应的特征
判断:
置换反应一定是氧化还原反应 ( )
复分解反应一定不是氧化还原反应 ( )
有单质参加的化合反应一定是氧化还原反应( )
有单质生成的分解反应一定是氧化还原反应( )
有单质参加的反应一定是氧化还原反应( )
第三节 氧化还原反应
第2课时:氧化剂和还原剂
氧化剂和还原剂
PART 1
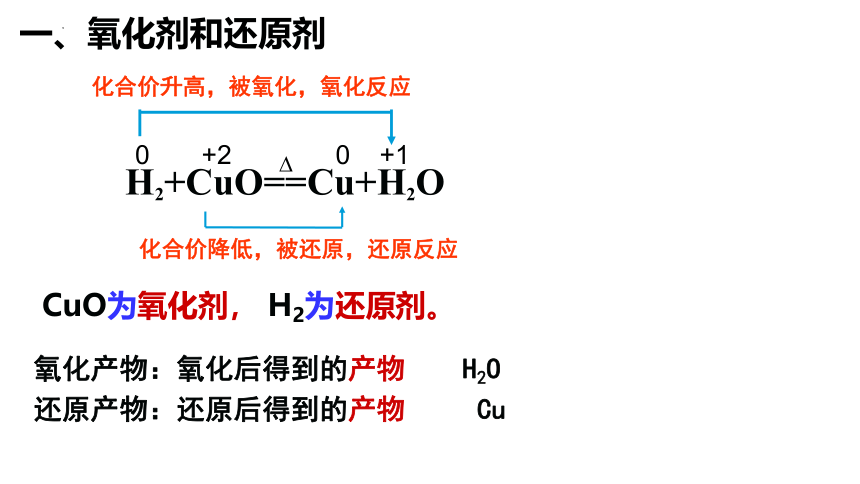
一、氧化剂和还原剂
H2+CuO==Cu+H2O
化合价升高,被氧化,氧化反应
化合价降低,被还原,还原反应
0 +2 0 +1
CuO为氧化剂, H2为还原剂。
氧化产物:氧化后得到的产物 H2O
还原产物:还原后得到的产物 Cu
氧化剂+还原剂===还原产物+氧化产物
得电子,化合价降低,还原反应,被还原
失电子,化合价升高,氧化反应,被氧化
从氧化还原反应特征分析:
化合价升高的反应物为还原剂 H2
化合价降低的反应物为氧化剂 CuO
从氧化还原反应实质分析:
得到电子的(或电子对偏向)物质是氧化剂
失去电子的(或电子对偏离)物质是还原剂
巧记:升失还,降得氧。
若说应正相反。
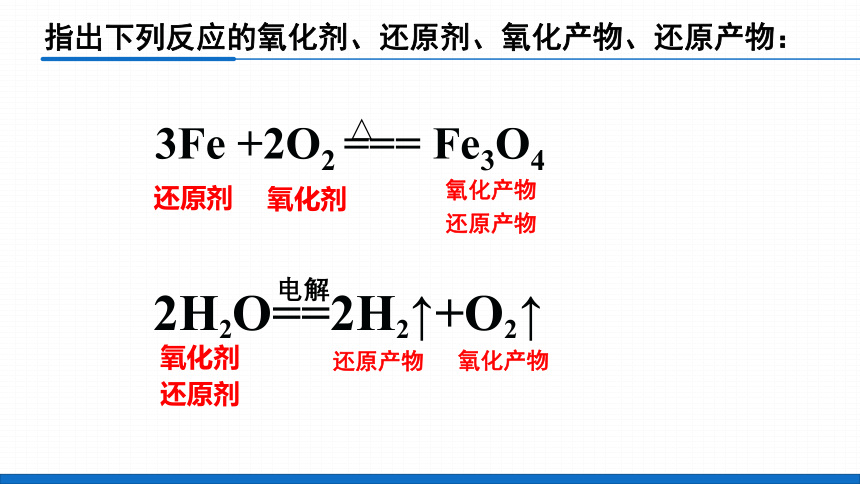
3Fe +2O2 === Fe3O4
△
2H2O==2H2↑+O2↑
电解
还原剂
氧化剂
还原产物
氧化产物
还原剂
氧化剂
还原产物
氧化产物
指出下列反应的氧化剂、还原剂、氧化产物、还原产物:
2、下列变化,需要加入适当的还原剂才能实现的( )
A.HCl→Cl2 B.H2S→SO2
C.Fe2O3→Fe D.CaO→Ca(OH)2
3、下列反应中,水做氧化剂的是( )
A.Cl2 + H2O = HCl + HClO
B.2H2O + 2Na = 2NaOH + H2↑
C.CaO + H2O = Ca(OH)2
D.2F2 +2H2O = 4HF + O2
C
B
常见的还原剂:
1.活泼的金属单质,如K 、Na、 Mg、 Zn、 Fe等
3.具有变价元素时处于低价的化合物,如H2S 、HI 、CO等
2.某些非金属单质,如C、 S、H2等
有还原性
3.不活泼的金属阳离子,如Ag+ 、Cu2+、Fe3+等。
常见的氧化剂:
1.活泼的非金属单质如:O2、Cl2 、I2、F2等
2.具有变价元素时处于高价的化合物,如H2SO4(浓)、HNO3、 KMnO4、 FeCl3等
有氧化性
说明:
1. 元素最低价态只有还原性,
元素最高价态只有氧化性,
元素中间价态既有氧化性和还原性
如Cl2、H2O2、Fe2+、H2SO3等既有氧化性有又还原性。
练习:
H2S具有氧化性还是还原性?
SO2呢?
在H+、Mg2+ 、Fe2+、Fe3+、S2-、I-、S中,
只有氧化性的是_________,
只有还原性的是________,
既有氧化性又有还原性的是___________。
H+、Mg2+ 、Fe3+
S2-、I-
Fe2+、 S
氧化还原反应规律
PART 2
目标一 物质氧化性、还原性的判断
1.物质氧化性、还原性的强弱只决定于得失电子的难易,与得失电子的多少无关。
如:钠、镁、铝的还原性强弱依次为:
Na>Mg>Al
目标一 物质氧化性、还原性的判断
2.利用氧化还原反应方程式判断:
氧化剂+还原剂 ===还原产物+氧化产物
强氧化性
强还原性
弱还原性
弱氧化性
氧化性:氧化剂>氧化产物
还原剂:还原剂>还原产物
应用:比较物质间氧化性或还原性的强弱
目标一 物质氧化性、还原性的判断
Fe>Cu
Cu2+>Fe2+
B
目标一 物质氧化性、还原性的判断
3.单质的氧化性、还原性比较
目标一 物质氧化性、还原性的判断
4.根据反应条件判断:
Na
Mg
KMnO4
MnO2
O2
目标一 物质氧化性、还原性的判断
F2
Cl2
Br2
I2
目标二 氧化还原反应的知识规律
规律1:强弱规律
氧化剂+还原剂 ===还原产物+氧化产物
强氧化性
强还原性
弱还原性
弱氧化性
氧化性:氧化剂>氧化产物
还原剂:还原剂>还原产物
熟记两条强弱顺序:
氧化性:
MnO4- > Cl2 >Br2 > Fe3+ > I2> S
还原性:
S2- > SO32- > I- > Fe2+ > Br- > Cl-
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
从左向右,单质的还原性逐渐减弱,
对应的阳离子的氧化性逐渐增强。
目标二 氧化还原反应的知识规律
规律2:相等规律
目标二 氧化还原反应的知识规律
规律3:归中规律
同种元素的相邻价态微粒间不发生氧化还原反应,同种元素的不同价态之间的氧化还原反应,价态变化“只靠拢,不交叉”。
目标二 氧化还原反应的知识规律
规律3:归中规律练习
目标二 氧化还原反应的知识规律
规律4:价态规律
最高价态只有氧化性,例如:
最低价态只有还原性,例如:
中间价态既有氧化性,又有还原性;例如:H2O2、Fe2+
MnO4-、Fe3+等
S2-、I-等。
目标二 氧化还原反应的知识规律
A
B
规律5:先后规律
多种氧化剂与一种还原剂相遇,氧化性强的先被还原;
多种还原剂与一种氧化剂相遇,还原性强的先被氧化
练习6:向CuSO4与FeSO4混合液中加Zn,先析出的是____________。
练习5:向CuSO4溶液中加Zn和Fe,先发生反应为______;
Zn
Cu
课堂训练与检测
目标二 氧化还原反应的知识规律
1.掌握常见的氧化剂和还原剂
升失还 ,降得氧,若说应正相反。
2. 掌握氧化还原反应的规律和应用;
规律一:强弱规律
规律二:相等规律
规律三: 归中规律 “只靠拢,不交叉”
规律四:价态规律
规律五:先后规律
课堂小结
布置作业
练习与应用P25 1-12,写在课本上,小组长检查
目标三 氧化还原反应配平
【原理】
氧化还原反应过程中氧化剂获得的电子总是来源于还原剂所失去的电子,氧化剂得到的电子总数和还原剂失去的电子总数是相等的,表现为元素化合价升降的总数相等.氧化还原反应的配平就是根据这一原理进行的。
目标三 氧化还原反应配平
一、一般方程式的配平
1.先写出反应物和生成物的分子式,并列出发生氧化和还原反应元素的化合价(标价态)
2.列出元素化合价的变化(列变化)
目标三 氧化还原反应配平
3.使化合价升高和降低的总数相等(求总数)
4.用观察法配平其它物质的系数(配系数)
目标三 氧化还原反应配平
练习:
目标三 氧化还原反应配平
二、 自身反应,逆向配平
目标三 氧化还原反应配平
练习:
目标三 氧化还原反应配平
三、 离子反应,三个守恒(元素、电子、电荷)
目标三 氧化还原反应配平
练习:
氧化还原反应的配平
课堂小结
1.先写出反应物和生成物的分子式,并列出发生氧化和还原反应元素的化合价(标价态)
2.列出元素化合价的变化(列变化)
3.使化合价升高和降低的总数相等(求总数)
4.用观察法配平其它物质的系数(配系数)。
布置作业
氧化还原反应 第2课时 训练案
复习
1、氧化还原反应的实质
2、氧化还原反应的特征
判断:
置换反应一定是氧化还原反应 ( )
复分解反应一定不是氧化还原反应 ( )
有单质参加的化合反应一定是氧化还原反应( )
有单质生成的分解反应一定是氧化还原反应( )
有单质参加的反应一定是氧化还原反应( )
第三节 氧化还原反应
第2课时:氧化剂和还原剂
氧化剂和还原剂
PART 1
一、氧化剂和还原剂
H2+CuO==Cu+H2O
化合价升高,被氧化,氧化反应
化合价降低,被还原,还原反应
0 +2 0 +1
CuO为氧化剂, H2为还原剂。
氧化产物:氧化后得到的产物 H2O
还原产物:还原后得到的产物 Cu
氧化剂+还原剂===还原产物+氧化产物
得电子,化合价降低,还原反应,被还原
失电子,化合价升高,氧化反应,被氧化
从氧化还原反应特征分析:
化合价升高的反应物为还原剂 H2
化合价降低的反应物为氧化剂 CuO
从氧化还原反应实质分析:
得到电子的(或电子对偏向)物质是氧化剂
失去电子的(或电子对偏离)物质是还原剂
巧记:升失还,降得氧。
若说应正相反。
3Fe +2O2 === Fe3O4
△
2H2O==2H2↑+O2↑
电解
还原剂
氧化剂
还原产物
氧化产物
还原剂
氧化剂
还原产物
氧化产物
指出下列反应的氧化剂、还原剂、氧化产物、还原产物:
2、下列变化,需要加入适当的还原剂才能实现的( )
A.HCl→Cl2 B.H2S→SO2
C.Fe2O3→Fe D.CaO→Ca(OH)2
3、下列反应中,水做氧化剂的是( )
A.Cl2 + H2O = HCl + HClO
B.2H2O + 2Na = 2NaOH + H2↑
C.CaO + H2O = Ca(OH)2
D.2F2 +2H2O = 4HF + O2
C
B
常见的还原剂:
1.活泼的金属单质,如K 、Na、 Mg、 Zn、 Fe等
3.具有变价元素时处于低价的化合物,如H2S 、HI 、CO等
2.某些非金属单质,如C、 S、H2等
有还原性
3.不活泼的金属阳离子,如Ag+ 、Cu2+、Fe3+等。
常见的氧化剂:
1.活泼的非金属单质如:O2、Cl2 、I2、F2等
2.具有变价元素时处于高价的化合物,如H2SO4(浓)、HNO3、 KMnO4、 FeCl3等
有氧化性
说明:
1. 元素最低价态只有还原性,
元素最高价态只有氧化性,
元素中间价态既有氧化性和还原性
如Cl2、H2O2、Fe2+、H2SO3等既有氧化性有又还原性。
练习:
H2S具有氧化性还是还原性?
SO2呢?
在H+、Mg2+ 、Fe2+、Fe3+、S2-、I-、S中,
只有氧化性的是_________,
只有还原性的是________,
既有氧化性又有还原性的是___________。
H+、Mg2+ 、Fe3+
S2-、I-
Fe2+、 S
氧化还原反应规律
PART 2
目标一 物质氧化性、还原性的判断
1.物质氧化性、还原性的强弱只决定于得失电子的难易,与得失电子的多少无关。
如:钠、镁、铝的还原性强弱依次为:
Na>Mg>Al
目标一 物质氧化性、还原性的判断
2.利用氧化还原反应方程式判断:
氧化剂+还原剂 ===还原产物+氧化产物
强氧化性
强还原性
弱还原性
弱氧化性
氧化性:氧化剂>氧化产物
还原剂:还原剂>还原产物
应用:比较物质间氧化性或还原性的强弱
目标一 物质氧化性、还原性的判断
Fe>Cu
Cu2+>Fe2+
B
目标一 物质氧化性、还原性的判断
3.单质的氧化性、还原性比较
目标一 物质氧化性、还原性的判断
4.根据反应条件判断:
Na
Mg
KMnO4
MnO2
O2
目标一 物质氧化性、还原性的判断
F2
Cl2
Br2
I2
目标二 氧化还原反应的知识规律
规律1:强弱规律
氧化剂+还原剂 ===还原产物+氧化产物
强氧化性
强还原性
弱还原性
弱氧化性
氧化性:氧化剂>氧化产物
还原剂:还原剂>还原产物
熟记两条强弱顺序:
氧化性:
MnO4- > Cl2 >Br2 > Fe3+ > I2> S
还原性:
S2- > SO32- > I- > Fe2+ > Br- > Cl-
K Ca Na Mg Al Zn Fe Sn Pb (H) Cu Hg Ag Pt Au
从左向右,单质的还原性逐渐减弱,
对应的阳离子的氧化性逐渐增强。
目标二 氧化还原反应的知识规律
规律2:相等规律
目标二 氧化还原反应的知识规律
规律3:归中规律
同种元素的相邻价态微粒间不发生氧化还原反应,同种元素的不同价态之间的氧化还原反应,价态变化“只靠拢,不交叉”。
目标二 氧化还原反应的知识规律
规律3:归中规律练习
目标二 氧化还原反应的知识规律
规律4:价态规律
最高价态只有氧化性,例如:
最低价态只有还原性,例如:
中间价态既有氧化性,又有还原性;例如:H2O2、Fe2+
MnO4-、Fe3+等
S2-、I-等。
目标二 氧化还原反应的知识规律
A
B
规律5:先后规律
多种氧化剂与一种还原剂相遇,氧化性强的先被还原;
多种还原剂与一种氧化剂相遇,还原性强的先被氧化
练习6:向CuSO4与FeSO4混合液中加Zn,先析出的是____________。
练习5:向CuSO4溶液中加Zn和Fe,先发生反应为______;
Zn
Cu
课堂训练与检测
目标二 氧化还原反应的知识规律
1.掌握常见的氧化剂和还原剂
升失还 ,降得氧,若说应正相反。
2. 掌握氧化还原反应的规律和应用;
规律一:强弱规律
规律二:相等规律
规律三: 归中规律 “只靠拢,不交叉”
规律四:价态规律
规律五:先后规律
课堂小结
布置作业
练习与应用P25 1-12,写在课本上,小组长检查
目标三 氧化还原反应配平
【原理】
氧化还原反应过程中氧化剂获得的电子总是来源于还原剂所失去的电子,氧化剂得到的电子总数和还原剂失去的电子总数是相等的,表现为元素化合价升降的总数相等.氧化还原反应的配平就是根据这一原理进行的。
目标三 氧化还原反应配平
一、一般方程式的配平
1.先写出反应物和生成物的分子式,并列出发生氧化和还原反应元素的化合价(标价态)
2.列出元素化合价的变化(列变化)
目标三 氧化还原反应配平
3.使化合价升高和降低的总数相等(求总数)
4.用观察法配平其它物质的系数(配系数)
目标三 氧化还原反应配平
练习:
目标三 氧化还原反应配平
二、 自身反应,逆向配平
目标三 氧化还原反应配平
练习:
目标三 氧化还原反应配平
三、 离子反应,三个守恒(元素、电子、电荷)
目标三 氧化还原反应配平
练习:
氧化还原反应的配平
课堂小结
1.先写出反应物和生成物的分子式,并列出发生氧化和还原反应元素的化合价(标价态)
2.列出元素化合价的变化(列变化)
3.使化合价升高和降低的总数相等(求总数)
4.用观察法配平其它物质的系数(配系数)。
布置作业
氧化还原反应 第2课时 训练案
