九年级化学鲁教版下册8.2海水“晒盐”基础训练(word版有答案)
文档属性
| 名称 | 九年级化学鲁教版下册8.2海水“晒盐”基础训练(word版有答案) |

|
|
| 格式 | docx | ||
| 文件大小 | 268.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-07-04 18:54:23 | ||
图片预览


文档简介
8.2海水“晒盐”基础训练-2021-2022学年九年级化学鲁教版下册
一、单选题
1.下列试剂中,能把稀硫酸、KOH溶液、CaCl2溶液一次性鉴别出来的是
A.KCl溶液 B.K2CO3溶液
C.稀盐酸 D.NaNO3溶液
2.将10 g硝酸钾完全溶解在100 g水中,下列说法不正确的是
A.溶质为10 g B.溶剂为100 g
C.溶液为110 g D.硝酸钾的溶解度为10 g
3.20℃时,氯化钠的溶解度为36g。对这句话理解错误的是
A.20℃时,100g水中最多能溶解氯化钠36g
B.20℃时,100g氯化钠饱和溶液中含氯化钠36g
C.20℃时,氯化钠饱和溶液中水与氯化钠的质量比为100∶36
D.20℃时,将36g氯化钠溶解于100g水中,所得溶液为该温度下氯化钠的饱和溶液
4.如图是a、b、c三种物质的溶解度曲线,下列说法正确的是
A.t2℃时,等质量的a、b、c配成饱和溶液,所得溶液质量a>b>c
B.将t2℃a、b、c的饱和溶液降温至t1℃,析出晶体的质量a>b>c
C.t2℃时,a、b、c的饱和溶液蒸发相同质量的水,析出晶体质量a>b>c
D.将t1℃时,a、b、c三种物质的饱和溶液升温至t2℃,其溶质质量分数由大到小的顺序是a>b>c
5.如图是对20℃一定质量的甲的溶液进行恒温蒸发结晶的实验过程,下列说法正确的是( )
A.蒸发前原溶液是饱和溶液
B.n的数值是12
C.甲物质在20℃时的溶解度是50g
D.甲物质的溶解度随温度的升高而增大
6.下图为Ca(OH)2的溶解度曲线;下表为20℃时溶解度的相对大小。下列说法正确的是( )
溶解度/g 一般称为
<0.01 难溶
0.01~1 微溶
1~10 可溶
>10 易容
A.Ca(OH)2 属于易溶物质
B.Ca(OH)2的溶解度随温度的升高而增大
C.30℃时,Ca(OH)2的饱和溶液中溶质与溶剂的质量比为3﹕20
D.70℃时Ca(OH)2的饱和溶液,降温到50℃时没有析出固体
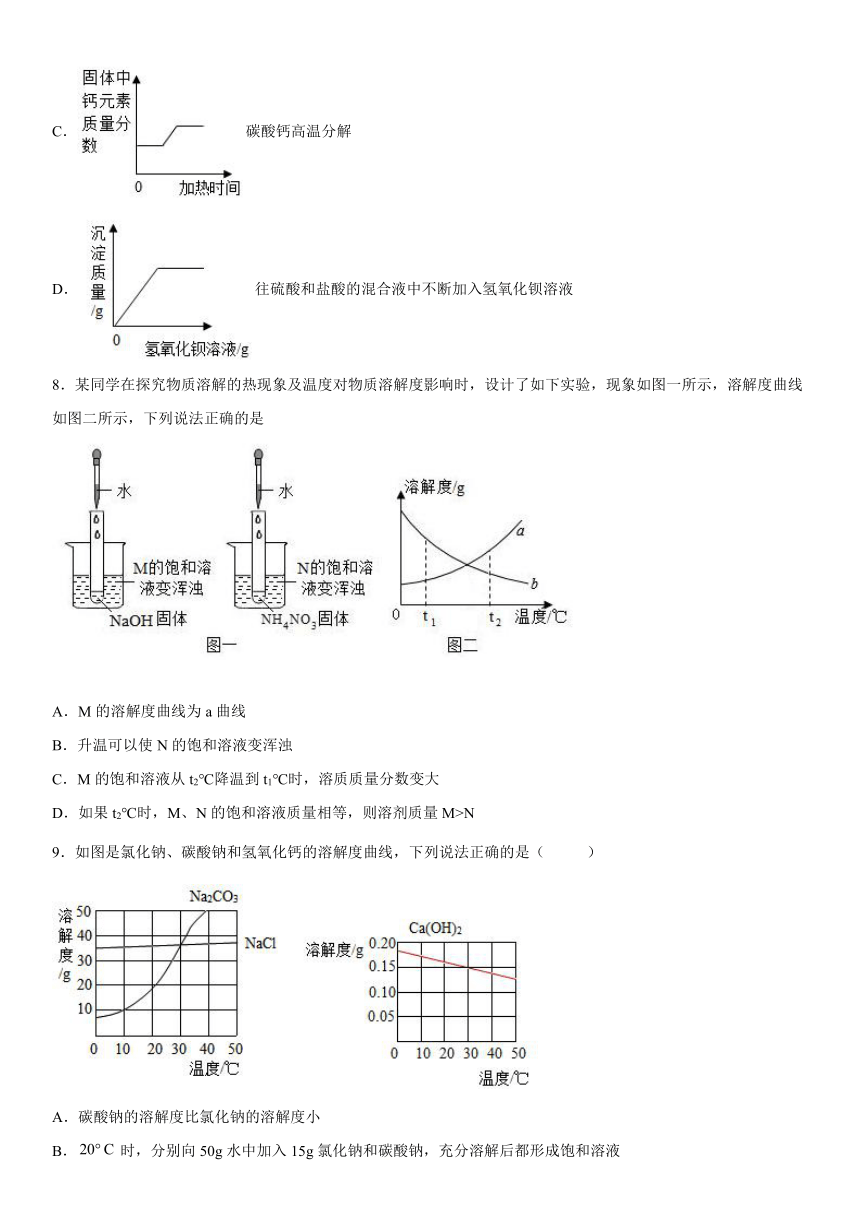
7.下列图像不能正确反映对应变化关系的是
A.室温(25℃)下往石灰水中不断加入氧化钙
B.往CuSO4和H2SO4的混合溶液中加入NaOH溶液
C.碳酸钙高温分解
D.往硫酸和盐酸的混合液中不断加入氢氧化钡溶液
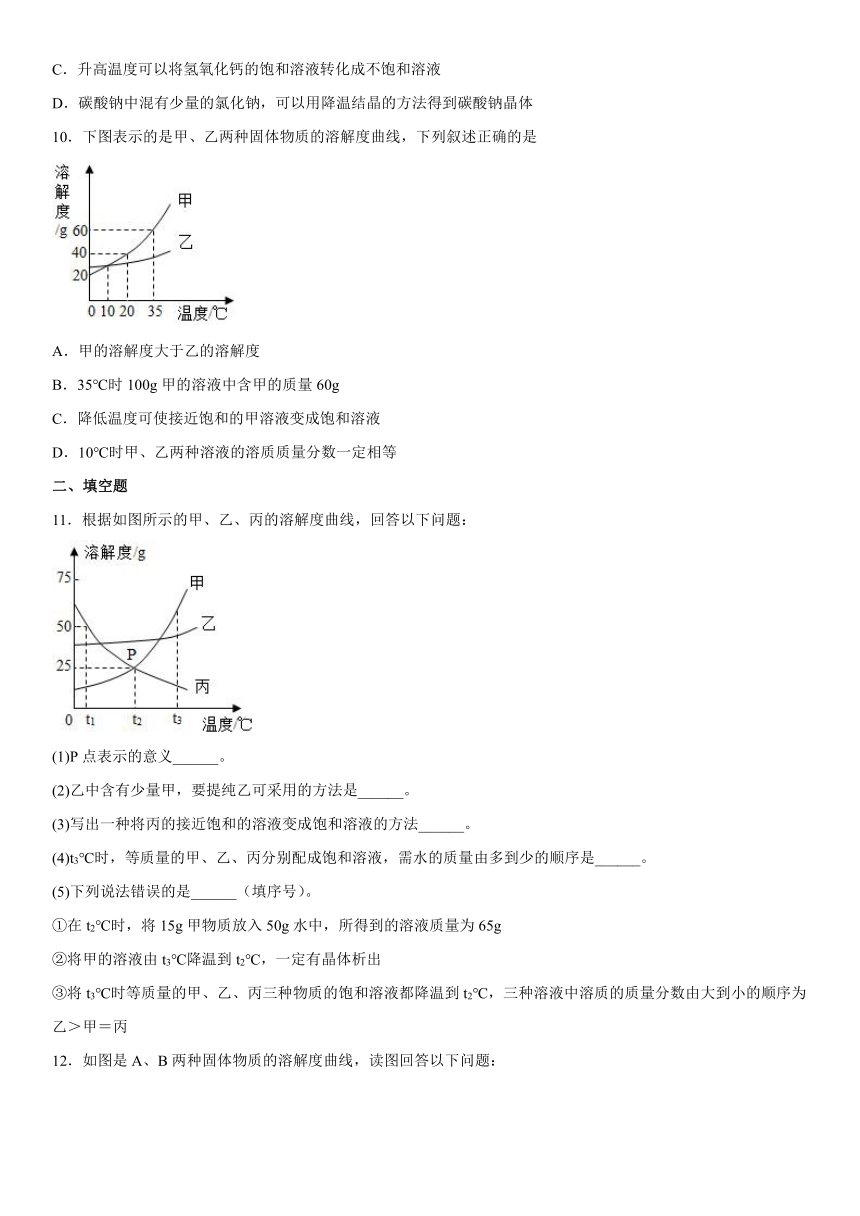
8.某同学在探究物质溶解的热现象及温度对物质溶解度影响时,设计了如下实验,现象如图一所示,溶解度曲线如图二所示,下列说法正确的是
A.M的溶解度曲线为a曲线
B.升温可以使N的饱和溶液变浑浊
C.M的饱和溶液从t2℃降温到t1℃时,溶质质量分数变大
D.如果t2℃时,M、N的饱和溶液质量相等,则溶剂质量M>N
9.如图是氯化钠、碳酸钠和氢氧化钙的溶解度曲线,下列说法正确的是( )
A.碳酸钠的溶解度比氯化钠的溶解度小
B.时,分别向50g水中加入15g氯化钠和碳酸钠,充分溶解后都形成饱和溶液
C.升高温度可以将氢氧化钙的饱和溶液转化成不饱和溶液
D.碳酸钠中混有少量的氯化钠,可以用降温结晶的方法得到碳酸钠晶体
10.下图表示的是甲、乙两种固体物质的溶解度曲线,下列叙述正确的是
A.甲的溶解度大于乙的溶解度
B.35℃时100g甲的溶液中含甲的质量60g
C.降低温度可使接近饱和的甲溶液变成饱和溶液
D.10℃时甲、乙两种溶液的溶质质量分数一定相等
二、填空题
11.根据如图所示的甲、乙、丙的溶解度曲线,回答以下问题:
(1)P点表示的意义______。
(2)乙中含有少量甲,要提纯乙可采用的方法是______。
(3)写出一种将丙的接近饱和的溶液变成饱和溶液的方法______。
(4)t3℃时,等质量的甲、乙、丙分别配成饱和溶液,需水的质量由多到少的顺序是______。
(5)下列说法错误的是______(填序号)。
①在t2℃时,将15g甲物质放入50g水中,所得到的溶液质量为65g
②将甲的溶液由t3℃降温到t2℃,一定有晶体析出
③将t3℃时等质量的甲、乙、丙三种物质的饱和溶液都降温到t2℃,三种溶液中溶质的质量分数由大到小的顺序为乙>甲=丙
12.如图是A、B两种固体物质的溶解度曲线,读图回答以下问题:
(1)若A物质中混合少量B物质,提纯A可用的方法是___________。
(2)将t2℃时A和B的饱和溶液同时降温至t1℃,则A和B的溶质质量分数为A__________B(< ,=,或>);
(3) t2℃时,向50gA物质的饱和溶液中加入60g水,所得溶液中溶质的质量分数为___________ (精确到小数点后一位 )。
13.将30g固体物质X(不含结晶水)投入盛有20g水的烧杯中,搅拌,测得0℃、t1℃、t2℃、t3℃时烧杯中溶液的质量分别如图中A、B、C、D点所示。
回答下列问题:
(1)A、B两点对应的溶液中溶质的质量分数较大的是____________(填字母编号)。
(2)0℃时,物质X的溶解度是____________。
(3)A、B、C、D四点对应的溶液中,一定属于饱和溶液的是____________(填字母编号)。
(4)下列说法正确的是_____________(填序号)。
①t1℃时,若向B点对应的烧杯中再加入30g水,搅拌,所得溶液为不饱和溶液
②若要从D点对应的溶液中得到全部固体X,可采用降温结晶的方法
③t2℃时,将物质X的饱和溶液变为不饱和溶液,溶质的质量可能增大
14.下图1为甲、乙两种固体物质的溶解度曲线。
(1)溶解度随温度升高而增大的物质是___________(填“甲”或“乙”)。
(2)某同学按图2所示进行实验,得到相应温度下的A、B、C溶液,在A、B、C三种溶液中属于饱和溶液的是___________(填字母)。向溶液C中再加入25g甲,充分搅拌,恢复到t2℃时,所得溶液中溶质的质量分数为___________(结果精确到0.1%)。
(3)将t2℃时的甲、乙两种物质的饱和溶液降温至t1℃,所得溶液中溶质的质量分数甲___________乙(填“<”、“=”或“>”)。
(4)若固体甲中含少量固体乙,可采用___________结晶的方法提纯甲。
(5)若甲为KNO3,如图所示,20℃时,将盛有饱和KNO3溶液的小试管放入盛水的烧杯中,向烧杯中加入某物质后,试管中有晶体析出。加入的物质可能是下列中的___________(填字母序号)。
A.氢氧化钠固体 B.生石灰固体 C.冰块 D.酒精 E.浓硫酸
三、实验题
15.某化学兴趣小组的同学做粗盐提纯实验,如图是同学们做粗盐提纯的实验示意图。
请回答下列问题:
(1)操作③中玻璃棒搅拌的作用是________________________。
(2)操作⑥中的错误是________________。
(3)粗盐提纯实验中的操作顺序为________________(填操作序号),以及称量精盐并计算产率。
(4)操作④中,当观察到蒸发皿内________________时,停止加热,让余热蒸干剩余液体。
16.请仔细观察下面溶液的变化并回答问题。
(1)A中的试管 __________ (填“能”或“不能”)把水加入浓硫酸中。
(2)B中溶液变浑浊的原因是 __________________
(3)把A中试管内试剂改为Mg和稀盐酸, _________ (填“会”或“不会”)出现与上图相同的现象。
(4)在A、B、C中Ca(OH)2溶液的质量分数的大小关系是 __________ (用A、B、C和 “>”、“<”、“=”表示)
四、计算题
17.化学兴趣小组的同学用46g稀硫酸与一定质量的氧化铜恰好完全反应,反应后得到的溶液质量为50g。求:
(1)氧化铜的质量为:___________g。
(2)反应后所得溶液中溶质的质量分数。
【提示:CuO+H2SO4═CuSO4+H2O】
18.现有含杂质的氯化镁样品10g(杂质不溶于水,也不参加反应),向其中加入一定量的氢氧化钠溶液恰好完全反应,过滤,得到117g质量分数为10%的溶液.求:
(1)样品中氯化镁的质量分数;
(2)所加入氢氧化钠溶液的质量分数(计算结果精确到0.1%).
19.某兴趣小组在实验室发现一瓶敞口久置的氢氧化钠和一瓶未标浓度的稀盐酸,为测定氢氧化钠的变质情况和稀盐酸的浓度,他们做了以下实验:取一定质量的变质的氢氧化钠样品于锥形瓶中,加入水充分溶解配成118.6g溶液,然后再向锥形瓶中滴加未知浓度的稀盐酸,测得加入稀盐酸的质量与锥形瓶中物质的质量关系如图所示;求:
(1)未知浓度的稀盐酸的溶质质量分数。
(2)反应至A点时,所得溶液的溶质质量分数(结果保留小数点后一位)。
参考答案:
1.B
2.D
3.B
4.C
5.C
6.D
7.A
8.D
9.D
10.C
11.(1)t2℃时,甲、丙物质的溶解度相等
(2)蒸发结晶
(3)增加溶质(或升高温度或蒸发溶剂)
(4)丙>乙>甲
(5)①②③
12.(1) 冷却热饱和溶液(或降温结晶) (2) > (3) 10.5%
13.(1) B 20g (2) A、B (3) ③
14.(1)甲
(2) B 28.6%
(3)>
(4)降温
(5)C
15.(1) 加快粗盐的溶解速率 (2) 缺少玻璃棒引流 ①⑤②③⑥④ (3) 出现较多量的固体
16.(1) 不能 (2) 浓硫酸溶于水放热,溶液温度升高,氢氧化钙溶解度减小,导致Ca(OH)2析出 (3) 会 A=C>B
17.(1)4g。
(2)设反应后所得溶液中溶质的质量为x
解得:x=8g
反应后所得溶液中溶质的质量分数为:=16%
答:反应后所得溶液中溶质的质量分数为16%。
18.(1)95%(2)7.1%
19.(1)由图中的质量关系图可知:产生二氧化碳的质量:218.6g-214.2g=4.4g;
设与碳酸钠反应的氯化氢的质量为x,生成氯化钠的质量为y。
x=7.3g
y=11.7g
未知浓度的稀盐酸的溶质质量分数为
答:未知浓度的稀盐酸的溶质质量分数为14.6%;
(2)设与氢氧化钠反应生成氯化钠的质量为m
m=11.7g
由图象看出烧杯的质量为218.6g-118.6g=100g
反应后溶液的质量为214.2g-100g=114.2g
反应至A点时,所得溶液的溶质质量分数:
答:反应至A点时,所得溶液的溶质质量分数为20.5%。
一、单选题
1.下列试剂中,能把稀硫酸、KOH溶液、CaCl2溶液一次性鉴别出来的是
A.KCl溶液 B.K2CO3溶液
C.稀盐酸 D.NaNO3溶液
2.将10 g硝酸钾完全溶解在100 g水中,下列说法不正确的是
A.溶质为10 g B.溶剂为100 g
C.溶液为110 g D.硝酸钾的溶解度为10 g
3.20℃时,氯化钠的溶解度为36g。对这句话理解错误的是
A.20℃时,100g水中最多能溶解氯化钠36g
B.20℃时,100g氯化钠饱和溶液中含氯化钠36g
C.20℃时,氯化钠饱和溶液中水与氯化钠的质量比为100∶36
D.20℃时,将36g氯化钠溶解于100g水中,所得溶液为该温度下氯化钠的饱和溶液
4.如图是a、b、c三种物质的溶解度曲线,下列说法正确的是
A.t2℃时,等质量的a、b、c配成饱和溶液,所得溶液质量a>b>c
B.将t2℃a、b、c的饱和溶液降温至t1℃,析出晶体的质量a>b>c
C.t2℃时,a、b、c的饱和溶液蒸发相同质量的水,析出晶体质量a>b>c
D.将t1℃时,a、b、c三种物质的饱和溶液升温至t2℃,其溶质质量分数由大到小的顺序是a>b>c
5.如图是对20℃一定质量的甲的溶液进行恒温蒸发结晶的实验过程,下列说法正确的是( )
A.蒸发前原溶液是饱和溶液
B.n的数值是12
C.甲物质在20℃时的溶解度是50g
D.甲物质的溶解度随温度的升高而增大
6.下图为Ca(OH)2的溶解度曲线;下表为20℃时溶解度的相对大小。下列说法正确的是( )
溶解度/g 一般称为
<0.01 难溶
0.01~1 微溶
1~10 可溶
>10 易容
A.Ca(OH)2 属于易溶物质
B.Ca(OH)2的溶解度随温度的升高而增大
C.30℃时,Ca(OH)2的饱和溶液中溶质与溶剂的质量比为3﹕20
D.70℃时Ca(OH)2的饱和溶液,降温到50℃时没有析出固体
7.下列图像不能正确反映对应变化关系的是
A.室温(25℃)下往石灰水中不断加入氧化钙
B.往CuSO4和H2SO4的混合溶液中加入NaOH溶液
C.碳酸钙高温分解
D.往硫酸和盐酸的混合液中不断加入氢氧化钡溶液
8.某同学在探究物质溶解的热现象及温度对物质溶解度影响时,设计了如下实验,现象如图一所示,溶解度曲线如图二所示,下列说法正确的是
A.M的溶解度曲线为a曲线
B.升温可以使N的饱和溶液变浑浊
C.M的饱和溶液从t2℃降温到t1℃时,溶质质量分数变大
D.如果t2℃时,M、N的饱和溶液质量相等,则溶剂质量M>N
9.如图是氯化钠、碳酸钠和氢氧化钙的溶解度曲线,下列说法正确的是( )
A.碳酸钠的溶解度比氯化钠的溶解度小
B.时,分别向50g水中加入15g氯化钠和碳酸钠,充分溶解后都形成饱和溶液
C.升高温度可以将氢氧化钙的饱和溶液转化成不饱和溶液
D.碳酸钠中混有少量的氯化钠,可以用降温结晶的方法得到碳酸钠晶体
10.下图表示的是甲、乙两种固体物质的溶解度曲线,下列叙述正确的是
A.甲的溶解度大于乙的溶解度
B.35℃时100g甲的溶液中含甲的质量60g
C.降低温度可使接近饱和的甲溶液变成饱和溶液
D.10℃时甲、乙两种溶液的溶质质量分数一定相等
二、填空题
11.根据如图所示的甲、乙、丙的溶解度曲线,回答以下问题:
(1)P点表示的意义______。
(2)乙中含有少量甲,要提纯乙可采用的方法是______。
(3)写出一种将丙的接近饱和的溶液变成饱和溶液的方法______。
(4)t3℃时,等质量的甲、乙、丙分别配成饱和溶液,需水的质量由多到少的顺序是______。
(5)下列说法错误的是______(填序号)。
①在t2℃时,将15g甲物质放入50g水中,所得到的溶液质量为65g
②将甲的溶液由t3℃降温到t2℃,一定有晶体析出
③将t3℃时等质量的甲、乙、丙三种物质的饱和溶液都降温到t2℃,三种溶液中溶质的质量分数由大到小的顺序为乙>甲=丙
12.如图是A、B两种固体物质的溶解度曲线,读图回答以下问题:
(1)若A物质中混合少量B物质,提纯A可用的方法是___________。
(2)将t2℃时A和B的饱和溶液同时降温至t1℃,则A和B的溶质质量分数为A__________B(< ,=,或>);
(3) t2℃时,向50gA物质的饱和溶液中加入60g水,所得溶液中溶质的质量分数为___________ (精确到小数点后一位 )。
13.将30g固体物质X(不含结晶水)投入盛有20g水的烧杯中,搅拌,测得0℃、t1℃、t2℃、t3℃时烧杯中溶液的质量分别如图中A、B、C、D点所示。
回答下列问题:
(1)A、B两点对应的溶液中溶质的质量分数较大的是____________(填字母编号)。
(2)0℃时,物质X的溶解度是____________。
(3)A、B、C、D四点对应的溶液中,一定属于饱和溶液的是____________(填字母编号)。
(4)下列说法正确的是_____________(填序号)。
①t1℃时,若向B点对应的烧杯中再加入30g水,搅拌,所得溶液为不饱和溶液
②若要从D点对应的溶液中得到全部固体X,可采用降温结晶的方法
③t2℃时,将物质X的饱和溶液变为不饱和溶液,溶质的质量可能增大
14.下图1为甲、乙两种固体物质的溶解度曲线。
(1)溶解度随温度升高而增大的物质是___________(填“甲”或“乙”)。
(2)某同学按图2所示进行实验,得到相应温度下的A、B、C溶液,在A、B、C三种溶液中属于饱和溶液的是___________(填字母)。向溶液C中再加入25g甲,充分搅拌,恢复到t2℃时,所得溶液中溶质的质量分数为___________(结果精确到0.1%)。
(3)将t2℃时的甲、乙两种物质的饱和溶液降温至t1℃,所得溶液中溶质的质量分数甲___________乙(填“<”、“=”或“>”)。
(4)若固体甲中含少量固体乙,可采用___________结晶的方法提纯甲。
(5)若甲为KNO3,如图所示,20℃时,将盛有饱和KNO3溶液的小试管放入盛水的烧杯中,向烧杯中加入某物质后,试管中有晶体析出。加入的物质可能是下列中的___________(填字母序号)。
A.氢氧化钠固体 B.生石灰固体 C.冰块 D.酒精 E.浓硫酸
三、实验题
15.某化学兴趣小组的同学做粗盐提纯实验,如图是同学们做粗盐提纯的实验示意图。
请回答下列问题:
(1)操作③中玻璃棒搅拌的作用是________________________。
(2)操作⑥中的错误是________________。
(3)粗盐提纯实验中的操作顺序为________________(填操作序号),以及称量精盐并计算产率。
(4)操作④中,当观察到蒸发皿内________________时,停止加热,让余热蒸干剩余液体。
16.请仔细观察下面溶液的变化并回答问题。
(1)A中的试管 __________ (填“能”或“不能”)把水加入浓硫酸中。
(2)B中溶液变浑浊的原因是 __________________
(3)把A中试管内试剂改为Mg和稀盐酸, _________ (填“会”或“不会”)出现与上图相同的现象。
(4)在A、B、C中Ca(OH)2溶液的质量分数的大小关系是 __________ (用A、B、C和 “>”、“<”、“=”表示)
四、计算题
17.化学兴趣小组的同学用46g稀硫酸与一定质量的氧化铜恰好完全反应,反应后得到的溶液质量为50g。求:
(1)氧化铜的质量为:___________g。
(2)反应后所得溶液中溶质的质量分数。
【提示:CuO+H2SO4═CuSO4+H2O】
18.现有含杂质的氯化镁样品10g(杂质不溶于水,也不参加反应),向其中加入一定量的氢氧化钠溶液恰好完全反应,过滤,得到117g质量分数为10%的溶液.求:
(1)样品中氯化镁的质量分数;
(2)所加入氢氧化钠溶液的质量分数(计算结果精确到0.1%).
19.某兴趣小组在实验室发现一瓶敞口久置的氢氧化钠和一瓶未标浓度的稀盐酸,为测定氢氧化钠的变质情况和稀盐酸的浓度,他们做了以下实验:取一定质量的变质的氢氧化钠样品于锥形瓶中,加入水充分溶解配成118.6g溶液,然后再向锥形瓶中滴加未知浓度的稀盐酸,测得加入稀盐酸的质量与锥形瓶中物质的质量关系如图所示;求:
(1)未知浓度的稀盐酸的溶质质量分数。
(2)反应至A点时,所得溶液的溶质质量分数(结果保留小数点后一位)。
参考答案:
1.B
2.D
3.B
4.C
5.C
6.D
7.A
8.D
9.D
10.C
11.(1)t2℃时,甲、丙物质的溶解度相等
(2)蒸发结晶
(3)增加溶质(或升高温度或蒸发溶剂)
(4)丙>乙>甲
(5)①②③
12.(1) 冷却热饱和溶液(或降温结晶) (2) > (3) 10.5%
13.(1) B 20g (2) A、B (3) ③
14.(1)甲
(2) B 28.6%
(3)>
(4)降温
(5)C
15.(1) 加快粗盐的溶解速率 (2) 缺少玻璃棒引流 ①⑤②③⑥④ (3) 出现较多量的固体
16.(1) 不能 (2) 浓硫酸溶于水放热,溶液温度升高,氢氧化钙溶解度减小,导致Ca(OH)2析出 (3) 会 A=C>B
17.(1)4g。
(2)设反应后所得溶液中溶质的质量为x
解得:x=8g
反应后所得溶液中溶质的质量分数为:=16%
答:反应后所得溶液中溶质的质量分数为16%。
18.(1)95%(2)7.1%
19.(1)由图中的质量关系图可知:产生二氧化碳的质量:218.6g-214.2g=4.4g;
设与碳酸钠反应的氯化氢的质量为x,生成氯化钠的质量为y。
x=7.3g
y=11.7g
未知浓度的稀盐酸的溶质质量分数为
答:未知浓度的稀盐酸的溶质质量分数为14.6%;
(2)设与氢氧化钠反应生成氯化钠的质量为m
m=11.7g
由图象看出烧杯的质量为218.6g-118.6g=100g
反应后溶液的质量为214.2g-100g=114.2g
反应至A点时,所得溶液的溶质质量分数:
答:反应至A点时,所得溶液的溶质质量分数为20.5%。
同课章节目录
- 第七单元 常见的酸和碱
- 第一节 酸及其性质
- 第二节 碱及其性质
- 第三节 溶液的酸碱性
- 第四节 酸碱中和反应
- 到实验室去:探究酸和碱的化学性质
- 第八单元 海水中的化学
- 第一节 海洋化学资源
- 第二节 海水“晒盐“
- 第三节 海水“制碱“
- 到实验室去:粗盐中难溶性杂质的去除
- 第九单元 金属
- 第一节 常见的金属材料
- 第二节 金属的化学性质
- 第三节 钢铁的锈蚀与防护
- 到实验室去 探究金属的性质
- 第十单元 化学与健康
- 第一节 食物中的有机物
- 第二节 化学元素与人体健康
- 第三节 远离有毒物质
- 第十一单元 化学与社会发展
- 第一节 化学与能源开发
- 第二节 化学与材料研制
- 第三节 化学与农业生产
- 第四节 化学与环境保护
