化学人教版(2019)必修第一册3.2合金和铝及其化合物(共46张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册3.2合金和铝及其化合物(共46张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 20.9MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-07-05 15:40:31 | ||
图片预览








文档简介
第三章 铁 金属材料
第二节金属材料
合金
青铜是最早使用的合金
商朝最大青铜器——后母戊鼎
合金在现代社会更是随处可见
一、合金的定义与特点
1. 合金的定义:由两种或两种以上的金属(或金属和非金属)熔合而成的具有金属特性的物质。
2. 合金的特点
①合金的硬度及机械性能一般优于各成分金属
②合金的熔点一般低于它的各成分金属
一、合金的定义与特点
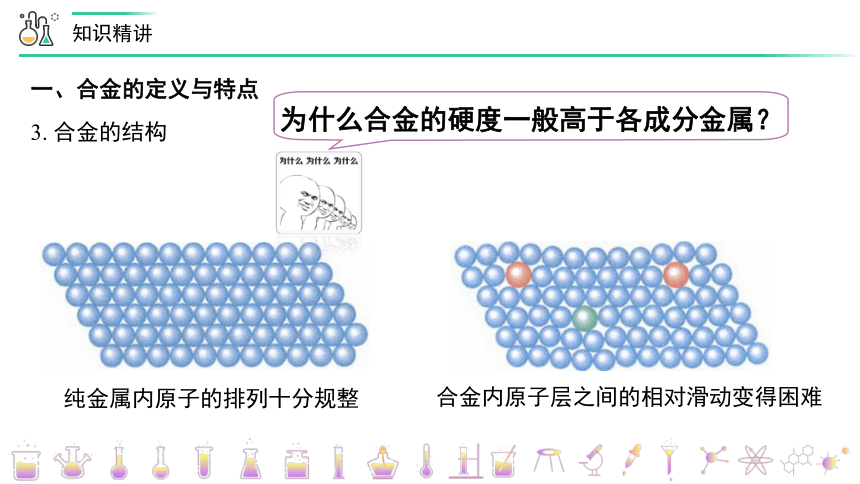
3. 合金的结构
纯金属内原子的排列十分规整
合金内原子层之间的相对滑动变得困难
为什么合金的硬度一般高于各成分金属?
二、铁合金
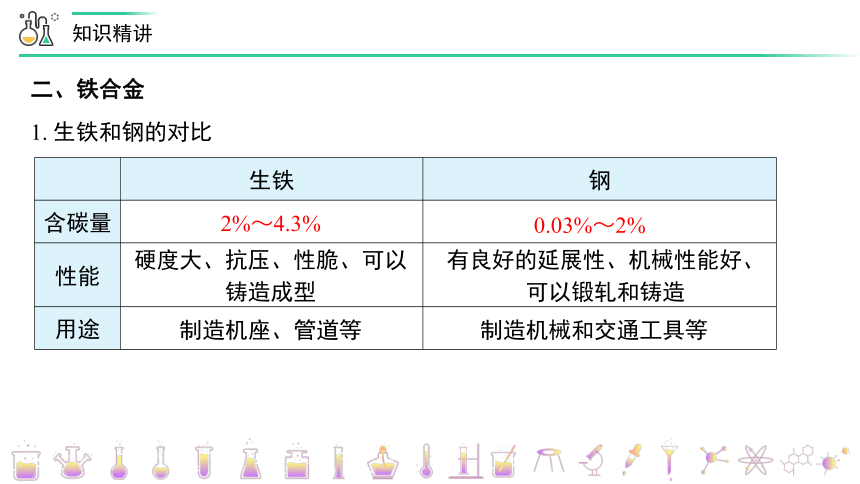
1. 生铁和钢的对比
?
生铁
钢
含碳量
性能
用途
2%~4.3%
0.03%~2%
硬度大、抗压、性脆、可以铸造成型
有良好的延展性、机械性能好、可以锻轧和铸造
制造机座、管道等
制造机械和交通工具等
二、铁合金
2. 钢的分类
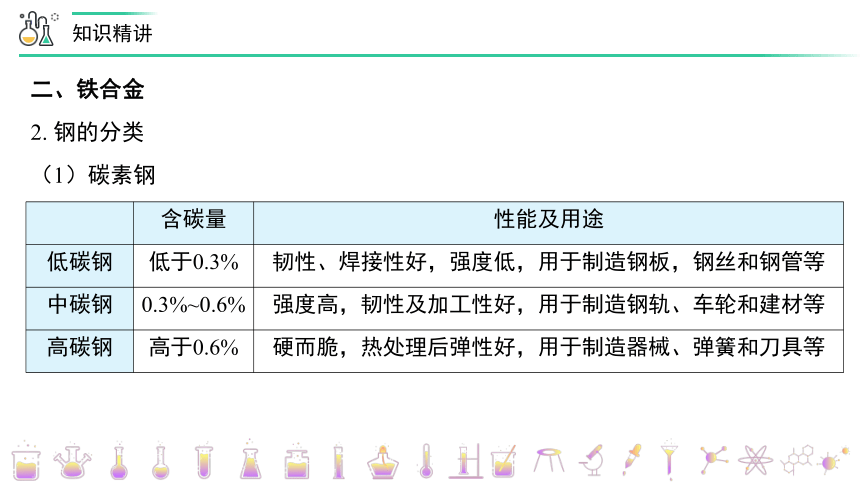
(1)碳素钢
?
含碳量
性能及用途
低碳钢
低于0.3%
韧性、焊接性好,强度低,用于制造钢板,钢丝和钢管等
中碳钢
0.3%~0.6%
强度高,韧性及加工性好,用于制造钢轨、车轮和建材等
高碳钢
高于0.6%
硬而脆,热处理后弹性好,用于制造器械、弹簧和刀具等
二、铁合金
2. 钢的分类
(2)合金钢
也叫特种钢,是在碳素钢里适量地加入一种或几种合金元素,使钢的组织结构发生变化,从而使钢具有各种特殊性能,如强度、硬度大,可塑性、韧性好,耐磨,耐腐蚀等。
(2)合金钢
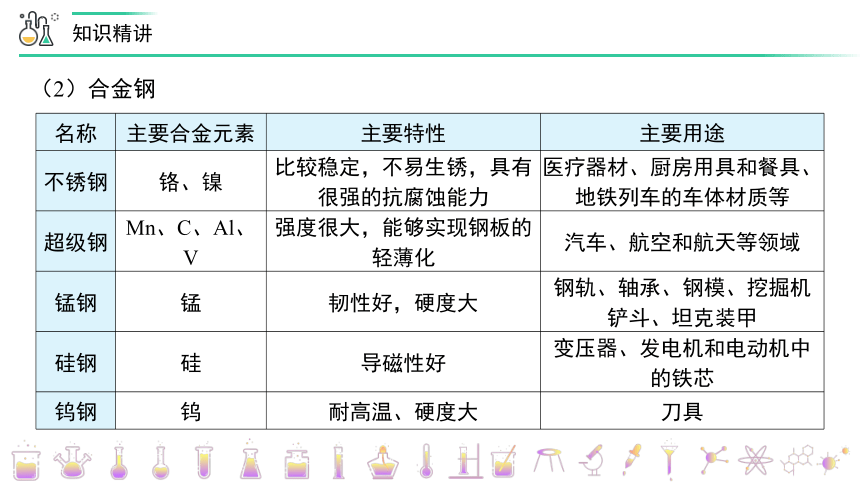
名称
主要合金元素
主要特性
主要用途
不锈钢
铬、镍
比较稳定,不易生锈,具有很强的抗腐蚀能力
医疗器材、厨房用具和餐具、地铁列车的车体材质等
超级钢
Mn、C、Al、V
强度很大,能够实现钢板的轻薄化
汽车、航空和航天等领域
锰钢
锰
韧性好,硬度大
钢轨、轴承、钢模、挖掘机铲斗、坦克装甲
硅钢
硅
导磁性好
变压器、发电机和电动机中的铁芯
钨钢
钨
耐高温、硬度大
刀具
三、铝合金
制取
性能
用途
向铝中加入少量的Cu、Mg、Si 、Mn、Zn及稀土元素等
密度小、强度高、塑性好、易于成型、具有较强的抗腐蚀能力等
制造炊具、门窗、飞机和宇宙飞船外壳的原料
资料卡片——用途广泛的稀土元素
镧系元素(57~71号元素)及钇和钪,共17种元素,称为稀土元素。
我国是稀土资源大国。到目前为止,我国的稀土储量、稀土产量、稀土用量和稀土出口量均居世界第一位。
稀土金属既可以单独使用,也可用于生产合金。在合金中加入适量稀土金属,能大大改善合金的性能。因而,稀土元素又被称为“冶金工业的维生素”。例如,在钢中加入稀土元素,可以增加钢的塑性、韧性、耐磨性、耐热性、耐腐蚀性和抗氧化性等。因此,稀土金属广泛应用在冶金、石油化工、材料工业(电子材料、荧光材料、发光材料、永磁材料、超导材料、染色材料、纳米材料、引火合金和催化剂等)、医药及农业等领域。
四、新型合金
1. 新型储氢合金材料的研究和开发将为氢气作为能源的实际应用起到重要的推动作用。
2. 钛合金、耐热合金和形状记忆合金等广泛应用于航空航天、生物工程和电子工业等领域。
什么是记忆合金?原理是什么?
知识总结
铝及其化合物
铝单质和氧化铝
一、铝的结构、存在、物理性质及用途
1.结构:铝的原子结构示意图为____________。
2. 存在:铝是地壳中含量最多的金属元素,自然界中的铝全部以_______存在。
3. 物理性质:_______色有金属光泽的固体,有良好的延展性、导电性和传热性等,密度较小,质地柔软。
4. 用途:① 纯铝用作导线;②铝合金用于制造汽车、飞机、生活用品等。
化合态
银白
二、铝的化学性质
1.铝与氧气的反应
① 常温:铝与空气中的氧气反应,表面生成一层_________的氧化铝薄膜,对内部金属起着_________作用,化学方程式为______________________________。
② 点燃:铝在氧气中点燃,放出大量的热和耀眼的白光,化学方程式为_____________________________。
致密
保护
4Al+3O2===2Al2O3
4Al+3O2===2Al2O3
点燃
天然的氧化铝俗名叫刚玉,机械手表中的轴承就是用它制作的,若刚玉中混入了微量的铬,就成了红宝石,若混入了微量的钛或铁,就成了蓝宝石。
四、铝和氧化铝的化学性质
实验步骤
现象及原理
开始无气泡,一段时间后才产生气泡。
Al2O3 + 6HCl = 2AlCl3 + 3H2O
2Al + 6HCl = 2AlCl3 + 3H2↑
将点燃的木条放在试管口_________。
有爆鸣声
实验3-4
取一支试管,加入5mL 的盐酸,再向试管中放入一小块铝片,观察现象。过一段时间后,将点燃的木条放在试管口,观察到什么实验现象?
问题解决:
为什么不能用钢丝球擦洗铝合金锅?为什么酸性物质会腐蚀锅体?
用钢丝球擦洗铝合金锅会破坏铝合金表面的氧化铝薄膜,减弱其防腐蚀的效果。酸性物质可以和氧化铝薄膜铝反应,进而腐蚀锅体。
在两支试管中分别加入少量的NaOH溶液,然后向其中一支试管中放入一小块铝片,向另一支试管中放入用砂纸仔细打磨过(除去表面的氧化膜)的一小块铝片。观察现象。过一段时间后,将点燃的木条分别放在两支试管口你观察到什么现象?
【实验3-5】Al、Al2O3和NaOH溶液反应
实验3-5
实验现象
反应方程式
铝片与NaOH溶液反应
铝片(打磨过)与NaOH溶液反应
开始没有气泡,一段时间后产生气泡,将点燃的木条放在试管口可观察到淡蓝色火焰。
立即产生气泡,将点燃的木条放在试管口可观察到淡蓝色火焰。
偏铝酸钠
【实验3-5】Al、Al2O3和NaOH溶液反应
【实验结论】
1、Al既能与稀盐酸反应又能与NaOH溶液反应,
都生成_______和氢气。
盐
2Al + 6HCl = 2AlCl3 + 3H2↑
2Al+2NaOH+2H2O = 2NaAlO2+3H2↑
【实验结论】
Al2O3 + 2NaOH = 2NaAlO2 + H2 O
Al2O3 + 6HCl = 2AlCl3 + 3H2 O
2、 Al2O3既能与稀盐酸反应又能与NaOH溶液反应,
都生成_______和 水 。
盐
两性氧化物:
既能与酸反应生成盐和水,又能与碱反应生成盐和水的氧化物,如Al2O3
问题解决:
铝制餐具为何不宜用来蒸煮或长时间存放酸性或碱性食品?
铝、氧化铝既能与酸反应,又能与碱反应
铝及其化合物
氢氧化铝
一、物理性质
白色胶状不溶于水的固体,有较强的吸附性。
二、用途
1. 氢氧化铝胶体有较强吸附性,可用于净水。
2. 氢氧化铝碱性不强,可以用作胃酸中和剂。
生活中常用明矾来净水
十二水硫酸铝钾是一种无机物,又称明矾,化学式为KAl(SO4)2·12H2O,是一种含有结晶水的硫酸钾和硫酸铝的复盐。
明矾可溶于水,发生电离:KAl(SO4)2==K++Al3++2SO42-,电离出的Al3+在水中生成氢氧化铝胶体,可以和悬浮在水中的泥沙形成絮状不溶物沉降下来,生活中常用于净水。
三、化学性质
1. 热稳定性
Al(OH)3不稳定,受热易分解:_________________________________。
2 Al(OH)3 ==== Al2O3 + 3H2O
△
2. 两性
Al(OH)3是两性氢氧化物,既能与酸,又能与碱反应。
既能与酸反应生成盐和水,又能与碱反应生成盐和水的氢氧化物,称为两性氢氧化物
2. 两性
Al(OH)3是两性氢氧化物,既能与酸,又能与碱反应。
?
化学方程式
离子方程式
酸
?
?
碱
?
?
Al(OH)3 + 3HCl==AlCl3 + 3H2O
Al(OH)3 + 3H+ == Al3+ + 3H2O
Al(OH)3 + NaOH==NaAlO2 + 2H2O
Al(OH)3 + OH- == AlO2- + 2H2O
(1)往AlCl3溶液中逐滴滴加NaOH溶液,会有什么现象?写出相关方程式。
?
?
(2)往NaAlO2溶液中逐滴滴加HCl溶液,会有什么现象?写出相关方程式。
?
?
(3)往AlCl3溶液中逐滴滴加稀氨水,会有什么现象?写出相关方程式。
?
?
(4)往NaAlO2溶液中通入CO2直至过量,会有什么现象?写出相关方程式。
?
Al3+ + 3OH- === Al(OH)3↓
AlO2- + CO2 + 2H2O === Al(OH)3↓ + HCO3-
Al(OH)3 + OH- == AlO2- + 2H2O
Al3+ + 3NH3·H2O === Al(OH)3↓+ 3NH4+
H+ + AlO2- + H2O=Al(OH)3
?
Al(OH)3 + 3H+ == Al3+ + 3H2O
归纳总结——Al3+、Al(OH)3、AlO2-的转化
Al3+ + 3OH- === Al(OH)3↓
Al(OH)3 + OH- === AlO2- + 2H2O
总:Al3+ + 4OH- === AlO2- + 2H2O
H+ + AlO2- + H2O === Al(OH)3↓
Al(OH)3 + 3H+ === Al3+ + 3H2O
AlO2- + 4H+ === Al3+ + 2H2O
五、氢氧化铝的制备
1. 向铝盐中加入足量氨水:___________________________________________。
2. 向偏铝酸盐中通入足量CO2:_______________________________________。
Al3+ + 3NH3·H2O === Al(OH)3↓+ 3NH4+
AlO2- + CO2 + 2H2O === Al(OH)3↓ + HCO3-
六、“铝三角”的转化关系
物质的量在化学方程式计算中的应用
还记得物质的量的相关计算公式吗?
n =
m
M
N
NA
=
=
V
VM
= cBV
化学方程式里的化学计量数,与上述物理量有什么关系吗?
一、化学方程式计算的基础
请说出上述方程式的微观意义
2Na + 2H2O === 2NaOH + H2↑
物质是由原子、分子、离子等粒子构成的,物质之间的化学反应也是粒子按照一定的数目关系进行的。
化学方程式中的化学计量系数可以明确表示出化学反应中粒子之间的数目关系。
一、化学方程式计算的基础
2Na + 2H2O === 2NaOH + H2↑
化学计量数之比
2 : 2 : 2 : 1
扩大6.02×1023倍
2×6.02×1023 :2×6.02×1023 :2×6.02×1023 :1×6.02×1023
物质的量之比
2 mol : 2 mol : 2 mol : 1 mol
化学方程式中各物质的化学计量数之比等于粒子个数之比,也等于各物质的物质的量之比。
一、化学方程式计算的基础
2H2 + O2 === 2H2O
化学计量数之比
2 : 1
物质的量之比
2 mol : 1 mol
对于有气体参与的反应,在同温同压下各气体的化学计量数之比等于体积之比。
气体体积之比
44.8 L : 22.4 L
点燃
二、根据化学方程式计算的一般步骤
小杨老师 15521324728
微信公众号:杨sir化学
写
设
标
写出正确的化学方程式
根据题意设所求物理量,如 n、m、V 等
在有关物质下面标出已知物质和所求物质的相关数值
列
列出比例式
解
根据比例式求解并作答
三、实例分析
250 ml 2mol/L的硫酸与足量的铁屑完全反应。计算:
(1)参加反应的铁屑的物质的量;(2)生成的H2的体积(标准状况)。
解:参加反应的H2SO4的物质的量为:2mol/L×0.25L=0.50 mol
(1)设参加反应的铁屑的物质的量为n(Fe)
Fe+H2SO4===FeSO4+H2↑
1 1
n(Fe) 0.50 mol
11=n(Fe)0.50mol
n(Fe)=0.50 mol
?
(2)设生成H2的物质的量为V(H2)
Fe+H2SO4===FeSO4+H2↑
1mol 22.4L
0.50 mol V(H2)
1?mol0.50mol=22.4LV(H2)
V(H2)=11.2L
?
答:参加反应的铁屑的物质的量为0.50 mol;生成H2的体积在标准状况下为11.2L
三、实例分析
根据题目,相关物理量可以设 n、m、V 等
列比例式时,可以横着比,也可以竖着比
250 ml 2mol/L的硫酸与足量的铁屑完全反应。计算:
(1)参加反应的铁屑的物质的量;(2)生成的H2的体积(标准状况)。
有没有其他解法?
解:参加反应的H2SO4的物质的量为:2mol/L×0.25L=0.50 mol
(1)设参加反应的铁屑的物质的量为n(Fe),生成H2的物质的量为n(H2)
Fe +H2SO4 === FeSO4+H2↑
1 1 1
n(Fe) 0.50 mol n(H2)
1n(Fe)=10.50mol=1n(H2)
n(Fe)=0.50 mol,n(H2)=0.50 mol
V(H2)=0.50 mol×22.4L/mol=11.2L
答:参加反应的铁屑的物质的量为0.50 mol;生成H2体积在标准状况下为11.2L
?
可以统一先求n
知识导航
第二节金属材料
合金
青铜是最早使用的合金
商朝最大青铜器——后母戊鼎
合金在现代社会更是随处可见
一、合金的定义与特点
1. 合金的定义:由两种或两种以上的金属(或金属和非金属)熔合而成的具有金属特性的物质。
2. 合金的特点
①合金的硬度及机械性能一般优于各成分金属
②合金的熔点一般低于它的各成分金属
一、合金的定义与特点
3. 合金的结构
纯金属内原子的排列十分规整
合金内原子层之间的相对滑动变得困难
为什么合金的硬度一般高于各成分金属?
二、铁合金
1. 生铁和钢的对比
?
生铁
钢
含碳量
性能
用途
2%~4.3%
0.03%~2%
硬度大、抗压、性脆、可以铸造成型
有良好的延展性、机械性能好、可以锻轧和铸造
制造机座、管道等
制造机械和交通工具等
二、铁合金
2. 钢的分类
(1)碳素钢
?
含碳量
性能及用途
低碳钢
低于0.3%
韧性、焊接性好,强度低,用于制造钢板,钢丝和钢管等
中碳钢
0.3%~0.6%
强度高,韧性及加工性好,用于制造钢轨、车轮和建材等
高碳钢
高于0.6%
硬而脆,热处理后弹性好,用于制造器械、弹簧和刀具等
二、铁合金
2. 钢的分类
(2)合金钢
也叫特种钢,是在碳素钢里适量地加入一种或几种合金元素,使钢的组织结构发生变化,从而使钢具有各种特殊性能,如强度、硬度大,可塑性、韧性好,耐磨,耐腐蚀等。
(2)合金钢
名称
主要合金元素
主要特性
主要用途
不锈钢
铬、镍
比较稳定,不易生锈,具有很强的抗腐蚀能力
医疗器材、厨房用具和餐具、地铁列车的车体材质等
超级钢
Mn、C、Al、V
强度很大,能够实现钢板的轻薄化
汽车、航空和航天等领域
锰钢
锰
韧性好,硬度大
钢轨、轴承、钢模、挖掘机铲斗、坦克装甲
硅钢
硅
导磁性好
变压器、发电机和电动机中的铁芯
钨钢
钨
耐高温、硬度大
刀具
三、铝合金
制取
性能
用途
向铝中加入少量的Cu、Mg、Si 、Mn、Zn及稀土元素等
密度小、强度高、塑性好、易于成型、具有较强的抗腐蚀能力等
制造炊具、门窗、飞机和宇宙飞船外壳的原料
资料卡片——用途广泛的稀土元素
镧系元素(57~71号元素)及钇和钪,共17种元素,称为稀土元素。
我国是稀土资源大国。到目前为止,我国的稀土储量、稀土产量、稀土用量和稀土出口量均居世界第一位。
稀土金属既可以单独使用,也可用于生产合金。在合金中加入适量稀土金属,能大大改善合金的性能。因而,稀土元素又被称为“冶金工业的维生素”。例如,在钢中加入稀土元素,可以增加钢的塑性、韧性、耐磨性、耐热性、耐腐蚀性和抗氧化性等。因此,稀土金属广泛应用在冶金、石油化工、材料工业(电子材料、荧光材料、发光材料、永磁材料、超导材料、染色材料、纳米材料、引火合金和催化剂等)、医药及农业等领域。
四、新型合金
1. 新型储氢合金材料的研究和开发将为氢气作为能源的实际应用起到重要的推动作用。
2. 钛合金、耐热合金和形状记忆合金等广泛应用于航空航天、生物工程和电子工业等领域。
什么是记忆合金?原理是什么?
知识总结
铝及其化合物
铝单质和氧化铝
一、铝的结构、存在、物理性质及用途
1.结构:铝的原子结构示意图为____________。
2. 存在:铝是地壳中含量最多的金属元素,自然界中的铝全部以_______存在。
3. 物理性质:_______色有金属光泽的固体,有良好的延展性、导电性和传热性等,密度较小,质地柔软。
4. 用途:① 纯铝用作导线;②铝合金用于制造汽车、飞机、生活用品等。
化合态
银白
二、铝的化学性质
1.铝与氧气的反应
① 常温:铝与空气中的氧气反应,表面生成一层_________的氧化铝薄膜,对内部金属起着_________作用,化学方程式为______________________________。
② 点燃:铝在氧气中点燃,放出大量的热和耀眼的白光,化学方程式为_____________________________。
致密
保护
4Al+3O2===2Al2O3
4Al+3O2===2Al2O3
点燃
天然的氧化铝俗名叫刚玉,机械手表中的轴承就是用它制作的,若刚玉中混入了微量的铬,就成了红宝石,若混入了微量的钛或铁,就成了蓝宝石。
四、铝和氧化铝的化学性质
实验步骤
现象及原理
开始无气泡,一段时间后才产生气泡。
Al2O3 + 6HCl = 2AlCl3 + 3H2O
2Al + 6HCl = 2AlCl3 + 3H2↑
将点燃的木条放在试管口_________。
有爆鸣声
实验3-4
取一支试管,加入5mL 的盐酸,再向试管中放入一小块铝片,观察现象。过一段时间后,将点燃的木条放在试管口,观察到什么实验现象?
问题解决:
为什么不能用钢丝球擦洗铝合金锅?为什么酸性物质会腐蚀锅体?
用钢丝球擦洗铝合金锅会破坏铝合金表面的氧化铝薄膜,减弱其防腐蚀的效果。酸性物质可以和氧化铝薄膜铝反应,进而腐蚀锅体。
在两支试管中分别加入少量的NaOH溶液,然后向其中一支试管中放入一小块铝片,向另一支试管中放入用砂纸仔细打磨过(除去表面的氧化膜)的一小块铝片。观察现象。过一段时间后,将点燃的木条分别放在两支试管口你观察到什么现象?
【实验3-5】Al、Al2O3和NaOH溶液反应
实验3-5
实验现象
反应方程式
铝片与NaOH溶液反应
铝片(打磨过)与NaOH溶液反应
开始没有气泡,一段时间后产生气泡,将点燃的木条放在试管口可观察到淡蓝色火焰。
立即产生气泡,将点燃的木条放在试管口可观察到淡蓝色火焰。
偏铝酸钠
【实验3-5】Al、Al2O3和NaOH溶液反应
【实验结论】
1、Al既能与稀盐酸反应又能与NaOH溶液反应,
都生成_______和氢气。
盐
2Al + 6HCl = 2AlCl3 + 3H2↑
2Al+2NaOH+2H2O = 2NaAlO2+3H2↑
【实验结论】
Al2O3 + 2NaOH = 2NaAlO2 + H2 O
Al2O3 + 6HCl = 2AlCl3 + 3H2 O
2、 Al2O3既能与稀盐酸反应又能与NaOH溶液反应,
都生成_______和 水 。
盐
两性氧化物:
既能与酸反应生成盐和水,又能与碱反应生成盐和水的氧化物,如Al2O3
问题解决:
铝制餐具为何不宜用来蒸煮或长时间存放酸性或碱性食品?
铝、氧化铝既能与酸反应,又能与碱反应
铝及其化合物
氢氧化铝
一、物理性质
白色胶状不溶于水的固体,有较强的吸附性。
二、用途
1. 氢氧化铝胶体有较强吸附性,可用于净水。
2. 氢氧化铝碱性不强,可以用作胃酸中和剂。
生活中常用明矾来净水
十二水硫酸铝钾是一种无机物,又称明矾,化学式为KAl(SO4)2·12H2O,是一种含有结晶水的硫酸钾和硫酸铝的复盐。
明矾可溶于水,发生电离:KAl(SO4)2==K++Al3++2SO42-,电离出的Al3+在水中生成氢氧化铝胶体,可以和悬浮在水中的泥沙形成絮状不溶物沉降下来,生活中常用于净水。
三、化学性质
1. 热稳定性
Al(OH)3不稳定,受热易分解:_________________________________。
2 Al(OH)3 ==== Al2O3 + 3H2O
△
2. 两性
Al(OH)3是两性氢氧化物,既能与酸,又能与碱反应。
既能与酸反应生成盐和水,又能与碱反应生成盐和水的氢氧化物,称为两性氢氧化物
2. 两性
Al(OH)3是两性氢氧化物,既能与酸,又能与碱反应。
?
化学方程式
离子方程式
酸
?
?
碱
?
?
Al(OH)3 + 3HCl==AlCl3 + 3H2O
Al(OH)3 + 3H+ == Al3+ + 3H2O
Al(OH)3 + NaOH==NaAlO2 + 2H2O
Al(OH)3 + OH- == AlO2- + 2H2O
(1)往AlCl3溶液中逐滴滴加NaOH溶液,会有什么现象?写出相关方程式。
?
?
(2)往NaAlO2溶液中逐滴滴加HCl溶液,会有什么现象?写出相关方程式。
?
?
(3)往AlCl3溶液中逐滴滴加稀氨水,会有什么现象?写出相关方程式。
?
?
(4)往NaAlO2溶液中通入CO2直至过量,会有什么现象?写出相关方程式。
?
Al3+ + 3OH- === Al(OH)3↓
AlO2- + CO2 + 2H2O === Al(OH)3↓ + HCO3-
Al(OH)3 + OH- == AlO2- + 2H2O
Al3+ + 3NH3·H2O === Al(OH)3↓+ 3NH4+
H+ + AlO2- + H2O=Al(OH)3
?
Al(OH)3 + 3H+ == Al3+ + 3H2O
归纳总结——Al3+、Al(OH)3、AlO2-的转化
Al3+ + 3OH- === Al(OH)3↓
Al(OH)3 + OH- === AlO2- + 2H2O
总:Al3+ + 4OH- === AlO2- + 2H2O
H+ + AlO2- + H2O === Al(OH)3↓
Al(OH)3 + 3H+ === Al3+ + 3H2O
AlO2- + 4H+ === Al3+ + 2H2O
五、氢氧化铝的制备
1. 向铝盐中加入足量氨水:___________________________________________。
2. 向偏铝酸盐中通入足量CO2:_______________________________________。
Al3+ + 3NH3·H2O === Al(OH)3↓+ 3NH4+
AlO2- + CO2 + 2H2O === Al(OH)3↓ + HCO3-
六、“铝三角”的转化关系
物质的量在化学方程式计算中的应用
还记得物质的量的相关计算公式吗?
n =
m
M
N
NA
=
=
V
VM
= cBV
化学方程式里的化学计量数,与上述物理量有什么关系吗?
一、化学方程式计算的基础
请说出上述方程式的微观意义
2Na + 2H2O === 2NaOH + H2↑
物质是由原子、分子、离子等粒子构成的,物质之间的化学反应也是粒子按照一定的数目关系进行的。
化学方程式中的化学计量系数可以明确表示出化学反应中粒子之间的数目关系。
一、化学方程式计算的基础
2Na + 2H2O === 2NaOH + H2↑
化学计量数之比
2 : 2 : 2 : 1
扩大6.02×1023倍
2×6.02×1023 :2×6.02×1023 :2×6.02×1023 :1×6.02×1023
物质的量之比
2 mol : 2 mol : 2 mol : 1 mol
化学方程式中各物质的化学计量数之比等于粒子个数之比,也等于各物质的物质的量之比。
一、化学方程式计算的基础
2H2 + O2 === 2H2O
化学计量数之比
2 : 1
物质的量之比
2 mol : 1 mol
对于有气体参与的反应,在同温同压下各气体的化学计量数之比等于体积之比。
气体体积之比
44.8 L : 22.4 L
点燃
二、根据化学方程式计算的一般步骤
小杨老师 15521324728
微信公众号:杨sir化学
写
设
标
写出正确的化学方程式
根据题意设所求物理量,如 n、m、V 等
在有关物质下面标出已知物质和所求物质的相关数值
列
列出比例式
解
根据比例式求解并作答
三、实例分析
250 ml 2mol/L的硫酸与足量的铁屑完全反应。计算:
(1)参加反应的铁屑的物质的量;(2)生成的H2的体积(标准状况)。
解:参加反应的H2SO4的物质的量为:2mol/L×0.25L=0.50 mol
(1)设参加反应的铁屑的物质的量为n(Fe)
Fe+H2SO4===FeSO4+H2↑
1 1
n(Fe) 0.50 mol
11=n(Fe)0.50mol
n(Fe)=0.50 mol
?
(2)设生成H2的物质的量为V(H2)
Fe+H2SO4===FeSO4+H2↑
1mol 22.4L
0.50 mol V(H2)
1?mol0.50mol=22.4LV(H2)
V(H2)=11.2L
?
答:参加反应的铁屑的物质的量为0.50 mol;生成H2的体积在标准状况下为11.2L
三、实例分析
根据题目,相关物理量可以设 n、m、V 等
列比例式时,可以横着比,也可以竖着比
250 ml 2mol/L的硫酸与足量的铁屑完全反应。计算:
(1)参加反应的铁屑的物质的量;(2)生成的H2的体积(标准状况)。
有没有其他解法?
解:参加反应的H2SO4的物质的量为:2mol/L×0.25L=0.50 mol
(1)设参加反应的铁屑的物质的量为n(Fe),生成H2的物质的量为n(H2)
Fe +H2SO4 === FeSO4+H2↑
1 1 1
n(Fe) 0.50 mol n(H2)
1n(Fe)=10.50mol=1n(H2)
n(Fe)=0.50 mol,n(H2)=0.50 mol
V(H2)=0.50 mol×22.4L/mol=11.2L
答:参加反应的铁屑的物质的量为0.50 mol;生成H2体积在标准状况下为11.2L
?
可以统一先求n
知识导航
