化学人教版(2019)必修第一册3.1铁及其化合物(共30张ppt)
文档属性
| 名称 | 化学人教版(2019)必修第一册3.1铁及其化合物(共30张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 4.9MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-07-05 15:46:36 | ||
图片预览









文档简介
(共30张PPT)
3.1铁及其化合物(一)
第三章 铁 金属材料
——铁的单质、氧化物
人类最早使用的铁,是来自太空的陨铁。
铁在自然界中可以像陨铁中的铁那样以单质形态存在,但主要是以+2价和+3价化合物的形态存在于矿石中。铁元素在地壳中的含量仅次于氧、硅和铝,居第四位。
陨铁
1.铁元素的存在
赤铁矿(Fe2O3)
红棕色
磁铁矿(Fe3O4) 黑色
形态
单质(游离态)
化合态
地壳中元素含量递减
O Si Al Fe
2.铁的应用历史
铜柄铁剑是春秋时期的铁剑,1957年在甘肃省灵台县景家庄出土。距今2600年。
此剑剑叶铁质,残长9厘米,宽3厘米,厚0.3厘米,焊接于铜镡上。铁剑叶全部锈蚀,从铁锈上可以清楚看出用丝织物包裹的痕迹。
最早人工冶铁制品——春秋初年秦国的铜柄铁剑
铁制品在生活中非常常见
(2)铁的冶炼
冶炼方法:用还原的方法把铁从铁矿石中提炼出来。
高炉炼铁
Fe2O3 + 3CO 2Fe + 3CO2
其中生成CO的反应是
C + O2 ==== CO2
CO2 + C ==== 2CO
高温
高温
3.铁的物理性质
4.铁的化学性质
棕褐色
2. Fe与非氧化性酸反应
3. 与盐溶液(如硫酸铜)反应
Fe+2H+===Fe2++H2↑
Fe+CuSO4===FeSO4+Cu
Fe+Cu2+===Fe2++Cu
4.铁的化学性质
思考与交流:观察下列反应式,查看铁的化合价变化有何异同。
2Fe+3Cl2——2FeCl3
加热
Fe
FeCl3
化合价升高
0
+3
Fe+2HCl——2FeCl2+H2
Fe
FeCl2
化合价升高
0
+2
Fe+CuSO4——FeSO4+Cu
Fe
FeSO4
化合价升高
0
+2
4.铁的化学性质
为什么有的反应式中铁的化合价变成+2,有的变成+3?
在一定条件下,铁作为还原剂能与某些非金属单质、酸和盐溶液反应。
铁与氧化性较弱的氧化剂(如盐酸、硫酸铜等)反应,铁原子失去2个电子生成+2价铁的化合物。
铁与氧化性较强的氧化剂(如氯气等)反应,铁原子则失去3个电子生成+3价铁的化合物。
Fe-3e-→Fe3+ 棕黄色
Fe-2e-→Fe2+ 浅绿色
在钢铁厂的生产中,炽热的铁水或钢水注入模具之前,模具必须进行充分的干燥处理。这是为什么呢?
钢水注入干燥的模具
提示:铁与水会反应吗?
4.铁的化学性质
生活经验告诉我们,常温下,铁与水是不发生反应的。但在高温下,铁能与水发生反应。
湿棉花
还原铁粉
肥皂液
燃着的火柴
在高温下,铁能与水蒸气发生反应,生成四氧化三铁和氢气。
4.铁的化学性质
试管底部放入湿棉花,加热湿棉花产生水蒸气。试管中部放入铁粉装好装置,加热,使水蒸气与铁粉在高温下反应。
装置末端将产生的气体导入肥皂液中是为了产生气泡,便于通过点燃验证产物中的气体。
现象:蒸发皿中产生大量的肥皂泡,放出的气体能点燃,或会发出爆鸣声,反应后试管内固体仍为黑色。
分析:根据气体检测结果,证明为氢气;反应后试管内固体仍为黑色,说明不是氧化铁或氢氧化铁,因此可能是四氧化三铁。
湿棉花
还原铁粉
肥皂液
燃着的火柴
【思考】如何验证固体是否是四氧化三铁。
试管冷却后,利用磁铁在试管外侧吸一吸。若固体被吸引,证明固体是四氧化三铁。
4.铁的化学性质
【思考】如何验证反应生成的气体产物。
用小试管收集一试管气体,点燃,听到轻微噗声,证明生成的是氢气。
湿棉花
还原铁粉
肥皂液
燃着的火柴
在高温下,铁能与水蒸气发生反应,生成四氧化三铁和氢气。
4.铁的化学性质
反应式 中的气体H2为什么不加“↑”符号呢?
3Fe+4H2O(g)—— Fe3O4+4H2
高温
水在高温下为气态,因此等号右边的气体H2不用加“↑”符号。
铁元素可以形成三种氧化物,分别是氧化亚铁( FeO )、氧化铁(Fe2O3)和四氧化三铁(Fe3O4)。观察三者的外观,并对其作出描述。推测这三种氧化物有什么相同的化学性质和不同的化学性质,并说出你的推测依据?
FeO
Fe3O4
Fe2O3
推测:从分类的角度分析,三者都是金属氧化物,都能与酸反应。三者都难溶于水,不与水反应。
从价态的角度分析, FeO、 Fe3O4既有氧化性又有还原性, Fe2O3主要有氧化性。
5.铁的氧化物
化学名称 氧化亚铁 氧化铁 四氧化三铁
化学式
铁元素化合价
俗称 ——
矿石
色、态
水溶性
FeO
Fe2O3
Fe3O4
+2
+3
+2、+3
铁红
磁性氧化铁
黑色粉末
红棕色粉末
黑色晶体
均不溶于水
(1)物理性质
5.铁的氧化物
赤铁矿
磁铁矿
化学名称 氧化亚铁 氧化铁 四氧化三铁
稳定性
氧化物类别
与盐酸反应 (用离子方程式表示)
氧化性(被CO\H2还原)
用途 ——
(2)化学性质
不稳定
稳定
稳定
在空气中加热生成Fe3O4
均为碱性氧化物
FeO + 2H+ =Fe2+ +H2O
Fe2O3 +6H+ =2Fe3+ +3H2O
Fe3O4 +8H+ = 2Fe3+ + Fe2+ +4H2O
FexOy+yCO === xFe+yCO2
△
复杂氧化物
红色油漆和涂料、炼铁原料
制录音磁带和电讯器材,打印机或复印机的墨粉
4.铁的氧化物
在两支试管中分别加入少量的FeCl3溶液和FeSO4溶液,然后各滴入NaOH溶液。观察并描述发生的现象。
FeCl3溶液
NaOH溶液
FeSO4溶液
NaOH溶液
实验室制备
制备氢氧化亚铁
制备氢氧化铁
FeCl3+3NaOH=Fe(OH)3↓+3NaCl
Fe3++3OH-=Fe(OH)3↓
(红褐色沉淀)
现象:产生红褐色沉淀。
Fe(OH)3受热分解:2Fe(OH)3 Fe2O3 + 3H2O
FeCl3溶液
NaOH溶液
实验室制备Fe(OH)3
FeSO4+2NaOH = Fe(OH)2↓+Na2SO4
现象:生成白色沉淀,迅速变为灰绿色,最后变成红褐色
4Fe(OH)2+O2+2H2O = 4Fe(OH)3
(红褐色沉淀)
Fe2 + 2OH = Fe(OH)2
(白色沉淀)
FeSO4溶液
NaOH溶液
实验室制备Fe(OH)2
生成的白色絮状沉淀迅速变成灰绿色,过一段时间后还会有红褐色物质生成。
白色的Fe(OH)2会被溶解在溶液中的氧气氧化。那么,在实验室里,如何得到Fe(OH)2呢
【探究一】
Fe(OH)3和Fe(OH)2的实验室制法
在两支试管里分别加入少量的FeCl3和新制FeSO4溶液,然后滴入NaOH溶液,观察并记录现象。
思考探究下列问题:
3.在实验中,若想长时间观察到生成的白色Fe(OH)2沉淀,除使用新制FeSO4溶液外,还应创造一个怎样的反应环境?
1.两试管中有什么现象?久置于空气中又有什么现象?
1号试管中生成红褐色沉淀;久置不变色,2号试管中生成白色沉淀,且沉淀迅速变成灰绿色,过一段时间后有红褐色物质生成。
2.在制备Fe(OH)2时,为什么要用新制的FeSO4溶液并将吸有NaOH溶液的胶头滴管尖嘴插入液面以下?
用新制的FeSO4溶液为了防止Fe2+被氧化成Fe3+;滴管尖嘴插入液面以下是为了防止生成的Fe(OH)2与O2接触而被氧化。
因为Fe(OH)2易被氧气氧化而发生颜色变化,应尽可能创造无氧环境
以防止 Fe(OH)2被氧化。
实验室制备Fe(OH)2 改进
FeSO4溶液
NaOH溶液
改进后装置①优点:
操作步骤:配制溶液的蒸馏水煮沸,除去溶解的氧气,然后用苯液封,防止空气溶解,装有NaOH溶液的滴管插入液面下慢慢挤出溶液,这些操作均能防止Fe(OH)2与氧气接触,避免其被氧化,因此能较长时间观察到白色沉淀。
装置①
还有没有其他改进方案?
【讨论】下图为实验方案改进,请讨论装置②的防氧化原理。
铁粉和硫酸反应得到H2,装置充满了H2,生成的Fe(OH)2没有与O2接触。
FeSO4溶液
NaOH溶液
实验室制备Fe(OH)2 改进
装置②优点:
铁粉与稀硫酸反应生成的氢气排除了装置内的空气,同时试管内剩余的氢气起到保护气的作用,防止了Fe(OH)2与氧气接触,避免其被氧化,因此能较长时间观察到白色沉淀。
装置②
FeSO4溶液
NaOH溶液
打开止水夹a,检验试管B出口处排出的氢气的纯度。当排出的H2纯净时,夹紧止水夹a。
装置③优点:
铁粉与稀硫酸反应生成的氢气排除了装置内的空气,同时试管内剩余的氢气起到保护气的作用,防止了Fe(OH)2与氧气接触,避免其被氧化,因此能较长时间观察到白色沉淀。
装置③的防氧化原理和装置②类似,如何操作才能达到目的?
装置③
【总结】
防止Fe(OH)2氧化的方法
(1)含Fe2+的溶液必须是新制的,并放入Fe粉,以防Fe2+被氧化成Fe3+。
(2)除去溶液中溶解的O2,其方法是加热煮沸NaOH溶液。
(3)长胶头滴管末端插入试管内的液面以下。
(4)在FeSO4溶液液面上加植物油或苯进行液封。
(5)在容器内充满H2等气体,保证无O2环境。
【典例】下列各图示中能较长时间看到Fe(OH)2白色沉淀的是_________ (填序号)。
(变式训练)下列关于氢氧化亚铁及其制备方法的叙述中,不正确的是( )
A.氢氧化亚铁易被空气氧化
B.氢氧化亚铁为灰绿色絮状沉淀
C.可利用如图所示装置制备氢氧化亚铁
D.实验中所用氢氧化钠溶液应预先煮沸
①②③
B
四氧化三铁
氧化铁
氧化亚铁
铁的氧化物
制磁铁及
炼铁原料
油漆、涂料及
炼铁原料
—
用途
Fe3O4+8HCl ===2FeCl3+
FeCl2+4H2O
Fe2O3+6HCl
===2FeCl3+3H2O
FeO+2HCl ===FeCl2+H2O
与酸反应
均不溶于水
溶解性
—
碱性氧化物
碱性氧化物
氧化物类别
黑色晶体
红棕色粉末
黑色粉末
颜色、状态
磁性氧化铁
铁红
—
俗名
+2、+3
+3
+2
铁的化合价
Fe3O4
Fe2O3
FeO
化学式
铁的氧化物小结
Fe(OH)2 Fe(OH)3
色态
水溶性
制法
稳定性
与盐酸反应
转化
白色固体
红褐色固体
不溶
不溶
Fe2++2OH-=Fe(OH)2↓
4Fe(OH)2+O2+2H2O=4Fe(OH)3
Fe(OH)2+2H+=Fe2++2H2O
Fe(OH)3+3H+=Fe3+3H2O
Fe3++3OH-=Fe(OH)3↓
2Fe(OH)3==Fe2O3+3H2O
△
Fe(OH)2、 Fe(OH)3 性质比较
Fe(OH)2==FeO+H2O
△
FeSO4溶液
加入NaOH溶液现象
离子
方程式
FeCl3溶液
产生红褐色沉淀
Fe3++3OH-=Fe(OH)3↓
生成的白色絮状沉淀
Fe2++2OH-==Fe(OH)2↓(白色)
4Fe(OH)2+O2+2H2O=4Fe(OH)3
迅速变成灰绿色,最后变成红褐色
Fe(OH)2、 Fe(OH)3 小结
Fe(OH)2 Fe(OH)3
色态
水溶性
制法
稳定性
与盐酸反应
转化
白色固体
红褐色固体
不溶
不溶
Fe2++2OH-=Fe(OH)2↓
4Fe(OH)2+O2+2H2O=4Fe(OH)3
Fe(OH)2+2H+=Fe2++2H2O
Fe(OH)3+3H+=Fe3+3H2O
Fe3++3OH-=Fe(OH)3↓
2Fe(OH)3==Fe2O3+3H2O
△
Fe(OH)2、 Fe(OH)3 性质小结
Fe(OH)2==FeO+H2O
△
3.1铁及其化合物(一)
第三章 铁 金属材料
——铁的单质、氧化物
人类最早使用的铁,是来自太空的陨铁。
铁在自然界中可以像陨铁中的铁那样以单质形态存在,但主要是以+2价和+3价化合物的形态存在于矿石中。铁元素在地壳中的含量仅次于氧、硅和铝,居第四位。
陨铁
1.铁元素的存在
赤铁矿(Fe2O3)
红棕色
磁铁矿(Fe3O4) 黑色
形态
单质(游离态)
化合态
地壳中元素含量递减
O Si Al Fe
2.铁的应用历史
铜柄铁剑是春秋时期的铁剑,1957年在甘肃省灵台县景家庄出土。距今2600年。
此剑剑叶铁质,残长9厘米,宽3厘米,厚0.3厘米,焊接于铜镡上。铁剑叶全部锈蚀,从铁锈上可以清楚看出用丝织物包裹的痕迹。
最早人工冶铁制品——春秋初年秦国的铜柄铁剑
铁制品在生活中非常常见
(2)铁的冶炼
冶炼方法:用还原的方法把铁从铁矿石中提炼出来。
高炉炼铁
Fe2O3 + 3CO 2Fe + 3CO2
其中生成CO的反应是
C + O2 ==== CO2
CO2 + C ==== 2CO
高温
高温
3.铁的物理性质
4.铁的化学性质
棕褐色
2. Fe与非氧化性酸反应
3. 与盐溶液(如硫酸铜)反应
Fe+2H+===Fe2++H2↑
Fe+CuSO4===FeSO4+Cu
Fe+Cu2+===Fe2++Cu
4.铁的化学性质
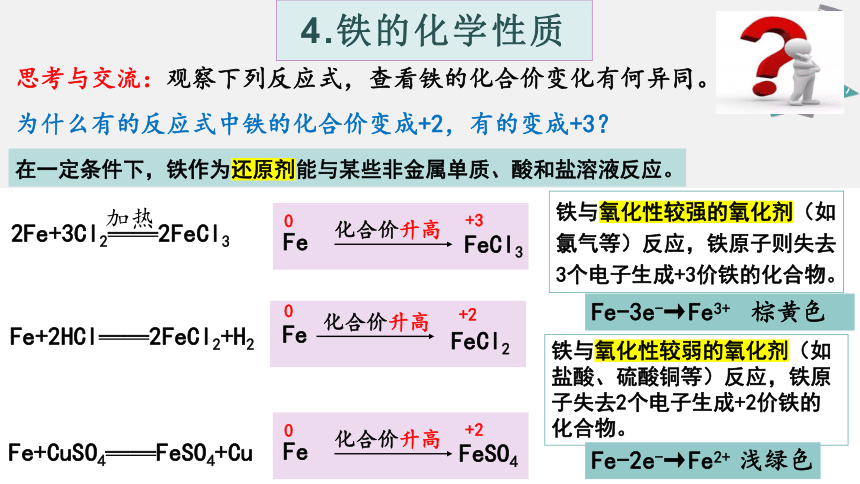
思考与交流:观察下列反应式,查看铁的化合价变化有何异同。
2Fe+3Cl2——2FeCl3
加热
Fe
FeCl3
化合价升高
0
+3
Fe+2HCl——2FeCl2+H2
Fe
FeCl2
化合价升高
0
+2
Fe+CuSO4——FeSO4+Cu
Fe
FeSO4
化合价升高
0
+2
4.铁的化学性质
为什么有的反应式中铁的化合价变成+2,有的变成+3?
在一定条件下,铁作为还原剂能与某些非金属单质、酸和盐溶液反应。
铁与氧化性较弱的氧化剂(如盐酸、硫酸铜等)反应,铁原子失去2个电子生成+2价铁的化合物。
铁与氧化性较强的氧化剂(如氯气等)反应,铁原子则失去3个电子生成+3价铁的化合物。
Fe-3e-→Fe3+ 棕黄色
Fe-2e-→Fe2+ 浅绿色
在钢铁厂的生产中,炽热的铁水或钢水注入模具之前,模具必须进行充分的干燥处理。这是为什么呢?
钢水注入干燥的模具
提示:铁与水会反应吗?
4.铁的化学性质
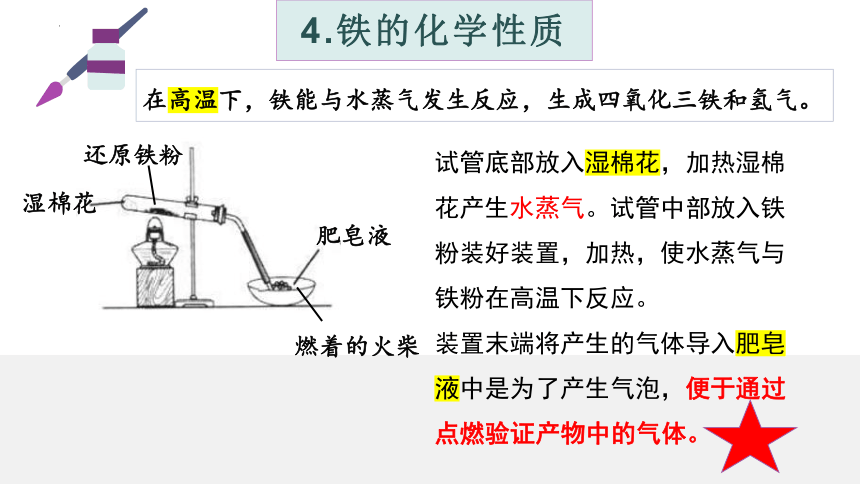
生活经验告诉我们,常温下,铁与水是不发生反应的。但在高温下,铁能与水发生反应。
湿棉花
还原铁粉
肥皂液
燃着的火柴
在高温下,铁能与水蒸气发生反应,生成四氧化三铁和氢气。
4.铁的化学性质
试管底部放入湿棉花,加热湿棉花产生水蒸气。试管中部放入铁粉装好装置,加热,使水蒸气与铁粉在高温下反应。
装置末端将产生的气体导入肥皂液中是为了产生气泡,便于通过点燃验证产物中的气体。
现象:蒸发皿中产生大量的肥皂泡,放出的气体能点燃,或会发出爆鸣声,反应后试管内固体仍为黑色。
分析:根据气体检测结果,证明为氢气;反应后试管内固体仍为黑色,说明不是氧化铁或氢氧化铁,因此可能是四氧化三铁。
湿棉花
还原铁粉
肥皂液
燃着的火柴
【思考】如何验证固体是否是四氧化三铁。
试管冷却后,利用磁铁在试管外侧吸一吸。若固体被吸引,证明固体是四氧化三铁。
4.铁的化学性质
【思考】如何验证反应生成的气体产物。
用小试管收集一试管气体,点燃,听到轻微噗声,证明生成的是氢气。
湿棉花
还原铁粉
肥皂液
燃着的火柴
在高温下,铁能与水蒸气发生反应,生成四氧化三铁和氢气。
4.铁的化学性质
反应式 中的气体H2为什么不加“↑”符号呢?
3Fe+4H2O(g)—— Fe3O4+4H2
高温
水在高温下为气态,因此等号右边的气体H2不用加“↑”符号。
铁元素可以形成三种氧化物,分别是氧化亚铁( FeO )、氧化铁(Fe2O3)和四氧化三铁(Fe3O4)。观察三者的外观,并对其作出描述。推测这三种氧化物有什么相同的化学性质和不同的化学性质,并说出你的推测依据?
FeO
Fe3O4
Fe2O3
推测:从分类的角度分析,三者都是金属氧化物,都能与酸反应。三者都难溶于水,不与水反应。
从价态的角度分析, FeO、 Fe3O4既有氧化性又有还原性, Fe2O3主要有氧化性。
5.铁的氧化物
化学名称 氧化亚铁 氧化铁 四氧化三铁
化学式
铁元素化合价
俗称 ——
矿石
色、态
水溶性
FeO
Fe2O3
Fe3O4
+2
+3
+2、+3
铁红
磁性氧化铁
黑色粉末
红棕色粉末
黑色晶体
均不溶于水
(1)物理性质
5.铁的氧化物
赤铁矿
磁铁矿
化学名称 氧化亚铁 氧化铁 四氧化三铁
稳定性
氧化物类别
与盐酸反应 (用离子方程式表示)
氧化性(被CO\H2还原)
用途 ——
(2)化学性质
不稳定
稳定
稳定
在空气中加热生成Fe3O4
均为碱性氧化物
FeO + 2H+ =Fe2+ +H2O
Fe2O3 +6H+ =2Fe3+ +3H2O
Fe3O4 +8H+ = 2Fe3+ + Fe2+ +4H2O
FexOy+yCO === xFe+yCO2
△
复杂氧化物
红色油漆和涂料、炼铁原料
制录音磁带和电讯器材,打印机或复印机的墨粉
4.铁的氧化物
在两支试管中分别加入少量的FeCl3溶液和FeSO4溶液,然后各滴入NaOH溶液。观察并描述发生的现象。
FeCl3溶液
NaOH溶液
FeSO4溶液
NaOH溶液
实验室制备
制备氢氧化亚铁
制备氢氧化铁
FeCl3+3NaOH=Fe(OH)3↓+3NaCl
Fe3++3OH-=Fe(OH)3↓
(红褐色沉淀)
现象:产生红褐色沉淀。
Fe(OH)3受热分解:2Fe(OH)3 Fe2O3 + 3H2O
FeCl3溶液
NaOH溶液
实验室制备Fe(OH)3
FeSO4+2NaOH = Fe(OH)2↓+Na2SO4
现象:生成白色沉淀,迅速变为灰绿色,最后变成红褐色
4Fe(OH)2+O2+2H2O = 4Fe(OH)3
(红褐色沉淀)
Fe2 + 2OH = Fe(OH)2
(白色沉淀)
FeSO4溶液
NaOH溶液
实验室制备Fe(OH)2
生成的白色絮状沉淀迅速变成灰绿色,过一段时间后还会有红褐色物质生成。
白色的Fe(OH)2会被溶解在溶液中的氧气氧化。那么,在实验室里,如何得到Fe(OH)2呢
【探究一】
Fe(OH)3和Fe(OH)2的实验室制法
在两支试管里分别加入少量的FeCl3和新制FeSO4溶液,然后滴入NaOH溶液,观察并记录现象。
思考探究下列问题:
3.在实验中,若想长时间观察到生成的白色Fe(OH)2沉淀,除使用新制FeSO4溶液外,还应创造一个怎样的反应环境?
1.两试管中有什么现象?久置于空气中又有什么现象?
1号试管中生成红褐色沉淀;久置不变色,2号试管中生成白色沉淀,且沉淀迅速变成灰绿色,过一段时间后有红褐色物质生成。
2.在制备Fe(OH)2时,为什么要用新制的FeSO4溶液并将吸有NaOH溶液的胶头滴管尖嘴插入液面以下?
用新制的FeSO4溶液为了防止Fe2+被氧化成Fe3+;滴管尖嘴插入液面以下是为了防止生成的Fe(OH)2与O2接触而被氧化。
因为Fe(OH)2易被氧气氧化而发生颜色变化,应尽可能创造无氧环境
以防止 Fe(OH)2被氧化。
实验室制备Fe(OH)2 改进
FeSO4溶液
NaOH溶液
改进后装置①优点:
操作步骤:配制溶液的蒸馏水煮沸,除去溶解的氧气,然后用苯液封,防止空气溶解,装有NaOH溶液的滴管插入液面下慢慢挤出溶液,这些操作均能防止Fe(OH)2与氧气接触,避免其被氧化,因此能较长时间观察到白色沉淀。
装置①
还有没有其他改进方案?
【讨论】下图为实验方案改进,请讨论装置②的防氧化原理。
铁粉和硫酸反应得到H2,装置充满了H2,生成的Fe(OH)2没有与O2接触。
FeSO4溶液
NaOH溶液
实验室制备Fe(OH)2 改进
装置②优点:
铁粉与稀硫酸反应生成的氢气排除了装置内的空气,同时试管内剩余的氢气起到保护气的作用,防止了Fe(OH)2与氧气接触,避免其被氧化,因此能较长时间观察到白色沉淀。
装置②
FeSO4溶液
NaOH溶液
打开止水夹a,检验试管B出口处排出的氢气的纯度。当排出的H2纯净时,夹紧止水夹a。
装置③优点:
铁粉与稀硫酸反应生成的氢气排除了装置内的空气,同时试管内剩余的氢气起到保护气的作用,防止了Fe(OH)2与氧气接触,避免其被氧化,因此能较长时间观察到白色沉淀。
装置③的防氧化原理和装置②类似,如何操作才能达到目的?
装置③
【总结】
防止Fe(OH)2氧化的方法
(1)含Fe2+的溶液必须是新制的,并放入Fe粉,以防Fe2+被氧化成Fe3+。
(2)除去溶液中溶解的O2,其方法是加热煮沸NaOH溶液。
(3)长胶头滴管末端插入试管内的液面以下。
(4)在FeSO4溶液液面上加植物油或苯进行液封。
(5)在容器内充满H2等气体,保证无O2环境。
【典例】下列各图示中能较长时间看到Fe(OH)2白色沉淀的是_________ (填序号)。
(变式训练)下列关于氢氧化亚铁及其制备方法的叙述中,不正确的是( )
A.氢氧化亚铁易被空气氧化
B.氢氧化亚铁为灰绿色絮状沉淀
C.可利用如图所示装置制备氢氧化亚铁
D.实验中所用氢氧化钠溶液应预先煮沸
①②③
B
四氧化三铁
氧化铁
氧化亚铁
铁的氧化物
制磁铁及
炼铁原料
油漆、涂料及
炼铁原料
—
用途
Fe3O4+8HCl ===2FeCl3+
FeCl2+4H2O
Fe2O3+6HCl
===2FeCl3+3H2O
FeO+2HCl ===FeCl2+H2O
与酸反应
均不溶于水
溶解性
—
碱性氧化物
碱性氧化物
氧化物类别
黑色晶体
红棕色粉末
黑色粉末
颜色、状态
磁性氧化铁
铁红
—
俗名
+2、+3
+3
+2
铁的化合价
Fe3O4
Fe2O3
FeO
化学式
铁的氧化物小结
Fe(OH)2 Fe(OH)3
色态
水溶性
制法
稳定性
与盐酸反应
转化
白色固体
红褐色固体
不溶
不溶
Fe2++2OH-=Fe(OH)2↓
4Fe(OH)2+O2+2H2O=4Fe(OH)3
Fe(OH)2+2H+=Fe2++2H2O
Fe(OH)3+3H+=Fe3+3H2O
Fe3++3OH-=Fe(OH)3↓
2Fe(OH)3==Fe2O3+3H2O
△
Fe(OH)2、 Fe(OH)3 性质比较
Fe(OH)2==FeO+H2O
△
FeSO4溶液
加入NaOH溶液现象
离子
方程式
FeCl3溶液
产生红褐色沉淀
Fe3++3OH-=Fe(OH)3↓
生成的白色絮状沉淀
Fe2++2OH-==Fe(OH)2↓(白色)
4Fe(OH)2+O2+2H2O=4Fe(OH)3
迅速变成灰绿色,最后变成红褐色
Fe(OH)2、 Fe(OH)3 小结
Fe(OH)2 Fe(OH)3
色态
水溶性
制法
稳定性
与盐酸反应
转化
白色固体
红褐色固体
不溶
不溶
Fe2++2OH-=Fe(OH)2↓
4Fe(OH)2+O2+2H2O=4Fe(OH)3
Fe(OH)2+2H+=Fe2++2H2O
Fe(OH)3+3H+=Fe3+3H2O
Fe3++3OH-=Fe(OH)3↓
2Fe(OH)3==Fe2O3+3H2O
△
Fe(OH)2、 Fe(OH)3 性质小结
Fe(OH)2==FeO+H2O
△
