山东省济宁二中2012-2013学年高二下学期期中考试化学(理)试题(有答案)
文档属性
| 名称 | 山东省济宁二中2012-2013学年高二下学期期中考试化学(理)试题(有答案) |

|
|
| 格式 | zip | ||
| 文件大小 | 37.8KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2013-06-19 00:00:00 | ||
图片预览


文档简介
济宁二中2012-2013学年高二下学期期中考试
化学(理 )试题
一、选择题(本题包括16个小题,每小题4分,共64分)
1.下列四种元素中,其单质氧化性最强的是 ( )。
A.原子含有未成对电子最多的第二周期元素 B.位于周期表中第三周期ⅢA族的元素
C.原子最外层电子排布为2s22p4的元素 D.原子最外层电子排布为3s23p3的元素
2.不能说明X的电负性比Y的大的是( )。
A.与H2化合时X单质比Y单质容易,
B.X的最高价氧化物对应水化物的酸性比Y的最高价氧化物对应水化物的
酸性强,
C.X原子的最外层电子数比Y原子最外层电子数多,
D.X单质可以把Y从其氢化物中置换出来,
3.下列各组元素,按原子半径依次减小,元素第一电离能逐渐升高的顺序排列的是 ( )。
A.K、Na、Li B.Al、Mg、Na C.N、O、C D.Cl、S、P
4.已知X、Y是主族元素,I为电离能,单位是kJ·mol-1。请根据下表所列数据判断,错误的是 ( )。
元素
I1
I2
I3
I4
X
500
4 600
6 900
9 500
Y
580
1 800
2 700
11 600
A.元素X的常见化合价是+1价
B.元素Y是ⅢA族元素
C.元素X与氯形成化合物时,化学式可能是XCl
D.若元素Y处于第三周期,它可与冷水剧烈反应
5.下列各组元素的性质正确的是( )。
A.第一电离能:B>Al>Ga B.电负性:F>N>O
C.最高正价:F>S>Si D.原子半径:P>N>C
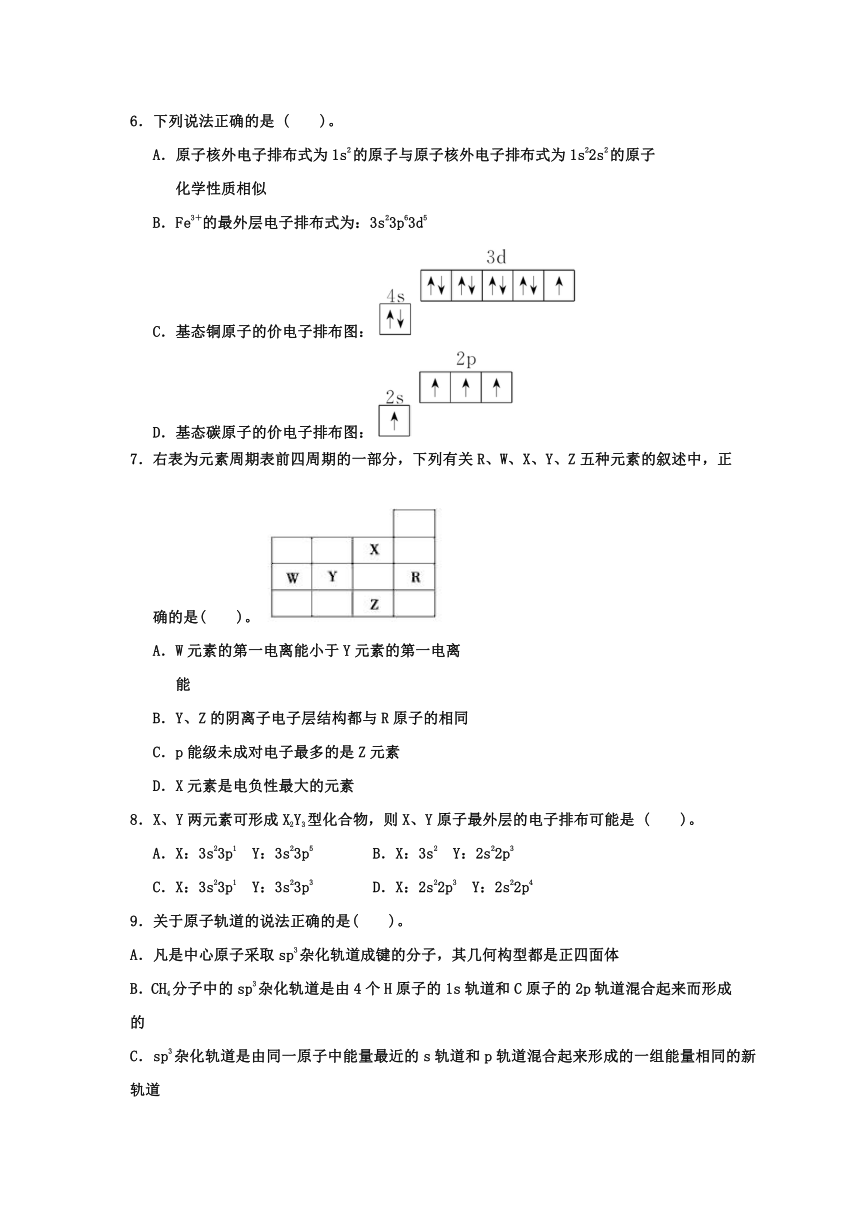
6.下列说法正确的是 ( )。
A.原子核外电子排布式为1s2的原子与原子核外电子排布式为1s22s2的原子
化学性质相似
B.Fe3+的最外层电子排布式为:3s23p63d5
C.基态铜原子的价电子排布图:
D.基态碳原子的价电子排布图:
7.右表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )。
A.W元素的第一电离能小于Y元素的第一电离
能
B.Y、Z的阴离子电子层结构都与R原子的相同
C.p能级未成对电子最多的是Z元素
D.X元素是电负性最大的元素
8.X、Y两元素可形成X2Y3型化合物,则X、Y原子最外层的电子排布可能是 ( )。
A.X:3s23p1 Y:3s23p5 B.X:3s2 Y:2s22p3
C.X:3s23p1 Y:3s23p3 D.X:2s22p3 Y:2s22p4
9.关于原子轨道的说法正确的是( )。
A.凡是中心原子采取sp3杂化轨道成键的分子,其几何构型都是正四面体
B.CH4分子中的sp3杂化轨道是由4个H原子的1s轨道和C原子的2p轨道混合起来而形成的
C.sp3杂化轨道是由同一原子中能量最近的s轨道和p轨道混合起来形成的一组能量相同的新轨道
D.凡AB3型的共价化合物,其中心原子A均采用sp3杂化轨道成键
10.构造原理揭示的电子排布能级顺序,实质是各能级能量高低,若以E表示某能级的能量,下列能量大小顺序中正确的是?
A.E(3s)>E(2s)>E(1s)???????????????B.E(3s)>E(3p)>E(3d)?
C.E(4f)>E(4s)>E(3d)???????????????D.E(5s)>E(4s)>E(4f)
11.下列各组微粒中不属于等电子体的是 ( )。
A.CH4、NH4+ B.H2S、HCl C.CO2、N2O D.CO32-、NO3-
12.配位化合物的数量巨大,组成和结构形形色色,丰富多彩。请指出配合物[Cu(NH3)4](OH)2的中心离子、配体、中心离子的电荷数和配位数 ( )。
A.Cu2+、NH3、+2、4 B.Cu+、NH3、+1、4
C.Cu2+、OH-、+2、2 D.Cu2+、NH3、+2、2
13.氯化硼的熔点为-107℃,沸点为12.5℃,在其分子中键与键之间的夹角为120°,它能水解,有关叙述正确的是( )。
A.氯化硼液态时能导电而固态时不导电 B.氯化硼中心原子采用 sp杂化
C.氯化硼分子呈正三角形,属非极性分子 D.其分子空间结构类似NH3
14.根据价层电子对互斥模型,下列分子或者离子的空间构型不是三角锥形的是 ( )。
A.PCl3 B.H3O+ C.HCHO D.PH3
15.下列变化或数据与氢键无关的是 ( )。
A.水的沸点比硫化氢的沸点高 B.氨分子与水分子形成一水合氨
C.乙醇能跟水以任意比混溶 D.SbH3的沸点比PH3高
16.下列说法中不正确的是( )。
A.当两种原子的电负性相差很大时,相互之间通常形成离子键
B.不含金属元素的化合物不一定是共价化合物
C.HCl分子中的共价键是由氢原子的1s轨道和氯原子的3s轨道重叠形成的
D.四氯化碳分子中含四个共价单键,为正四面体
二、非选择题(本题包括4个小题,共36分)
17.(6分)A、B、C、D是同一周期的四种元素。A、B、C的原子序数依次相差为1。A元素的单质的化学性质活泼,A元素的原子在本周期中第一电离能最小。B元素的氧化物2.0 g恰好跟100 mL 0.5 mol·L-1硫酸完全
A的原子结构示意图:________,C原子反应。B元素单质跟D元素单质反应生成化合物BD2。根据以上事实,填写下列空白: BD2的电子式为________;若向C的氧化物的水化物中加入A的氧化物的水化物,则溶液显碱性。这一反应的化学方程式是________________________。
18.(14分)短周期元素A、B、C的原子序数逐渐增大,它们形成的离子具有相同的电子层结构, B和C的单质都能跟水剧烈反应,B为电负性数值最大的元素。B单质与H2O反应产生A单质,0.5 mol C单质跟水反应时,在标准状况下放出5.6 L H2,此时C转化成具有氖原子核外电子层结构的离子。问:
(1)A、B、C各是什么元素?
(2)写出这三种元素所形成化合物的化学式,其中有一种淡黄色固体,写出它作为呼吸面具中供养剂时的所有反应原理 ,并指出氧化剂、还原剂。
19.(8分)A、B、C、D、E分别代表五种短周期元素,且原子序数依次增大,已知:B的最外层电子排布是ns2npn+1;C的p能级上未成对的电子比B少一个;D的二价阳离子与C的阴离子具有相同的电子层结构;E与D同周期且E在该周期中原子半径最小;B与A的单质能生成具有刺激性气味的气体。
(1)B原子核外电子排布式为________。
(2)A与E化合时原子间以________键相结合,D与C化合时原子间以
________键相结合。
(3)写出A、C的单质直接化合形成的化合物与E单质反应的离子方程式:
__________________________________________________________________
_________________________________________________________________。
(4)A与B形成化合物时,中心原子采取________杂化成键,其立体结构为
________,属于________(填“极性”或“非极性”)分子。
20.(8分)氮元素可以形成多种化合物。 回答以下问题:
(1)基态氮原子的价电子排布式是________。
(2)C、N、O三种元素第一电离能从大到小的顺序是________。
(3)肼(N2H4)分子可视为NH3分子中的一个氢原子被—NH2(氨基)取代形成的
另一种氮的氢化物。
NH3分子的空间构型是________;N2H4分子中氮原子轨道的杂化类型是
________。
化学(理 )试题
一、选择题(本题包括16个小题,每小题4分,共64分)
1.下列四种元素中,其单质氧化性最强的是 ( )。
A.原子含有未成对电子最多的第二周期元素 B.位于周期表中第三周期ⅢA族的元素
C.原子最外层电子排布为2s22p4的元素 D.原子最外层电子排布为3s23p3的元素
2.不能说明X的电负性比Y的大的是( )。
A.与H2化合时X单质比Y单质容易,
B.X的最高价氧化物对应水化物的酸性比Y的最高价氧化物对应水化物的
酸性强,
C.X原子的最外层电子数比Y原子最外层电子数多,
D.X单质可以把Y从其氢化物中置换出来,
3.下列各组元素,按原子半径依次减小,元素第一电离能逐渐升高的顺序排列的是 ( )。
A.K、Na、Li B.Al、Mg、Na C.N、O、C D.Cl、S、P
4.已知X、Y是主族元素,I为电离能,单位是kJ·mol-1。请根据下表所列数据判断,错误的是 ( )。
元素
I1
I2
I3
I4
X
500
4 600
6 900
9 500
Y
580
1 800
2 700
11 600
A.元素X的常见化合价是+1价
B.元素Y是ⅢA族元素
C.元素X与氯形成化合物时,化学式可能是XCl
D.若元素Y处于第三周期,它可与冷水剧烈反应
5.下列各组元素的性质正确的是( )。
A.第一电离能:B>Al>Ga B.电负性:F>N>O
C.最高正价:F>S>Si D.原子半径:P>N>C
6.下列说法正确的是 ( )。
A.原子核外电子排布式为1s2的原子与原子核外电子排布式为1s22s2的原子
化学性质相似
B.Fe3+的最外层电子排布式为:3s23p63d5
C.基态铜原子的价电子排布图:
D.基态碳原子的价电子排布图:
7.右表为元素周期表前四周期的一部分,下列有关R、W、X、Y、Z五种元素的叙述中,正确的是( )。
A.W元素的第一电离能小于Y元素的第一电离
能
B.Y、Z的阴离子电子层结构都与R原子的相同
C.p能级未成对电子最多的是Z元素
D.X元素是电负性最大的元素
8.X、Y两元素可形成X2Y3型化合物,则X、Y原子最外层的电子排布可能是 ( )。
A.X:3s23p1 Y:3s23p5 B.X:3s2 Y:2s22p3
C.X:3s23p1 Y:3s23p3 D.X:2s22p3 Y:2s22p4
9.关于原子轨道的说法正确的是( )。
A.凡是中心原子采取sp3杂化轨道成键的分子,其几何构型都是正四面体
B.CH4分子中的sp3杂化轨道是由4个H原子的1s轨道和C原子的2p轨道混合起来而形成的
C.sp3杂化轨道是由同一原子中能量最近的s轨道和p轨道混合起来形成的一组能量相同的新轨道
D.凡AB3型的共价化合物,其中心原子A均采用sp3杂化轨道成键
10.构造原理揭示的电子排布能级顺序,实质是各能级能量高低,若以E表示某能级的能量,下列能量大小顺序中正确的是?
A.E(3s)>E(2s)>E(1s)???????????????B.E(3s)>E(3p)>E(3d)?
C.E(4f)>E(4s)>E(3d)???????????????D.E(5s)>E(4s)>E(4f)
11.下列各组微粒中不属于等电子体的是 ( )。
A.CH4、NH4+ B.H2S、HCl C.CO2、N2O D.CO32-、NO3-
12.配位化合物的数量巨大,组成和结构形形色色,丰富多彩。请指出配合物[Cu(NH3)4](OH)2的中心离子、配体、中心离子的电荷数和配位数 ( )。
A.Cu2+、NH3、+2、4 B.Cu+、NH3、+1、4
C.Cu2+、OH-、+2、2 D.Cu2+、NH3、+2、2
13.氯化硼的熔点为-107℃,沸点为12.5℃,在其分子中键与键之间的夹角为120°,它能水解,有关叙述正确的是( )。
A.氯化硼液态时能导电而固态时不导电 B.氯化硼中心原子采用 sp杂化
C.氯化硼分子呈正三角形,属非极性分子 D.其分子空间结构类似NH3
14.根据价层电子对互斥模型,下列分子或者离子的空间构型不是三角锥形的是 ( )。
A.PCl3 B.H3O+ C.HCHO D.PH3
15.下列变化或数据与氢键无关的是 ( )。
A.水的沸点比硫化氢的沸点高 B.氨分子与水分子形成一水合氨
C.乙醇能跟水以任意比混溶 D.SbH3的沸点比PH3高
16.下列说法中不正确的是( )。
A.当两种原子的电负性相差很大时,相互之间通常形成离子键
B.不含金属元素的化合物不一定是共价化合物
C.HCl分子中的共价键是由氢原子的1s轨道和氯原子的3s轨道重叠形成的
D.四氯化碳分子中含四个共价单键,为正四面体
二、非选择题(本题包括4个小题,共36分)
17.(6分)A、B、C、D是同一周期的四种元素。A、B、C的原子序数依次相差为1。A元素的单质的化学性质活泼,A元素的原子在本周期中第一电离能最小。B元素的氧化物2.0 g恰好跟100 mL 0.5 mol·L-1硫酸完全
A的原子结构示意图:________,C原子反应。B元素单质跟D元素单质反应生成化合物BD2。根据以上事实,填写下列空白: BD2的电子式为________;若向C的氧化物的水化物中加入A的氧化物的水化物,则溶液显碱性。这一反应的化学方程式是________________________。
18.(14分)短周期元素A、B、C的原子序数逐渐增大,它们形成的离子具有相同的电子层结构, B和C的单质都能跟水剧烈反应,B为电负性数值最大的元素。B单质与H2O反应产生A单质,0.5 mol C单质跟水反应时,在标准状况下放出5.6 L H2,此时C转化成具有氖原子核外电子层结构的离子。问:
(1)A、B、C各是什么元素?
(2)写出这三种元素所形成化合物的化学式,其中有一种淡黄色固体,写出它作为呼吸面具中供养剂时的所有反应原理 ,并指出氧化剂、还原剂。
19.(8分)A、B、C、D、E分别代表五种短周期元素,且原子序数依次增大,已知:B的最外层电子排布是ns2npn+1;C的p能级上未成对的电子比B少一个;D的二价阳离子与C的阴离子具有相同的电子层结构;E与D同周期且E在该周期中原子半径最小;B与A的单质能生成具有刺激性气味的气体。
(1)B原子核外电子排布式为________。
(2)A与E化合时原子间以________键相结合,D与C化合时原子间以
________键相结合。
(3)写出A、C的单质直接化合形成的化合物与E单质反应的离子方程式:
__________________________________________________________________
_________________________________________________________________。
(4)A与B形成化合物时,中心原子采取________杂化成键,其立体结构为
________,属于________(填“极性”或“非极性”)分子。
20.(8分)氮元素可以形成多种化合物。 回答以下问题:
(1)基态氮原子的价电子排布式是________。
(2)C、N、O三种元素第一电离能从大到小的顺序是________。
(3)肼(N2H4)分子可视为NH3分子中的一个氢原子被—NH2(氨基)取代形成的
另一种氮的氢化物。
NH3分子的空间构型是________;N2H4分子中氮原子轨道的杂化类型是
________。
同课章节目录
