人教版(2019)高二下学期化学选择性必修2第三章晶体结构与性质 单元测试(word版有答案)
文档属性
| 名称 | 人教版(2019)高二下学期化学选择性必修2第三章晶体结构与性质 单元测试(word版有答案) |  | |
| 格式 | docx | ||
| 文件大小 | 818.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-07-06 14:25:34 | ||
图片预览



文档简介
第三章晶体结构与性质章节训练
一、单选题(共13道)
1.下列物质的熔、沸点高低顺序正确的是
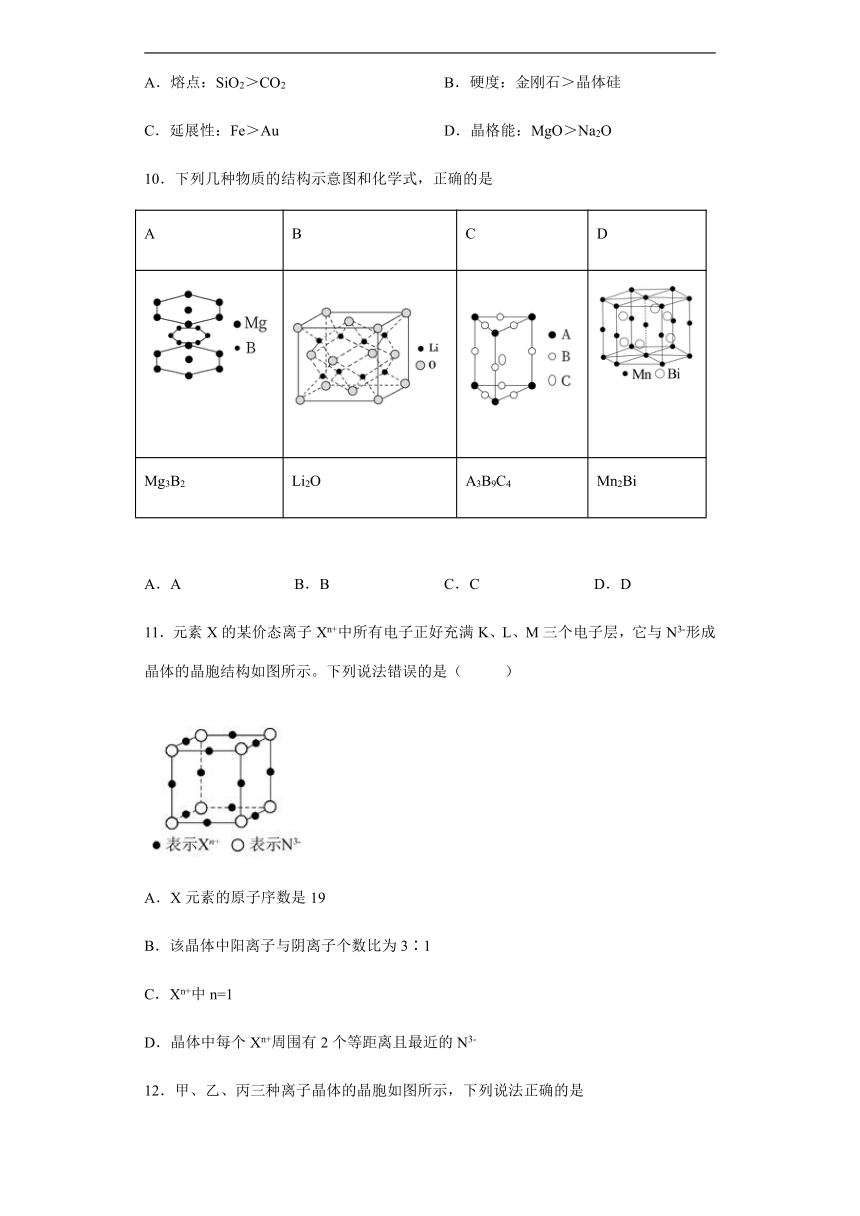
A.金刚石>晶体硅>二氧化硅>碳化硅 B.
C. D.金刚石>生铁>钠>纯铁
2.下列反应的离子方程式正确的是
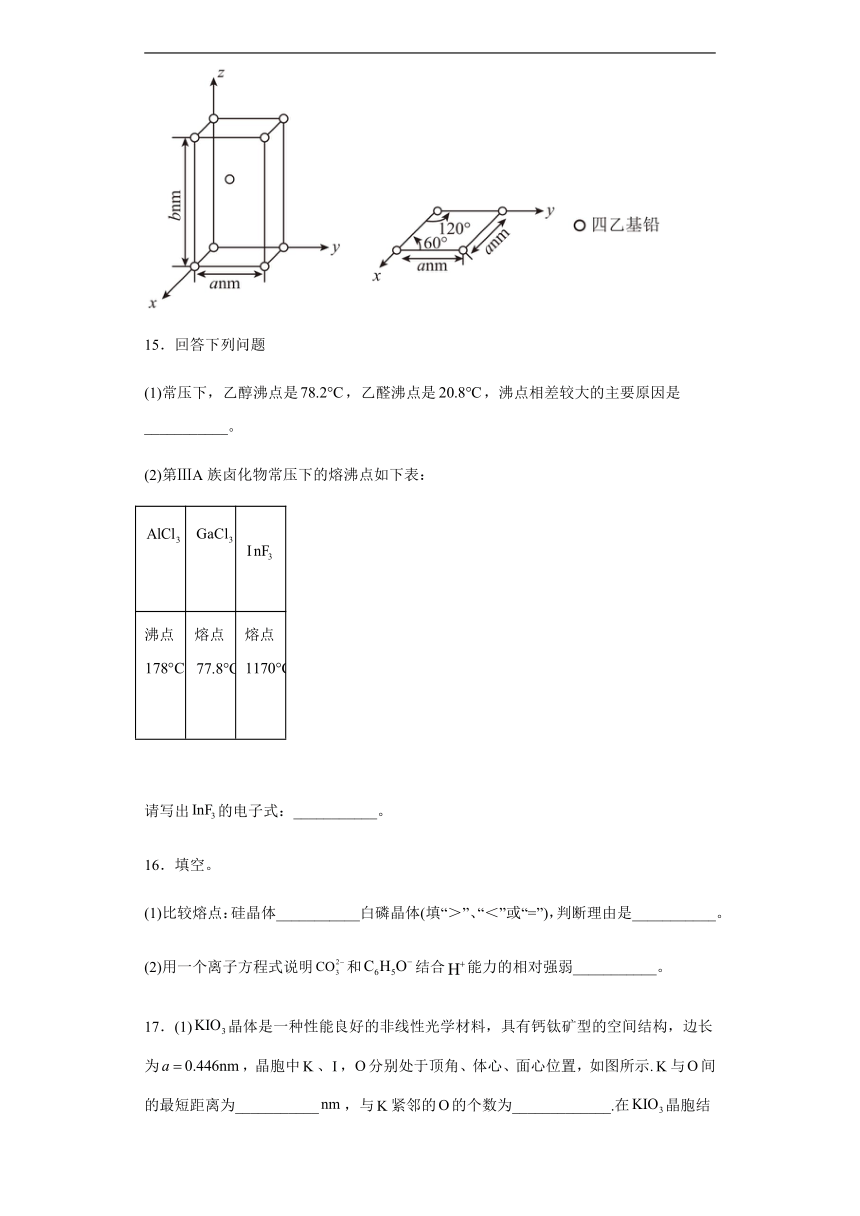
A.向硝酸银溶液中加入足量铜:Cu+Ag+=Ag+Cu2+
B.向硫酸铝溶液中加入过量氢氧化钠溶液:Al3++4OH-=[Al(OH)4]-
C.向NH4HCO3溶液中加入足量Ba(OH)2溶液:HCO+Ba2++2OH-=BaCO3↓+H2O
D.向硫酸铜溶液中加入过量氨水:Cu2++2NH3·H2O =Cu(OH)2↓+2NH
3.下列关于C、Si及其化合物结构与性质的论述错误的是
A.键能 、 ,因此C2H6稳定性大于Si2H6
B.立方型SiC是与金刚石成键、结构均相似的共价晶体,因此具有很高的硬度
C.SiH4中Si的化合价为+4,CH4中C的化合价为-4,因此SiH4还原性小于CH4
D.Si原子间难形成双键而C原子间可以,是因为Si的原子半径大于C,难形成 键
4.石墨晶体为层状结构,每一层均为碳原子与周围其他3个碳原子相结合而成平面片层,同层相邻碳原子间距142pm、相邻片层间距为335 pm。如图是其晶体结构片层俯视图。每一层由无数个正六边形构成,则平均每一个正六边形所占有的碳原子为
A.6 B.4 C.3 D.2
5.0.01molCrCl3·6H2O在水溶液中用过量硝酸银溶液处理,生成0.02molAgCl沉淀。已知该CrCl3·6H2O中Cr3+形成六个配位键,则其结构是
A.[Cr(H2O)6]Cl3 B.[Cr(H2O)5Cl]Cl2·H2O
C.[Cr(H2O)4Cl]Cl2·2H2O D.[Cr(H2O)3Cl3]Cl2·3H2O
6.下列有关晶格能的叙述正确的是
A.晶格能是气态离子形成1 mol离子晶体吸收的能量
B.晶格能通常取正值,但是有时也取负值
C.晶格能越大,形成的离子晶体越稳定
D.晶格能越大,物质的硬度反而越小
7.下列说法正确的是
A.第三周期主族元素从左到右,最高价氧化物中离子键的百分数逐渐增大
B.大多数晶体都是过渡晶体
C.过渡晶体是指某些物质的晶体通过改变条件,转化为另一种晶体
D.是纯粹的离子晶体,是纯粹的共价晶体
8.下列说法不正确的是
A.中离子键的百分数为62%,则不是纯粹的离子晶体,是离子晶体与共价晶体之间的过渡晶体
B.通常当作离子晶体来处理,因为是偏向离子晶体的过渡晶体,在许多性质上与纯粹的离子晶体接近
C.是偏向离子晶体的过渡晶体,当作离子晶体来处理;是偏向共价晶体的过渡晶体,当作共价晶体来处理
D.分子晶体、共价晶体、金属晶体和离子晶体都有过渡型
9.下列关于晶体性质的比较中,错误的是
A.熔点:SiO2>CO2 B.硬度:金刚石>晶体硅
C.延展性:Fe>Au D.晶格能:MgO>Na2O
10.下列几种物质的结构示意图和化学式,正确的是
A B C D
Mg3B2 Li2O A3B9C4 Mn2Bi
A.A B.B C.C D.D
11.元素X的某价态离子Xn+中所有电子正好充满K、L、M三个电子层,它与N3-形成晶体的晶胞结构如图所示。下列说法错误的是( )
A.X元素的原子序数是19
B.该晶体中阳离子与阴离子个数比为3∶1
C.Xn+中n=1
D.晶体中每个Xn+周围有2个等距离且最近的N3-
12.甲、乙、丙三种离子晶体的晶胞如图所示,下列说法正确的是
A.甲的化学式(X为阳离子)为XY
B.乙中A、B、C三种微粒的个数比是1:3:1
C.丙是CsCl晶体的晶胞
D.乙中与A距离最近且相等的B有8个
13.乙二胺四乙酸又叫,是化学中一种良好的配合剂,形成的配合物又叫螯合物。在配合滴定中经常用到,一般是测定金属离子的含量。已知:配离子结构如图。下列叙述错误的是
A.中氮原子杂化方式
B.M元素可以是、或
C.M元素的配位数是6
D.的化学键有:键、配位键、键和离子键
二、填空题(共8道)
14.Pb(CH2CH3)4在晶体结构中的配位数是_______
15.回答下列问题
(1)常压下,乙醇沸点是,乙醛沸点是,沸点相差较大的主要原因是___________。
(2)第ⅢA族卤化物常压下的熔沸点如下表:
沸点 熔点 熔点
请写出的电子式:___________。
16.填空。
(1)比较熔点:硅晶体___________白磷晶体(填“>”、“<”或“=”),判断理由是___________。
(2)用一个离子方程式说明和结合能力的相对强弱___________。
17.(1)晶体是一种性能良好的非线性光学材料,具有钙钛矿型的空间结构,边长为,晶胞中、,分别处于顶角、体心、面心位置,如图所示.与间的最短距离为___________,与紧邻的的个数为_____________.在晶胞结构的另一种表示中,处于各顶角位置,则处于____________位置,处于____________位置.
(2)具有型结构(如图),其中阴离子采用最密堆积方式,X射线衍射实验测得的晶胞参数为,则为_____________.也属于型结构晶胞参数为,则为____________.
18.(1)已知:
物质 性质
质硬,熔点:3200℃,沸点:4820℃
具有挥发性,熔点:,沸点:136.4℃
的熔沸点明显高于的原因是_______。
(2)六方氮化硼晶体结构(如下图)与石墨相似,都是混合型晶体。但六方氮化硼晶体不导电,原因是_______。
19.Ni和La的合金是目前使用广泛的储氢材料,具有大容量、长寿命等特点,在中国已实现了产业化。该合金的晶胞结构如图所示。
(1)该晶胞中Ni原子与La原子的数量比为___________。
(2)已知该晶胞的摩尔质量为,密度为。设为阿伏加德罗常数的值,则该晶胞的体积是___________(用含、、的代数式表示)。
(3)该晶体内部具有空隙,且每个晶胞的空隙中储存6个氢原子时比较稳定。已知:,;标准状况下氢气的密度为;。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为___________。
20.某晶体的晶胞结构如图所示.请回答下列问题:
(1)晶体中每个Y粒子同时吸引着_______个X粒子,每个X粒子同时吸引着_______个Y粒子,该晶体的化学式为_______。
(2)晶体中每个X粒子周围与它最近且距离相等的X粒子共有_______个。
(3)设该晶体的摩尔质量为,晶体密度为,阿伏加德罗常数为,则晶体中两个最近的X粒子间的距离为_______。
21.为纪念1905年爱因斯坦连续发表6篇论文导致物理学大变革100周年,今年被定为国际物理年,本题涉及的“热电效应”机理也是爱因斯坦首先阐释的,即他提出的被后人称为“爱因斯坦振荡器”的独立振荡原子与温度关系的模型。
(1)如图是热电效应之一的图解。给出图中所有英文单词(或词组)及物理学符号的意义,并为此图写一篇不超过200字(包括标点符号等)的说明文_______。
(2)如图是化学家合成的能实现热电效应的一种晶体的晶胞模型。图中的大原子是稀土原子,如镧;小原子是周期系第五主族元素,如锑;中等大小的原子是周期系VIII族元素,如铁,按如下结构图写出这种热电晶体的化学式_______。给出计算过程_______。提示:晶胞的6个面的原子数相同。设晶体中锑的氧化态为-1,镧的氧化态为+3,问:铁的平均氧化态多大_______?
试卷第1页,共3页
参考答案:
1.B
【解析】
A.四种物质全部为共价晶体,由于键长,故键能,所以晶体硅的熔、沸点应比碳化硅的小,A错误;
B.四种物质为结构相似的分子晶体,相对分子质量越大,熔、沸点越高,B正确;
C.为离子晶体,固态、固态均为分子晶体,且常温常压下呈液态,呈气态,故熔、沸点:,C错误;
D.合金的熔、沸点比纯金属的低,熔、沸点高低顺序为金刚石>纯铁>生铁>钠,D错误。
故选:B。
2.B
【解析】
A.选项所给离子方程式电荷不守恒,正确离子方程式为Cu+2Ag+=2Ag+Cu2+,A错误;
B.向硫酸铝溶液中加入过量氢氧化钠溶液,生成的氢氧化铝沉淀可与NaOH反应得到四羟基和铝酸钠,离子方程式为Al3++4OH-=[Al(OH)4]-,B正确;
C.向NH4HCO3溶液中加入足量Ba(OH)2溶液,铵根也可以反应,离子方程式为NH+HCO+ Ba2++2OH-=BaCO3↓+NH3·H2O+H2O,C错误;
D.向硫酸铜溶液中加入过量氨水得到铜氨络离子,离子方程式为Cu2++4NH3·H2O=[Cu(NH3)4]2++4H2O,D错误;
综上所述答案为B。
3.C
【解析】
A.因键能C—C>Si—Si、C—H>Si—H,故C2H6的键能总和大于Si2H6,键能越大越稳定,故C2H6的稳定性大于Si2H6,A正确;
B.SiC的成键和结构与金刚石类似均为原子晶体,金刚石的硬度很大,类比可推测SiC的硬度和很大,B正确;
C.SiH4中Si的化合价为+4价,C的非金属性强于Si,则C的氧化性强于Si,则Si的阴离子的还原性强于C的阴离子,则SiH4的还原性较强,C错误;
D.Si原子的半径大于C原子,在形成化学键时纺锤形的p轨道很难相互重叠形成π键,故Si原子间难形成双键,D正确;
故选C。
4.D
【解析】
如图,每个碳原子与周围三个碳原子相连,每个六边形中的一个碳原子占,六边形占有的碳原子为,故选D。
5.B
【解析】
A.若其结构为[Cr(H2O)6]Cl3,则与硝酸银反应后 生成0.03molAgCl沉淀,故A错误;
B.根据题意知,氯化铬(CrCl3 6H2O)和氯化银的物质的量之比是1:2,根据氯离子守恒知,一个氯化铬(CrCl3 6H2O)化学式中含有2个氯离子,剩余的1个氯离子是配原子,所以氯化铬(CrCl3 6H2O)的化学式可能为[Cr(H2O)5Cl]Cl2 H2O,故B正确;
C.根据题意知,CrCl3·6H2O中Cr3+形成六个配位键,而该结构中只存在五个配位键,故C错误;
D.若其结构为[Cr(H2O)3Cl3]Cl2·3H2O,则该物质应为CrCl5·6H2O,而不是CrCl3·6H2O,故D错误;
答案选B。
6.C
【解析】
A.晶格能是气态离子形成1 mol离子晶体释放的能量,A叙述错误;
B.晶格能通常取正值,而不取负值,B叙述错误;
C.晶格能越大,离子键越强,形成的离子晶体越稳定,C叙述正确;
D.晶格能越大,离子键越强,物质的硬度越大,D叙述错误;
答案为C。
7.B
【解析】
A.第三周期主族元素从左到右,元素的电负性逐渐增大,与氧元素的电负性差值逐渐减小,则最高价氧化物中离子键的百分数逐渐减小,A错误;
B.纯粹的典型晶体不多,大多数晶体是四类典型晶体之间的过渡晶体,B正确;
C.过渡晶体是介于离子晶体、共价晶体、分子晶体和金属晶体之间的过渡状态,C错误;
D.、都不是纯粹的典型晶体,而是离子晶体和共价晶体之间的过渡晶体,D错误;
故选B。
8.C
【解析】
A.中离子键的百分数为62%,说明还存在共价键,则不是纯粹的离子晶体,是离子晶体与共价晶体之间的过渡晶体,故A正确;
B.离子键与共价键的区别在于形成化学键的两元素电负性差值,差值大为离子键,差值小为共价键,通常当作离子晶体来处理,因为是偏向离子晶体的过渡晶体,在许多性质上与纯粹的离子晶体接近,故B正确;
C.、均是偏向共价晶体的过渡晶体,当作共价晶体来处理,故C错误;
D.根据微粒间存在的作用力分析,分子晶体、共价晶体、金属晶体和离子晶体都有过渡型,故D正确;
故选C。
9.C
【解析】
A.SiO2是原子晶体,原子间存以较强的共价键相互作用,而CO2是分子晶体,分子间只有较小的范德华力,所以熔点SiO2>CO2 ,故A正确;
B.金刚石和晶体硅都是原子晶体,原子晶体中化学键键能越大、键长越短,其硬度越大,键长C-CC.Au质软,延展性在金属中最好,则延展性:FeD.晶格能与离子半径成反比,与电荷成正比,离子半径:Mg2+答案选C。
10.B
【解析】
A.该晶胞中Mg原子个数,B原子个数=6,Mg、B原子个数之比=3:6=1:2,所以其化学式为MgB2,故A错误;
B.该晶胞中Li+个数=8、O2-个数,则Li+、O2-个数之比=8:4=2:1,所以其化学式为Li2O,故B正确;
C.该晶胞中B粒子个数、A粒子个数、C粒子个数=1,则A、B、C粒子个数之比:2:1=1:4:2,故C错误;
D.Mn原子个数、Bi原子个数为6,所以Mn、Bi原子个数之比为6:6=1:1,所以其化学式为MnBi,故D错误;
故选B。
11.A
【解析】
该晶胞中Xn+个数=12×=3、N3-个数=8×=1,所以N3-、Xn+个数之比为1∶3,根据化合价的代数和为0知n=+1,元素X的某价态离子Xn+中所有电子正好充满K、L、M三个电子层,则X原子核外电子数=2+8+18+1=29,为Cu元素,该化合物为Cu3N,据此分析解答。
A.根据上述分析,X为Cu元素,核电荷数为29,故A错误;
B.该晶胞中Xn+个数=12×=3、N3-个数=8×=1,所以该晶体中阳离子与阴离子个数比为3∶1,故B正确;
C.N3-、Xn+个数之比为1∶3,根据化合物中化合价的代数和为0判断n=1,故C正确;
D.以一个棱上的Xn+为中心,该离子被4个晶胞共用,与晶体中每个Xn+周围等距离且最近的N3-只有其相邻顶点上的离子,有2个,故D正确;
故选A。
【点睛】
正确判断Xn+为哪种离子是解本题关键。本题的易错点为D中配位数的计算,要注意每个Xn+周围等距离且最近的N3-有2个,每个N3-周围等距离且最近的Xn+有6个。
12.B
【解析】
A.据图可知,Y位于立方体的4个顶点,根据均摊法,Y的个数为4×=,X位于体心,X的个数为1,X和Y的个数比为2:1,所以甲的化学式为X2Y,故A错误;
B.据图可知,A位于8个顶点,根据均摊法,A的个数为8×=1,B位于6个面心,B的个数为6×=3,C位于体心,个数为1,则A、B、C的个数比为1:3:1,故B正确;
C.在CsCl晶胞里,Cl-作简单立方堆积,Cs+填在立方体空隙中,正负离子配位数均为8,所以丙不是CsCl的晶胞,丙是NaCl的晶胞,故C错误;
D.乙中A位于立方体的顶点,B位于面心,在以A为中心的3个平面的4个顶点的B都和A距离相等且距离最近,所以这样的B有12个,故D错误;
故选B。
13.B
【解析】
A.根据该配离子结构,氮原子成四个单键(有1个配位键),属于杂化方式,故A正确;
B.依图可知,M的配位数为6,而的配位数为4,故B项错误;
C.根据该配离子结构,M元素的配位数是6,故C正确;
D.是离子化合物,含有离子键;阴离子是复杂离子,含有共价单键、共价双键,单键为键、双键含σ键、键,铁离子含有空轨道,与之结合的氮原子、氧原子含有孤电子对,与铁离子形成配位键,故D正确;
故选B。
14.12
【解析】
Pb(CH2CH3)4晶体为六方最密堆积,则其结构中的配位数为12。
15.(1)乙醇分子间有氢键,乙醛分子间是范德华力,氢键强于范德华力
(2)
【解析】
(1)
相对分子质量接近的共价分子构成的分子晶体熔沸点规律:分子间有氢键的>没有氢键的。乙醇沸点是,乙醛沸点是,二者相对分子质量接近、但乙醇沸点远大于乙醛的主要原因是:乙醇分子间有氢键,乙醛分子间是范德华力,氢键强于范德华力。
(2)
由表知,和的熔沸点远低于,则和的晶体为分子晶体、的晶体为离子晶体, 的电子式:。
16.(1) > 晶体硅为原子晶体,熔化时破坏共价键;白磷为分子晶体,熔化时破坏分子间作用力
(2)
【解析】
(1)
由于晶体硅为原子晶体,熔化时破坏共价键;白磷为分子晶体,熔化时破坏分子间作用力,因此硅晶体的熔点高于白磷晶体,故答案为:>,晶体硅为原子晶体,熔化时破坏共价键;白磷为分子晶体,熔化时破坏分子间作用力。
(2)
根据反应可知,比结合能力更强,故答案为:。
17. 0.315 12 体心 棱心 0.148 0.076
【解析】
(1)由晶胞结构可知,晶胞中与间的最短距离为晶胞面对角线的一半,即;晶胞中在同一平面内,与紧邻的的个数为4,故晶胞中与紧邻的的个数为.根据的化学式以及晶胞结构可知,若I处于各顶角位置,则该晶胞中处于体心, 处于棱心。故答案为:0.315;12;体心;棱心;
(2)具有型结构,由晶胞结构图可知,氧离子沿晶胞的面对角线方向接触,所以半径为面对角线的,即;也属于型结构,MnO的晶胞参数比MgO更大,说明阴离子之间不再接触,阴、阳离子沿坐标轴方向接触,故,r(Mn2+)=0.076nm。故答案为:0.148;0.076。
18. 是原子晶体,是分子晶体,共价键比分子间作用力强 氮化硼晶体的层状结构中没有自动移动的电子
【解析】
(1)的熔沸点明显高于的原因是:是原子晶体,是分子晶体,共价键比分子间作用力强;
(2)六方氮化硼晶体结构与石墨相似,都是混合型晶体。但六方氮化硼晶体不导电,原因是:氮化硼晶体的层状结构中没有自动移动的电子。
19. 5:1 1236
【解析】
(1)从题图中可以看出,La位于平行六面体的顶角,晶胞中La的原子数为;平行六面体的上、下两个面各有2个Ni原子,四个侧面各有1个Ni原子,体心还有1个Ni原子,故晶胞中Ni的原子数为;故该晶胞中Ni原于与La原子的数量比为5:1。
(2)由(1)知,该晶胞化学式为LaNi5,每个晶胞含1个LaNi5,则n(LaNi5)=,故该晶胞的质量m= mol,所以晶胞的体积为。
(3)该晶胞体积V=,一个晶胞能吸收6个氢原子,相当于3个H2,故所吸收H2的质量m=
则该合金储氢后氢气的密度,
故储氢能力。
20. 4 8 (或) 12
【解析】
(1)由题图可得,晶体中每个Y粒子同时吸引着4个X粒子;在题图所示晶胞中,以面心处的X粒子为研究对象,每个X粒子同时吸引着4个Y粒子,而每个X粒子被2个晶胞所共用,则在晶体中每个X粒子同时吸引着个Y粒子;一个晶胞中含有X粒子的数目为,含有Y粒子的数目为8,X、Y粒子数目之比为1:2,故该晶体的化学式为或;
(2)由晶胞结构可知,以顶点的X粒子为研究对象,一个晶胞内与之距离最近且相等的X粒子位于面心处,有3个,而每个顶点X粒子被8个晶胞所共用,每个面心X粒子被2个晶胞所共用,则晶体中与X粒子距离最近且相等的X粒子的数目为;
(3)设该晶胞的边长为,则可得,解得,晶胞的边长为晶体中两个最近的X粒子间距离的倍,则晶体中两个最近的X粒子间的距离为。
21. input—输入 hot—热(端) cold—冷 (端) heat flow—热流 I—电流强度 n—n型半导体 p—p型半导体 i+—正电流。向热电材料构成的半导体的n-p结的远端输入外电流,半导体发生空穴导电,电流流经n-p结时发生复合,外电流输入的能量转化为热流,使n-p结的温度越来越低,而其远端的温度越来越高,即有类似冰箱制冷的效应 LaFe4Sb12 晶胞里有2个La原子(处于晶胞的顶角和体心);有8个Fe原子(处于锑形成的八面体的中心);锑八面体是共顶角相连的,平均每个八面体有6/2=3个锑原子,晶胞中共有8个八面体,8×3=24个锑原子;即:La2Fe8Sb24 9/4=2.25
【解析】
略
答案第1页,共2页
一、单选题(共13道)
1.下列物质的熔、沸点高低顺序正确的是
A.金刚石>晶体硅>二氧化硅>碳化硅 B.
C. D.金刚石>生铁>钠>纯铁
2.下列反应的离子方程式正确的是
A.向硝酸银溶液中加入足量铜:Cu+Ag+=Ag+Cu2+
B.向硫酸铝溶液中加入过量氢氧化钠溶液:Al3++4OH-=[Al(OH)4]-
C.向NH4HCO3溶液中加入足量Ba(OH)2溶液:HCO+Ba2++2OH-=BaCO3↓+H2O
D.向硫酸铜溶液中加入过量氨水:Cu2++2NH3·H2O =Cu(OH)2↓+2NH
3.下列关于C、Si及其化合物结构与性质的论述错误的是
A.键能 、 ,因此C2H6稳定性大于Si2H6
B.立方型SiC是与金刚石成键、结构均相似的共价晶体,因此具有很高的硬度
C.SiH4中Si的化合价为+4,CH4中C的化合价为-4,因此SiH4还原性小于CH4
D.Si原子间难形成双键而C原子间可以,是因为Si的原子半径大于C,难形成 键
4.石墨晶体为层状结构,每一层均为碳原子与周围其他3个碳原子相结合而成平面片层,同层相邻碳原子间距142pm、相邻片层间距为335 pm。如图是其晶体结构片层俯视图。每一层由无数个正六边形构成,则平均每一个正六边形所占有的碳原子为
A.6 B.4 C.3 D.2
5.0.01molCrCl3·6H2O在水溶液中用过量硝酸银溶液处理,生成0.02molAgCl沉淀。已知该CrCl3·6H2O中Cr3+形成六个配位键,则其结构是
A.[Cr(H2O)6]Cl3 B.[Cr(H2O)5Cl]Cl2·H2O
C.[Cr(H2O)4Cl]Cl2·2H2O D.[Cr(H2O)3Cl3]Cl2·3H2O
6.下列有关晶格能的叙述正确的是
A.晶格能是气态离子形成1 mol离子晶体吸收的能量
B.晶格能通常取正值,但是有时也取负值
C.晶格能越大,形成的离子晶体越稳定
D.晶格能越大,物质的硬度反而越小
7.下列说法正确的是
A.第三周期主族元素从左到右,最高价氧化物中离子键的百分数逐渐增大
B.大多数晶体都是过渡晶体
C.过渡晶体是指某些物质的晶体通过改变条件,转化为另一种晶体
D.是纯粹的离子晶体,是纯粹的共价晶体
8.下列说法不正确的是
A.中离子键的百分数为62%,则不是纯粹的离子晶体,是离子晶体与共价晶体之间的过渡晶体
B.通常当作离子晶体来处理,因为是偏向离子晶体的过渡晶体,在许多性质上与纯粹的离子晶体接近
C.是偏向离子晶体的过渡晶体,当作离子晶体来处理;是偏向共价晶体的过渡晶体,当作共价晶体来处理
D.分子晶体、共价晶体、金属晶体和离子晶体都有过渡型
9.下列关于晶体性质的比较中,错误的是
A.熔点:SiO2>CO2 B.硬度:金刚石>晶体硅
C.延展性:Fe>Au D.晶格能:MgO>Na2O
10.下列几种物质的结构示意图和化学式,正确的是
A B C D
Mg3B2 Li2O A3B9C4 Mn2Bi
A.A B.B C.C D.D
11.元素X的某价态离子Xn+中所有电子正好充满K、L、M三个电子层,它与N3-形成晶体的晶胞结构如图所示。下列说法错误的是( )
A.X元素的原子序数是19
B.该晶体中阳离子与阴离子个数比为3∶1
C.Xn+中n=1
D.晶体中每个Xn+周围有2个等距离且最近的N3-
12.甲、乙、丙三种离子晶体的晶胞如图所示,下列说法正确的是
A.甲的化学式(X为阳离子)为XY
B.乙中A、B、C三种微粒的个数比是1:3:1
C.丙是CsCl晶体的晶胞
D.乙中与A距离最近且相等的B有8个
13.乙二胺四乙酸又叫,是化学中一种良好的配合剂,形成的配合物又叫螯合物。在配合滴定中经常用到,一般是测定金属离子的含量。已知:配离子结构如图。下列叙述错误的是
A.中氮原子杂化方式
B.M元素可以是、或
C.M元素的配位数是6
D.的化学键有:键、配位键、键和离子键
二、填空题(共8道)
14.Pb(CH2CH3)4在晶体结构中的配位数是_______
15.回答下列问题
(1)常压下,乙醇沸点是,乙醛沸点是,沸点相差较大的主要原因是___________。
(2)第ⅢA族卤化物常压下的熔沸点如下表:
沸点 熔点 熔点
请写出的电子式:___________。
16.填空。
(1)比较熔点:硅晶体___________白磷晶体(填“>”、“<”或“=”),判断理由是___________。
(2)用一个离子方程式说明和结合能力的相对强弱___________。
17.(1)晶体是一种性能良好的非线性光学材料,具有钙钛矿型的空间结构,边长为,晶胞中、,分别处于顶角、体心、面心位置,如图所示.与间的最短距离为___________,与紧邻的的个数为_____________.在晶胞结构的另一种表示中,处于各顶角位置,则处于____________位置,处于____________位置.
(2)具有型结构(如图),其中阴离子采用最密堆积方式,X射线衍射实验测得的晶胞参数为,则为_____________.也属于型结构晶胞参数为,则为____________.
18.(1)已知:
物质 性质
质硬,熔点:3200℃,沸点:4820℃
具有挥发性,熔点:,沸点:136.4℃
的熔沸点明显高于的原因是_______。
(2)六方氮化硼晶体结构(如下图)与石墨相似,都是混合型晶体。但六方氮化硼晶体不导电,原因是_______。
19.Ni和La的合金是目前使用广泛的储氢材料,具有大容量、长寿命等特点,在中国已实现了产业化。该合金的晶胞结构如图所示。
(1)该晶胞中Ni原子与La原子的数量比为___________。
(2)已知该晶胞的摩尔质量为,密度为。设为阿伏加德罗常数的值,则该晶胞的体积是___________(用含、、的代数式表示)。
(3)该晶体内部具有空隙,且每个晶胞的空隙中储存6个氢原子时比较稳定。已知:,;标准状况下氢气的密度为;。若忽略吸氢前后晶胞的体积变化,则该储氢材料的储氢能力为___________。
20.某晶体的晶胞结构如图所示.请回答下列问题:
(1)晶体中每个Y粒子同时吸引着_______个X粒子,每个X粒子同时吸引着_______个Y粒子,该晶体的化学式为_______。
(2)晶体中每个X粒子周围与它最近且距离相等的X粒子共有_______个。
(3)设该晶体的摩尔质量为,晶体密度为,阿伏加德罗常数为,则晶体中两个最近的X粒子间的距离为_______。
21.为纪念1905年爱因斯坦连续发表6篇论文导致物理学大变革100周年,今年被定为国际物理年,本题涉及的“热电效应”机理也是爱因斯坦首先阐释的,即他提出的被后人称为“爱因斯坦振荡器”的独立振荡原子与温度关系的模型。
(1)如图是热电效应之一的图解。给出图中所有英文单词(或词组)及物理学符号的意义,并为此图写一篇不超过200字(包括标点符号等)的说明文_______。
(2)如图是化学家合成的能实现热电效应的一种晶体的晶胞模型。图中的大原子是稀土原子,如镧;小原子是周期系第五主族元素,如锑;中等大小的原子是周期系VIII族元素,如铁,按如下结构图写出这种热电晶体的化学式_______。给出计算过程_______。提示:晶胞的6个面的原子数相同。设晶体中锑的氧化态为-1,镧的氧化态为+3,问:铁的平均氧化态多大_______?
试卷第1页,共3页
参考答案:
1.B
【解析】
A.四种物质全部为共价晶体,由于键长,故键能,所以晶体硅的熔、沸点应比碳化硅的小,A错误;
B.四种物质为结构相似的分子晶体,相对分子质量越大,熔、沸点越高,B正确;
C.为离子晶体,固态、固态均为分子晶体,且常温常压下呈液态,呈气态,故熔、沸点:,C错误;
D.合金的熔、沸点比纯金属的低,熔、沸点高低顺序为金刚石>纯铁>生铁>钠,D错误。
故选:B。
2.B
【解析】
A.选项所给离子方程式电荷不守恒,正确离子方程式为Cu+2Ag+=2Ag+Cu2+,A错误;
B.向硫酸铝溶液中加入过量氢氧化钠溶液,生成的氢氧化铝沉淀可与NaOH反应得到四羟基和铝酸钠,离子方程式为Al3++4OH-=[Al(OH)4]-,B正确;
C.向NH4HCO3溶液中加入足量Ba(OH)2溶液,铵根也可以反应,离子方程式为NH+HCO+ Ba2++2OH-=BaCO3↓+NH3·H2O+H2O,C错误;
D.向硫酸铜溶液中加入过量氨水得到铜氨络离子,离子方程式为Cu2++4NH3·H2O=[Cu(NH3)4]2++4H2O,D错误;
综上所述答案为B。
3.C
【解析】
A.因键能C—C>Si—Si、C—H>Si—H,故C2H6的键能总和大于Si2H6,键能越大越稳定,故C2H6的稳定性大于Si2H6,A正确;
B.SiC的成键和结构与金刚石类似均为原子晶体,金刚石的硬度很大,类比可推测SiC的硬度和很大,B正确;
C.SiH4中Si的化合价为+4价,C的非金属性强于Si,则C的氧化性强于Si,则Si的阴离子的还原性强于C的阴离子,则SiH4的还原性较强,C错误;
D.Si原子的半径大于C原子,在形成化学键时纺锤形的p轨道很难相互重叠形成π键,故Si原子间难形成双键,D正确;
故选C。
4.D
【解析】
如图,每个碳原子与周围三个碳原子相连,每个六边形中的一个碳原子占,六边形占有的碳原子为,故选D。
5.B
【解析】
A.若其结构为[Cr(H2O)6]Cl3,则与硝酸银反应后 生成0.03molAgCl沉淀,故A错误;
B.根据题意知,氯化铬(CrCl3 6H2O)和氯化银的物质的量之比是1:2,根据氯离子守恒知,一个氯化铬(CrCl3 6H2O)化学式中含有2个氯离子,剩余的1个氯离子是配原子,所以氯化铬(CrCl3 6H2O)的化学式可能为[Cr(H2O)5Cl]Cl2 H2O,故B正确;
C.根据题意知,CrCl3·6H2O中Cr3+形成六个配位键,而该结构中只存在五个配位键,故C错误;
D.若其结构为[Cr(H2O)3Cl3]Cl2·3H2O,则该物质应为CrCl5·6H2O,而不是CrCl3·6H2O,故D错误;
答案选B。
6.C
【解析】
A.晶格能是气态离子形成1 mol离子晶体释放的能量,A叙述错误;
B.晶格能通常取正值,而不取负值,B叙述错误;
C.晶格能越大,离子键越强,形成的离子晶体越稳定,C叙述正确;
D.晶格能越大,离子键越强,物质的硬度越大,D叙述错误;
答案为C。
7.B
【解析】
A.第三周期主族元素从左到右,元素的电负性逐渐增大,与氧元素的电负性差值逐渐减小,则最高价氧化物中离子键的百分数逐渐减小,A错误;
B.纯粹的典型晶体不多,大多数晶体是四类典型晶体之间的过渡晶体,B正确;
C.过渡晶体是介于离子晶体、共价晶体、分子晶体和金属晶体之间的过渡状态,C错误;
D.、都不是纯粹的典型晶体,而是离子晶体和共价晶体之间的过渡晶体,D错误;
故选B。
8.C
【解析】
A.中离子键的百分数为62%,说明还存在共价键,则不是纯粹的离子晶体,是离子晶体与共价晶体之间的过渡晶体,故A正确;
B.离子键与共价键的区别在于形成化学键的两元素电负性差值,差值大为离子键,差值小为共价键,通常当作离子晶体来处理,因为是偏向离子晶体的过渡晶体,在许多性质上与纯粹的离子晶体接近,故B正确;
C.、均是偏向共价晶体的过渡晶体,当作共价晶体来处理,故C错误;
D.根据微粒间存在的作用力分析,分子晶体、共价晶体、金属晶体和离子晶体都有过渡型,故D正确;
故选C。
9.C
【解析】
A.SiO2是原子晶体,原子间存以较强的共价键相互作用,而CO2是分子晶体,分子间只有较小的范德华力,所以熔点SiO2>CO2 ,故A正确;
B.金刚石和晶体硅都是原子晶体,原子晶体中化学键键能越大、键长越短,其硬度越大,键长C-C
10.B
【解析】
A.该晶胞中Mg原子个数,B原子个数=6,Mg、B原子个数之比=3:6=1:2,所以其化学式为MgB2,故A错误;
B.该晶胞中Li+个数=8、O2-个数,则Li+、O2-个数之比=8:4=2:1,所以其化学式为Li2O,故B正确;
C.该晶胞中B粒子个数、A粒子个数、C粒子个数=1,则A、B、C粒子个数之比:2:1=1:4:2,故C错误;
D.Mn原子个数、Bi原子个数为6,所以Mn、Bi原子个数之比为6:6=1:1,所以其化学式为MnBi,故D错误;
故选B。
11.A
【解析】
该晶胞中Xn+个数=12×=3、N3-个数=8×=1,所以N3-、Xn+个数之比为1∶3,根据化合价的代数和为0知n=+1,元素X的某价态离子Xn+中所有电子正好充满K、L、M三个电子层,则X原子核外电子数=2+8+18+1=29,为Cu元素,该化合物为Cu3N,据此分析解答。
A.根据上述分析,X为Cu元素,核电荷数为29,故A错误;
B.该晶胞中Xn+个数=12×=3、N3-个数=8×=1,所以该晶体中阳离子与阴离子个数比为3∶1,故B正确;
C.N3-、Xn+个数之比为1∶3,根据化合物中化合价的代数和为0判断n=1,故C正确;
D.以一个棱上的Xn+为中心,该离子被4个晶胞共用,与晶体中每个Xn+周围等距离且最近的N3-只有其相邻顶点上的离子,有2个,故D正确;
故选A。
【点睛】
正确判断Xn+为哪种离子是解本题关键。本题的易错点为D中配位数的计算,要注意每个Xn+周围等距离且最近的N3-有2个,每个N3-周围等距离且最近的Xn+有6个。
12.B
【解析】
A.据图可知,Y位于立方体的4个顶点,根据均摊法,Y的个数为4×=,X位于体心,X的个数为1,X和Y的个数比为2:1,所以甲的化学式为X2Y,故A错误;
B.据图可知,A位于8个顶点,根据均摊法,A的个数为8×=1,B位于6个面心,B的个数为6×=3,C位于体心,个数为1,则A、B、C的个数比为1:3:1,故B正确;
C.在CsCl晶胞里,Cl-作简单立方堆积,Cs+填在立方体空隙中,正负离子配位数均为8,所以丙不是CsCl的晶胞,丙是NaCl的晶胞,故C错误;
D.乙中A位于立方体的顶点,B位于面心,在以A为中心的3个平面的4个顶点的B都和A距离相等且距离最近,所以这样的B有12个,故D错误;
故选B。
13.B
【解析】
A.根据该配离子结构,氮原子成四个单键(有1个配位键),属于杂化方式,故A正确;
B.依图可知,M的配位数为6,而的配位数为4,故B项错误;
C.根据该配离子结构,M元素的配位数是6,故C正确;
D.是离子化合物,含有离子键;阴离子是复杂离子,含有共价单键、共价双键,单键为键、双键含σ键、键,铁离子含有空轨道,与之结合的氮原子、氧原子含有孤电子对,与铁离子形成配位键,故D正确;
故选B。
14.12
【解析】
Pb(CH2CH3)4晶体为六方最密堆积,则其结构中的配位数为12。
15.(1)乙醇分子间有氢键,乙醛分子间是范德华力,氢键强于范德华力
(2)
【解析】
(1)
相对分子质量接近的共价分子构成的分子晶体熔沸点规律:分子间有氢键的>没有氢键的。乙醇沸点是,乙醛沸点是,二者相对分子质量接近、但乙醇沸点远大于乙醛的主要原因是:乙醇分子间有氢键,乙醛分子间是范德华力,氢键强于范德华力。
(2)
由表知,和的熔沸点远低于,则和的晶体为分子晶体、的晶体为离子晶体, 的电子式:。
16.(1) > 晶体硅为原子晶体,熔化时破坏共价键;白磷为分子晶体,熔化时破坏分子间作用力
(2)
【解析】
(1)
由于晶体硅为原子晶体,熔化时破坏共价键;白磷为分子晶体,熔化时破坏分子间作用力,因此硅晶体的熔点高于白磷晶体,故答案为:>,晶体硅为原子晶体,熔化时破坏共价键;白磷为分子晶体,熔化时破坏分子间作用力。
(2)
根据反应可知,比结合能力更强,故答案为:。
17. 0.315 12 体心 棱心 0.148 0.076
【解析】
(1)由晶胞结构可知,晶胞中与间的最短距离为晶胞面对角线的一半,即;晶胞中在同一平面内,与紧邻的的个数为4,故晶胞中与紧邻的的个数为.根据的化学式以及晶胞结构可知,若I处于各顶角位置,则该晶胞中处于体心, 处于棱心。故答案为:0.315;12;体心;棱心;
(2)具有型结构,由晶胞结构图可知,氧离子沿晶胞的面对角线方向接触,所以半径为面对角线的,即;也属于型结构,MnO的晶胞参数比MgO更大,说明阴离子之间不再接触,阴、阳离子沿坐标轴方向接触,故,r(Mn2+)=0.076nm。故答案为:0.148;0.076。
18. 是原子晶体,是分子晶体,共价键比分子间作用力强 氮化硼晶体的层状结构中没有自动移动的电子
【解析】
(1)的熔沸点明显高于的原因是:是原子晶体,是分子晶体,共价键比分子间作用力强;
(2)六方氮化硼晶体结构与石墨相似,都是混合型晶体。但六方氮化硼晶体不导电,原因是:氮化硼晶体的层状结构中没有自动移动的电子。
19. 5:1 1236
【解析】
(1)从题图中可以看出,La位于平行六面体的顶角,晶胞中La的原子数为;平行六面体的上、下两个面各有2个Ni原子,四个侧面各有1个Ni原子,体心还有1个Ni原子,故晶胞中Ni的原子数为;故该晶胞中Ni原于与La原子的数量比为5:1。
(2)由(1)知,该晶胞化学式为LaNi5,每个晶胞含1个LaNi5,则n(LaNi5)=,故该晶胞的质量m= mol,所以晶胞的体积为。
(3)该晶胞体积V=,一个晶胞能吸收6个氢原子,相当于3个H2,故所吸收H2的质量m=
则该合金储氢后氢气的密度,
故储氢能力。
20. 4 8 (或) 12
【解析】
(1)由题图可得,晶体中每个Y粒子同时吸引着4个X粒子;在题图所示晶胞中,以面心处的X粒子为研究对象,每个X粒子同时吸引着4个Y粒子,而每个X粒子被2个晶胞所共用,则在晶体中每个X粒子同时吸引着个Y粒子;一个晶胞中含有X粒子的数目为,含有Y粒子的数目为8,X、Y粒子数目之比为1:2,故该晶体的化学式为或;
(2)由晶胞结构可知,以顶点的X粒子为研究对象,一个晶胞内与之距离最近且相等的X粒子位于面心处,有3个,而每个顶点X粒子被8个晶胞所共用,每个面心X粒子被2个晶胞所共用,则晶体中与X粒子距离最近且相等的X粒子的数目为;
(3)设该晶胞的边长为,则可得,解得,晶胞的边长为晶体中两个最近的X粒子间距离的倍,则晶体中两个最近的X粒子间的距离为。
21. input—输入 hot—热(端) cold—冷 (端) heat flow—热流 I—电流强度 n—n型半导体 p—p型半导体 i+—正电流。向热电材料构成的半导体的n-p结的远端输入外电流,半导体发生空穴导电,电流流经n-p结时发生复合,外电流输入的能量转化为热流,使n-p结的温度越来越低,而其远端的温度越来越高,即有类似冰箱制冷的效应 LaFe4Sb12 晶胞里有2个La原子(处于晶胞的顶角和体心);有8个Fe原子(处于锑形成的八面体的中心);锑八面体是共顶角相连的,平均每个八面体有6/2=3个锑原子,晶胞中共有8个八面体,8×3=24个锑原子;即:La2Fe8Sb24 9/4=2.25
【解析】
略
答案第1页,共2页
