1.1物质的分类及转化 课件 2022-2023学年高一上学期化学人教版(2019)必修第一册(33张ppt)
文档属性
| 名称 | 1.1物质的分类及转化 课件 2022-2023学年高一上学期化学人教版(2019)必修第一册(33张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 3.9MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-07-06 14:44:59 | ||
图片预览









文档简介
(共33张PPT)
物质的分类及转化
内容总览
1、根据物质的组成和性质分类(P6-7)
2、分散系及其分类(P8-9)
3、酸碱盐的性质(P9-10)
4、物质的转化(P10-11)
请你回忆初中学过的单质、化合物、氧化物的概念,并举例
单质:同种元素组成的纯净物
化合物:由两种或两种以上元素组成的纯净物
氧化物:由两种元素组成的化合物,其中有一种元素是氧
1、根据物质的组成和性质分类--初高衔接
1、根据物质的组成和性质分类--知识体系
分类标准
分类方法
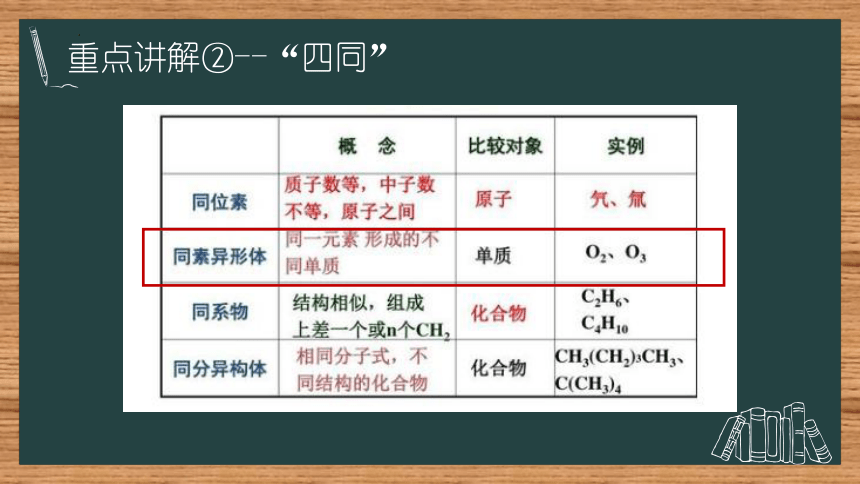
同位素
同素异形体
同分异构体
同系物
物质组成
物质性质
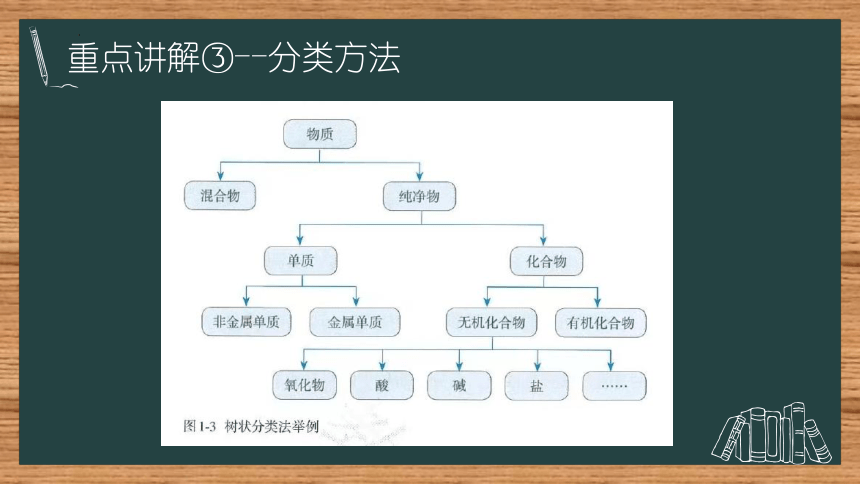
树状分类法
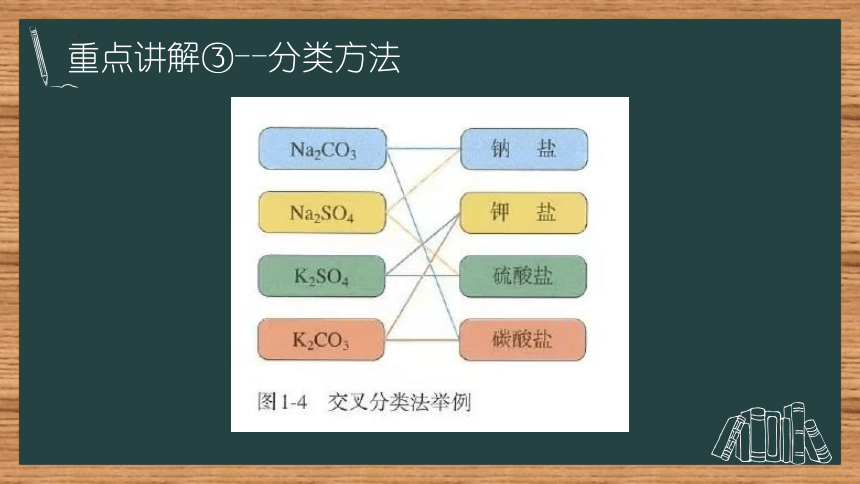
交叉分类法
单质
化合物
酸性氧化物
碱性氧化物
重点讲解①--酸性氧化物、碱性氧化物
酸性氧化物:能与碱反应生成盐和水的氧化物
碱性氧化物:能与酸反应生成盐和水的氧化物
CO2+Ca(OH)2====CaCO3 +H2O
CaO+2HCl====CaCl2+H2O
重点讲解②--“四同”
重点讲解③--分类方法
重点讲解③--分类方法
巩固练习1
经分析,某物质只含有一种元素,则此物质( )
A、一定是一种单质
B、一定是纯净物
C、一定是混合物
D、可能是纯净物,也可能是混合物
巩固练习1
解析:只含有一种元素,则一定是单质。
综上,可能是纯净物,也可能是混合物。
但可能是一种单质,如H2,为纯净物;
也可能是同素异形体的混合物,如金刚石和石墨的混合物,或O2和O3的混合物。
巩固练习1
经分析,某物质只含有一种元素,则此物质( )
A、一定是一种单质
B、一定是纯净物
C、一定是混合物
D、可能是纯净物,也可能是混合物
D
巩固练习2
⑨⑩;⑤;③;④;⑥⑦;单质;O3
请你回忆初中学过的悬浊液和乳浊液的概念,并举例
悬浊液:以细小固体颗粒形式分散于水中形成的混合物,如粉笔灰分散到水中
乳浊液:以小液滴形式分散于水中形成的混合物,如油滴分散到水中
悬浊液、乳浊液不均一不稳定
溶液均一稳定
2、分散系及其分类--初高衔接
2、分散系及其分类--知识体系
分散系
(混合物)
分散质
分散剂
溶液(<1nm)
悬浊液、乳浊液(>100nm)
胶体(1-100nm)
丁达尔效应
气溶胶:云、雾
液溶胶:Fe(OH)3胶体
固溶胶:有色玻璃
重点讲解①--分散系
分散系:把一种(或多种)物质以粒子形式分散到另一种(或多种)物质中所形成的混合物
分散质:分散系中被分散成粒子的物质
分散剂:分散系中分散质以外的物质
1、根据分散质粒子直径对分散系分类
溶液(<1nm)
悬浊液、乳浊液(>100nm)
胶体(1-100nm)
2、根据分散剂种类对胶体分类
气溶胶:云、雾
液溶胶:Fe(OH)3胶体 FeCl3+3H2O===Fe(OH)3(胶体)+3HCl
固溶胶:有色玻璃
重点讲解②--分散系的分类
溶液
胶体
悬浊液、乳浊液
1nm
100nm
丁达尔效应:由于胶体粒子对光线散射(光波偏离原来方向而分散传播)形成的
验证方法:当光束通过胶体时,可以看到一条光亮的“通路”
重点讲解③--胶体特有的现象
巩固练习3
小于1nm
1-100nm
大于100nm
Fe(OH)3胶体、云、有色玻璃
食用油加水、粉笔灰加水
NaCl溶液
巩固练习4
丁达尔效应是胶体特有的现象
C
请你回忆初中学过的酸碱盐的化学性质,并举例
酸+活泼金属---->盐+H2
酸+碱性氧化物-->盐+水
酸 + 碱---->盐 + 水
酸 + 盐--->新酸+新盐
3、酸碱盐的性质--初高衔接
Fe2O3+6HCl===2FeCl3+3H2O
NaOH+HCl===NaCl+H2O
BaCl2+H2SO4===BaSO4 +2HCl
Zn+H2SO4===ZnSO4+H2
请你回忆初中学过的酸碱盐的化学性质,并举例
3、酸碱盐的性质--初高衔接
碱+酸性氧化物-->盐+水
碱 + 酸---->盐 + 水
可溶性碱+可溶性盐--->新碱+新盐
2NaOH+CO2===Na2CO3+H2O
NaOH+HCl===NaCl+H2O
2NaOH+CuSO4===Na2SO4+Cu(OH)2
请你回忆初中学过的酸碱盐的化学性质,并举例
金属+可溶性盐-->新金属+新盐
酸+可溶性盐-->新酸+新盐
可溶性碱+可溶性盐-->新碱+新盐
可溶性盐+可溶性盐-->新盐和新盐
3、酸碱盐的性质--初高衔接
Fe+CuSO4===FeSO4+Cu
Na2CO3+2HCl===2NaCl+H2O+CO2
2NaOH+CuCl2===2NaCl+Cu(OH)2
NaCl+AgNO3=== AgCl +NaNO3
3、酸碱盐的性质--知识体系
酸碱盐的化学性质
所属化学反应类型
化学反应类型间关系
反应类型 形式 实例
化合反应
分解反应
置换反应
复分解反应
A+B===AB
AB===A+B
AB+C===A+BC
AB+CD===AD+CB
CaCl2+Na2CO3==CaCO3 +2NaCl
Zn+H2SO4==ZnSO4+H2
Cu(OH)2===CuO+H2O、电解水
NH3+HCl==NH4Cl、生成水
重点讲解①--化学反应类型
氧化还原反应:元素化合价发生变化
非氧化还原反应:元素化合价不发生变化
根据物质类别和组成
根据元素化合价是否改变
化合反应
分解反应
置换反应
复分解反应
氧化还原反应
非氧化还原反应
重点讲解②--化学反应类型之间的关系
氧化还原反应
置换反应
分解反应
复分解反应
化合反应
重点讲解②--化学反应类型之间的关系
4、物质的转化
应用:确定制取某类物质的方法
巩固练习5
(1)CaO;碱性氧化物;(2)CaO+H2O===Ca(OH)2
(3)与酸反应CaO+2HCl===CaCl2+H2O
(4)硅胶
归纳总结1
分类标准
分类方法
同位素
同素异形体
同分异构体
同系物
物质组成
物质性质
树状分类法
交叉分类法
单质
化合物
酸性氧化物
碱性氧化物
归纳总结2
分散系
(混合物)
分散质
分散剂
溶液(<1nm)
悬浊液、乳浊液(>100nm)
胶体(1-100nm)
丁达尔效应
气溶胶:云、雾
液溶胶:Fe(OH)3胶体
固溶胶:有色玻璃
酸碱盐的化学性质
所属化学反应类型
化学反应类型间关系
归纳总结3
氧化还原反应
置换反应
分解反应
复分解反应
化合反应
化学反应类型之间的关系
感 谢 观 看 !
物质的分类及转化
内容总览
1、根据物质的组成和性质分类(P6-7)
2、分散系及其分类(P8-9)
3、酸碱盐的性质(P9-10)
4、物质的转化(P10-11)
请你回忆初中学过的单质、化合物、氧化物的概念,并举例
单质:同种元素组成的纯净物
化合物:由两种或两种以上元素组成的纯净物
氧化物:由两种元素组成的化合物,其中有一种元素是氧
1、根据物质的组成和性质分类--初高衔接
1、根据物质的组成和性质分类--知识体系
分类标准
分类方法
同位素
同素异形体
同分异构体
同系物
物质组成
物质性质
树状分类法
交叉分类法
单质
化合物
酸性氧化物
碱性氧化物
重点讲解①--酸性氧化物、碱性氧化物
酸性氧化物:能与碱反应生成盐和水的氧化物
碱性氧化物:能与酸反应生成盐和水的氧化物
CO2+Ca(OH)2====CaCO3 +H2O
CaO+2HCl====CaCl2+H2O
重点讲解②--“四同”
重点讲解③--分类方法
重点讲解③--分类方法
巩固练习1
经分析,某物质只含有一种元素,则此物质( )
A、一定是一种单质
B、一定是纯净物
C、一定是混合物
D、可能是纯净物,也可能是混合物
巩固练习1
解析:只含有一种元素,则一定是单质。
综上,可能是纯净物,也可能是混合物。
但可能是一种单质,如H2,为纯净物;
也可能是同素异形体的混合物,如金刚石和石墨的混合物,或O2和O3的混合物。
巩固练习1
经分析,某物质只含有一种元素,则此物质( )
A、一定是一种单质
B、一定是纯净物
C、一定是混合物
D、可能是纯净物,也可能是混合物
D
巩固练习2
⑨⑩;⑤;③;④;⑥⑦;单质;O3
请你回忆初中学过的悬浊液和乳浊液的概念,并举例
悬浊液:以细小固体颗粒形式分散于水中形成的混合物,如粉笔灰分散到水中
乳浊液:以小液滴形式分散于水中形成的混合物,如油滴分散到水中
悬浊液、乳浊液不均一不稳定
溶液均一稳定
2、分散系及其分类--初高衔接
2、分散系及其分类--知识体系
分散系
(混合物)
分散质
分散剂
溶液(<1nm)
悬浊液、乳浊液(>100nm)
胶体(1-100nm)
丁达尔效应
气溶胶:云、雾
液溶胶:Fe(OH)3胶体
固溶胶:有色玻璃
重点讲解①--分散系
分散系:把一种(或多种)物质以粒子形式分散到另一种(或多种)物质中所形成的混合物
分散质:分散系中被分散成粒子的物质
分散剂:分散系中分散质以外的物质
1、根据分散质粒子直径对分散系分类
溶液(<1nm)
悬浊液、乳浊液(>100nm)
胶体(1-100nm)
2、根据分散剂种类对胶体分类
气溶胶:云、雾
液溶胶:Fe(OH)3胶体 FeCl3+3H2O===Fe(OH)3(胶体)+3HCl
固溶胶:有色玻璃
重点讲解②--分散系的分类
溶液
胶体
悬浊液、乳浊液
1nm
100nm
丁达尔效应:由于胶体粒子对光线散射(光波偏离原来方向而分散传播)形成的
验证方法:当光束通过胶体时,可以看到一条光亮的“通路”
重点讲解③--胶体特有的现象
巩固练习3
小于1nm
1-100nm
大于100nm
Fe(OH)3胶体、云、有色玻璃
食用油加水、粉笔灰加水
NaCl溶液
巩固练习4
丁达尔效应是胶体特有的现象
C
请你回忆初中学过的酸碱盐的化学性质,并举例
酸+活泼金属---->盐+H2
酸+碱性氧化物-->盐+水
酸 + 碱---->盐 + 水
酸 + 盐--->新酸+新盐
3、酸碱盐的性质--初高衔接
Fe2O3+6HCl===2FeCl3+3H2O
NaOH+HCl===NaCl+H2O
BaCl2+H2SO4===BaSO4 +2HCl
Zn+H2SO4===ZnSO4+H2
请你回忆初中学过的酸碱盐的化学性质,并举例
3、酸碱盐的性质--初高衔接
碱+酸性氧化物-->盐+水
碱 + 酸---->盐 + 水
可溶性碱+可溶性盐--->新碱+新盐
2NaOH+CO2===Na2CO3+H2O
NaOH+HCl===NaCl+H2O
2NaOH+CuSO4===Na2SO4+Cu(OH)2
请你回忆初中学过的酸碱盐的化学性质,并举例
金属+可溶性盐-->新金属+新盐
酸+可溶性盐-->新酸+新盐
可溶性碱+可溶性盐-->新碱+新盐
可溶性盐+可溶性盐-->新盐和新盐
3、酸碱盐的性质--初高衔接
Fe+CuSO4===FeSO4+Cu
Na2CO3+2HCl===2NaCl+H2O+CO2
2NaOH+CuCl2===2NaCl+Cu(OH)2
NaCl+AgNO3=== AgCl +NaNO3
3、酸碱盐的性质--知识体系
酸碱盐的化学性质
所属化学反应类型
化学反应类型间关系
反应类型 形式 实例
化合反应
分解反应
置换反应
复分解反应
A+B===AB
AB===A+B
AB+C===A+BC
AB+CD===AD+CB
CaCl2+Na2CO3==CaCO3 +2NaCl
Zn+H2SO4==ZnSO4+H2
Cu(OH)2===CuO+H2O、电解水
NH3+HCl==NH4Cl、生成水
重点讲解①--化学反应类型
氧化还原反应:元素化合价发生变化
非氧化还原反应:元素化合价不发生变化
根据物质类别和组成
根据元素化合价是否改变
化合反应
分解反应
置换反应
复分解反应
氧化还原反应
非氧化还原反应
重点讲解②--化学反应类型之间的关系
氧化还原反应
置换反应
分解反应
复分解反应
化合反应
重点讲解②--化学反应类型之间的关系
4、物质的转化
应用:确定制取某类物质的方法
巩固练习5
(1)CaO;碱性氧化物;(2)CaO+H2O===Ca(OH)2
(3)与酸反应CaO+2HCl===CaCl2+H2O
(4)硅胶
归纳总结1
分类标准
分类方法
同位素
同素异形体
同分异构体
同系物
物质组成
物质性质
树状分类法
交叉分类法
单质
化合物
酸性氧化物
碱性氧化物
归纳总结2
分散系
(混合物)
分散质
分散剂
溶液(<1nm)
悬浊液、乳浊液(>100nm)
胶体(1-100nm)
丁达尔效应
气溶胶:云、雾
液溶胶:Fe(OH)3胶体
固溶胶:有色玻璃
酸碱盐的化学性质
所属化学反应类型
化学反应类型间关系
归纳总结3
氧化还原反应
置换反应
分解反应
复分解反应
化合反应
化学反应类型之间的关系
感 谢 观 看 !
