第二节 水的电离和溶液的酸碱性
文档属性
| 名称 | 第二节 水的电离和溶液的酸碱性 |  | |
| 格式 | zip | ||
| 文件大小 | 2.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2013-06-22 16:14:19 | ||
图片预览






文档简介
课件17张PPT。美丽的湿地公园那年冬天我们一起玩雪我要喝水 第二节
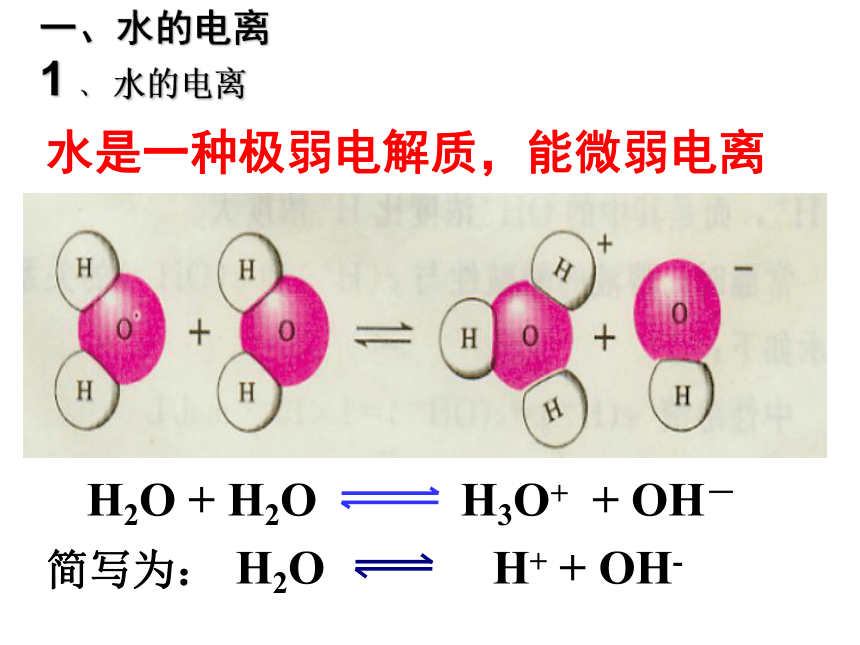
水的电离和溶液的酸碱性简写为:一、水的电离
1 、 水的电离 水是一种极弱电解质,能微弱电离电离平衡常数:
K 电离=2、水的离子积( Kw)表达式:Kw =C(H+) ·C(OH-)25℃时,1L(55.6 mol)纯水中有1×10-7 mol
水发生电离,则该纯水中
C(H+) = mol/L;
C(OH-) = mol/L;
C(H+) C(OH-)(填<、>、=)
Kw= 。Kw只与 有关,与 无关。3、影响水的电离平衡的因素水的电离是 过程,升高温度, 水的电离, Kw 。 25 ℃ 时 KW=1×10-14
100 ℃时 KW=1×10-12(1)温度:(2)浓度C(H+)=1×10-7 PH=7 中性C(H+)=1×10-6 PH=6 中性对常温下纯水进行下列操作,填写下表 加酸或加碱:抑制水的电离,但水的离子积保持不变。在一定条件下向水中加入下列固体盐加能水解的盐:促进水的电离,但水的离子积保持不变。②任何稀的水溶液中都存在
Kw= c(H+)·c(OH-) 4、归纳①任何水溶液中,均存在水的电离平衡。且由水电离产生的C水 (H+) = C 水(OH-)稀酸溶液: Kw= c(H+)酸·c(OH-)水=1×10-14稀碱溶液: Kw= c(H+)水·c(OH-)碱=1×10-14练习1:
0.01mol/L盐酸溶液中C(H+)、C(OH-)分别为多少?
由水电离出的C(H+)、 C(OH-)分别为多少?
变式训练1:
0.01mol/LNaOH溶液中C(H+)、C(OH-)分别为多少?
由水电离出的C(H+)、 C(OH-)分别为多少?
变式训练2:
PH=2的NH4Cl 溶液C(H+)、C(OH-)分别为多少?
由水电离出的C(H+)、 C(OH-)分别为多少?
变式训练3:
PH=12的CH3COOH 溶液中
C(H+)、C(OH-)分别为多少?
由水电离出的C(H+)、 C(OH-)分别为多少?在由水电离出的c(H+)=10-12mol/L的溶液中,一定能大量共存的离子组是( )
A.K+、Fe3+、SO42-、MnO4-
B.Na+、Cl-、NO3-、SO42-
C.Al3+、NH4+、Cl-、SO42-
D.Na+、AlO2-、Br-、Cl-B练习2:水的
电离水的离子积:影响因素KW = c(OH -)· c(H+)
( 25℃时,KW = 1.0 ×10 -14 )温度:
加能水解的盐:T ↑, KW ↑抑制水的电离, KW不变促进水的电离, KW 不变 小结加酸或加碱:浓度:
水的电离和溶液的酸碱性简写为:一、水的电离
1 、 水的电离 水是一种极弱电解质,能微弱电离电离平衡常数:
K 电离=2、水的离子积( Kw)表达式:Kw =C(H+) ·C(OH-)25℃时,1L(55.6 mol)纯水中有1×10-7 mol
水发生电离,则该纯水中
C(H+) = mol/L;
C(OH-) = mol/L;
C(H+) C(OH-)(填<、>、=)
Kw= 。Kw只与 有关,与 无关。3、影响水的电离平衡的因素水的电离是 过程,升高温度, 水的电离, Kw 。 25 ℃ 时 KW=1×10-14
100 ℃时 KW=1×10-12(1)温度:(2)浓度C(H+)=1×10-7 PH=7 中性C(H+)=1×10-6 PH=6 中性对常温下纯水进行下列操作,填写下表 加酸或加碱:抑制水的电离,但水的离子积保持不变。在一定条件下向水中加入下列固体盐加能水解的盐:促进水的电离,但水的离子积保持不变。②任何稀的水溶液中都存在
Kw= c(H+)·c(OH-) 4、归纳①任何水溶液中,均存在水的电离平衡。且由水电离产生的C水 (H+) = C 水(OH-)稀酸溶液: Kw= c(H+)酸·c(OH-)水=1×10-14稀碱溶液: Kw= c(H+)水·c(OH-)碱=1×10-14练习1:
0.01mol/L盐酸溶液中C(H+)、C(OH-)分别为多少?
由水电离出的C(H+)、 C(OH-)分别为多少?
变式训练1:
0.01mol/LNaOH溶液中C(H+)、C(OH-)分别为多少?
由水电离出的C(H+)、 C(OH-)分别为多少?
变式训练2:
PH=2的NH4Cl 溶液C(H+)、C(OH-)分别为多少?
由水电离出的C(H+)、 C(OH-)分别为多少?
变式训练3:
PH=12的CH3COOH 溶液中
C(H+)、C(OH-)分别为多少?
由水电离出的C(H+)、 C(OH-)分别为多少?在由水电离出的c(H+)=10-12mol/L的溶液中,一定能大量共存的离子组是( )
A.K+、Fe3+、SO42-、MnO4-
B.Na+、Cl-、NO3-、SO42-
C.Al3+、NH4+、Cl-、SO42-
D.Na+、AlO2-、Br-、Cl-B练习2:水的
电离水的离子积:影响因素KW = c(OH -)· c(H+)
( 25℃时,KW = 1.0 ×10 -14 )温度:
加能水解的盐:T ↑, KW ↑抑制水的电离, KW不变促进水的电离, KW 不变 小结加酸或加碱:浓度:
