2022-2023学年高一上学期化学人教版(2019)必修第一册1.2离子反应 课件(23张ppt)
文档属性
| 名称 | 2022-2023学年高一上学期化学人教版(2019)必修第一册1.2离子反应 课件(23张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 3.6MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-07-08 23:13:09 | ||
图片预览





文档简介
(共23张PPT)
1.2离子反应
内容总览
1、电解质的电离(P13-15)
2、离子反应(P16-18)
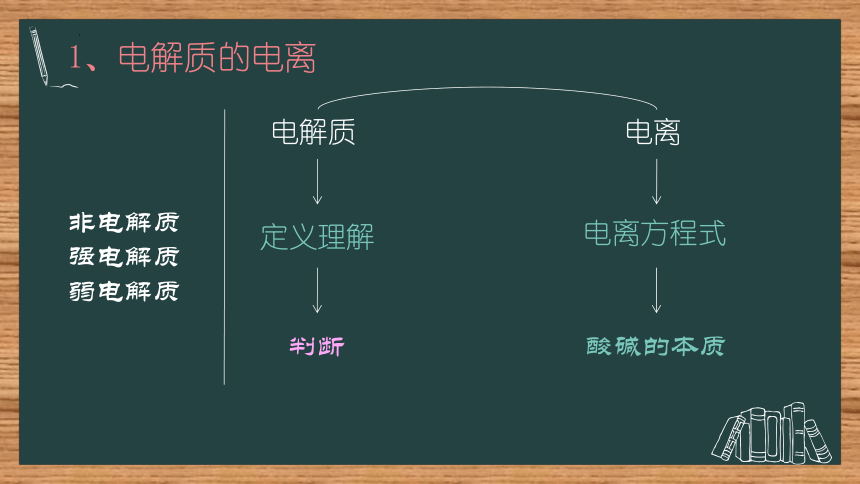
1、电解质的电离
电解质
电离
定义理解
电离方程式
酸碱的本质
判断
非电解质强电解质
弱电解质
2、离子反应
离子反应的定义
离子方程式的书写
离子方程式的意义
中和反应
复分解反应
置换反应
“写”“拆”“删”“查”
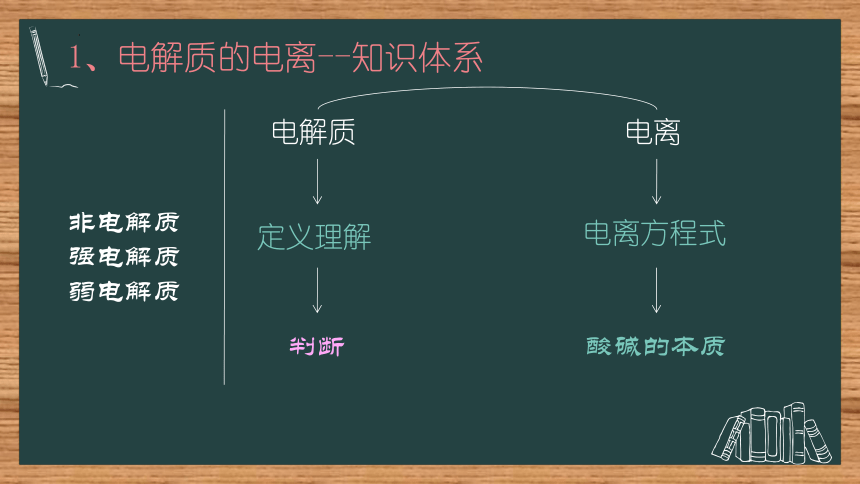
1、电解质的电离--知识体系
电解质
电离
定义理解
电离方程式
酸碱的本质
判断
非电解质强电解质
弱电解质
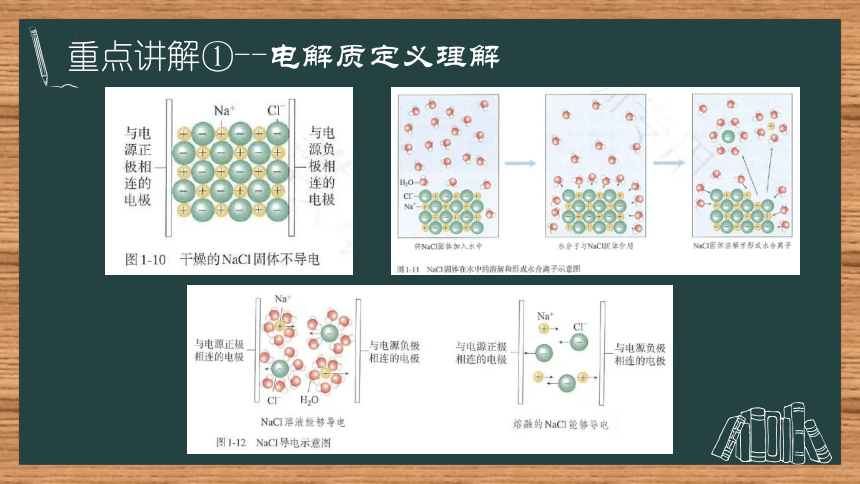
重点讲解①--电解质定义
电解质:在水溶液里或熔融状态下能够导电的化合物
非电解质:在水溶液里和熔融状态下都不能导电的化合物
强电解质:在水溶液中完全电离的电解质,比如强酸、强碱、大部分盐
弱电解质:在水溶液中部分电离的电解质,比如弱酸、弱碱、少数盐
重点讲解①--电解质定义理解
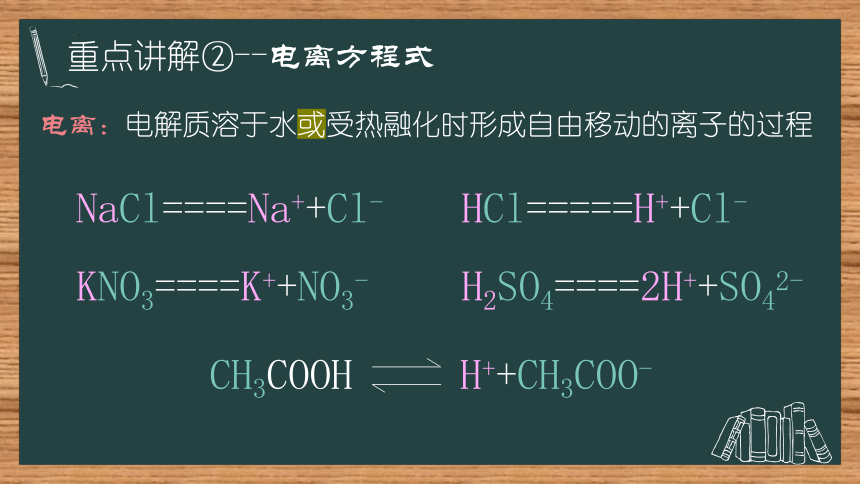
重点讲解②--电离方程式
电离:电解质溶于水或受热融化时形成自由移动的离子的过程
NaCl====Na++Cl-
HCl=====H++Cl-
KNO3====K++NO3-
H2SO4====2H++SO42-
CH3COOH H++CH3COO-
重点讲解③--酸碱的本质
HCl=====H++Cl-
H2SO4=====2H++SO42-
NaOH===Na++OH-
Ca(OH)2===Ca2++2OH-
酸:电离时生成的阳离子全部是H+
碱:电离时生成的阴离子全部是OH-
巩固练习1--电解质的判断
C
巩固练习2--电离方程式
(1)HNO3 ==== H++NO3-
(2)KOH ==== K++OH-
(3)Fe2(SO4)3 === 2Fe3++3SO42-
(4)NH4NO3 ==== NH4++NO3-
2、离子反应--知识体系
离子反应的定义
离子方程式的书写
离子方程式的意义
中和反应
复分解反应
置换反应
“写”“拆”“删”“查”
重点讲解①--离子反应的定义
离子反应:在反应中有离子参加或有离子生成的反应
电解质在溶液中的反应实质上是离子之间的反应
Na2SO4+BaCl2===BaSO4 +2NaCl
Ba2++SO42-===BaSO4
1、写:写出反应的化学方程式
2、拆:把易溶于水且易电离的物质写成离子形式,其他物质仍用化学式表示
重点讲解②--离子方程式的书写
3、删:删去方程式两边不参加反应的离子,并化为最简
4、查:离子方程式两边各元素的原子个数和电荷数是否相等
“3拆”强酸强碱可溶性盐
“9不拆”单质、固体、氧化物、挥发性物质、弱电解质、沉淀、非电解质、酸式弱酸根、络离子
1、写:
2、拆:
重点讲解②--离子方程式的书写
3、删:
4、查:离子方程式两边各元素的原子个数和电荷数是否相等
Na2SO4+BaCl2===BaSO4 +2NaCl
2Na++SO42-+Ba2++2Cl- === BaSO4 +2Na++2Cl-
SO42-+Ba2+===BaSO4
Ba2++SO42-===BaSO4
强酸与强碱发生中和反应的实质:H++OH-===H2O
重点讲解③--离子方程式的意义
HCl+NaOH==NaCl+H2O
HCl+KOH==KCl+H2O
H2SO4+2NaOH==Na2SO4+2H2O
H2SO4+2KOH==K2SO4+2H2O
H++OH-===H2O
H++OH-===H2O
H++OH-===H2O
H++OH-===H2O
复分解反应(AB+CD===AD+CB)
重点讲解③--离子方程式的意义
化学方程式:CaCl2+Na2CO3==CaCO3 +2NaCl
离子方程式:Ca2++CO32-==CaCO3
这类离子反应的实质是两种电解质在溶液中相互交换离子
这类离子反应发生的条件生成沉淀、放出气体或生成水
置换反应(AB+C===A+BC)
重点讲解③--离子方程式的意义
离子反应的优点是能够看清一个化学反应的实质
离子反应在物质制备和分离、物质提纯和鉴定以及消除水中污染物等方面都有广泛的应用
化学方程式:Zn+H2SO4==ZnSO4+H2
离子方程式:Zn+2H+==Zn2++H2
巩固练习3
B
巩固练习4
(1)Zn+2H+==Zn2++H2
(2)Zn+Cu2+==Zn2++Cu
(3)H++OH-==H2O
(4)Ba2++2OH-+Cu2++SO42- == BaSO4 +Cu(OH)2
电解质
电离
定义理解
电离方程式
酸碱的本质
判断
非电解质强电解质
弱电解质
归纳总结1
离子反应的定义
离子方程式的书写
离子方程式的意义
中和反应
复分解反应
置换反应
“写”“拆”“删”“查”
归纳总结2
感 谢 观 看 !
1.2离子反应
内容总览
1、电解质的电离(P13-15)
2、离子反应(P16-18)
1、电解质的电离
电解质
电离
定义理解
电离方程式
酸碱的本质
判断
非电解质强电解质
弱电解质
2、离子反应
离子反应的定义
离子方程式的书写
离子方程式的意义
中和反应
复分解反应
置换反应
“写”“拆”“删”“查”
1、电解质的电离--知识体系
电解质
电离
定义理解
电离方程式
酸碱的本质
判断
非电解质强电解质
弱电解质
重点讲解①--电解质定义
电解质:在水溶液里或熔融状态下能够导电的化合物
非电解质:在水溶液里和熔融状态下都不能导电的化合物
强电解质:在水溶液中完全电离的电解质,比如强酸、强碱、大部分盐
弱电解质:在水溶液中部分电离的电解质,比如弱酸、弱碱、少数盐
重点讲解①--电解质定义理解
重点讲解②--电离方程式
电离:电解质溶于水或受热融化时形成自由移动的离子的过程
NaCl====Na++Cl-
HCl=====H++Cl-
KNO3====K++NO3-
H2SO4====2H++SO42-
CH3COOH H++CH3COO-
重点讲解③--酸碱的本质
HCl=====H++Cl-
H2SO4=====2H++SO42-
NaOH===Na++OH-
Ca(OH)2===Ca2++2OH-
酸:电离时生成的阳离子全部是H+
碱:电离时生成的阴离子全部是OH-
巩固练习1--电解质的判断
C
巩固练习2--电离方程式
(1)HNO3 ==== H++NO3-
(2)KOH ==== K++OH-
(3)Fe2(SO4)3 === 2Fe3++3SO42-
(4)NH4NO3 ==== NH4++NO3-
2、离子反应--知识体系
离子反应的定义
离子方程式的书写
离子方程式的意义
中和反应
复分解反应
置换反应
“写”“拆”“删”“查”
重点讲解①--离子反应的定义
离子反应:在反应中有离子参加或有离子生成的反应
电解质在溶液中的反应实质上是离子之间的反应
Na2SO4+BaCl2===BaSO4 +2NaCl
Ba2++SO42-===BaSO4
1、写:写出反应的化学方程式
2、拆:把易溶于水且易电离的物质写成离子形式,其他物质仍用化学式表示
重点讲解②--离子方程式的书写
3、删:删去方程式两边不参加反应的离子,并化为最简
4、查:离子方程式两边各元素的原子个数和电荷数是否相等
“3拆”强酸强碱可溶性盐
“9不拆”单质、固体、氧化物、挥发性物质、弱电解质、沉淀、非电解质、酸式弱酸根、络离子
1、写:
2、拆:
重点讲解②--离子方程式的书写
3、删:
4、查:离子方程式两边各元素的原子个数和电荷数是否相等
Na2SO4+BaCl2===BaSO4 +2NaCl
2Na++SO42-+Ba2++2Cl- === BaSO4 +2Na++2Cl-
SO42-+Ba2+===BaSO4
Ba2++SO42-===BaSO4
强酸与强碱发生中和反应的实质:H++OH-===H2O
重点讲解③--离子方程式的意义
HCl+NaOH==NaCl+H2O
HCl+KOH==KCl+H2O
H2SO4+2NaOH==Na2SO4+2H2O
H2SO4+2KOH==K2SO4+2H2O
H++OH-===H2O
H++OH-===H2O
H++OH-===H2O
H++OH-===H2O
复分解反应(AB+CD===AD+CB)
重点讲解③--离子方程式的意义
化学方程式:CaCl2+Na2CO3==CaCO3 +2NaCl
离子方程式:Ca2++CO32-==CaCO3
这类离子反应的实质是两种电解质在溶液中相互交换离子
这类离子反应发生的条件生成沉淀、放出气体或生成水
置换反应(AB+C===A+BC)
重点讲解③--离子方程式的意义
离子反应的优点是能够看清一个化学反应的实质
离子反应在物质制备和分离、物质提纯和鉴定以及消除水中污染物等方面都有广泛的应用
化学方程式:Zn+H2SO4==ZnSO4+H2
离子方程式:Zn+2H+==Zn2++H2
巩固练习3
B
巩固练习4
(1)Zn+2H+==Zn2++H2
(2)Zn+Cu2+==Zn2++Cu
(3)H++OH-==H2O
(4)Ba2++2OH-+Cu2++SO42- == BaSO4 +Cu(OH)2
电解质
电离
定义理解
电离方程式
酸碱的本质
判断
非电解质强电解质
弱电解质
归纳总结1
离子反应的定义
离子方程式的书写
离子方程式的意义
中和反应
复分解反应
置换反应
“写”“拆”“删”“查”
归纳总结2
感 谢 观 看 !
