1.2.1+离子反应(1)【教学课件】-2022-2023学年高一化学同步备课系列(人教版2019必修第一册)
文档属性
| 名称 | 1.2.1+离子反应(1)【教学课件】-2022-2023学年高一化学同步备课系列(人教版2019必修第一册) |

|
|
| 格式 | pptx | ||
| 文件大小 | 14.5MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-07-07 00:00:00 | ||
图片预览







文档简介
(共32张PPT)
第一章 物质及其变化
第二节 离子反应
第1课时
2
1
本节重、难点
电离、电解质和非电解质的概念
电离方程式
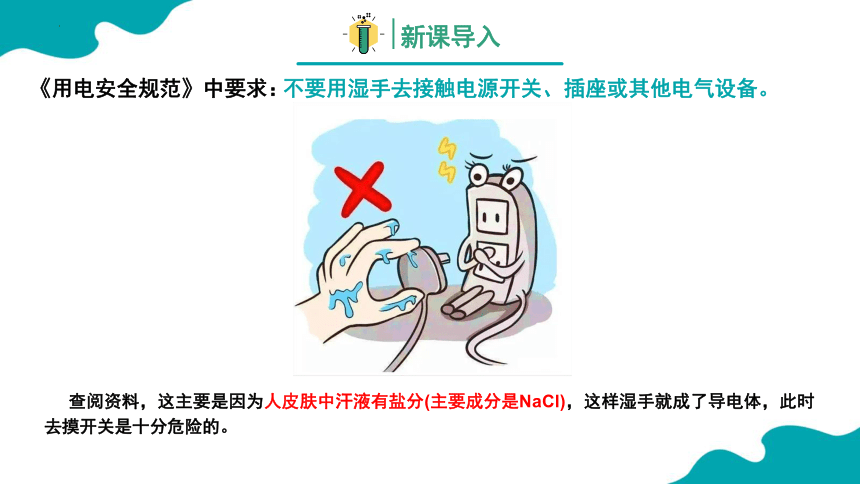
查阅资料,这主要是因为人皮肤中汗液有盐分(主要成分是NaCl),这样湿手就成了导电体,此时去摸开关是十分危险的。
《用电安全规范》中要求:
不要用湿手去接触电源开关、插座或其他电气设备。
NaCl固体 溶于水到底发生了什么变化呢?
实验探究
试验物质的导电性
探究一:在三个烧杯中分别加入干燥的NaCl固体、KNO3固体和蒸馏水,如图所示连接装置,将石墨电极依次放入三个烧杯中,分别接通电源,观察并记录现象。
探究二:取上述烧杯中的NaCl固体、KNO3固体各少许,分别加入另外两个盛有蒸馏水的烧杯中,用玻璃棒搅拌,使固体完全溶解形成溶液。如图所示,将石墨电极依次放入NaC1溶液、KNO3溶液中,分别接通电源,观察并记录现象。
实验现象及结论
样品 干燥的NaCl固体 干燥的KNO3固体 蒸馏水 NaCl溶液 KNO3溶液
现象
结论
灯泡不亮
灯泡不亮
灯泡不亮
灯泡亮
灯泡亮
干燥的NaCl固体不导电
干燥的KNO3固体不导电
蒸馏水不导电
NaCl溶液导电
KNO3溶液导电
实验探究
试验物质的导电性
电流:
由带电的粒子定向移动形成的。
金属里含有可以自由移动的电子,当金属的两端加上一个电压时,迫使电子进行定向移动,于是就可以导电了。
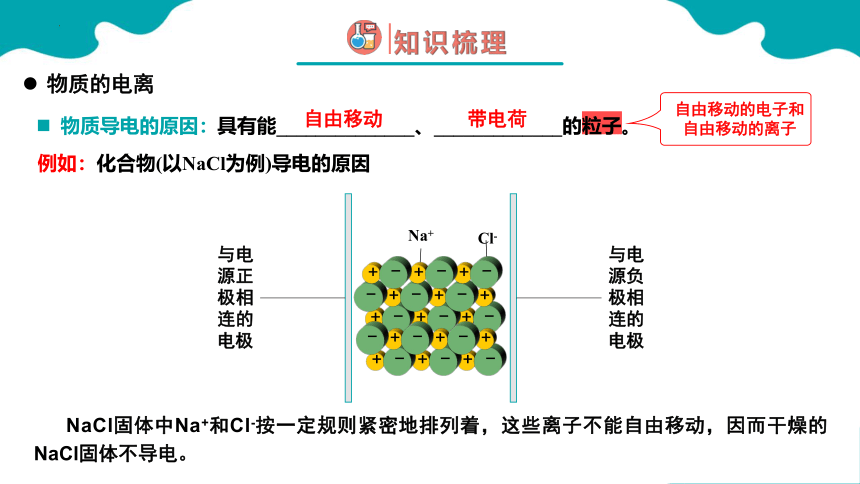
物质导电的原因:
自由移动
带电荷
物质的电离
例如:化合物(以NaCl为例)导电的原因
具有能______________、_____________的粒子。
自由移动的电子和自由移动的离子
+
-
+
-
+
-
+
-
+
-
+
-
+
-
+
-
+
-
+
-
+
-
+
-
+
-
+
-
+
-
Cl-
Na+
与电源正极相连的电极
与电源负极相连的电极
NaCl固体中Na+和Cl-按一定规则紧密地排列着,这些离子不能自由移动,因而干燥的NaCl固体不导电。
物质的电离
例如:化合物(以NaCl为例)导电的原因
物质导电的原因:
自由移动
带电荷
具有能______________、_____________的粒子。
自由移动的电子和自由移动的离子
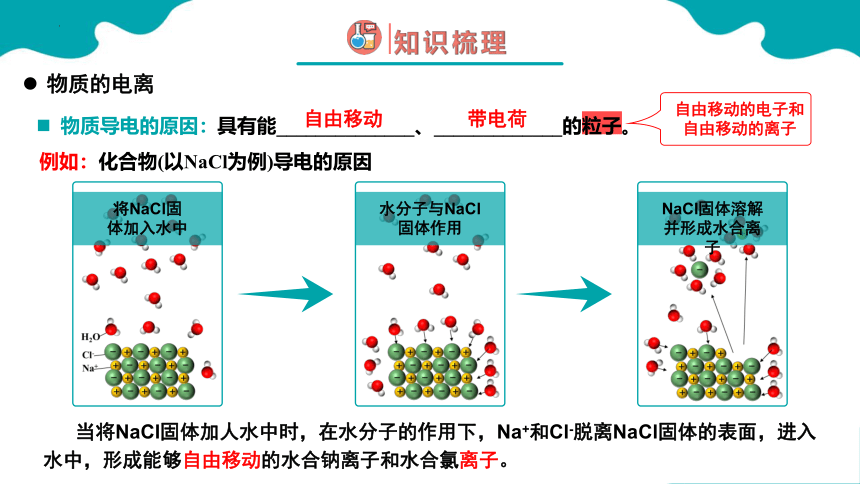
当将NaCl固体加人水中时,在水分子的作用下,Na+和Cl-脱离NaCl固体的表面,进入水中,形成能够自由移动的水合钠离子和水合氯离子。
将NaCl固体加入水中
水分子与NaCl固体作用
NaCl固体溶解并形成水合离子
盐酸,NaOH溶液,NaCl固体,石墨,NaCl溶液、蔗糖溶液,酒精溶液,Cu
石墨、Cu等单质导电是由于有自由移动的电子;
盐酸、 NaCl溶液、 NaOH溶液等化合物溶液导电是由于有自由移动的离子;
【例1】下列物质中能导电的物质有哪些?为什么?
像蔗糖、酒精等物质,本身就不具备离子,所以它们是不会导电的。
NaCl固体不导电,NaCl溶液可导电,那么,熔融状态下NaCl能否导电呢?
熔融:常温下是固体的纯净物在一定温度下达到熔点变成液态物质,且此液态物质有液体的某些物理性质,那么这种新的状态叫作该物质的熔融状态。
+
-
+
-
+
-
Cl-
Na+
与电源正极相连的电极
与电源负极相连的电极
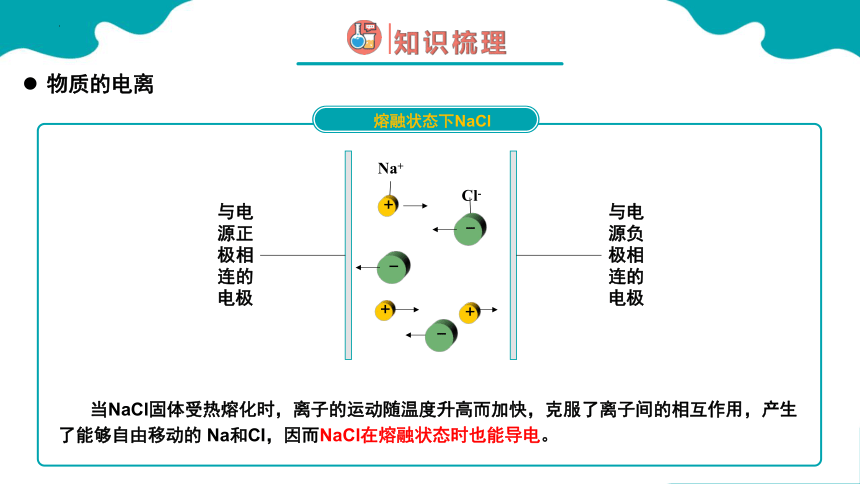
熔融状态下NaCl
当NaCl固体受热熔化时,离子的运动随温度升高而加快,克服了离子间的相互作用,产生了能够自由移动的 Na和CI,因而NaCl在熔融状态时也能导电。
物质的电离
NaCl固体 NaCl溶液 熔融NaCl
含有微粒 Na+、Cl- 水合钠离子、水合氯离子 Na+、Cl-
微粒能否自由移动
能自由移动的原因 在水分子作用下Na+、Cl-脱离NaCl固体的表面 受热熔化时,离子运动随温度升高而加快,克服了离子间的作用
否
能
能
物质的电离
例如:化合物(以NaCl为例)导电的原因
物质导电的原因:
自由移动
带电荷
具有能______________、_____________的粒子。
自由移动的电子和自由移动的离子
结论:化合物能导电的状态为_____或_________。
溶液
熔融状态
电离与通电无关
电离:
01
像食盐这类由离子构成且易溶的物质在水溶液中和熔融状态都能电离。
02
像BaSO4、MgO这类由离子构成且难溶的物质,在水中几乎不电离,只能熔融时电离。
像硫酸,氯化氢这类由分子构成的物质就只能在水溶液中电离。而酒精、葡萄糖这类由分子构成的物质不能电离。
03
化合物能否电离取决于构成化合物的微粒和性质
物质的电离
化合物在水分子作用下或受热熔化时,离解成能自由移动的离子的过程。
结论
定义:表示电解质电离的式子。
书写要求:左边写电解质的化学式,右边写电离出的离子。
实例:HCl===H++Cl-;NaCl===Na++Cl-;Ba(OH)2===____________。
Ba2++2OH-
物质的电离
电离方程式:
(表示方法)
从电离角度认识酸、碱、盐
酸
盐
碱
定义:电离时,能生成_________和___________________________ (或非金属离子)的化合物
定义:电离时生成阳离子_________的化合物
全部是H+
定义:电离时生成阴离子___________的化合物
全部是OH-
金属阳离子(或铵根离子)
酸根离子
电离方程式:
HNO3===H++NO3-
KOH===K++OH-
电离方程式:
电离方程式:
NH4NO3===NH4++NO3-
电解质发生电离,是在通电条件下才发生的( )
NaHSO4在水溶液中可以电离出H+,所以NaHSO4属于酸( )
液态硫酸无法电离,只有在溶于水形成水溶液时才发生电离( )
×
×
√
【例1】请同学们认真思考并判断正误:
【例2】NaHSO4通常为晶体,易溶于水,它溶于水时电离出三种不同的离子,溶液显酸性。NaHSO4受热熔化时只能电离出两种不同的离子。
(1)NaHSO4在水溶液中的电离方程式为 。
(2)NaHSO4在熔融状态下的电离方程式为 。
(3)下列说法中正确的是 (填字母)。
a.NaHSO4属于酸
b.NaHSO4属于盐
c. NaHSO4溶液能与Zn反应生成氢气
bc
NaHSO4===Na++H++SO42-
NaHSO4 ====== Na++HSO4-
熔融
物质的电离
电离方程式书写的注意事项
符合客观事实:
不能随意书写离子符号,要注意正确标注离子所带的电荷及其数目。
质量守恒:
即电离方程式左右两侧元素的种类、原子或原子团的个数相等。
电荷守恒:
即电离方程式左右两侧的正负电荷数相等,溶液呈电中性。
能发生电离的物质(化合物)
溶于水
熔融状态
溶于水
不能发生电离的物质(化合物)
本身不含离子
(含的是分子)
本身含有离子
本身不含离子(含的是分子)
电解质
非电解质
在水中
在熔融状态下
都不发生电离
物质的电离
电离条件
电离条件
物质的电离
电解质
定义:
物质类别:
在水溶液里或熔融状态下能够导电的化合物。
(电解质是本身能电离的化合物)
包括酸、碱、盐、水、活泼金属氧化物。
NaCl、NaOH在水溶液和熔融时都能导电,所以NaCl 、NaOH是电解质。
BaSO4、Al2O3等难溶,在溶液中几乎不导电,但是在熔融状态电离而导电,所以也是电解质。
氯化氢、硫酸融化即液态不导电,但是盐酸、稀硫酸能导电,所以氯化氢、硫酸是电解质。
【例1】CO2、NH3等溶于水能导电,它们是电解质吗?
判断依据:化合物本身能否电离出离子,
CO2水溶液中,CO2与水反应生成H2CO3。离子是由H2CO3电离的,所以CO2不是电解质。与CO2 相似的还有SO2、 SO3 、P2O5等。
结论:二氧化碳、氨气等不是电解质。
氨水中的铵根离子,氢氧根离子是NH3· H2O电离的,所以氨气也不是电解质。
与导电性、溶解性无关。
非电解质
物质的电离
非电解质
非金属氧化物(除H2O)、大多数有机物、部分非金属氢化物,NH3、CH4等
定义:
物质类别:
在水溶液里或熔融状态下都不能够导电的化合物。
不是电解质与非电解质怎么区分呢?
单质:如C、Cu、Zn
混合物:如NaCl溶液、盐酸、氨水
不是电解质,但不是非电解质
不是电解质
非电解质
电解质与化合物之间的关系
电解质是本身能电离的化合物,不是单质也不是混合物;
能导电的物质不一定是电解质;
电解质不一定能导电,电解质必须在水溶液或熔化状态下才能导电;
电解质能导电,但导电的本质是它本身电离出自由移动的离子而导电,不是它与其他物质发生反应后的物质导电。
物质的电离
总结
铜丝、NaCl溶液和盐酸都能导电,所以三者都是电解质( )
NH3、CO2的水溶液能导电,所以NH3、CO2均是电解质( )
NaCl是电解质,所以NaCl固体可以导电( )
BaSO4难溶于水,其水溶液几乎不导电,所以BaSO4不是电解质( )
×
×
×
×
【例1】请同学们认真思考并判断正误:
判断电解质的思维流程
判断物质是否属于化合物,单质、混合物一定不是电解质
第一步
第二步
第三步
判断化合物在水溶液里或熔融状态下能否导电,至少其一导电为电解质
根据经验:酸、碱、盐都是电解质,非金属氧化物都不是电解质
物质的电离
用水将一组化合物溶解,制成电解质饮料。此饮料可补充人体新陈代谢的消耗。其电解质成分有钠离子、钾离子、镁离子、氯离子、硫酸根离子、磷酸根离子、柠檬酸盐、蔗糖、葡萄糖、维生素C及维生素B6。
电解质饮料
1.下列说法正确的是( )
A.铜、石墨均能导电,所以它们都是电解质
B.氨、二氧化碳的水溶液都能导电,所以它们都是电解质
C.液态氯化氢、固体氯化钠都不能导电,所以它们都是非电解质
D.蔗糖、酒精在水溶液里或熔融状态下都不能导电,所以它们都是非电解质
D
选项 A B C D
电解质 Fe NaCl溶液 CaCO3 HNO3
非电解质 C12H22O11(蔗糖) BaSO4 SO2 H2O
2.下列各组关于电解质、非电解质的归类,完全正确的是( )
C
3.现有中学化学中常见的八种物质:
①固体氢氧化钡 ②石墨碳棒 ③纯醋酸 ④液态氯化氢 ⑤硫酸氢钾固体 ⑥熔融氯化钠 ⑦蔗糖 ⑧碳酸钠粉末
请用序号填空:
(1)上述状态下可导电的是 ,属于非电解质的是 。
(2)属于酸的是 ,属于碱的是 ,属于盐的是 。
(3)写出①④⑤⑧在水溶液中的电离方程式:
① ; ④ ;
⑤ ; ⑧ 。
②⑥
⑦
③④
①
⑤⑥⑧
Ba(OH)2===Ba2++2OH-
HCl=== H++Cl-
KHSO4===K++H++SO42-
Na2CO3===2Na++CO32-
4.判断下列物质在水溶液中的电离方程式是否正确,不正确的加以改正。
_______________________________
(2)Ba(OH)2===Ba2++(OH-)2
____________________________________
__________________________________
______________________________________
不正确;改正:Ba(OH)2===Ba2++2OH-
5.某一化学兴趣小组的同学在家中进行实验,按照图A连接好线路,发现灯泡不亮;按照图B连接好线路,发现灯泡亮了。由此得出的以下结论正确的是( )
A.硝酸钾固体不是电解质
B.硝酸钾溶液是电解质
C.硝酸钾在水溶液中电离出了可以自由移动的离子
D.在硝酸钾溶液中,水电离出了大量的离子
C
第二节 离子反应
第2课时
电离
电解质
定义:化合物在水分子作用下或受热熔化时,离解成能自由移动的离子的过程
在水溶液里或熔融状态下能够导电的化合物
电离方程式
表示电解质电离的式子
书写要求:左边写电解质的化学式,右边写电离出的离子
THANKS
谢谢聆听
第一章 物质及其变化
第二节 离子反应
第1课时
2
1
本节重、难点
电离、电解质和非电解质的概念
电离方程式
查阅资料,这主要是因为人皮肤中汗液有盐分(主要成分是NaCl),这样湿手就成了导电体,此时去摸开关是十分危险的。
《用电安全规范》中要求:
不要用湿手去接触电源开关、插座或其他电气设备。
NaCl固体 溶于水到底发生了什么变化呢?
实验探究
试验物质的导电性
探究一:在三个烧杯中分别加入干燥的NaCl固体、KNO3固体和蒸馏水,如图所示连接装置,将石墨电极依次放入三个烧杯中,分别接通电源,观察并记录现象。
探究二:取上述烧杯中的NaCl固体、KNO3固体各少许,分别加入另外两个盛有蒸馏水的烧杯中,用玻璃棒搅拌,使固体完全溶解形成溶液。如图所示,将石墨电极依次放入NaC1溶液、KNO3溶液中,分别接通电源,观察并记录现象。
实验现象及结论
样品 干燥的NaCl固体 干燥的KNO3固体 蒸馏水 NaCl溶液 KNO3溶液
现象
结论
灯泡不亮
灯泡不亮
灯泡不亮
灯泡亮
灯泡亮
干燥的NaCl固体不导电
干燥的KNO3固体不导电
蒸馏水不导电
NaCl溶液导电
KNO3溶液导电
实验探究
试验物质的导电性
电流:
由带电的粒子定向移动形成的。
金属里含有可以自由移动的电子,当金属的两端加上一个电压时,迫使电子进行定向移动,于是就可以导电了。
物质导电的原因:
自由移动
带电荷
物质的电离
例如:化合物(以NaCl为例)导电的原因
具有能______________、_____________的粒子。
自由移动的电子和自由移动的离子
+
-
+
-
+
-
+
-
+
-
+
-
+
-
+
-
+
-
+
-
+
-
+
-
+
-
+
-
+
-
Cl-
Na+
与电源正极相连的电极
与电源负极相连的电极
NaCl固体中Na+和Cl-按一定规则紧密地排列着,这些离子不能自由移动,因而干燥的NaCl固体不导电。
物质的电离
例如:化合物(以NaCl为例)导电的原因
物质导电的原因:
自由移动
带电荷
具有能______________、_____________的粒子。
自由移动的电子和自由移动的离子
当将NaCl固体加人水中时,在水分子的作用下,Na+和Cl-脱离NaCl固体的表面,进入水中,形成能够自由移动的水合钠离子和水合氯离子。
将NaCl固体加入水中
水分子与NaCl固体作用
NaCl固体溶解并形成水合离子
盐酸,NaOH溶液,NaCl固体,石墨,NaCl溶液、蔗糖溶液,酒精溶液,Cu
石墨、Cu等单质导电是由于有自由移动的电子;
盐酸、 NaCl溶液、 NaOH溶液等化合物溶液导电是由于有自由移动的离子;
【例1】下列物质中能导电的物质有哪些?为什么?
像蔗糖、酒精等物质,本身就不具备离子,所以它们是不会导电的。
NaCl固体不导电,NaCl溶液可导电,那么,熔融状态下NaCl能否导电呢?
熔融:常温下是固体的纯净物在一定温度下达到熔点变成液态物质,且此液态物质有液体的某些物理性质,那么这种新的状态叫作该物质的熔融状态。
+
-
+
-
+
-
Cl-
Na+
与电源正极相连的电极
与电源负极相连的电极
熔融状态下NaCl
当NaCl固体受热熔化时,离子的运动随温度升高而加快,克服了离子间的相互作用,产生了能够自由移动的 Na和CI,因而NaCl在熔融状态时也能导电。
物质的电离
NaCl固体 NaCl溶液 熔融NaCl
含有微粒 Na+、Cl- 水合钠离子、水合氯离子 Na+、Cl-
微粒能否自由移动
能自由移动的原因 在水分子作用下Na+、Cl-脱离NaCl固体的表面 受热熔化时,离子运动随温度升高而加快,克服了离子间的作用
否
能
能
物质的电离
例如:化合物(以NaCl为例)导电的原因
物质导电的原因:
自由移动
带电荷
具有能______________、_____________的粒子。
自由移动的电子和自由移动的离子
结论:化合物能导电的状态为_____或_________。
溶液
熔融状态
电离与通电无关
电离:
01
像食盐这类由离子构成且易溶的物质在水溶液中和熔融状态都能电离。
02
像BaSO4、MgO这类由离子构成且难溶的物质,在水中几乎不电离,只能熔融时电离。
像硫酸,氯化氢这类由分子构成的物质就只能在水溶液中电离。而酒精、葡萄糖这类由分子构成的物质不能电离。
03
化合物能否电离取决于构成化合物的微粒和性质
物质的电离
化合物在水分子作用下或受热熔化时,离解成能自由移动的离子的过程。
结论
定义:表示电解质电离的式子。
书写要求:左边写电解质的化学式,右边写电离出的离子。
实例:HCl===H++Cl-;NaCl===Na++Cl-;Ba(OH)2===____________。
Ba2++2OH-
物质的电离
电离方程式:
(表示方法)
从电离角度认识酸、碱、盐
酸
盐
碱
定义:电离时,能生成_________和___________________________ (或非金属离子)的化合物
定义:电离时生成阳离子_________的化合物
全部是H+
定义:电离时生成阴离子___________的化合物
全部是OH-
金属阳离子(或铵根离子)
酸根离子
电离方程式:
HNO3===H++NO3-
KOH===K++OH-
电离方程式:
电离方程式:
NH4NO3===NH4++NO3-
电解质发生电离,是在通电条件下才发生的( )
NaHSO4在水溶液中可以电离出H+,所以NaHSO4属于酸( )
液态硫酸无法电离,只有在溶于水形成水溶液时才发生电离( )
×
×
√
【例1】请同学们认真思考并判断正误:
【例2】NaHSO4通常为晶体,易溶于水,它溶于水时电离出三种不同的离子,溶液显酸性。NaHSO4受热熔化时只能电离出两种不同的离子。
(1)NaHSO4在水溶液中的电离方程式为 。
(2)NaHSO4在熔融状态下的电离方程式为 。
(3)下列说法中正确的是 (填字母)。
a.NaHSO4属于酸
b.NaHSO4属于盐
c. NaHSO4溶液能与Zn反应生成氢气
bc
NaHSO4===Na++H++SO42-
NaHSO4 ====== Na++HSO4-
熔融
物质的电离
电离方程式书写的注意事项
符合客观事实:
不能随意书写离子符号,要注意正确标注离子所带的电荷及其数目。
质量守恒:
即电离方程式左右两侧元素的种类、原子或原子团的个数相等。
电荷守恒:
即电离方程式左右两侧的正负电荷数相等,溶液呈电中性。
能发生电离的物质(化合物)
溶于水
熔融状态
溶于水
不能发生电离的物质(化合物)
本身不含离子
(含的是分子)
本身含有离子
本身不含离子(含的是分子)
电解质
非电解质
在水中
在熔融状态下
都不发生电离
物质的电离
电离条件
电离条件
物质的电离
电解质
定义:
物质类别:
在水溶液里或熔融状态下能够导电的化合物。
(电解质是本身能电离的化合物)
包括酸、碱、盐、水、活泼金属氧化物。
NaCl、NaOH在水溶液和熔融时都能导电,所以NaCl 、NaOH是电解质。
BaSO4、Al2O3等难溶,在溶液中几乎不导电,但是在熔融状态电离而导电,所以也是电解质。
氯化氢、硫酸融化即液态不导电,但是盐酸、稀硫酸能导电,所以氯化氢、硫酸是电解质。
【例1】CO2、NH3等溶于水能导电,它们是电解质吗?
判断依据:化合物本身能否电离出离子,
CO2水溶液中,CO2与水反应生成H2CO3。离子是由H2CO3电离的,所以CO2不是电解质。与CO2 相似的还有SO2、 SO3 、P2O5等。
结论:二氧化碳、氨气等不是电解质。
氨水中的铵根离子,氢氧根离子是NH3· H2O电离的,所以氨气也不是电解质。
与导电性、溶解性无关。
非电解质
物质的电离
非电解质
非金属氧化物(除H2O)、大多数有机物、部分非金属氢化物,NH3、CH4等
定义:
物质类别:
在水溶液里或熔融状态下都不能够导电的化合物。
不是电解质与非电解质怎么区分呢?
单质:如C、Cu、Zn
混合物:如NaCl溶液、盐酸、氨水
不是电解质,但不是非电解质
不是电解质
非电解质
电解质与化合物之间的关系
电解质是本身能电离的化合物,不是单质也不是混合物;
能导电的物质不一定是电解质;
电解质不一定能导电,电解质必须在水溶液或熔化状态下才能导电;
电解质能导电,但导电的本质是它本身电离出自由移动的离子而导电,不是它与其他物质发生反应后的物质导电。
物质的电离
总结
铜丝、NaCl溶液和盐酸都能导电,所以三者都是电解质( )
NH3、CO2的水溶液能导电,所以NH3、CO2均是电解质( )
NaCl是电解质,所以NaCl固体可以导电( )
BaSO4难溶于水,其水溶液几乎不导电,所以BaSO4不是电解质( )
×
×
×
×
【例1】请同学们认真思考并判断正误:
判断电解质的思维流程
判断物质是否属于化合物,单质、混合物一定不是电解质
第一步
第二步
第三步
判断化合物在水溶液里或熔融状态下能否导电,至少其一导电为电解质
根据经验:酸、碱、盐都是电解质,非金属氧化物都不是电解质
物质的电离
用水将一组化合物溶解,制成电解质饮料。此饮料可补充人体新陈代谢的消耗。其电解质成分有钠离子、钾离子、镁离子、氯离子、硫酸根离子、磷酸根离子、柠檬酸盐、蔗糖、葡萄糖、维生素C及维生素B6。
电解质饮料
1.下列说法正确的是( )
A.铜、石墨均能导电,所以它们都是电解质
B.氨、二氧化碳的水溶液都能导电,所以它们都是电解质
C.液态氯化氢、固体氯化钠都不能导电,所以它们都是非电解质
D.蔗糖、酒精在水溶液里或熔融状态下都不能导电,所以它们都是非电解质
D
选项 A B C D
电解质 Fe NaCl溶液 CaCO3 HNO3
非电解质 C12H22O11(蔗糖) BaSO4 SO2 H2O
2.下列各组关于电解质、非电解质的归类,完全正确的是( )
C
3.现有中学化学中常见的八种物质:
①固体氢氧化钡 ②石墨碳棒 ③纯醋酸 ④液态氯化氢 ⑤硫酸氢钾固体 ⑥熔融氯化钠 ⑦蔗糖 ⑧碳酸钠粉末
请用序号填空:
(1)上述状态下可导电的是 ,属于非电解质的是 。
(2)属于酸的是 ,属于碱的是 ,属于盐的是 。
(3)写出①④⑤⑧在水溶液中的电离方程式:
① ; ④ ;
⑤ ; ⑧ 。
②⑥
⑦
③④
①
⑤⑥⑧
Ba(OH)2===Ba2++2OH-
HCl=== H++Cl-
KHSO4===K++H++SO42-
Na2CO3===2Na++CO32-
4.判断下列物质在水溶液中的电离方程式是否正确,不正确的加以改正。
_______________________________
(2)Ba(OH)2===Ba2++(OH-)2
____________________________________
__________________________________
______________________________________
不正确;改正:Ba(OH)2===Ba2++2OH-
5.某一化学兴趣小组的同学在家中进行实验,按照图A连接好线路,发现灯泡不亮;按照图B连接好线路,发现灯泡亮了。由此得出的以下结论正确的是( )
A.硝酸钾固体不是电解质
B.硝酸钾溶液是电解质
C.硝酸钾在水溶液中电离出了可以自由移动的离子
D.在硝酸钾溶液中,水电离出了大量的离子
C
第二节 离子反应
第2课时
电离
电解质
定义:化合物在水分子作用下或受热熔化时,离解成能自由移动的离子的过程
在水溶液里或熔融状态下能够导电的化合物
电离方程式
表示电解质电离的式子
书写要求:左边写电解质的化学式,右边写电离出的离子
THANKS
谢谢聆听
