第三节羧酸酯课件
图片预览







文档简介
课件61张PPT。高二化学选修5
第三章烃的含氧衍生物第三节 羧酸 酯一、羧酸
1.概念:由 与 相连构成的化合物。
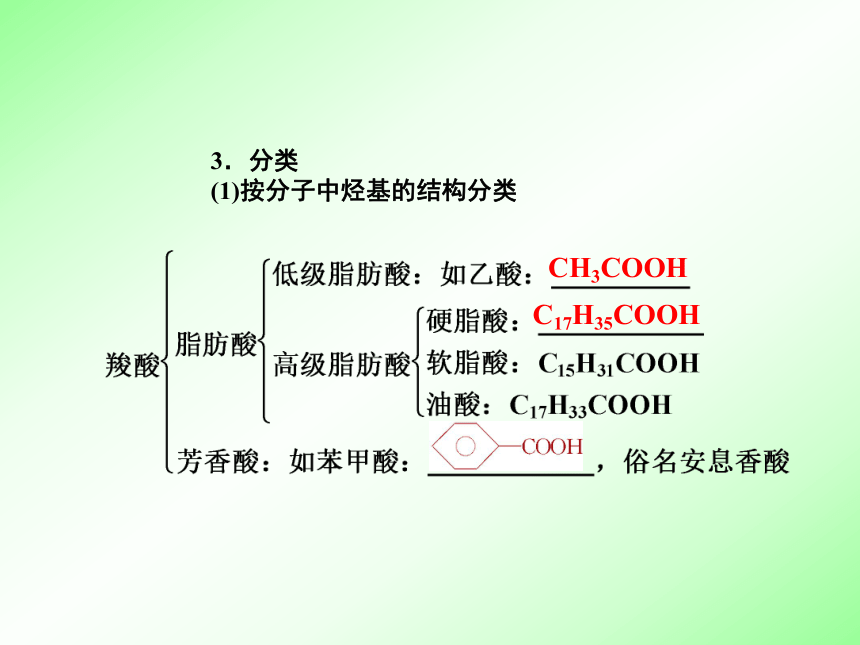
2.通式:R —COOH ,官能团 。基础知识梳理烃基羧基—COOH3.分类
(1)按分子中烃基的结构分类CH3COOHC17H35COOH(2)按分子中羧基的数目分类4.通性:羧酸分子中都含有官能团 ,因此都具有 性,都能发生酯化反应。羧基酸二、乙酸
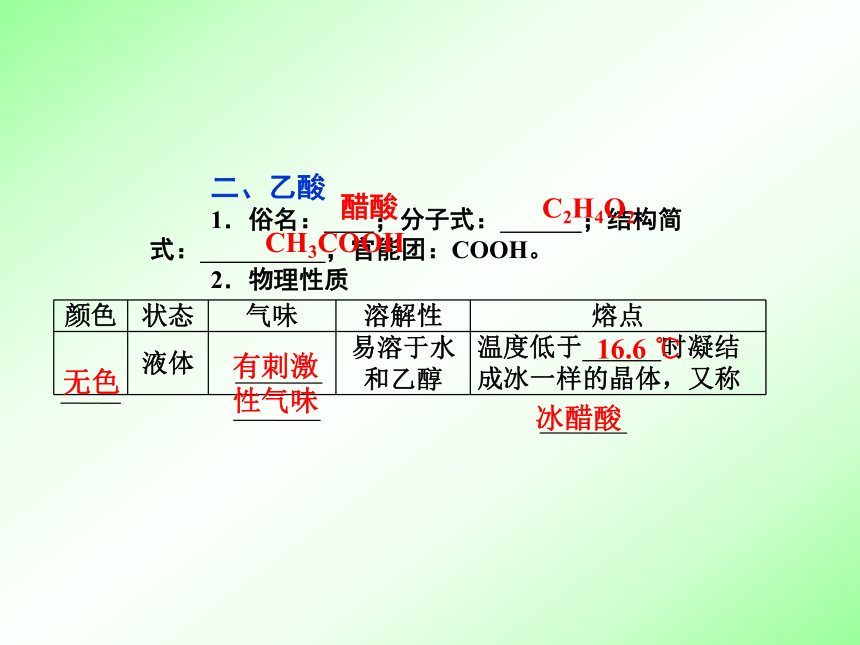
1.俗名: ;分子式: ;结构简式: ,官能团:COOH。
2.物理性质醋酸C2H4O2CH3COOH有刺激性气味无色16.6 ℃冰醋酸3.化学性质
(1)酸性:一元 酸,比碳酸酸性 。电离方程式为CH3COOH??CH3COO-+H+;
乙酸具有酸的通性:
①能使紫色石蕊试液 ;
②能与活泼金属(如Na)反应放出 :
2CH3COOH+2Na―→2CH3COONa+H2↑;
弱强变红氢气③能与碱(如NaOH)发生 反应:
CH3COOH+OH-―→CH3COO-+H2O;
④能与 氧化物(如MgO)反应:
2CH3COOH+MgO―→Mg(CH3COO)2+H2O;
⑤能与比醋酸酸性弱的弱酸盐反应,如碳酸钠与醋酸反应:
。
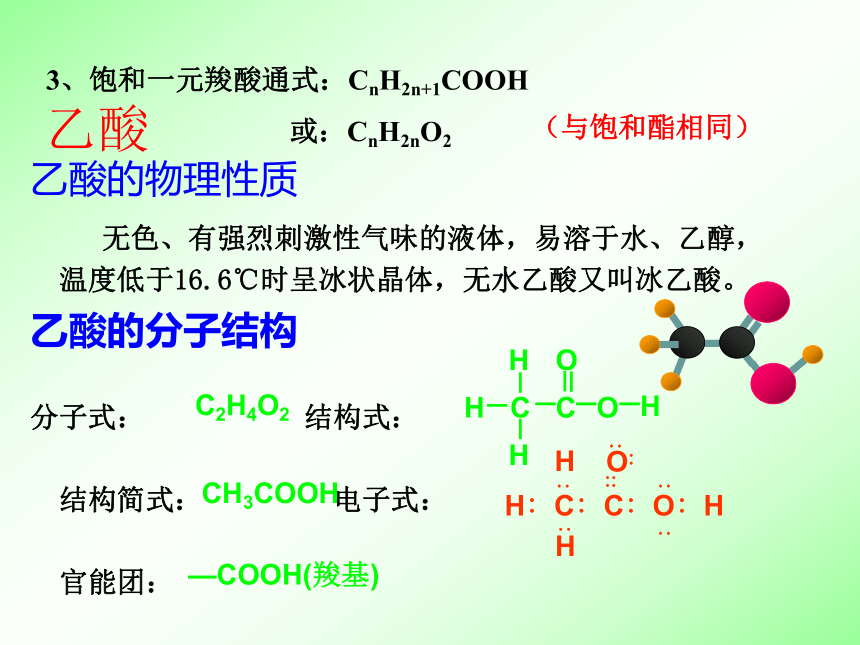
中和碱性2CH3COOH+CO32-―→2CH3COO-+CO2↑+H2O3、饱和一元羧酸通式:CnH2n+1COOH
或:CnH2nO2(与饱和酯相同)乙酸 乙酸的物理性质
无色、有强烈刺激性气味的液体,易溶于水、乙醇,
温度低于16.6℃时呈冰状晶体,无水乙酸又叫冰乙酸。
乙酸的分子结构
分子式: 结构式:
结构简式: 电子式:
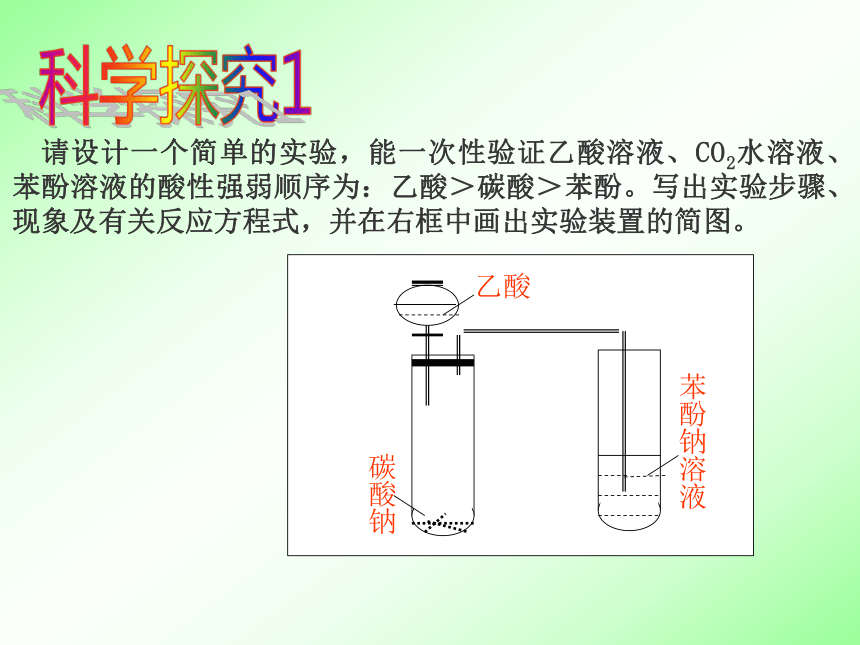
官能团: C2H4O2CH3COOH—COOH(羧基) 无水乙酸又称冰醋酸(熔点16.6℃)。在室温较低时,无水乙酸就会凝结成像冰一样的晶体。请简单说明在实验中若遇到这种情况时,你将如何从试剂瓶中取出无水乙酸。 思考 认识乙酸的核磁共振氢谱,说明两个吸收峰的意义及峰的面积比探究 请设计一个简单的实验,能一次性验证乙酸溶液、CO2水溶液、苯酚溶液的酸性强弱顺序为:乙酸>碳酸>苯酚。写出实验步骤、现象及有关反应方程式,并在右框中画出实验装置的简图。
科学探究1乙酸的酯化反应【思考】1.浓硫酸的作用?
催化剂和吸水剂
2.饱和碳酸钠溶液的作用?
吸收乙醇和乙酸
减小酯在水中的溶解度
3.导管不伸入液面下的原因?
防止碳酸钠溶液倒吸实验现象:饱和碳酸钠溶液的液面上有透明的油状液体,并可闻到香味。乙酸乙酯复习乙酸乙酯的制取:1818科学探究2乙酸的酯化反应
酸和醇作用生成酯和水的反应
浓硫酸、加热
酸脱羟基醇脱氢酯化
反应概念
条件
规律(2)酯化反应(或取代反应)
①含义:酸和醇作用生成 的反应。
②断键方式:酸脱 ,醇脱 。
③乙酸与乙醇的反应:酯和水羟基氢三、酯2.酯的性质
酯一般难溶于水,主要化学性质是易发生 反应,其条件是 或 ,有关化学方程式:
(1)酸性条件水解酸催化碱催化(2)碱性条件思考醇、酚、羧酸的结构中均有—OH,可分别称之为“醇羟基”、“酚羟基”和“羧羟基”。由于这些与—OH所连的基团不同,—OH受相连基团的影响就不同。故羟基上的氢原子的活性也就不同,表现在性质上也相差较大,可比较如下:
课堂互动讲练结论:羟基的活性:羧酸>酚>醇。1.羧酸都是弱酸,不同的羧酸酸性不同,但低级羧酸都比碳酸的酸性强。几种简单的羧酸的酸性关系为甲酸>苯甲酸>乙酸>丙酸。乙酸与H2SO3、H2CO3、HF等几种弱电解质的酸性关系为H2SO3>HF>CH3COOH>H2CO3。
2.低级羧酸才会使紫色石蕊试液变红,醇、酚、高级脂肪酸不会使紫色石蕊试液变红。某有机物的结构简式如图【思路点拨】 解决本题要注意以下三点:
(1)反应物中的官能团及官能团的变化情况。
(2)氢原子的活泼性顺序为:—COOH>酚羟基>醇羟基。
(3)所选试剂和不同官能团上的氢原子反应情况不同。
【答案】 NaHCO3 NaOH或Na2CO3 Na互动探究1.下列物质中最难电离出H+的是( )
A.CH3COOH B.C2H5OH
C.H2O D.C6H5OH
解析:选B。四种物质电离出H+的顺序为:CH3COOH>C6H5OH>H2O>C2H5OH。1.反应机理
羧酸与醇发生酯化反应时,一般是羧酸分子中的羟基与醇分子中羟基上的氢原子结合生成水,其余部分结合生成酯,用示踪原子法可以证明。1.所有的酯化反应,条件均为浓H2SO4、加热;酯化反应为可逆反应,书写方程式时用“??”。
2.利用自身酯化或相互酯化生成环酯的结构特点以确定有机物中羟基位置。下图中A、B、C、D、E、F、G均为有机化合物。根据上图回答问题:
(1)D、F的化学名称是________、________。
(2)写出下列反应的化学方程式,并注明反应类型
②____________________________,________ ________________________________________________________________;
④____________________________,________ _______________________________________________________________。(3)A的结构简式是________,1 mol A与足量的NaOH溶液反应会消耗________mol NaOH。
(4)符合下列3个条件的B的同分异构体的数目有________个。
①含有邻二取代苯环结构
②与B有相同官能团
③不与FeCl3溶液发生显色反应2.某有机化合物X(C7H8O)与另一有机化合物Y发生如下反应生成化合物Z(C11H14O2)。(1)X是下列化合物之一,已知X不能与FeCl3溶液发生显色反应,则X是________(填标号字母)。(2)Y的分子式是__________________,可能的结构简式是______________________和__________________。
(3)Y有多种同分异构体,其中一种同分异构体E发生银镜反应后,其产物经氧化可得到F(C4H8O3)。F可发生如下反应:该反应的类型是________,E的结构简式是________。(4)若Y与E具有相同的碳链,则Z的结构简式为______________________。
解析:(1)符合X分子式C7H8O的有选项B和D,B中—OH直接连在苯环上,属于酚,能与FeCl3溶液发生显色反应,所以选D。(3)能发生银镜反应的Y的同分异构体E可能为甲酸丙酯、甲酸异丙酯、CH2OHCH2CH2CHO、CH3CHOHCH2CHO、CH3CH2CHOHCHO等多种有机物。此处可以通过F来确定E,已知F可以脱水生成无支链的五元环酯,则F为CH2OHCH2CH2COOH,则能被氧化成F的E的结构简式应为CH2OHCH2CH2CHO。
答案:(1)D
(2)C4H8O2 CH3CH2CH2COOH
CH3CH(CH3)COOH
(3)酯化反应 CH2OHCH2CH2CHO1.反应原料:乙醇、乙酸、浓H2SO4、饱和Na2CO3溶液。3.反应装置:试管、酒精灯、导管、铁架台等。
4.实验方法:在一支试管里先加入3 mL乙醇,然后一边摇动,一边慢慢地加入2 mL浓H2SO4和2 mL冰醋酸,按如图连接好装置。用酒精灯小心均匀地加热试管3 min~5 min,产生的蒸气经导管通到饱和Na2CO3溶液的液面上,此时可以观察到有透明的油状液体浮在液面上。取下盛有饱和Na2CO3溶液的试管,并停止加热,振荡盛有饱和Na2CO3溶液的试管后静置,待溶液分层后,可观察到上层的透明油状液体乙酸乙酯,并可闻到果香气味。 5.注意事项
(1)实验中浓硫酸起催化剂和吸水剂作用。
(2)盛反应混合液的试管要向上倾斜约45°,主要目的是增大反应混合液的受热面积。
(3)导管应较长,除导气外还兼起冷凝作用。导管末端只能接近饱和Na2CO3溶液的液面而不能伸入液面以下,目的是防止受热不均发生倒吸。(4)实验中应小心均匀加热使液体保持微沸,这样有利于产物的生成和蒸出,以提高乙酸乙酯的产率。
(5)饱和Na2CO3溶液的作用是吸收乙酸,溶解乙醇,冷凝酯蒸气且减小酯在水中的溶解度,以利于分层析出。
(6)不能用NaOH溶液代替饱和Na2CO3溶液,因乙酸乙酯在NaOH存在时易水解,几乎得不到乙酸乙酯。
可用图示装置制取少量乙酸乙酯(酒精灯等在图中均已略去)。请填空:(1)试管a中需加入浓硫酸、冰醋酸和乙醇各2 mL,正确的加入顺序及操作是_______________ _______________________________________________________________________________________________________。(2)为防止a中的液体在实验时发生暴沸,在加热前应采取的措施是__________________ _______________________________________________________________________________________________________________________。
(3)实验中加热试管a的目的是:
①________________________________;
②_________________________________。
(4)试管b中加有饱和Na2CO3溶液,其作用是______________________________________ ___________________________________。
(5)反应结束后,振荡试管b,静置。观察到的现象是_____________________________。
【思路点拨】 解决本题要注意以下三点:
(1)浓硫酸和其他试剂混合时的添加顺序。
(2)酯化反应的条件和反应限度。
(3)产物的净化。
【解析】 (1)浓H2SO4溶于水会放出大量热,因此应先加入乙醇,然后边摇动试管边慢慢加入浓H2SO4,最后再加入冰醋酸。
(2)为了防止反应时发生暴沸,在加热前应在试管中加入几粒沸石(或碎瓷片)。
(3)加热试管可提高反应速率,同时可将乙酸乙酯及时蒸出,有利于提高乙酸乙酯的产率。(4)乙酸乙酯在饱和Na2CO3溶液中的溶解度很小,而蒸出的乙酸和乙醇在其中的溶解度很大,因此便于分离出乙酸乙酯。
(5)试管内液体分层,上层为透明的油状液体。
【答案】 (1)先加入乙醇,然后边摇动试管边慢慢加入浓H2SO4,再加入冰醋酸
(2)在试管中加入几粒沸石(或碎瓷片)
(3)①加快反应速率
②及时将产物乙酸乙酯蒸出,有利于平衡向生成乙酸乙酯的方向移动
(4)吸收随乙酸乙酯蒸出的乙酸和乙醇,降低酯的溶解度
(5)b中的液体分层,上层是透明的油状液体(1)在乙酸和乙醇发生酯化反应的过程中,浓H2SO4起到了哪些作用?在乙醇制乙烯的过程中浓H2SO4起什么作用?
(2)如何除去乙酸乙酯中含有的杂质乙酸和乙醇?
【提示】 (1)在酯化过程中,浓H2SO4作催化剂和吸水剂。在乙醇制乙烯的过程中浓H2SO4起催化作用和脱水作用。
(2)乙酸乙酯难溶于饱和Na2CO3溶液,乙酸由于与Na2CO3反应而溶解,乙醇易溶于Na2CO3溶液。因此将样品加入分液漏斗中,再加入饱和Na2CO3溶液后振荡分液即可。互动探究3.实验室合成乙酸乙酯的步骤如下:在圆底烧瓶内加入乙醇、浓硫酸和乙酸,瓶口竖直安装通有冷却水的冷凝管(使反应混合物的蒸气冷凝为液体流回烧瓶内),加热回流一段时间后换成蒸馏装置进行蒸馏,得到含有乙醇、乙酸和水的乙酸乙酯粗产品。请回答下列问题:
(1)在烧瓶中除了加入乙醇、浓硫酸和乙酸外,还应放入________,目的是_____________ _______________________________________。
(2)反应中加入过量的乙醇,目的是_______ _______________________________________。(3)现拟分离含乙酸、乙醇和水的乙酸乙酯粗产品,如图是分离操作步骤流程图(图中圆括号内为适当的试剂,方括号内为适当的分离方法)。试剂a是 ,试剂b是 ;分离方法①是 ,分离方法②是 ,分离方法③是 。
(4)在得到的A中加入无水碳酸钠粉末,振荡,目的是______________________________ _______________________________________。
答案:(1)沸石或碎瓷片 防止暴沸
(2)提高乙酸的转化率
(3)饱和碳酸钠溶液 稀硫酸 分液 蒸馏 蒸馏
(4)除去乙酸乙酯中的水分
第三章烃的含氧衍生物第三节 羧酸 酯一、羧酸
1.概念:由 与 相连构成的化合物。
2.通式:R —COOH ,官能团 。基础知识梳理烃基羧基—COOH3.分类
(1)按分子中烃基的结构分类CH3COOHC17H35COOH(2)按分子中羧基的数目分类4.通性:羧酸分子中都含有官能团 ,因此都具有 性,都能发生酯化反应。羧基酸二、乙酸
1.俗名: ;分子式: ;结构简式: ,官能团:COOH。
2.物理性质醋酸C2H4O2CH3COOH有刺激性气味无色16.6 ℃冰醋酸3.化学性质
(1)酸性:一元 酸,比碳酸酸性 。电离方程式为CH3COOH??CH3COO-+H+;
乙酸具有酸的通性:
①能使紫色石蕊试液 ;
②能与活泼金属(如Na)反应放出 :
2CH3COOH+2Na―→2CH3COONa+H2↑;
弱强变红氢气③能与碱(如NaOH)发生 反应:
CH3COOH+OH-―→CH3COO-+H2O;
④能与 氧化物(如MgO)反应:
2CH3COOH+MgO―→Mg(CH3COO)2+H2O;
⑤能与比醋酸酸性弱的弱酸盐反应,如碳酸钠与醋酸反应:
。
中和碱性2CH3COOH+CO32-―→2CH3COO-+CO2↑+H2O3、饱和一元羧酸通式:CnH2n+1COOH
或:CnH2nO2(与饱和酯相同)乙酸 乙酸的物理性质
无色、有强烈刺激性气味的液体,易溶于水、乙醇,
温度低于16.6℃时呈冰状晶体,无水乙酸又叫冰乙酸。
乙酸的分子结构
分子式: 结构式:
结构简式: 电子式:
官能团: C2H4O2CH3COOH—COOH(羧基) 无水乙酸又称冰醋酸(熔点16.6℃)。在室温较低时,无水乙酸就会凝结成像冰一样的晶体。请简单说明在实验中若遇到这种情况时,你将如何从试剂瓶中取出无水乙酸。 思考 认识乙酸的核磁共振氢谱,说明两个吸收峰的意义及峰的面积比探究 请设计一个简单的实验,能一次性验证乙酸溶液、CO2水溶液、苯酚溶液的酸性强弱顺序为:乙酸>碳酸>苯酚。写出实验步骤、现象及有关反应方程式,并在右框中画出实验装置的简图。
科学探究1乙酸的酯化反应【思考】1.浓硫酸的作用?
催化剂和吸水剂
2.饱和碳酸钠溶液的作用?
吸收乙醇和乙酸
减小酯在水中的溶解度
3.导管不伸入液面下的原因?
防止碳酸钠溶液倒吸实验现象:饱和碳酸钠溶液的液面上有透明的油状液体,并可闻到香味。乙酸乙酯复习乙酸乙酯的制取:1818科学探究2乙酸的酯化反应
酸和醇作用生成酯和水的反应
浓硫酸、加热
酸脱羟基醇脱氢酯化
反应概念
条件
规律(2)酯化反应(或取代反应)
①含义:酸和醇作用生成 的反应。
②断键方式:酸脱 ,醇脱 。
③乙酸与乙醇的反应:酯和水羟基氢三、酯2.酯的性质
酯一般难溶于水,主要化学性质是易发生 反应,其条件是 或 ,有关化学方程式:
(1)酸性条件水解酸催化碱催化(2)碱性条件思考醇、酚、羧酸的结构中均有—OH,可分别称之为“醇羟基”、“酚羟基”和“羧羟基”。由于这些与—OH所连的基团不同,—OH受相连基团的影响就不同。故羟基上的氢原子的活性也就不同,表现在性质上也相差较大,可比较如下:
课堂互动讲练结论:羟基的活性:羧酸>酚>醇。1.羧酸都是弱酸,不同的羧酸酸性不同,但低级羧酸都比碳酸的酸性强。几种简单的羧酸的酸性关系为甲酸>苯甲酸>乙酸>丙酸。乙酸与H2SO3、H2CO3、HF等几种弱电解质的酸性关系为H2SO3>HF>CH3COOH>H2CO3。
2.低级羧酸才会使紫色石蕊试液变红,醇、酚、高级脂肪酸不会使紫色石蕊试液变红。某有机物的结构简式如图【思路点拨】 解决本题要注意以下三点:
(1)反应物中的官能团及官能团的变化情况。
(2)氢原子的活泼性顺序为:—COOH>酚羟基>醇羟基。
(3)所选试剂和不同官能团上的氢原子反应情况不同。
【答案】 NaHCO3 NaOH或Na2CO3 Na互动探究1.下列物质中最难电离出H+的是( )
A.CH3COOH B.C2H5OH
C.H2O D.C6H5OH
解析:选B。四种物质电离出H+的顺序为:CH3COOH>C6H5OH>H2O>C2H5OH。1.反应机理
羧酸与醇发生酯化反应时,一般是羧酸分子中的羟基与醇分子中羟基上的氢原子结合生成水,其余部分结合生成酯,用示踪原子法可以证明。1.所有的酯化反应,条件均为浓H2SO4、加热;酯化反应为可逆反应,书写方程式时用“??”。
2.利用自身酯化或相互酯化生成环酯的结构特点以确定有机物中羟基位置。下图中A、B、C、D、E、F、G均为有机化合物。根据上图回答问题:
(1)D、F的化学名称是________、________。
(2)写出下列反应的化学方程式,并注明反应类型
②____________________________,________ ________________________________________________________________;
④____________________________,________ _______________________________________________________________。(3)A的结构简式是________,1 mol A与足量的NaOH溶液反应会消耗________mol NaOH。
(4)符合下列3个条件的B的同分异构体的数目有________个。
①含有邻二取代苯环结构
②与B有相同官能团
③不与FeCl3溶液发生显色反应2.某有机化合物X(C7H8O)与另一有机化合物Y发生如下反应生成化合物Z(C11H14O2)。(1)X是下列化合物之一,已知X不能与FeCl3溶液发生显色反应,则X是________(填标号字母)。(2)Y的分子式是__________________,可能的结构简式是______________________和__________________。
(3)Y有多种同分异构体,其中一种同分异构体E发生银镜反应后,其产物经氧化可得到F(C4H8O3)。F可发生如下反应:该反应的类型是________,E的结构简式是________。(4)若Y与E具有相同的碳链,则Z的结构简式为______________________。
解析:(1)符合X分子式C7H8O的有选项B和D,B中—OH直接连在苯环上,属于酚,能与FeCl3溶液发生显色反应,所以选D。(3)能发生银镜反应的Y的同分异构体E可能为甲酸丙酯、甲酸异丙酯、CH2OHCH2CH2CHO、CH3CHOHCH2CHO、CH3CH2CHOHCHO等多种有机物。此处可以通过F来确定E,已知F可以脱水生成无支链的五元环酯,则F为CH2OHCH2CH2COOH,则能被氧化成F的E的结构简式应为CH2OHCH2CH2CHO。
答案:(1)D
(2)C4H8O2 CH3CH2CH2COOH
CH3CH(CH3)COOH
(3)酯化反应 CH2OHCH2CH2CHO1.反应原料:乙醇、乙酸、浓H2SO4、饱和Na2CO3溶液。3.反应装置:试管、酒精灯、导管、铁架台等。
4.实验方法:在一支试管里先加入3 mL乙醇,然后一边摇动,一边慢慢地加入2 mL浓H2SO4和2 mL冰醋酸,按如图连接好装置。用酒精灯小心均匀地加热试管3 min~5 min,产生的蒸气经导管通到饱和Na2CO3溶液的液面上,此时可以观察到有透明的油状液体浮在液面上。取下盛有饱和Na2CO3溶液的试管,并停止加热,振荡盛有饱和Na2CO3溶液的试管后静置,待溶液分层后,可观察到上层的透明油状液体乙酸乙酯,并可闻到果香气味。 5.注意事项
(1)实验中浓硫酸起催化剂和吸水剂作用。
(2)盛反应混合液的试管要向上倾斜约45°,主要目的是增大反应混合液的受热面积。
(3)导管应较长,除导气外还兼起冷凝作用。导管末端只能接近饱和Na2CO3溶液的液面而不能伸入液面以下,目的是防止受热不均发生倒吸。(4)实验中应小心均匀加热使液体保持微沸,这样有利于产物的生成和蒸出,以提高乙酸乙酯的产率。
(5)饱和Na2CO3溶液的作用是吸收乙酸,溶解乙醇,冷凝酯蒸气且减小酯在水中的溶解度,以利于分层析出。
(6)不能用NaOH溶液代替饱和Na2CO3溶液,因乙酸乙酯在NaOH存在时易水解,几乎得不到乙酸乙酯。
可用图示装置制取少量乙酸乙酯(酒精灯等在图中均已略去)。请填空:(1)试管a中需加入浓硫酸、冰醋酸和乙醇各2 mL,正确的加入顺序及操作是_______________ _______________________________________________________________________________________________________。(2)为防止a中的液体在实验时发生暴沸,在加热前应采取的措施是__________________ _______________________________________________________________________________________________________________________。
(3)实验中加热试管a的目的是:
①________________________________;
②_________________________________。
(4)试管b中加有饱和Na2CO3溶液,其作用是______________________________________ ___________________________________。
(5)反应结束后,振荡试管b,静置。观察到的现象是_____________________________。
【思路点拨】 解决本题要注意以下三点:
(1)浓硫酸和其他试剂混合时的添加顺序。
(2)酯化反应的条件和反应限度。
(3)产物的净化。
【解析】 (1)浓H2SO4溶于水会放出大量热,因此应先加入乙醇,然后边摇动试管边慢慢加入浓H2SO4,最后再加入冰醋酸。
(2)为了防止反应时发生暴沸,在加热前应在试管中加入几粒沸石(或碎瓷片)。
(3)加热试管可提高反应速率,同时可将乙酸乙酯及时蒸出,有利于提高乙酸乙酯的产率。(4)乙酸乙酯在饱和Na2CO3溶液中的溶解度很小,而蒸出的乙酸和乙醇在其中的溶解度很大,因此便于分离出乙酸乙酯。
(5)试管内液体分层,上层为透明的油状液体。
【答案】 (1)先加入乙醇,然后边摇动试管边慢慢加入浓H2SO4,再加入冰醋酸
(2)在试管中加入几粒沸石(或碎瓷片)
(3)①加快反应速率
②及时将产物乙酸乙酯蒸出,有利于平衡向生成乙酸乙酯的方向移动
(4)吸收随乙酸乙酯蒸出的乙酸和乙醇,降低酯的溶解度
(5)b中的液体分层,上层是透明的油状液体(1)在乙酸和乙醇发生酯化反应的过程中,浓H2SO4起到了哪些作用?在乙醇制乙烯的过程中浓H2SO4起什么作用?
(2)如何除去乙酸乙酯中含有的杂质乙酸和乙醇?
【提示】 (1)在酯化过程中,浓H2SO4作催化剂和吸水剂。在乙醇制乙烯的过程中浓H2SO4起催化作用和脱水作用。
(2)乙酸乙酯难溶于饱和Na2CO3溶液,乙酸由于与Na2CO3反应而溶解,乙醇易溶于Na2CO3溶液。因此将样品加入分液漏斗中,再加入饱和Na2CO3溶液后振荡分液即可。互动探究3.实验室合成乙酸乙酯的步骤如下:在圆底烧瓶内加入乙醇、浓硫酸和乙酸,瓶口竖直安装通有冷却水的冷凝管(使反应混合物的蒸气冷凝为液体流回烧瓶内),加热回流一段时间后换成蒸馏装置进行蒸馏,得到含有乙醇、乙酸和水的乙酸乙酯粗产品。请回答下列问题:
(1)在烧瓶中除了加入乙醇、浓硫酸和乙酸外,还应放入________,目的是_____________ _______________________________________。
(2)反应中加入过量的乙醇,目的是_______ _______________________________________。(3)现拟分离含乙酸、乙醇和水的乙酸乙酯粗产品,如图是分离操作步骤流程图(图中圆括号内为适当的试剂,方括号内为适当的分离方法)。试剂a是 ,试剂b是 ;分离方法①是 ,分离方法②是 ,分离方法③是 。
(4)在得到的A中加入无水碳酸钠粉末,振荡,目的是______________________________ _______________________________________。
答案:(1)沸石或碎瓷片 防止暴沸
(2)提高乙酸的转化率
(3)饱和碳酸钠溶液 稀硫酸 分液 蒸馏 蒸馏
(4)除去乙酸乙酯中的水分
