2022年浙江省普通高中学业水平考试 学考复习——专题9 原子结构与元素周期表(32张PPT)
文档属性
| 名称 | 2022年浙江省普通高中学业水平考试 学考复习——专题9 原子结构与元素周期表(32张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 3.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-07-10 17:05:24 | ||
图片预览









文档简介
(共32张PPT)
组织建设
化学 · 学考
专题9 原子结构与元素周期表
知识点一 原子的构成
2. 原子核外电子排布的基本规律(1~18号元素原子结构)
(1)原子核外电子排布规律
(2)原子核外电子排布的表示方法——原子(或离子)结构示意图
Na的原子结构示意图:
例1 [2021 浙江杭州富阳实验中学月考]C在考古学和医学上有着广泛用途,下列有关 C的说法中正确的是( )
A.质子数为14 B.中子数为6
C.质量数为8 D.电子数为6
D
考查点1 原子的构成
变式 [2021·浙江嘉兴南湖片区期中] 在离子 Rn- 中,共有x个核外电子,R原子的质量数为A,则R原子核内含有的中子数目是( )
A.A-x+n B.A-x C.A-x-n D.A+x-n
A
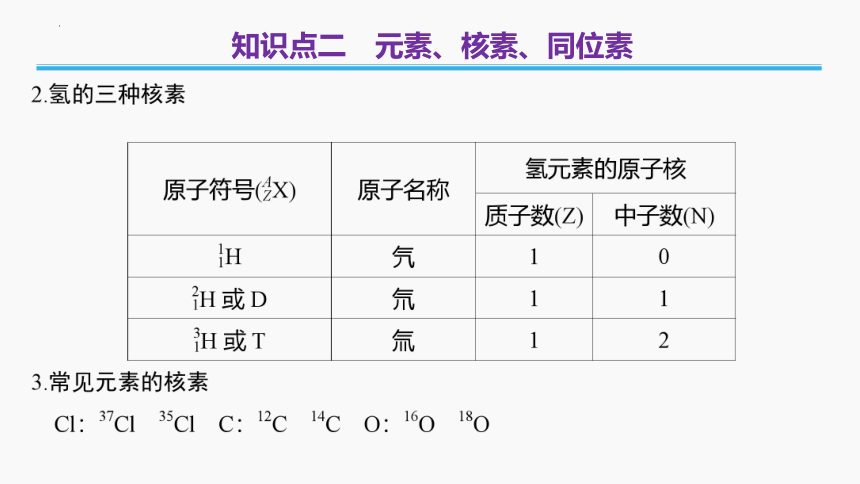
知识点二 元素、核素、同位素
(三)同位素
例2 下列说法正确的是( )
A.C60和石墨互为同素异形体
B.H、D、T是同一种核素
C.14C与 14N中含有相同的中子数
D.1H、2H2、3H+互为同位素
A
考查点2 同位素相关概念辨析
变式 下列说法正确的是( )
A.H与D、16O2与 18O2均互为同位素
B.O、O、O、O互为同素异形体
C.N所含的质子数、电子数和H3O+均相等
D.氢元素有氕、氘、氚三种核素,可以通过化学反应相互转化
C
6.(2021·浙江7月学考)下列说法正确的是( )
A.16O2和18O2互为同位素 B.金刚石和石墨互为同素异形体
C.CH4和HC≡CH互为同系物 D.乙醛和乙醇互为同分异构体
B
7.(2020·浙江7月学考)下列说法正确的是( )
A.1H2和2H2互为同位素 B.O2和O3互为同素异形体
C.淀粉和纤维素互为同分异构体 D.CH4和C3H6互为同系物
B
元素周期表的结构
9.(2021·浙江7月学考)四种短周期元素X、Y、Z和W在元素周期表中的位置如图,其中X原子的最外层电子数是次外层电子数的3倍。下列说法正确的是( )
A.X位于第2周期第ⅣA族
B.Y的非金属性比Z的强
C.Z的原子半径比X的大
D.W的含氧酸一定是强酸
C
X
Y Z W
11.(2021·浙江慈溪中学高一单元测试)美国劳伦斯国家实验室曾在1999年宣布用86Rb离子轰击208Pb靶得到118号元素的一种原子,其质量数为293。其后,反复实验均未能重现118号元素的信号,因此该实验室在2001年8月宣布收回该论文;但是科学家们相信,完整的第七周期包含的元素数目与第六周期相同。若118号元素将来被确认,则下列预测合理的是( )
A.它的中子数是118 B.它是活泼的金属元素
C.它是第八周期元素 D.它的最外层电子数是8
D
12.(2021·浙江杭州7月学考模拟)钾、铷、铯在过量的氧气中燃烧均生成黄色的超氧化物(如KO2)。 下列说法不正确的是( )
A.在450 ℃ 、15 MPa 的压力下, Na 与 O2反应也能够得纯净的 NaO2,常温下Na2O2的稳定性比 NaO2好
B.CsO2具有强氧化性,能与水反应生成O2,其中水作还原剂
C.4KO2+2CO2===2K2CO3+3O2,因此可用来作氧气源
D.KO2与水反应后的溶液呈强碱性
B
四、原子结构与元素的性质
13.(2021·浙江黄金卷)已知锂及其化合物的许多性质与碱金属差异较大,却与镁相似。下面有关锂及其化合物的性质的叙述不正确的是( )
A.锂在过量氧气中燃烧,主要产物是Li2O而不是Li2O2
B.Li2CO3受热很难分解
C.在相同温度下,溶解度Li2CO3小于LiHCO3
D.少量的锂保存在固体石蜡中
B
卤素单质的化学性质
卤素单质与氢气反应的条件及生成物的稳定性
卤素单质 F2 Cl2 Br2 I2
与H2反 应条件 暗处 光照或 点燃 加热至一 定温度 不断加热
氢化物 稳定性 很稳定 较稳定 不如HCl稳定 不稳定、
易分解
14.(2021·浙江义乌4月高一测试)随着卤素原子半径的增大,下列递变规律正确的是( )
A.单质的熔沸点逐渐降低
B.卤素离子的还原性逐渐增强
C.气态氢化物的稳定性逐渐增强
D.单质与氢气化合的能力逐渐增强
B
15.(2021·浙江苍南卫城中学7月学考模拟)革命烈士方志敏同志曾在监狱里用米汤(内含淀粉)给鲁迅先生写过信。鲁迅先生收到信,用一化学试剂一刷后看清了信中内容,可能使用的化学试剂是( )
A.碘化钾 B.溴水
C.碘酒 D.淀粉-KI溶液
C
16.甲、乙、丙三种溶液各含有一种X-(X-为Cl-、Br-或I-)离子,向甲中加淀粉溶液和氯水,则溶液变为橙色,再加乙溶液,颜色无明显变化。则甲、乙、丙依次含有( )
A.Br-、Cl-、I- B.Br-、I-、Cl-
C.I-、Br-、Cl- D.Cl-、I-、Br-
A
硅、磷、硫、氯的非金属性的递变规律
Si P S Cl
最高价氧化 物对应水化 物的酸性 H2SiO3:弱酸 H3PO4:中强酸 H2SO4:强酸 HClO4:强酸
酸性:HClO4>H2SO4>H3PO4>H2SiO3 结论 Si、P、S、Cl的非金属性逐渐增强 五、元素周期律
在第三周期元素中,除稀有气体元素外:
(1)原子半径最小的元素是________(填元素符号)。
(2)金属性最强的元素是________(填元素符号)。
(3)元素化合价最高的是________,其相应的氧化物的化学式为________。最高价氧化物对应水化物酸性最强的是________(用化学式回答,下同)。
(4)元素化合价最低的是________,其相应氢化物的化学式为________。
(5)最高价氧化物对应水化物碱性最强的是________。
(6)氧化物中具有两性的是________。
18.(2021·浙江嘉兴、湖州4月联考)下列排列顺序错误的是( )
A.酸性:H4SiO4<H3PO4<H2SO4<HClO4
B.沸点:HF>HI>HBr>HCl
C.氢化物的稳定性:SiH4>H2S>H2O>HF
D.原子半径:F<O<S<Na
C
19.(2021·浙江苍南卫城中学7月学考模拟)下列关于主族元素性质递变规律叙述不正确的是( )
A.同主族元素从上到下,原子半径越大金属性越强
B.同周期元素从左到右,非金属性逐渐增强
C.同周期元素从左到右,气态氢化物稳定性逐渐增强
D.同主族元素从上到下,原子半径越小越容易失去电子
D
20.(2021·浙江丽水6月学考模拟)有Wn+、Xm+、Ym-、Zn-四种短周期元素的离子(m>n),且W、X、Y、Z四种原子的M电子层上的电子数均为奇数。下列说法中正确的是( )
A.Wn+、Xm+、Ym-、Zn-的离子半径依次减小
B.Y、Z的气态氢化物的热稳定性:YHm>HnZ
C.W、X、Y、Z的最高价氧化物对应的水化物都是强电解质
D.W、X、Y、Z的最高价氧化物对应的水化物的碱性依次减弱,酸性依次增强
D
六、元素周期表和元素周期律的应用
(一)元素周期表的金属区和非金属区
1.分界线的划分:沿着周期表中B、Si、As、Te、At和Al、Ge、Sb、Po之间画一条斜线,斜线的左面是金属元素,右面是非金属元素。
2.分界线附近的元素,既能表现出一定的金属性,又能表现出一定的非金属性,故元素的金属性和非金属性之间没有严格的界线。
21.辨析易错易混
(1)同周期元素,从左到右,原子半径逐渐减小,离子半径也逐渐减小( )
(2)第二周期元素从左到右,最高正价从+1递增到+7( )
(3)元素的原子得电子越多,非金属性越强;失电子越多,金属性越强( )
(4)元素的氧化物对应的水化物酸性越强,非金属性越强;碱性越强,金属性越强( )
(5)HF、HCl、HBr、HI的热稳定性和还原性从左到右依次减弱( )
×
×
×
×
×
(6)SiH4、PH3、H2S、HCl的热稳定性和还原性从左到右依次增强( )
(7)元素的气态氢化物越稳定,非金属性越强,其水溶液的酸性越强,还原性越弱( )
(8)第二周期非金属元素的气态氢化物溶于水后,水溶液均为酸性( )
(9)电子层结构相同的离子,其半径随原子序数的增大而减小( )
(10)在金属和非金属的分界处寻找催化剂和耐高温、耐腐蚀的合金材料( )
(11)制备新型农药材料的元素,应在非金属元素区寻找( )
×
×
×
√
×
√
22.(2020·浙江7月学考)X、Y、Z、Q和R五种短周期元素在周期表中的位置如图所示,其中X原子的次外层电子数是最外层电子数的一半。下列说法不正确的是( )
A.Y的原子半径比Z的小
B.Y元素位于第二周期ⅤA族
C.R元素的气态氢化物比Q元素的稳定
D.与X元素同主族的下一周期元素的单质可
作为半导体材料
A
X Y Z
Q R
23.(2020·浙江1月学考)下图为元素周期表短周期的一部分,其中X元素原子
最外层电子数是次外层的两倍。下列说法不正确的是( )
A.X的原子半径比Y的大
B.Y元素的非金属性比Z强
C.Z元素位于第三周期ⅣA族
D.W的氧化物的水化物是强酸
D
X Y
Z W
24.(2021·浙江1月学考)现有4种短周期主族元素X、Y、Z和Q,原子序数依次
增大,其中Z、Q在同一周期。相关信息如下表。
元素 相关信息
X 最外层电子数是核外电子总数的一半
Y 最高化合价和最低化合价之和为零
Z 单质为淡黃色固体,常存在于火山喷口附近
Q 同周期元素中原子半径最小
下列说法正确的是( )
A.常温时,X单质能与水发生剧烈反应
B.Y与Q可形成YQ4分子
C.Y、Z、Q最高价氧化物对应水化物的酸性依次减弱
D.第4周期且与Q同主族元素的单质在常温常压下呈固态
B
组织建设
化学 · 学考
专题9 原子结构与元素周期表
知识点一 原子的构成
2. 原子核外电子排布的基本规律(1~18号元素原子结构)
(1)原子核外电子排布规律
(2)原子核外电子排布的表示方法——原子(或离子)结构示意图
Na的原子结构示意图:
例1 [2021 浙江杭州富阳实验中学月考]C在考古学和医学上有着广泛用途,下列有关 C的说法中正确的是( )
A.质子数为14 B.中子数为6
C.质量数为8 D.电子数为6
D
考查点1 原子的构成
变式 [2021·浙江嘉兴南湖片区期中] 在离子 Rn- 中,共有x个核外电子,R原子的质量数为A,则R原子核内含有的中子数目是( )
A.A-x+n B.A-x C.A-x-n D.A+x-n
A
知识点二 元素、核素、同位素
(三)同位素
例2 下列说法正确的是( )
A.C60和石墨互为同素异形体
B.H、D、T是同一种核素
C.14C与 14N中含有相同的中子数
D.1H、2H2、3H+互为同位素
A
考查点2 同位素相关概念辨析
变式 下列说法正确的是( )
A.H与D、16O2与 18O2均互为同位素
B.O、O、O、O互为同素异形体
C.N所含的质子数、电子数和H3O+均相等
D.氢元素有氕、氘、氚三种核素,可以通过化学反应相互转化
C
6.(2021·浙江7月学考)下列说法正确的是( )
A.16O2和18O2互为同位素 B.金刚石和石墨互为同素异形体
C.CH4和HC≡CH互为同系物 D.乙醛和乙醇互为同分异构体
B
7.(2020·浙江7月学考)下列说法正确的是( )
A.1H2和2H2互为同位素 B.O2和O3互为同素异形体
C.淀粉和纤维素互为同分异构体 D.CH4和C3H6互为同系物
B
元素周期表的结构
9.(2021·浙江7月学考)四种短周期元素X、Y、Z和W在元素周期表中的位置如图,其中X原子的最外层电子数是次外层电子数的3倍。下列说法正确的是( )
A.X位于第2周期第ⅣA族
B.Y的非金属性比Z的强
C.Z的原子半径比X的大
D.W的含氧酸一定是强酸
C
X
Y Z W
11.(2021·浙江慈溪中学高一单元测试)美国劳伦斯国家实验室曾在1999年宣布用86Rb离子轰击208Pb靶得到118号元素的一种原子,其质量数为293。其后,反复实验均未能重现118号元素的信号,因此该实验室在2001年8月宣布收回该论文;但是科学家们相信,完整的第七周期包含的元素数目与第六周期相同。若118号元素将来被确认,则下列预测合理的是( )
A.它的中子数是118 B.它是活泼的金属元素
C.它是第八周期元素 D.它的最外层电子数是8
D
12.(2021·浙江杭州7月学考模拟)钾、铷、铯在过量的氧气中燃烧均生成黄色的超氧化物(如KO2)。 下列说法不正确的是( )
A.在450 ℃ 、15 MPa 的压力下, Na 与 O2反应也能够得纯净的 NaO2,常温下Na2O2的稳定性比 NaO2好
B.CsO2具有强氧化性,能与水反应生成O2,其中水作还原剂
C.4KO2+2CO2===2K2CO3+3O2,因此可用来作氧气源
D.KO2与水反应后的溶液呈强碱性
B
四、原子结构与元素的性质
13.(2021·浙江黄金卷)已知锂及其化合物的许多性质与碱金属差异较大,却与镁相似。下面有关锂及其化合物的性质的叙述不正确的是( )
A.锂在过量氧气中燃烧,主要产物是Li2O而不是Li2O2
B.Li2CO3受热很难分解
C.在相同温度下,溶解度Li2CO3小于LiHCO3
D.少量的锂保存在固体石蜡中
B
卤素单质的化学性质
卤素单质与氢气反应的条件及生成物的稳定性
卤素单质 F2 Cl2 Br2 I2
与H2反 应条件 暗处 光照或 点燃 加热至一 定温度 不断加热
氢化物 稳定性 很稳定 较稳定 不如HCl稳定 不稳定、
易分解
14.(2021·浙江义乌4月高一测试)随着卤素原子半径的增大,下列递变规律正确的是( )
A.单质的熔沸点逐渐降低
B.卤素离子的还原性逐渐增强
C.气态氢化物的稳定性逐渐增强
D.单质与氢气化合的能力逐渐增强
B
15.(2021·浙江苍南卫城中学7月学考模拟)革命烈士方志敏同志曾在监狱里用米汤(内含淀粉)给鲁迅先生写过信。鲁迅先生收到信,用一化学试剂一刷后看清了信中内容,可能使用的化学试剂是( )
A.碘化钾 B.溴水
C.碘酒 D.淀粉-KI溶液
C
16.甲、乙、丙三种溶液各含有一种X-(X-为Cl-、Br-或I-)离子,向甲中加淀粉溶液和氯水,则溶液变为橙色,再加乙溶液,颜色无明显变化。则甲、乙、丙依次含有( )
A.Br-、Cl-、I- B.Br-、I-、Cl-
C.I-、Br-、Cl- D.Cl-、I-、Br-
A
硅、磷、硫、氯的非金属性的递变规律
Si P S Cl
最高价氧化 物对应水化 物的酸性 H2SiO3:弱酸 H3PO4:中强酸 H2SO4:强酸 HClO4:强酸
酸性:HClO4>H2SO4>H3PO4>H2SiO3 结论 Si、P、S、Cl的非金属性逐渐增强 五、元素周期律
在第三周期元素中,除稀有气体元素外:
(1)原子半径最小的元素是________(填元素符号)。
(2)金属性最强的元素是________(填元素符号)。
(3)元素化合价最高的是________,其相应的氧化物的化学式为________。最高价氧化物对应水化物酸性最强的是________(用化学式回答,下同)。
(4)元素化合价最低的是________,其相应氢化物的化学式为________。
(5)最高价氧化物对应水化物碱性最强的是________。
(6)氧化物中具有两性的是________。
18.(2021·浙江嘉兴、湖州4月联考)下列排列顺序错误的是( )
A.酸性:H4SiO4<H3PO4<H2SO4<HClO4
B.沸点:HF>HI>HBr>HCl
C.氢化物的稳定性:SiH4>H2S>H2O>HF
D.原子半径:F<O<S<Na
C
19.(2021·浙江苍南卫城中学7月学考模拟)下列关于主族元素性质递变规律叙述不正确的是( )
A.同主族元素从上到下,原子半径越大金属性越强
B.同周期元素从左到右,非金属性逐渐增强
C.同周期元素从左到右,气态氢化物稳定性逐渐增强
D.同主族元素从上到下,原子半径越小越容易失去电子
D
20.(2021·浙江丽水6月学考模拟)有Wn+、Xm+、Ym-、Zn-四种短周期元素的离子(m>n),且W、X、Y、Z四种原子的M电子层上的电子数均为奇数。下列说法中正确的是( )
A.Wn+、Xm+、Ym-、Zn-的离子半径依次减小
B.Y、Z的气态氢化物的热稳定性:YHm>HnZ
C.W、X、Y、Z的最高价氧化物对应的水化物都是强电解质
D.W、X、Y、Z的最高价氧化物对应的水化物的碱性依次减弱,酸性依次增强
D
六、元素周期表和元素周期律的应用
(一)元素周期表的金属区和非金属区
1.分界线的划分:沿着周期表中B、Si、As、Te、At和Al、Ge、Sb、Po之间画一条斜线,斜线的左面是金属元素,右面是非金属元素。
2.分界线附近的元素,既能表现出一定的金属性,又能表现出一定的非金属性,故元素的金属性和非金属性之间没有严格的界线。
21.辨析易错易混
(1)同周期元素,从左到右,原子半径逐渐减小,离子半径也逐渐减小( )
(2)第二周期元素从左到右,最高正价从+1递增到+7( )
(3)元素的原子得电子越多,非金属性越强;失电子越多,金属性越强( )
(4)元素的氧化物对应的水化物酸性越强,非金属性越强;碱性越强,金属性越强( )
(5)HF、HCl、HBr、HI的热稳定性和还原性从左到右依次减弱( )
×
×
×
×
×
(6)SiH4、PH3、H2S、HCl的热稳定性和还原性从左到右依次增强( )
(7)元素的气态氢化物越稳定,非金属性越强,其水溶液的酸性越强,还原性越弱( )
(8)第二周期非金属元素的气态氢化物溶于水后,水溶液均为酸性( )
(9)电子层结构相同的离子,其半径随原子序数的增大而减小( )
(10)在金属和非金属的分界处寻找催化剂和耐高温、耐腐蚀的合金材料( )
(11)制备新型农药材料的元素,应在非金属元素区寻找( )
×
×
×
√
×
√
22.(2020·浙江7月学考)X、Y、Z、Q和R五种短周期元素在周期表中的位置如图所示,其中X原子的次外层电子数是最外层电子数的一半。下列说法不正确的是( )
A.Y的原子半径比Z的小
B.Y元素位于第二周期ⅤA族
C.R元素的气态氢化物比Q元素的稳定
D.与X元素同主族的下一周期元素的单质可
作为半导体材料
A
X Y Z
Q R
23.(2020·浙江1月学考)下图为元素周期表短周期的一部分,其中X元素原子
最外层电子数是次外层的两倍。下列说法不正确的是( )
A.X的原子半径比Y的大
B.Y元素的非金属性比Z强
C.Z元素位于第三周期ⅣA族
D.W的氧化物的水化物是强酸
D
X Y
Z W
24.(2021·浙江1月学考)现有4种短周期主族元素X、Y、Z和Q,原子序数依次
增大,其中Z、Q在同一周期。相关信息如下表。
元素 相关信息
X 最外层电子数是核外电子总数的一半
Y 最高化合价和最低化合价之和为零
Z 单质为淡黃色固体,常存在于火山喷口附近
Q 同周期元素中原子半径最小
下列说法正确的是( )
A.常温时,X单质能与水发生剧烈反应
B.Y与Q可形成YQ4分子
C.Y、Z、Q最高价氧化物对应水化物的酸性依次减弱
D.第4周期且与Q同主族元素的单质在常温常压下呈固态
B
同课章节目录
