2021-2022学年高二下学期化学苏教版(2020)选择性必修3-1.2 科学家怎样研究有机物 课件(32张ppt)
文档属性
| 名称 | 2021-2022学年高二下学期化学苏教版(2020)选择性必修3-1.2 科学家怎样研究有机物 课件(32张ppt) |

|
|
| 格式 | pptx | ||
| 文件大小 | 45.7MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 其它版本 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-07-11 09:49:32 | ||
图片预览










文档简介
(共32张PPT)
专题一 认识有机化合物
第二单元 科学家怎样研究有机物
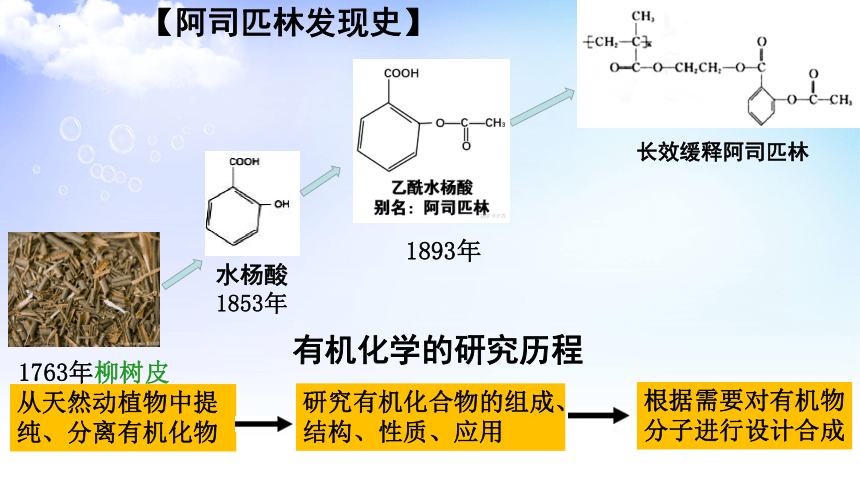
水杨酸
1853年
长效缓释阿司匹林
1763年柳树皮
1893年
从天然动植物中提纯、分离有机化物
研究有机化合物的组成、结构、性质、应用
根据需要对有机物分子进行设计合成
【阿司匹林发现史】
有机化学的研究历程
有机化合物提纯、分离
1、重结晶
(1)原理:利用混合物中各组分在同一溶剂中溶解度不同而相互分离。
(2)条件:
①杂质在所选溶剂中溶解度要很小或很大,易于除去。
②被提纯的有机物在此溶剂中溶解度受温度影响较大。
(3)范围:常用于分离、提纯固体有机物。
(4)仪器:烧杯、玻璃棒、蒸发皿、酒精灯。
2、萃取
(1)液液萃取
①原理:利用物质在两种互不相溶的溶剂中的溶解度不同、将物质从一种溶剂转移到另一种溶剂中。
②条件:原溶剂与萃取剂互不相溶,物质在两种溶剂中溶解度相差较大。
③范围:提纯液体有机物。
④仪器:分液漏斗。
萃取碘水
(2)固液萃取
①原理:利用溶剂使固体物料中可溶性物质溶解于其中而加以分离。
②范围:提纯固体物料中的有机物。
③常用溶剂:水、醇或其他有机溶剂。
3、蒸馏
(1)原理:利用混合物中各组分的沸点不同而进行分离。
(2)条件:
①该有机物热稳定性强。
②一般有机物与杂质的沸点应相差30℃以上。
(3)范围:分离、提纯互溶液态有机物。
(4)仪器:酒精灯、蒸馏烧瓶、温度计、冷凝管、牛角管、锥形瓶。
有关蒸馏的注意事项:
1.蒸馏时,在蒸馏烧瓶中需要加入沸石,防止暴沸。
2.蒸馏乙醇水溶液无法得到无水乙醇。
乙醇和水
95.5%乙醇
直接蒸馏
无水乙醇
加入生石灰,
再蒸馏
有机化合物组成的研究
组成元素分析
最简式
分子式
分子结构
有机化合物常含有C、H、O、卤素(Cl、Br、I等)、N、S、P等元素。
一、定性分析元素组成
思考1:如何设计实验证明有机物中含C元素和H元素呢?
有机物A
燃烧
H2O
CO2
H
C
+ O2
思考:如果有机物燃烧只生成CO2、H2O,该有机物中一定只含有C、H元素吗?
除C、H元素外,可能还有O元素
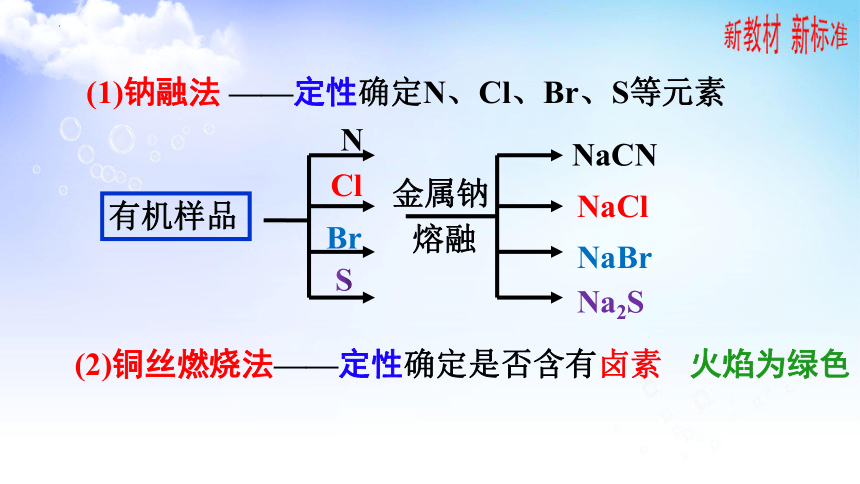
(1)钠融法 ——定性确定N、Cl、Br、S等元素
有机样品
金属钠
熔融
NaCN
NaCl
NaBr
Na2S
(2)铜丝燃烧法——定性确定是否含有卤素
火焰为绿色
N
Cl
Br
S
(3)元素分析仪
原理:在不断通入氧气流的条件下,把样品加热到950℃~1200℃,使之充分燃烧,再对燃烧产物进行自动分析。
所需样品量小,分析速度快,可以同时对C、H、O、S等多种元素进行分析,与计算机相连,可进行数据的存储和统计分析,并可根据要求生产各种形式的分析报告。
李比希法(定量分析):1831年,李比希最早提出测定有机物中C、H元素质量分数的方法。
二、定量分析有机物中各元素的质量分数
将有机物不充分燃烧生成的CO充分氧化成CO2
如图所示的是用燃烧法确定有机物分子式的常用装置。现准确称取3.0g样品(只含C、H、O三种元素中的两种或三种),经燃烧后A管增重4.4g,B管增重1.8g。
实验方案设计
每个实验装置的作用是什么,该实验装置的连接顺序是什么?
得出:n(H)=0.2mol n(C)=0.1mol
无水CaCl2
碱石灰
1.8g
4.4g
O2
3 g
N(C) : N(H) : N(O)=1:2:1
最简式(实验式):
CH2O
数据处理
n(H2O)=0.1mol
n(CO2)=0.1mol
CH2O
最简式(实验式)
已知:A的相对分子质量为60,求A的分子式。
设分子式为(CH2O)n
C2H4O2
分子式
?
相对分子质量
思考:如何确定有机物的相对分子质量?
1.标态密度法:
根据标准状况下气体的密度,求算相对分子质量:
公式:M=22.4×ρ
2.相对密度法:
根据气体A相对于气体B的相对密度,求算相对分子质量:
公式:MA=D×MB
3.混合物的平均相对分子质量:
=
例1、实验测得某碳氢化合物A中含碳80%,含氢20%,又测得该化合物对氢气的相对密度为15。求该化合物的分子式。
三、有机化合物结构的研究
德国化学家李比希(1803~1873)
1、有机物中的基团
有机化合物由“基”组成,有机物中的基团具有不同的结构和性质,它们是不带电的。
如: 羧基(—COOH ) 羟基(—OH)
氨基(—NH2 ) 醛基(—CHO )
烃基(—R)等 。
2、有机化合物结构的分析方法
(1)红外光谱法:利用有机物分子中不同基团的特征吸收频率不同,测试并记录有机物对一定波长范围的红外光谱吸收情况。
应用:初步判断该有机物中含有那些基团。
乙醇的红外吸收光谱图
(2)核磁共振:
原理:有机物分子中的H原子核所处的化学环境(附近的基团)不同,代表核磁特性的峰在核磁共振谱图中横坐标(化学位移)的位置也就不同。
应用:测定有机物分子中氢原子类型
分析:特征峰的数目=氢原子种类数
O
H
C
C
H
H
H
H
H
O
C
C
H
H
H
H
H
H
H
分子中有1种氢原子
分子中有3种氢原子
δ/ppm
δ/ppm
例如:分子式为C2H6O的有机物的核磁共振谱图
等效氢原子法(又称对称法)
分子中等效氢原子有如下情况:
①分子中同一个碳原子上连接的氢原子等效。
②同一个碳原子上所连接的甲基上的氢原子等效。
③分子中处于对称位置上的氢原子是等效的。
问题探究:下列有机物中有几种H原子以及个数之比?
CH3-CH-CH3
CH3
CH3-C-CH3
CH3
CH3
CH3-CH2-CH-CH3
CH3
CH3-CH2-OH
① CH3CH3
② CH3OH
练习:判断下列核磁共振图谱对应哪种有机物?
A
B
应用:测定相对分子质量
(3)质谱法:
原理:用高能电子束轰击有机物分子,使之分离成带电的“碎片",这些不同离子具有不同的质量,质量不同的离子在磁场作用下达到检测器的时间有差异,其结果被记录为质谱图。
分析:质核比的最大值=分子的相对分子质量
乙醇的质谱图
有 机 化 学 反 应 的 研 究
三、有机化学反应的研究
1.自由基反应
2.同位素示踪法
3.离子型反应
HBr→H++Br-
CH2=CH2+H+→CH3CH2
+
CH3CH2+Br-→CH3CH2Br
+
专题一 认识有机化合物
第二单元 科学家怎样研究有机物
水杨酸
1853年
长效缓释阿司匹林
1763年柳树皮
1893年
从天然动植物中提纯、分离有机化物
研究有机化合物的组成、结构、性质、应用
根据需要对有机物分子进行设计合成
【阿司匹林发现史】
有机化学的研究历程
有机化合物提纯、分离
1、重结晶
(1)原理:利用混合物中各组分在同一溶剂中溶解度不同而相互分离。
(2)条件:
①杂质在所选溶剂中溶解度要很小或很大,易于除去。
②被提纯的有机物在此溶剂中溶解度受温度影响较大。
(3)范围:常用于分离、提纯固体有机物。
(4)仪器:烧杯、玻璃棒、蒸发皿、酒精灯。
2、萃取
(1)液液萃取
①原理:利用物质在两种互不相溶的溶剂中的溶解度不同、将物质从一种溶剂转移到另一种溶剂中。
②条件:原溶剂与萃取剂互不相溶,物质在两种溶剂中溶解度相差较大。
③范围:提纯液体有机物。
④仪器:分液漏斗。
萃取碘水
(2)固液萃取
①原理:利用溶剂使固体物料中可溶性物质溶解于其中而加以分离。
②范围:提纯固体物料中的有机物。
③常用溶剂:水、醇或其他有机溶剂。
3、蒸馏
(1)原理:利用混合物中各组分的沸点不同而进行分离。
(2)条件:
①该有机物热稳定性强。
②一般有机物与杂质的沸点应相差30℃以上。
(3)范围:分离、提纯互溶液态有机物。
(4)仪器:酒精灯、蒸馏烧瓶、温度计、冷凝管、牛角管、锥形瓶。
有关蒸馏的注意事项:
1.蒸馏时,在蒸馏烧瓶中需要加入沸石,防止暴沸。
2.蒸馏乙醇水溶液无法得到无水乙醇。
乙醇和水
95.5%乙醇
直接蒸馏
无水乙醇
加入生石灰,
再蒸馏
有机化合物组成的研究
组成元素分析
最简式
分子式
分子结构
有机化合物常含有C、H、O、卤素(Cl、Br、I等)、N、S、P等元素。
一、定性分析元素组成
思考1:如何设计实验证明有机物中含C元素和H元素呢?
有机物A
燃烧
H2O
CO2
H
C
+ O2
思考:如果有机物燃烧只生成CO2、H2O,该有机物中一定只含有C、H元素吗?
除C、H元素外,可能还有O元素
(1)钠融法 ——定性确定N、Cl、Br、S等元素
有机样品
金属钠
熔融
NaCN
NaCl
NaBr
Na2S
(2)铜丝燃烧法——定性确定是否含有卤素
火焰为绿色
N
Cl
Br
S
(3)元素分析仪
原理:在不断通入氧气流的条件下,把样品加热到950℃~1200℃,使之充分燃烧,再对燃烧产物进行自动分析。
所需样品量小,分析速度快,可以同时对C、H、O、S等多种元素进行分析,与计算机相连,可进行数据的存储和统计分析,并可根据要求生产各种形式的分析报告。
李比希法(定量分析):1831年,李比希最早提出测定有机物中C、H元素质量分数的方法。
二、定量分析有机物中各元素的质量分数
将有机物不充分燃烧生成的CO充分氧化成CO2
如图所示的是用燃烧法确定有机物分子式的常用装置。现准确称取3.0g样品(只含C、H、O三种元素中的两种或三种),经燃烧后A管增重4.4g,B管增重1.8g。
实验方案设计
每个实验装置的作用是什么,该实验装置的连接顺序是什么?
得出:n(H)=0.2mol n(C)=0.1mol
无水CaCl2
碱石灰
1.8g
4.4g
O2
3 g
N(C) : N(H) : N(O)=1:2:1
最简式(实验式):
CH2O
数据处理
n(H2O)=0.1mol
n(CO2)=0.1mol
CH2O
最简式(实验式)
已知:A的相对分子质量为60,求A的分子式。
设分子式为(CH2O)n
C2H4O2
分子式
?
相对分子质量
思考:如何确定有机物的相对分子质量?
1.标态密度法:
根据标准状况下气体的密度,求算相对分子质量:
公式:M=22.4×ρ
2.相对密度法:
根据气体A相对于气体B的相对密度,求算相对分子质量:
公式:MA=D×MB
3.混合物的平均相对分子质量:
=
例1、实验测得某碳氢化合物A中含碳80%,含氢20%,又测得该化合物对氢气的相对密度为15。求该化合物的分子式。
三、有机化合物结构的研究
德国化学家李比希(1803~1873)
1、有机物中的基团
有机化合物由“基”组成,有机物中的基团具有不同的结构和性质,它们是不带电的。
如: 羧基(—COOH ) 羟基(—OH)
氨基(—NH2 ) 醛基(—CHO )
烃基(—R)等 。
2、有机化合物结构的分析方法
(1)红外光谱法:利用有机物分子中不同基团的特征吸收频率不同,测试并记录有机物对一定波长范围的红外光谱吸收情况。
应用:初步判断该有机物中含有那些基团。
乙醇的红外吸收光谱图
(2)核磁共振:
原理:有机物分子中的H原子核所处的化学环境(附近的基团)不同,代表核磁特性的峰在核磁共振谱图中横坐标(化学位移)的位置也就不同。
应用:测定有机物分子中氢原子类型
分析:特征峰的数目=氢原子种类数
O
H
C
C
H
H
H
H
H
O
C
C
H
H
H
H
H
H
H
分子中有1种氢原子
分子中有3种氢原子
δ/ppm
δ/ppm
例如:分子式为C2H6O的有机物的核磁共振谱图
等效氢原子法(又称对称法)
分子中等效氢原子有如下情况:
①分子中同一个碳原子上连接的氢原子等效。
②同一个碳原子上所连接的甲基上的氢原子等效。
③分子中处于对称位置上的氢原子是等效的。
问题探究:下列有机物中有几种H原子以及个数之比?
CH3-CH-CH3
CH3
CH3-C-CH3
CH3
CH3
CH3-CH2-CH-CH3
CH3
CH3-CH2-OH
① CH3CH3
② CH3OH
练习:判断下列核磁共振图谱对应哪种有机物?
A
B
应用:测定相对分子质量
(3)质谱法:
原理:用高能电子束轰击有机物分子,使之分离成带电的“碎片",这些不同离子具有不同的质量,质量不同的离子在磁场作用下达到检测器的时间有差异,其结果被记录为质谱图。
分析:质核比的最大值=分子的相对分子质量
乙醇的质谱图
有 机 化 学 反 应 的 研 究
三、有机化学反应的研究
1.自由基反应
2.同位素示踪法
3.离子型反应
HBr→H++Br-
CH2=CH2+H+→CH3CH2
+
CH3CH2+Br-→CH3CH2Br
+
同课章节目录
