化学键
图片预览








文档简介
课件48张PPT。第一章 物质结构 元素周期表第三节 化学健你有想过吗?
1.为什么一百多种元素可形成千千万万种物质?
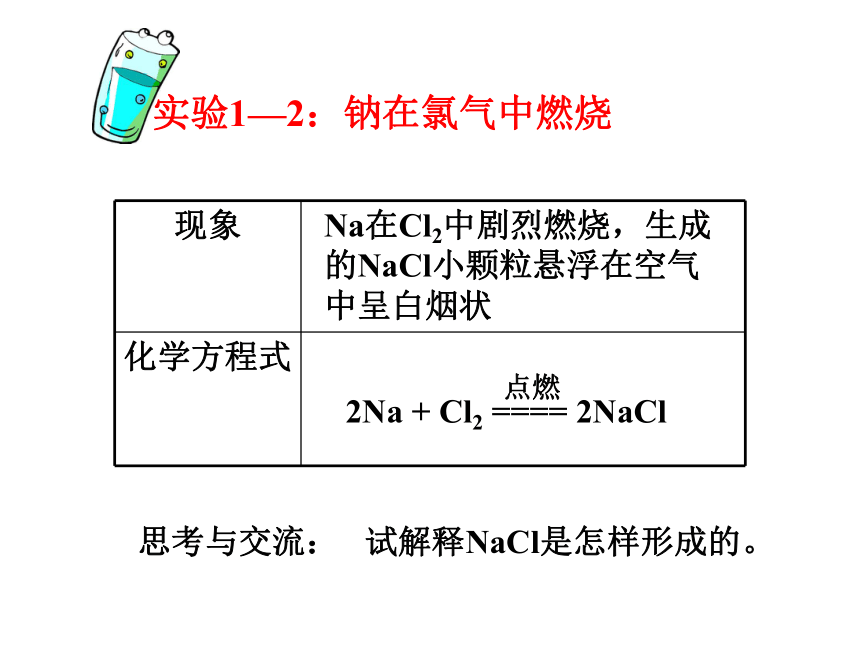
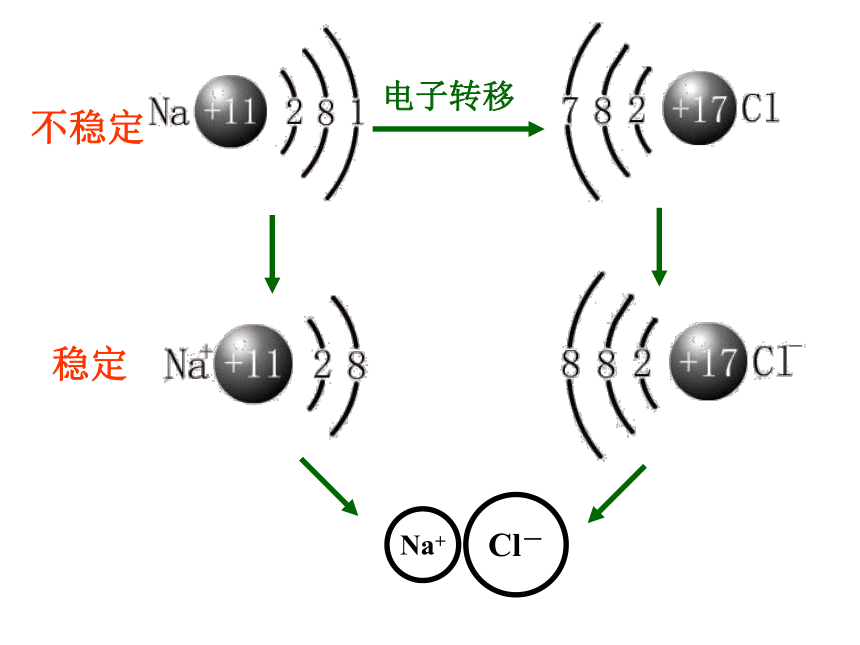
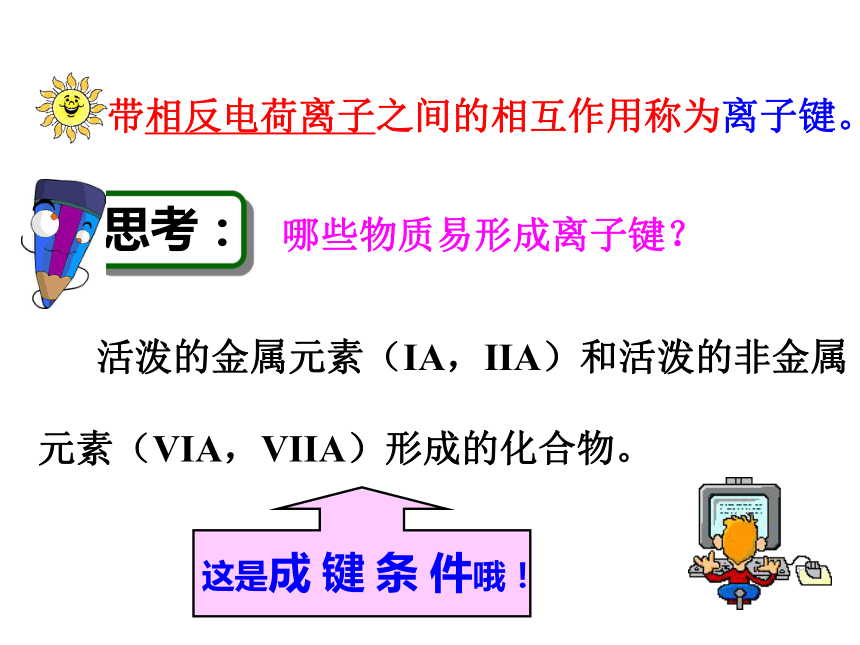
2. 为什么两个氢原子可以形成氢分子,而两个氦原子却不能形成氦分子?3.化合物中原子为什么总是按一定数目相结合? 离 子 键化 学 键——实验1—2:钠在氯气中燃烧Na在Cl2中剧烈燃烧,生成的NaCl小颗粒悬浮在空气中呈白烟状思考与交流: 试解释NaCl是怎样形成的。不稳定稳定定义:象Na+与Cl-之间,带相反电荷离子之间的相互作用称为离子键。由离子键构成的化合物叫做离子化合物。阴、阳离子静电引力离子键构成离子键的粒子:作用力:静电作用斥力 活泼的金属元素(IA,IIA)和活泼的非金属
元素(VIA,VIIA)形成的化合物。 这是成 键 条 件哦! 带相反电荷离子之间的相互作用称为离子键。一.离子键:使阴、阳离子结合成化合物的静电作用。[思考与讨论]1.离子键是一种什么性质的 相互作用?2.离子化合物溶于水或熔化时离子键是否发生变化?阴阳离子间的静电作用 (静电吸引=静电排斥)转化成自由移动的离子,离子键即被破坏。课堂练习练习1、下列说法正确的是:
A.离子键就是使阴、阳离子结合成化合物的静电引力
B.所有金属与所有非金属原子之间都能形成离子键
C.在化合物CaCl2中,两个氯离子之间也存在离子键
D.钠原子与氯原子结合成氯化钠后体系能量降低
D练习2、下列各数值表示有关元素的原子序数,其所表示的各原子组中能以离子键相互结合成稳定化合物的是:
A.10与12 B.8与17
C. 11与17 D.6与14C 在元素符号周围用“ · ”或“×”来表示原子最外层电子的式子,叫电子式。H ·Na · ·Mg ·原子的电子式:离子的电子式:H+Na+Mg2+电子式1、金属阳离子的电子式就是其离子符号。 2、非金属阴离子的电子式要标 [ ] 及“ 电荷数 ”。离子化合物的电子式:3、离子化合物的电子式就是由阴、阳离子的电子式合并而成。在元素符号周围用用“ · ”表示最外层电子 写出下列粒子的电子式:
硫原子, 溴离子, 钾离子K+
氯化钠Na+氟化镁Mg2+如何用电子式表示离子化合物的形成过程? 例:用电子式表示氯化钠、溴化钙的形成过程 Na ·+→Na+·Ca·++→Ca2+
1.原子A的电子式 + 原子B的电子式→化合物的电子式 2.不能把“→”写成“=”。 3.在箭号右边,不能把相同离子合并在一起。注意+·Ca·
→
Ca2+2⑴ 用电子式表示氧化镁的形成过程 · Mg ·+→Mg2+⑵ 用电子式表示硫化钾的形成过程 2K·+→K+K+K·+
K·
+K+→ K+
原子A的电子式 + 原子B的电子式 → 化合物的电子式 本节小结离子键:使阴、阳离子结合成化合物的静电作用.
(成键粒子、成键条件)
活泼金属原子M活泼非金属原子N失去电子得到电子阳离子Mm+阴离子Nn-静电作用 静电吸引=静电排斥离 子 键 影 响 因 素 ①离子半径 ②离子电荷
离子化合物用电子式表示例本节小结: 由离子键构成的化合物一定是离子化合物区分: 用电子式表示物质
用电子式表示物质形成过程 某ⅡA族元素 X 和ⅦA族元素 Y 可形成
离子化合物,请用电子式表示该离子化合物。 X2+ 钠与氧气在常温下反应生成氧化钠。请
用电子式表示氧化钠的形成过程。2Na·+→Na+Na+ 活泼的金属元素和活泼非金属元素化合时形成离子键。请思考,非金属元素之间化合时,能形成离子键吗?为什么? 不能,因非金属元素的原子均有获得电子的倾向。 非金属元素的原子间可通过共用电子对的方法使双方最外电子层均达到稳定结构。讨论 氢分子的形成: H · 氯化氢分子的形成:· H+→H ·+→ 原子之间通过共用电子对所形成的相互作用,叫做共价键。共用电子对不偏移,成键原子不显电性 共用电子对偏向氯原子,共价键特点:共价键特点:H﹣H(结构式)H﹣Cl(结构式)氯原子带部分负电荷,氢原子带部分正电荷。 碘 +→ 用电子式表示下列共价分子的形成过程水 二氧化碳 氨 2 H ·+→硫化氢2 H ·+→3 H ·+→+2→定义:原子之间通过共用电子对所形成的相互作用,叫做共价键。成键微粒:原子相互作用:共用电子对成键元素:同种或不同种非金属元素含有共价键的化合物不一定是共价化合物共价键 氢氧化钠晶体中,钠离子与氢氧根离子以
离子键结合;在氢氧根离子中,氢与氧以共价
键结合。请用电子式表示氢氧化钠。 [ ] +- 过氧化钠晶体中,过氧根离子 (O2 ) 2-与钠
离子以离子键结合;在过氧根离子中,两个氧
原子以共价键结合。请用电子式表示过氧化钠。[ ]++2-定义:相邻的两个或多个原子(或离子)之间强烈的相互作用叫做化学键。化学键离子键金属键共价键非极性键极性键 由阴、阳离子之间通过静电作用所形成的化学键叫离子键 原子之间通过共用电子对所形成的化学键叫共价键三、化学键从有关离子键和化合键的讨论中,我们可以看到,原子结合成分子时原子之间存在着相互作用。这种相互作用存在于直接相邻的原子之间,破坏它要消耗比较大的能量,这是是使原子相互联结形成分子的主要因素。这种相邻的原子之间强烈的相互作用叫做化学键。化学键稀有气体单质中不存在;
多原子单质分子中存在共价键;
非金属化合物分子中存在共价键(包括酸);
离子化合物中一定存在离子键,可能有共价键的存在(Na2O2、NaOH、NH4Cl),共价化合物中不存在离子键;
离子化合物可由非金属构成,
如:NH4NO3、NH4Cl 。化学键的存在: 一个化学反应的的过程,本质上就是旧化学键断裂和新化学键形成的过程。思考:用化学键的观点来分析化学反应的本质是什么?化学反应的本质:四、分子间作用力和氢键1.分子间作用力 定义: 把分子聚集在一起的作用力叫做分子间作用力(也叫范德华力)。 (1)分子间作用力比化学键弱得多,是一种微弱的相互作用,它主要影响物质的熔、沸点等物理性质,而化学键主要影响物质的化学性质。 (2)分子间作用力主要存在于由分子构成的物质中,如:多数非金属单质、稀有气体、非金属氧化物、酸、氢化物、有机物等。 (3)分子间作用力的范围很小(一般是300-500pm),只有分子间的距离很小时才有。 (4)一般来说,对于组成和结构相似的物质,相对分子质量越大,分子间作用力越大,物质的熔、沸点越高。如卤素单质:应用:对于四氟化碳、四氯化碳、四溴化碳、四碘化碳,其熔沸点如何变化?归纳:分子间作用力与化学键的比较原子间分子之间作用力大作用力小影响化学性质和
物理性质影响物理性质
(熔沸点等)分子之间无化学键 为什么HF、H2O和NH3的沸点会反常呢?讨论:一些氢化物的沸点2.氢键1)形成条件:原子半径较小,非金属性很强的原子X,(N、O、F)与H原子形成强极性共价键,与另一个分子中的半径较小,非金属性很强的原子Y (N、O、F),在分子间H与Y产生较强的静电吸引,形成氢键2)表示方法:X—H…Y—H(X.Y可相同或不同,一般为N、O、F)。3)氢键能级:比化学键弱很多但比分子间作用力稍强4)特征:具有方向性。结果1:氢键的形成会使含有氢键的物质的熔、沸点大大升高。如:水的沸点高、氨易液化等。这是因为固体熔化或液体汽化时,必须破坏分子间作用力和氢键思考:为什么冰会浮在水面上?
雪花为什么是六角形的?结果2:氢键的形成对物质的溶解性也有影响,如:NH3极易溶于水。5)氢键作用:使物质有较高的熔沸点(H2O、 HF 、NH3) 使物质易溶于水(C2H5OH,CH3COOH) 解释一些反常现象 原子分子离子宏观 物质或范德华力得失电子范德华力
氢键共价键金属键或共价键离子键离子晶体分子晶体原子晶体金属晶体小结:有几种形成方式?1.下列物质中含有共价键的离子化合物是
A.Ba(OH)2 B.CaCl2
C.H2O D.H2A2.在下列分子结构中,原子的最外层电子不能满足8电子稳定结构的是
A.CO2 B.PCl3
C.CCl4 D.NO2
D3.下列各分子中,化学键类型有差异的是
A.H2O、CO2
B.MgF2、H2O2
C.NaOH、Ba(OH)2
D.NaCl、KCl
4.下列每种粒子中,所含化学键完全相同的是
A.Na2O2 B.H2O2
C.H2O D.NH4ClBC5.下列过程中,共价键被破坏的是( )
A.碘升华 B.溴蒸气被木炭吸附
C.蔗糖溶于水 D.氯化氢气体溶于水
6.最近,科学研制得一种新的分子,它具有空心的类似足球状结构,化学式为C60,下列说法正确的是
A.C60的熔沸点高 B.C60和金刚石都是碳单质
C.C60中含离子键 D.C60中只有共价键DBDHH7.下列既含有离子键又含有共价键的
化合物是( )
A.HI B.NaOH C.Br2 D.NaCl
8.下列电子式书写正确的是( )
A.∶N∶∶∶N∶ B.H∶N∶H
C.H+[∶O∶]2-H+ D.Na+[∶Cl∶]- BAD9.下列各数值表示有关元素的原子序数,其所表示的各原子组中能以离子键相互结合成稳定化合物的是: ( )
A.10与12 B.8与17
C.11与17 D.6与14
10.下列说法正确的是:( )
A.离子键就是使阴、阳离子结合成化合物的静电引力
B.所有金属与所有非金属原子之间都能形成离子键
C.在化合物CaCl2中,两个氯离子之间也存在离子键
D.钠原子与氯原子结合成氯化钠后体系能量降低
CD11.下列说法中正确的是( )
A.含有离子键的化合物必是离子化合物
B.具有共价键的化合物就是共价化合物
C.共价化合物可能含离子键
D.离子化合物中可能含有共价键
12.下列物质中有氧离子存在的是( )
A.H2O B.CaO C.KClO D.KOH
13.下列关于离子化合物的叙述正确的是( )
A.离子化合物中都含有离子键
B.离子化合物中的阳离子只能是金属离子
C.离子化合物如能溶于水,其水溶液一定可以导电
D.溶于水可以导电的化合物一定是离子化合物
ADBA C14:下列物质中,1.含离子键的物质是(??? );2.含非极性共价键的物质是(??? );3.含极性共价键的物质是( )。
A、KF B、H2O C、 N2 D、 F2
E、CS2 F、CaCl2、 G、CH4
H、CCl4 I、 Br2 J、 PH3
15.下列性质中,可以证明某化合物内一定存在离子键的是( )
A.可溶于水 B.具有较高的熔点
C.水溶液能导电 D.熔融状态能导电
A、F、B、E、G、H、J、C、D、I、D16.下列关于电子式的说法不正确的是( )
A.每种元素的原子都可以写出电子式
B.简单阳离子的电子式与它的离子符号相同
C.阴离子的电子式要加方括号表示
D.电子式就是核外电子排布的式子
17.下列化合物全部以共用电子对成键的是( )
A.NH3 B.Ba(OH)2
C.MgCl2 D.NH4ClDA18.下列每组中各物质内既有离子键又有共价键的一组是
A.NaOH、H2SO4、(NH4)2SO4 B.MgO、Na2SO4、NH4HCO3
C.Na2O2、KOH、Na2SO4
D.HCl、Al2O3、MgCl2
19.下列物质中,属于共价化合物的是
A.NH4Cl B.H2SO4
C.NaCl D.I2CB20.分析下列化学式中画有横线的元素,选出符合①②③要求的物质,填在横线上。
A.NH3 B.H2O C.HCl D.CH4
①所有的价电子都参与形成共价键的是 ;
②只有一个价电子参与形成共价键的是 ;
③最外层含有一对未成键电子的是 。DCA21.下列物质中,不存在化学键的是
A.水 B.食盐 C.氯气 D.氦气
22.下列各分子中,化学键类型有差异的是
A.H2O、CO2 B.MgF2、H2O2
C.NaOH、Ba(OH)2 D.NaCl、KCl
23.某电解质,当把其固体加热时,能生成气体并生成一种新的离子化合物的是 ( )
A.H2SO4 B.KClO3
C.NaOH D.NaHCO3DBB D25.下列变化中,不需要破坏化学键的是( )
A.氯化氢溶于水 B.加热氯酸钾使其分解
C.碘升华 D.氯化钠溶于水
26. X和Y两元素的原子,在化学反应中都容易失去2个电子形成稳定结构,已知X的原子半径小于Y的原子半径,下列说法正确的是( )
A.两种原子失去电子能力相同
B.两种原子的核外具有相同的电子层数
C.Y(OH)2的碱性比X(OH)2的碱性强
D.Y的金属性比X的金属性强CC D27.下列说法正确的是 ( )
A.含有金属元素的化合物一定是离子化合物
B.第ⅠA族和第ⅦA族原子化合时,一定生成离子键
C.由非金属元素形成的化合物一定不是离子化合物
D.活泼金属与非金属化合时,能形成离子键D其中A项AlCl3是共价化合物;B项HCl是共价键;C项如NH4Cl是离子化合物。
1.为什么一百多种元素可形成千千万万种物质?
2. 为什么两个氢原子可以形成氢分子,而两个氦原子却不能形成氦分子?3.化合物中原子为什么总是按一定数目相结合? 离 子 键化 学 键——实验1—2:钠在氯气中燃烧Na在Cl2中剧烈燃烧,生成的NaCl小颗粒悬浮在空气中呈白烟状思考与交流: 试解释NaCl是怎样形成的。不稳定稳定定义:象Na+与Cl-之间,带相反电荷离子之间的相互作用称为离子键。由离子键构成的化合物叫做离子化合物。阴、阳离子静电引力离子键构成离子键的粒子:作用力:静电作用斥力 活泼的金属元素(IA,IIA)和活泼的非金属
元素(VIA,VIIA)形成的化合物。 这是成 键 条 件哦! 带相反电荷离子之间的相互作用称为离子键。一.离子键:使阴、阳离子结合成化合物的静电作用。[思考与讨论]1.离子键是一种什么性质的 相互作用?2.离子化合物溶于水或熔化时离子键是否发生变化?阴阳离子间的静电作用 (静电吸引=静电排斥)转化成自由移动的离子,离子键即被破坏。课堂练习练习1、下列说法正确的是:
A.离子键就是使阴、阳离子结合成化合物的静电引力
B.所有金属与所有非金属原子之间都能形成离子键
C.在化合物CaCl2中,两个氯离子之间也存在离子键
D.钠原子与氯原子结合成氯化钠后体系能量降低
D练习2、下列各数值表示有关元素的原子序数,其所表示的各原子组中能以离子键相互结合成稳定化合物的是:
A.10与12 B.8与17
C. 11与17 D.6与14C 在元素符号周围用“ · ”或“×”来表示原子最外层电子的式子,叫电子式。H ·Na · ·Mg ·原子的电子式:离子的电子式:H+Na+Mg2+电子式1、金属阳离子的电子式就是其离子符号。 2、非金属阴离子的电子式要标 [ ] 及“ 电荷数 ”。离子化合物的电子式:3、离子化合物的电子式就是由阴、阳离子的电子式合并而成。在元素符号周围用用“ · ”表示最外层电子 写出下列粒子的电子式:
硫原子, 溴离子, 钾离子K+
氯化钠Na+氟化镁Mg2+如何用电子式表示离子化合物的形成过程? 例:用电子式表示氯化钠、溴化钙的形成过程 Na ·+→Na+·Ca·++→Ca2+
1.原子A的电子式 + 原子B的电子式→化合物的电子式 2.不能把“→”写成“=”。 3.在箭号右边,不能把相同离子合并在一起。注意+·Ca·
→
Ca2+2⑴ 用电子式表示氧化镁的形成过程 · Mg ·+→Mg2+⑵ 用电子式表示硫化钾的形成过程 2K·+→K+K+K·+
K·
+K+→ K+
原子A的电子式 + 原子B的电子式 → 化合物的电子式 本节小结离子键:使阴、阳离子结合成化合物的静电作用.
(成键粒子、成键条件)
活泼金属原子M活泼非金属原子N失去电子得到电子阳离子Mm+阴离子Nn-静电作用 静电吸引=静电排斥离 子 键 影 响 因 素 ①离子半径 ②离子电荷
离子化合物用电子式表示例本节小结: 由离子键构成的化合物一定是离子化合物区分: 用电子式表示物质
用电子式表示物质形成过程 某ⅡA族元素 X 和ⅦA族元素 Y 可形成
离子化合物,请用电子式表示该离子化合物。 X2+ 钠与氧气在常温下反应生成氧化钠。请
用电子式表示氧化钠的形成过程。2Na·+→Na+Na+ 活泼的金属元素和活泼非金属元素化合时形成离子键。请思考,非金属元素之间化合时,能形成离子键吗?为什么? 不能,因非金属元素的原子均有获得电子的倾向。 非金属元素的原子间可通过共用电子对的方法使双方最外电子层均达到稳定结构。讨论 氢分子的形成: H · 氯化氢分子的形成:· H+→H ·+→ 原子之间通过共用电子对所形成的相互作用,叫做共价键。共用电子对不偏移,成键原子不显电性 共用电子对偏向氯原子,共价键特点:共价键特点:H﹣H(结构式)H﹣Cl(结构式)氯原子带部分负电荷,氢原子带部分正电荷。 碘 +→ 用电子式表示下列共价分子的形成过程水 二氧化碳 氨 2 H ·+→硫化氢2 H ·+→3 H ·+→+2→定义:原子之间通过共用电子对所形成的相互作用,叫做共价键。成键微粒:原子相互作用:共用电子对成键元素:同种或不同种非金属元素含有共价键的化合物不一定是共价化合物共价键 氢氧化钠晶体中,钠离子与氢氧根离子以
离子键结合;在氢氧根离子中,氢与氧以共价
键结合。请用电子式表示氢氧化钠。 [ ] +- 过氧化钠晶体中,过氧根离子 (O2 ) 2-与钠
离子以离子键结合;在过氧根离子中,两个氧
原子以共价键结合。请用电子式表示过氧化钠。[ ]++2-定义:相邻的两个或多个原子(或离子)之间强烈的相互作用叫做化学键。化学键离子键金属键共价键非极性键极性键 由阴、阳离子之间通过静电作用所形成的化学键叫离子键 原子之间通过共用电子对所形成的化学键叫共价键三、化学键从有关离子键和化合键的讨论中,我们可以看到,原子结合成分子时原子之间存在着相互作用。这种相互作用存在于直接相邻的原子之间,破坏它要消耗比较大的能量,这是是使原子相互联结形成分子的主要因素。这种相邻的原子之间强烈的相互作用叫做化学键。化学键稀有气体单质中不存在;
多原子单质分子中存在共价键;
非金属化合物分子中存在共价键(包括酸);
离子化合物中一定存在离子键,可能有共价键的存在(Na2O2、NaOH、NH4Cl),共价化合物中不存在离子键;
离子化合物可由非金属构成,
如:NH4NO3、NH4Cl 。化学键的存在: 一个化学反应的的过程,本质上就是旧化学键断裂和新化学键形成的过程。思考:用化学键的观点来分析化学反应的本质是什么?化学反应的本质:四、分子间作用力和氢键1.分子间作用力 定义: 把分子聚集在一起的作用力叫做分子间作用力(也叫范德华力)。 (1)分子间作用力比化学键弱得多,是一种微弱的相互作用,它主要影响物质的熔、沸点等物理性质,而化学键主要影响物质的化学性质。 (2)分子间作用力主要存在于由分子构成的物质中,如:多数非金属单质、稀有气体、非金属氧化物、酸、氢化物、有机物等。 (3)分子间作用力的范围很小(一般是300-500pm),只有分子间的距离很小时才有。 (4)一般来说,对于组成和结构相似的物质,相对分子质量越大,分子间作用力越大,物质的熔、沸点越高。如卤素单质:应用:对于四氟化碳、四氯化碳、四溴化碳、四碘化碳,其熔沸点如何变化?归纳:分子间作用力与化学键的比较原子间分子之间作用力大作用力小影响化学性质和
物理性质影响物理性质
(熔沸点等)分子之间无化学键 为什么HF、H2O和NH3的沸点会反常呢?讨论:一些氢化物的沸点2.氢键1)形成条件:原子半径较小,非金属性很强的原子X,(N、O、F)与H原子形成强极性共价键,与另一个分子中的半径较小,非金属性很强的原子Y (N、O、F),在分子间H与Y产生较强的静电吸引,形成氢键2)表示方法:X—H…Y—H(X.Y可相同或不同,一般为N、O、F)。3)氢键能级:比化学键弱很多但比分子间作用力稍强4)特征:具有方向性。结果1:氢键的形成会使含有氢键的物质的熔、沸点大大升高。如:水的沸点高、氨易液化等。这是因为固体熔化或液体汽化时,必须破坏分子间作用力和氢键思考:为什么冰会浮在水面上?
雪花为什么是六角形的?结果2:氢键的形成对物质的溶解性也有影响,如:NH3极易溶于水。5)氢键作用:使物质有较高的熔沸点(H2O、 HF 、NH3) 使物质易溶于水(C2H5OH,CH3COOH) 解释一些反常现象 原子分子离子宏观 物质或范德华力得失电子范德华力
氢键共价键金属键或共价键离子键离子晶体分子晶体原子晶体金属晶体小结:有几种形成方式?1.下列物质中含有共价键的离子化合物是
A.Ba(OH)2 B.CaCl2
C.H2O D.H2A2.在下列分子结构中,原子的最外层电子不能满足8电子稳定结构的是
A.CO2 B.PCl3
C.CCl4 D.NO2
D3.下列各分子中,化学键类型有差异的是
A.H2O、CO2
B.MgF2、H2O2
C.NaOH、Ba(OH)2
D.NaCl、KCl
4.下列每种粒子中,所含化学键完全相同的是
A.Na2O2 B.H2O2
C.H2O D.NH4ClBC5.下列过程中,共价键被破坏的是( )
A.碘升华 B.溴蒸气被木炭吸附
C.蔗糖溶于水 D.氯化氢气体溶于水
6.最近,科学研制得一种新的分子,它具有空心的类似足球状结构,化学式为C60,下列说法正确的是
A.C60的熔沸点高 B.C60和金刚石都是碳单质
C.C60中含离子键 D.C60中只有共价键DBDHH7.下列既含有离子键又含有共价键的
化合物是( )
A.HI B.NaOH C.Br2 D.NaCl
8.下列电子式书写正确的是( )
A.∶N∶∶∶N∶ B.H∶N∶H
C.H+[∶O∶]2-H+ D.Na+[∶Cl∶]- BAD9.下列各数值表示有关元素的原子序数,其所表示的各原子组中能以离子键相互结合成稳定化合物的是: ( )
A.10与12 B.8与17
C.11与17 D.6与14
10.下列说法正确的是:( )
A.离子键就是使阴、阳离子结合成化合物的静电引力
B.所有金属与所有非金属原子之间都能形成离子键
C.在化合物CaCl2中,两个氯离子之间也存在离子键
D.钠原子与氯原子结合成氯化钠后体系能量降低
CD11.下列说法中正确的是( )
A.含有离子键的化合物必是离子化合物
B.具有共价键的化合物就是共价化合物
C.共价化合物可能含离子键
D.离子化合物中可能含有共价键
12.下列物质中有氧离子存在的是( )
A.H2O B.CaO C.KClO D.KOH
13.下列关于离子化合物的叙述正确的是( )
A.离子化合物中都含有离子键
B.离子化合物中的阳离子只能是金属离子
C.离子化合物如能溶于水,其水溶液一定可以导电
D.溶于水可以导电的化合物一定是离子化合物
ADBA C14:下列物质中,1.含离子键的物质是(??? );2.含非极性共价键的物质是(??? );3.含极性共价键的物质是( )。
A、KF B、H2O C、 N2 D、 F2
E、CS2 F、CaCl2、 G、CH4
H、CCl4 I、 Br2 J、 PH3
15.下列性质中,可以证明某化合物内一定存在离子键的是( )
A.可溶于水 B.具有较高的熔点
C.水溶液能导电 D.熔融状态能导电
A、F、B、E、G、H、J、C、D、I、D16.下列关于电子式的说法不正确的是( )
A.每种元素的原子都可以写出电子式
B.简单阳离子的电子式与它的离子符号相同
C.阴离子的电子式要加方括号表示
D.电子式就是核外电子排布的式子
17.下列化合物全部以共用电子对成键的是( )
A.NH3 B.Ba(OH)2
C.MgCl2 D.NH4ClDA18.下列每组中各物质内既有离子键又有共价键的一组是
A.NaOH、H2SO4、(NH4)2SO4 B.MgO、Na2SO4、NH4HCO3
C.Na2O2、KOH、Na2SO4
D.HCl、Al2O3、MgCl2
19.下列物质中,属于共价化合物的是
A.NH4Cl B.H2SO4
C.NaCl D.I2CB20.分析下列化学式中画有横线的元素,选出符合①②③要求的物质,填在横线上。
A.NH3 B.H2O C.HCl D.CH4
①所有的价电子都参与形成共价键的是 ;
②只有一个价电子参与形成共价键的是 ;
③最外层含有一对未成键电子的是 。DCA21.下列物质中,不存在化学键的是
A.水 B.食盐 C.氯气 D.氦气
22.下列各分子中,化学键类型有差异的是
A.H2O、CO2 B.MgF2、H2O2
C.NaOH、Ba(OH)2 D.NaCl、KCl
23.某电解质,当把其固体加热时,能生成气体并生成一种新的离子化合物的是 ( )
A.H2SO4 B.KClO3
C.NaOH D.NaHCO3DBB D25.下列变化中,不需要破坏化学键的是( )
A.氯化氢溶于水 B.加热氯酸钾使其分解
C.碘升华 D.氯化钠溶于水
26. X和Y两元素的原子,在化学反应中都容易失去2个电子形成稳定结构,已知X的原子半径小于Y的原子半径,下列说法正确的是( )
A.两种原子失去电子能力相同
B.两种原子的核外具有相同的电子层数
C.Y(OH)2的碱性比X(OH)2的碱性强
D.Y的金属性比X的金属性强CC D27.下列说法正确的是 ( )
A.含有金属元素的化合物一定是离子化合物
B.第ⅠA族和第ⅦA族原子化合时,一定生成离子键
C.由非金属元素形成的化合物一定不是离子化合物
D.活泼金属与非金属化合时,能形成离子键D其中A项AlCl3是共价化合物;B项HCl是共价键;C项如NH4Cl是离子化合物。
