2022—2023学年上学期高一化学人教(2019)必修第一册第三章 铁 金属材料自测习题(word版含答案)
文档属性
| 名称 | 2022—2023学年上学期高一化学人教(2019)必修第一册第三章 铁 金属材料自测习题(word版含答案) |  | |
| 格式 | zip | ||
| 文件大小 | 174.5KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-07-12 21:50:15 | ||
图片预览




文档简介
第三章 铁 金属材料自测习题含答案2022—2023学年上学期高一化学人教(2019)必修第一册
人教(2019)必修第一册第三章 铁 金属材料
一、选择题。(14题)
1、证明某溶液中只含Fe2+而不含Fe3+的实验方法是( )
A. 只滴加KSCN溶液
B. 先滴加KSCN溶液,不显红色,再滴加氯水后显红色
C. 先滴加氯水,再滴加KSCN溶液后显红色
D. 滴加NaOH溶液,产生白色沉淀
2、在适当条件下不能与铁反应的物质是( )
A.氯气 B.盐酸 C.硫酸铜溶液 D.氢氧化钠溶液
3、将过量的Na2O2投入FeCl2溶液中,可观察到的现象是 ( )
A.有白色沉淀生成 B.有红褐色沉淀生成
C.溶液由浅绿色变为黄色 D.不可能有无色气体产生
4、铝合金在日常生活、航空航天和汽车制造等方面均有广泛用途。下列关于铝的说法正确的是 ( )
A.铝的表面容易形成致密的氧化膜,抗腐蚀性能好
B.常温下不与任何酸、碱反应
C.铝元素在地壳中的含量高,储量丰富,仅次于铁
D.工业上通常用钠与铝盐溶液反应来制备铝
5、实验室用足量的锌粒和100 mL稀硫酸制备氢气,当收集到标准状况下1.12 L H2时,反应停止,下列说法不正确的是( )
A.稀硫酸中H+的浓度是0.5 mol·L-1
B.消耗硫酸的物质的量是0.05 mol
C.消耗锌的质量是3.25 g
D.氢气中可能混有水蒸气
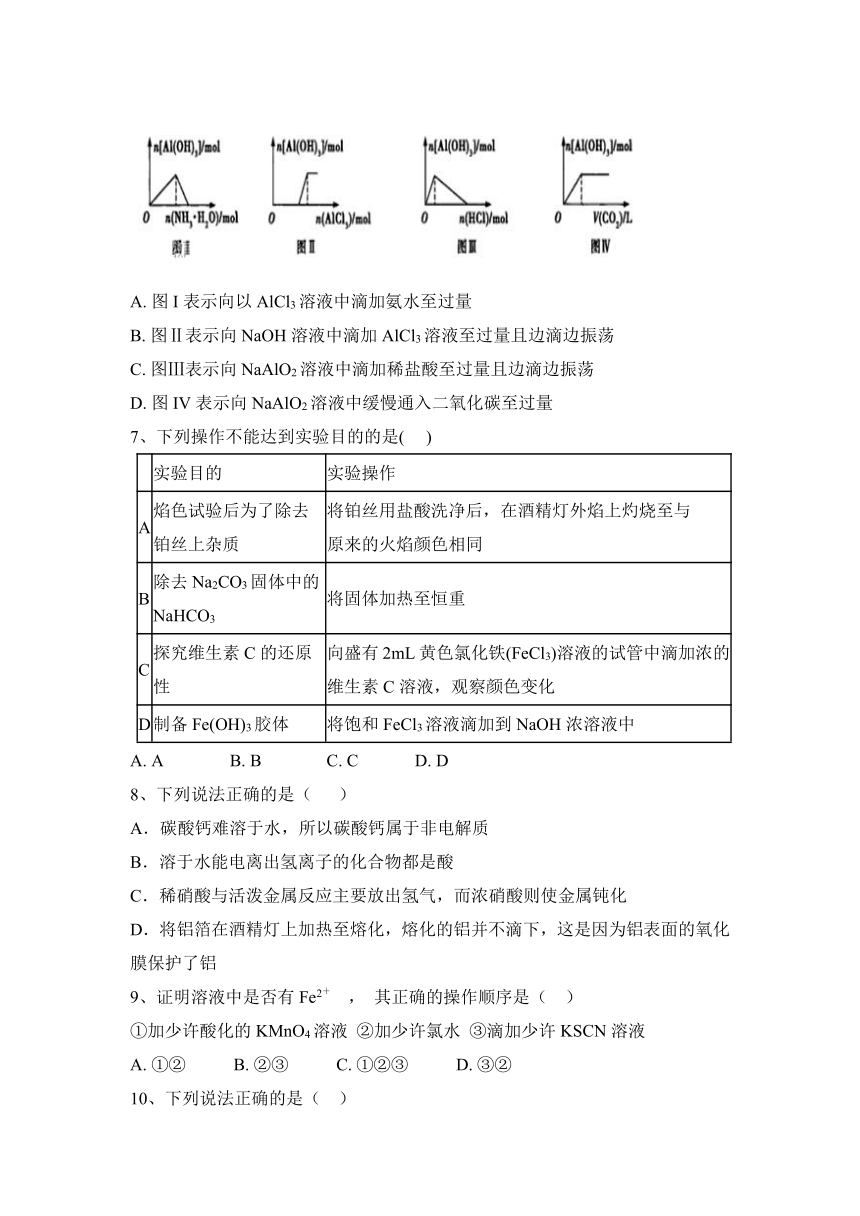
6、如图所示,下列说法错误的是( )
A. 图I表示向以AlCl3溶液中滴加氨水至过量
B. 图Ⅱ表示向NaOH溶液中滴加AlCl3溶液至过量且边滴边振荡
C. 图Ⅲ表示向NaAlO2溶液中滴加稀盐酸至过量且边滴边振荡
D. 图IV表示向NaAlO2溶液中缓慢通入二氧化碳至过量
7、下列操作不能达到实验目的的是( )
实验目的 实验操作
A 焰色试验后为了除去铂丝上杂质 将铂丝用盐酸洗净后,在酒精灯外焰上灼烧至与原来的火焰颜色相同
B 除去Na2CO3固体中的NaHCO3 将固体加热至恒重
C 探究维生素C的还原性 向盛有2mL黄色氯化铁(FeCl3)溶液的试管中滴加浓的维生素C溶液,观察颜色变化
D 制备Fe(OH)3胶体 将饱和FeCl3溶液滴加到NaOH浓溶液中
A. A B. B C. C D. D
8、下列说法正确的是( )
A.碳酸钙难溶于水,所以碳酸钙属于非电解质
B.溶于水能电离出氢离子的化合物都是酸
C.稀硝酸与活泼金属反应主要放出氢气,而浓硝酸则使金属钝化
D.将铝箔在酒精灯上加热至熔化,熔化的铝并不滴下,这是因为铝表面的氧化膜保护了铝
9、证明溶液中是否有Fe2+ , 其正确的操作顺序是( )
①加少许酸化的KMnO4溶液 ②加少许氯水 ③滴加少许KSCN溶液
A. ①② B. ②③ C. ①②③ D. ③②
10、下列说法正确的是( )
A. NaOH的摩尔质量为40g
B. 钠露置在空气中会发生一系列的变化,最终生成NaHCO3
C. 称取25g胆矾溶于1L水中,即可制得0.1mol·L-1的CuSO4溶液
D. 84消毒液不能与洁厕灵等酸性产品混用是为防止产生有毒的氯气
11、在含有FeCl3、FeCl2、AlCl3、NaCl的混合溶液中,加入足量的Na2O2固体,搅拌充分反应后,再加入过量盐酸,溶液中离子数目无变化的是( )
A. Na+ B. Al3+ C. Fe2+ D. Fe3+
12、某溶液含有K+、Fe3+、SO42-、OH-、I-中的几种。取样,滴加KSCN溶液后显血红色。为确定该溶液的组成,还需检验的离子是( )
A. K+ B. I- C. SO42- D. OH-
13、某无色溶液能与铝反应放出氢气,则该溶液中肯定不能大量共存的离子组是( )
A. NH4+、Na+、Ba2+、Cl- B. Na+、I-、HCO3-、SO42-
C. K+、Cl-、SO32-、[Al(OH)4]- D. Na+、Mg2+、SO42-、Cl-
14、常温时,将0.1 molFe(NO3)3和2molHCl溶于水得2L混合溶液,然后向该溶液投入m克铁粉使其充分反应后,滴加KSCN溶液不变红色。下列有关说法正确的是( )
A. 由于氧化性Fe3+>H+,首先发生的反应是:Fe+2Fe3+=3Fe2+
B. 当加入16.8g铁粉时,可生成标准状况下6.72L气体
C. 在铁粉充分反应后的溶液中,溶质含有硝酸亚铁和氯化铁
D. m至少等于28g,反应过程中溶液的质量一直在减小
二、非选择题。(4题)
15、铁是一种重要的金属材料,它的单质及化合物在生产生活中应用广泛。
(1)铁元素有三种常见的氧化物,分别是 FeO、Fe2O3、Fe3O4.其中具有磁性的是 ________,可作为红色颜料的是________。
(2)某补铁口服液中含有 Fe2+,为检验其是否被氧化变质,可取少量该口服液,向其中滴加 KSCN 溶液,若溶液变为________色,则说明其已变质。向该口服液中加入维生素 C 可防止其被氧化变质,此过程中利用了维生素 C 的________性。
(3)FeCl3可作为铜电路板的腐蚀液,其反应原理为Cu与FeCl3溶液反应生成FeCl2和CuCl2,该反应的化学方程式为________ 。
16、(1)在________ mol Al2(SO4)3中含0.3 mol SO42– , 含Al3+约________个。
(2)同温同压下,相同质量的SO2气体和SO3气体,其分子数之比为________,密度之比为________。
(3)质量同为46 g的两种气体,NO2和N2O4 , 物质的量之比为________,二者所含O原子个数之比为________。
17、(1)I.NaNO2和食盐外观很像,曾出现误把NaNO2当食盐而造成人员中毒的事情,在酸性溶液中它也是一种氧化剂,如NaNO2能把Fe2+氧化成Fe3+。已知NaNO2水溶液呈碱性,AgNO2是一种难溶于水白色固体。NaCl溶液呈中性。试回答下列问题:
人体正常的血红蛋白含有Fe2+。若误食亚硝酸盐,如NaNO2,则导致血红蛋白中的Fe2+转化为Fe3+而中毒(FeCl2溶液为浅绿色,FeCl3溶液为棕黄色),可以服用维生素C解毒,维生素C在解毒的过程中表现出________(填“氧化”或“还原”)性。
(2)下列方法中,不能用来区分NaNO2和NaCl的是__________。
A.测溶液的酸碱性
B.加入AgNO3溶液观察是否有沉淀生成
C.分别在它们的酸性溶液中加入FeCl2溶液,观察溶液颜色变化
(3)II.H3PO2是精细磷化工产品。工业制备原理如下:
a.2P4+3Ba(OH)2+6H2O=3Ba(H2PO2)2+2PH3↑
b.Ba(H2PO2)2+H2SO4=BaSO4↓+2H3PO2
下列推断正确的是__________
A.反应a是氧化还原反应,反应b是复分解反应
B.H3PO2中P化合价是+1
C.在反应a中发生氧化反应与还原反应的原子个数之比为1:1
(4)某离子反应涉及到H2O、ClO-、NH4+、OH-、N2、Cl-等微粒,其中N2、ClO-的粒子数随时间变化的曲线如图所示,请写出反应的离子方程________,ClO-表现出________性。
(5)用洁净的烧杯取少量蒸馏水,用酒精灯加热至沸腾,向烧杯中逐滴滴入物质M的饱和水溶液,继续煮沸至液体呈红褐色,停止加热。写出该过程反应的化学方程式________。
18、将5 g钠铝合金投入一定量水中,固体完全溶解,产生4.48 L(标准状况下)气体,反应后所得溶液体积为200 mL且只有一种溶质。回答下列问题:
(1)处理计算问题,通常可以用图示分析的方法。
写出化学式:A ,B ,C 。
经过分析得出,钠铝合金中两金属的物质的量之比为 。
(2)所得溶液的物质的量浓度为 。(假设溶液体积变化忽略不计)
第三章 铁 金属材料自测习题含答案2022—2023学年上学期高一化学人教(2019)必修第一册
人教(2019)必修第一册第三章 铁 金属材料
一、选择题。(14题)
1、证明某溶液中只含Fe2+而不含Fe3+的实验方法是( )
A. 只滴加KSCN溶液
B. 先滴加KSCN溶液,不显红色,再滴加氯水后显红色
C. 先滴加氯水,再滴加KSCN溶液后显红色
D. 滴加NaOH溶液,产生白色沉淀
【答案】B
2、在适当条件下不能与铁反应的物质是( )
A.氯气 B.盐酸 C.硫酸铜溶液 D.氢氧化钠溶液
【答案】D
3、将过量的Na2O2投入FeCl2溶液中,可观察到的现象是 ( )
A.有白色沉淀生成 B.有红褐色沉淀生成
C.溶液由浅绿色变为黄色 D.不可能有无色气体产生
【答案】B
4、铝合金在日常生活、航空航天和汽车制造等方面均有广泛用途。下列关于铝的说法正确的是 ( )
A.铝的表面容易形成致密的氧化膜,抗腐蚀性能好
B.常温下不与任何酸、碱反应
C.铝元素在地壳中的含量高,储量丰富,仅次于铁
D.工业上通常用钠与铝盐溶液反应来制备铝
【答案】A
5、实验室用足量的锌粒和100 mL稀硫酸制备氢气,当收集到标准状况下1.12 L H2时,反应停止,下列说法不正确的是( )
A.稀硫酸中H+的浓度是0.5 mol·L-1
B.消耗硫酸的物质的量是0.05 mol
C.消耗锌的质量是3.25 g
D.氢气中可能混有水蒸气
【答案】A
6、如图所示,下列说法错误的是( )
A. 图I表示向以AlCl3溶液中滴加氨水至过量
B. 图Ⅱ表示向NaOH溶液中滴加AlCl3溶液至过量且边滴边振荡
C. 图Ⅲ表示向NaAlO2溶液中滴加稀盐酸至过量且边滴边振荡
D. 图IV表示向NaAlO2溶液中缓慢通入二氧化碳至过量
【答案】A
7、下列操作不能达到实验目的的是( )
实验目的 实验操作
A 焰色试验后为了除去铂丝上杂质 将铂丝用盐酸洗净后,在酒精灯外焰上灼烧至与原来的火焰颜色相同
B 除去Na2CO3固体中的NaHCO3 将固体加热至恒重
C 探究维生素C的还原性 向盛有2mL黄色氯化铁(FeCl3)溶液的试管中滴加浓的维生素C溶液,观察颜色变化
D 制备Fe(OH)3胶体 将饱和FeCl3溶液滴加到NaOH浓溶液中
A. A B. B C. C D. D
【答案】D
8、下列说法正确的是( )
A.碳酸钙难溶于水,所以碳酸钙属于非电解质
B.溶于水能电离出氢离子的化合物都是酸
C.稀硝酸与活泼金属反应主要放出氢气,而浓硝酸则使金属钝化
D.将铝箔在酒精灯上加热至熔化,熔化的铝并不滴下,这是因为铝表面的氧化膜保护了铝
【答案】D
9、证明溶液中是否有Fe2+ , 其正确的操作顺序是( )
①加少许酸化的KMnO4溶液 ②加少许氯水 ③滴加少许KSCN溶液
A. ①② B. ②③ C. ①②③ D. ③②
【答案】D
10、下列说法正确的是( )
A. NaOH的摩尔质量为40g
B. 钠露置在空气中会发生一系列的变化,最终生成NaHCO3
C. 称取25g胆矾溶于1L水中,即可制得0.1mol·L-1的CuSO4溶液
D. 84消毒液不能与洁厕灵等酸性产品混用是为防止产生有毒的氯气
【答案】D
11、在含有FeCl3、FeCl2、AlCl3、NaCl的混合溶液中,加入足量的Na2O2固体,搅拌充分反应后,再加入过量盐酸,溶液中离子数目无变化的是( )
A. Na+ B. Al3+ C. Fe2+ D. Fe3+
【答案】B
12、某溶液含有K+、Fe3+、SO42-、OH-、I-中的几种。取样,滴加KSCN溶液后显血红色。为确定该溶液的组成,还需检验的离子是( )
A. K+ B. I- C. SO42- D. OH-
【答案】A
13、某无色溶液能与铝反应放出氢气,则该溶液中肯定不能大量共存的离子组是( )
A. NH4+、Na+、Ba2+、Cl- B. Na+、I-、HCO3-、SO42-
C. K+、Cl-、SO32-、[Al(OH)4]- D. Na+、Mg2+、SO42-、Cl-
【答案】 B
14、常温时,将0.1 molFe(NO3)3和2molHCl溶于水得2L混合溶液,然后向该溶液投入m克铁粉使其充分反应后,滴加KSCN溶液不变红色。下列有关说法正确的是( )
A. 由于氧化性Fe3+>H+,首先发生的反应是:Fe+2Fe3+=3Fe2+
B. 当加入16.8g铁粉时,可生成标准状况下6.72L气体
C. 在铁粉充分反应后的溶液中,溶质含有硝酸亚铁和氯化铁
D. m至少等于28g,反应过程中溶液的质量一直在减小
【答案】B
二、非选择题。(4题)
15、铁是一种重要的金属材料,它的单质及化合物在生产生活中应用广泛。
(1)铁元素有三种常见的氧化物,分别是 FeO、Fe2O3、Fe3O4.其中具有磁性的是 ________,可作为红色颜料的是________。
(2)某补铁口服液中含有 Fe2+,为检验其是否被氧化变质,可取少量该口服液,向其中滴加 KSCN 溶液,若溶液变为________色,则说明其已变质。向该口服液中加入维生素 C 可防止其被氧化变质,此过程中利用了维生素 C 的________性。
(3)FeCl3可作为铜电路板的腐蚀液,其反应原理为Cu与FeCl3溶液反应生成FeCl2和CuCl2,该反应的化学方程式为________ 。
【答案】 (1)Fe3O4;Fe2O3 (2)红;还原性
(3)Cu+2FeCl3=2FeCl2+CuCl2
16、(1)在________ mol Al2(SO4)3中含0.3 mol SO42– , 含Al3+约________个。
(2)同温同压下,相同质量的SO2气体和SO3气体,其分子数之比为________,密度之比为________。
(3)质量同为46 g的两种气体,NO2和N2O4 , 物质的量之比为________,二者所含O原子个数之比为________。
【答案】(1)0.1;1.204×1023
(2)5︰4;4︰5 (3)2︰1;1︰1
17、(1)I.NaNO2和食盐外观很像,曾出现误把NaNO2当食盐而造成人员中毒的事情,在酸性溶液中它也是一种氧化剂,如NaNO2能把Fe2+氧化成Fe3+。已知NaNO2水溶液呈碱性,AgNO2是一种难溶于水白色固体。NaCl溶液呈中性。试回答下列问题:
人体正常的血红蛋白含有Fe2+。若误食亚硝酸盐,如NaNO2,则导致血红蛋白中的Fe2+转化为Fe3+而中毒(FeCl2溶液为浅绿色,FeCl3溶液为棕黄色),可以服用维生素C解毒,维生素C在解毒的过程中表现出________(填“氧化”或“还原”)性。
(2)下列方法中,不能用来区分NaNO2和NaCl的是__________。
A.测溶液的酸碱性
B.加入AgNO3溶液观察是否有沉淀生成
C.分别在它们的酸性溶液中加入FeCl2溶液,观察溶液颜色变化
(3)II.H3PO2是精细磷化工产品。工业制备原理如下:
a.2P4+3Ba(OH)2+6H2O=3Ba(H2PO2)2+2PH3↑
b.Ba(H2PO2)2+H2SO4=BaSO4↓+2H3PO2
下列推断正确的是__________
A.反应a是氧化还原反应,反应b是复分解反应
B.H3PO2中P化合价是+1
C.在反应a中发生氧化反应与还原反应的原子个数之比为1:1
(4)某离子反应涉及到H2O、ClO-、NH4+、OH-、N2、Cl-等微粒,其中N2、ClO-的粒子数随时间变化的曲线如图所示,请写出反应的离子方程________,ClO-表现出________性。
(5)用洁净的烧杯取少量蒸馏水,用酒精灯加热至沸腾,向烧杯中逐滴滴入物质M的饱和水溶液,继续煮沸至液体呈红褐色,停止加热。写出该过程反应的化学方程式________。
(【5的条件】)【答案】 (1)还原 (2)B (3)A,B
(4)2NH +3ClO-+2OH-=N2+3Cl-+5H2O;氧化
(5)FeCl3 +3H2O Fe(OH)3(胶体)+3HCl
18、将5 g钠铝合金投入一定量水中,固体完全溶解,产生4.48 L(标准状况下)气体,反应后所得溶液体积为200 mL且只有一种溶质。回答下列问题:
(1)处理计算问题,通常可以用图示分析的方法。
写出化学式:A ,B ,C 。
经过分析得出,钠铝合金中两金属的物质的量之比为 。
(2)所得溶液的物质的量浓度为 。(假设溶液体积变化忽略不计)
【答案】(1)H2 NaOH NaAlO2 1∶1 (2)0.5 mol·L-1
人教(2019)必修第一册第三章 铁 金属材料
一、选择题。(14题)
1、证明某溶液中只含Fe2+而不含Fe3+的实验方法是( )
A. 只滴加KSCN溶液
B. 先滴加KSCN溶液,不显红色,再滴加氯水后显红色
C. 先滴加氯水,再滴加KSCN溶液后显红色
D. 滴加NaOH溶液,产生白色沉淀
2、在适当条件下不能与铁反应的物质是( )
A.氯气 B.盐酸 C.硫酸铜溶液 D.氢氧化钠溶液
3、将过量的Na2O2投入FeCl2溶液中,可观察到的现象是 ( )
A.有白色沉淀生成 B.有红褐色沉淀生成
C.溶液由浅绿色变为黄色 D.不可能有无色气体产生
4、铝合金在日常生活、航空航天和汽车制造等方面均有广泛用途。下列关于铝的说法正确的是 ( )
A.铝的表面容易形成致密的氧化膜,抗腐蚀性能好
B.常温下不与任何酸、碱反应
C.铝元素在地壳中的含量高,储量丰富,仅次于铁
D.工业上通常用钠与铝盐溶液反应来制备铝
5、实验室用足量的锌粒和100 mL稀硫酸制备氢气,当收集到标准状况下1.12 L H2时,反应停止,下列说法不正确的是( )
A.稀硫酸中H+的浓度是0.5 mol·L-1
B.消耗硫酸的物质的量是0.05 mol
C.消耗锌的质量是3.25 g
D.氢气中可能混有水蒸气
6、如图所示,下列说法错误的是( )
A. 图I表示向以AlCl3溶液中滴加氨水至过量
B. 图Ⅱ表示向NaOH溶液中滴加AlCl3溶液至过量且边滴边振荡
C. 图Ⅲ表示向NaAlO2溶液中滴加稀盐酸至过量且边滴边振荡
D. 图IV表示向NaAlO2溶液中缓慢通入二氧化碳至过量
7、下列操作不能达到实验目的的是( )
实验目的 实验操作
A 焰色试验后为了除去铂丝上杂质 将铂丝用盐酸洗净后,在酒精灯外焰上灼烧至与原来的火焰颜色相同
B 除去Na2CO3固体中的NaHCO3 将固体加热至恒重
C 探究维生素C的还原性 向盛有2mL黄色氯化铁(FeCl3)溶液的试管中滴加浓的维生素C溶液,观察颜色变化
D 制备Fe(OH)3胶体 将饱和FeCl3溶液滴加到NaOH浓溶液中
A. A B. B C. C D. D
8、下列说法正确的是( )
A.碳酸钙难溶于水,所以碳酸钙属于非电解质
B.溶于水能电离出氢离子的化合物都是酸
C.稀硝酸与活泼金属反应主要放出氢气,而浓硝酸则使金属钝化
D.将铝箔在酒精灯上加热至熔化,熔化的铝并不滴下,这是因为铝表面的氧化膜保护了铝
9、证明溶液中是否有Fe2+ , 其正确的操作顺序是( )
①加少许酸化的KMnO4溶液 ②加少许氯水 ③滴加少许KSCN溶液
A. ①② B. ②③ C. ①②③ D. ③②
10、下列说法正确的是( )
A. NaOH的摩尔质量为40g
B. 钠露置在空气中会发生一系列的变化,最终生成NaHCO3
C. 称取25g胆矾溶于1L水中,即可制得0.1mol·L-1的CuSO4溶液
D. 84消毒液不能与洁厕灵等酸性产品混用是为防止产生有毒的氯气
11、在含有FeCl3、FeCl2、AlCl3、NaCl的混合溶液中,加入足量的Na2O2固体,搅拌充分反应后,再加入过量盐酸,溶液中离子数目无变化的是( )
A. Na+ B. Al3+ C. Fe2+ D. Fe3+
12、某溶液含有K+、Fe3+、SO42-、OH-、I-中的几种。取样,滴加KSCN溶液后显血红色。为确定该溶液的组成,还需检验的离子是( )
A. K+ B. I- C. SO42- D. OH-
13、某无色溶液能与铝反应放出氢气,则该溶液中肯定不能大量共存的离子组是( )
A. NH4+、Na+、Ba2+、Cl- B. Na+、I-、HCO3-、SO42-
C. K+、Cl-、SO32-、[Al(OH)4]- D. Na+、Mg2+、SO42-、Cl-
14、常温时,将0.1 molFe(NO3)3和2molHCl溶于水得2L混合溶液,然后向该溶液投入m克铁粉使其充分反应后,滴加KSCN溶液不变红色。下列有关说法正确的是( )
A. 由于氧化性Fe3+>H+,首先发生的反应是:Fe+2Fe3+=3Fe2+
B. 当加入16.8g铁粉时,可生成标准状况下6.72L气体
C. 在铁粉充分反应后的溶液中,溶质含有硝酸亚铁和氯化铁
D. m至少等于28g,反应过程中溶液的质量一直在减小
二、非选择题。(4题)
15、铁是一种重要的金属材料,它的单质及化合物在生产生活中应用广泛。
(1)铁元素有三种常见的氧化物,分别是 FeO、Fe2O3、Fe3O4.其中具有磁性的是 ________,可作为红色颜料的是________。
(2)某补铁口服液中含有 Fe2+,为检验其是否被氧化变质,可取少量该口服液,向其中滴加 KSCN 溶液,若溶液变为________色,则说明其已变质。向该口服液中加入维生素 C 可防止其被氧化变质,此过程中利用了维生素 C 的________性。
(3)FeCl3可作为铜电路板的腐蚀液,其反应原理为Cu与FeCl3溶液反应生成FeCl2和CuCl2,该反应的化学方程式为________ 。
16、(1)在________ mol Al2(SO4)3中含0.3 mol SO42– , 含Al3+约________个。
(2)同温同压下,相同质量的SO2气体和SO3气体,其分子数之比为________,密度之比为________。
(3)质量同为46 g的两种气体,NO2和N2O4 , 物质的量之比为________,二者所含O原子个数之比为________。
17、(1)I.NaNO2和食盐外观很像,曾出现误把NaNO2当食盐而造成人员中毒的事情,在酸性溶液中它也是一种氧化剂,如NaNO2能把Fe2+氧化成Fe3+。已知NaNO2水溶液呈碱性,AgNO2是一种难溶于水白色固体。NaCl溶液呈中性。试回答下列问题:
人体正常的血红蛋白含有Fe2+。若误食亚硝酸盐,如NaNO2,则导致血红蛋白中的Fe2+转化为Fe3+而中毒(FeCl2溶液为浅绿色,FeCl3溶液为棕黄色),可以服用维生素C解毒,维生素C在解毒的过程中表现出________(填“氧化”或“还原”)性。
(2)下列方法中,不能用来区分NaNO2和NaCl的是__________。
A.测溶液的酸碱性
B.加入AgNO3溶液观察是否有沉淀生成
C.分别在它们的酸性溶液中加入FeCl2溶液,观察溶液颜色变化
(3)II.H3PO2是精细磷化工产品。工业制备原理如下:
a.2P4+3Ba(OH)2+6H2O=3Ba(H2PO2)2+2PH3↑
b.Ba(H2PO2)2+H2SO4=BaSO4↓+2H3PO2
下列推断正确的是__________
A.反应a是氧化还原反应,反应b是复分解反应
B.H3PO2中P化合价是+1
C.在反应a中发生氧化反应与还原反应的原子个数之比为1:1
(4)某离子反应涉及到H2O、ClO-、NH4+、OH-、N2、Cl-等微粒,其中N2、ClO-的粒子数随时间变化的曲线如图所示,请写出反应的离子方程________,ClO-表现出________性。
(5)用洁净的烧杯取少量蒸馏水,用酒精灯加热至沸腾,向烧杯中逐滴滴入物质M的饱和水溶液,继续煮沸至液体呈红褐色,停止加热。写出该过程反应的化学方程式________。
18、将5 g钠铝合金投入一定量水中,固体完全溶解,产生4.48 L(标准状况下)气体,反应后所得溶液体积为200 mL且只有一种溶质。回答下列问题:
(1)处理计算问题,通常可以用图示分析的方法。
写出化学式:A ,B ,C 。
经过分析得出,钠铝合金中两金属的物质的量之比为 。
(2)所得溶液的物质的量浓度为 。(假设溶液体积变化忽略不计)
第三章 铁 金属材料自测习题含答案2022—2023学年上学期高一化学人教(2019)必修第一册
人教(2019)必修第一册第三章 铁 金属材料
一、选择题。(14题)
1、证明某溶液中只含Fe2+而不含Fe3+的实验方法是( )
A. 只滴加KSCN溶液
B. 先滴加KSCN溶液,不显红色,再滴加氯水后显红色
C. 先滴加氯水,再滴加KSCN溶液后显红色
D. 滴加NaOH溶液,产生白色沉淀
【答案】B
2、在适当条件下不能与铁反应的物质是( )
A.氯气 B.盐酸 C.硫酸铜溶液 D.氢氧化钠溶液
【答案】D
3、将过量的Na2O2投入FeCl2溶液中,可观察到的现象是 ( )
A.有白色沉淀生成 B.有红褐色沉淀生成
C.溶液由浅绿色变为黄色 D.不可能有无色气体产生
【答案】B
4、铝合金在日常生活、航空航天和汽车制造等方面均有广泛用途。下列关于铝的说法正确的是 ( )
A.铝的表面容易形成致密的氧化膜,抗腐蚀性能好
B.常温下不与任何酸、碱反应
C.铝元素在地壳中的含量高,储量丰富,仅次于铁
D.工业上通常用钠与铝盐溶液反应来制备铝
【答案】A
5、实验室用足量的锌粒和100 mL稀硫酸制备氢气,当收集到标准状况下1.12 L H2时,反应停止,下列说法不正确的是( )
A.稀硫酸中H+的浓度是0.5 mol·L-1
B.消耗硫酸的物质的量是0.05 mol
C.消耗锌的质量是3.25 g
D.氢气中可能混有水蒸气
【答案】A
6、如图所示,下列说法错误的是( )
A. 图I表示向以AlCl3溶液中滴加氨水至过量
B. 图Ⅱ表示向NaOH溶液中滴加AlCl3溶液至过量且边滴边振荡
C. 图Ⅲ表示向NaAlO2溶液中滴加稀盐酸至过量且边滴边振荡
D. 图IV表示向NaAlO2溶液中缓慢通入二氧化碳至过量
【答案】A
7、下列操作不能达到实验目的的是( )
实验目的 实验操作
A 焰色试验后为了除去铂丝上杂质 将铂丝用盐酸洗净后,在酒精灯外焰上灼烧至与原来的火焰颜色相同
B 除去Na2CO3固体中的NaHCO3 将固体加热至恒重
C 探究维生素C的还原性 向盛有2mL黄色氯化铁(FeCl3)溶液的试管中滴加浓的维生素C溶液,观察颜色变化
D 制备Fe(OH)3胶体 将饱和FeCl3溶液滴加到NaOH浓溶液中
A. A B. B C. C D. D
【答案】D
8、下列说法正确的是( )
A.碳酸钙难溶于水,所以碳酸钙属于非电解质
B.溶于水能电离出氢离子的化合物都是酸
C.稀硝酸与活泼金属反应主要放出氢气,而浓硝酸则使金属钝化
D.将铝箔在酒精灯上加热至熔化,熔化的铝并不滴下,这是因为铝表面的氧化膜保护了铝
【答案】D
9、证明溶液中是否有Fe2+ , 其正确的操作顺序是( )
①加少许酸化的KMnO4溶液 ②加少许氯水 ③滴加少许KSCN溶液
A. ①② B. ②③ C. ①②③ D. ③②
【答案】D
10、下列说法正确的是( )
A. NaOH的摩尔质量为40g
B. 钠露置在空气中会发生一系列的变化,最终生成NaHCO3
C. 称取25g胆矾溶于1L水中,即可制得0.1mol·L-1的CuSO4溶液
D. 84消毒液不能与洁厕灵等酸性产品混用是为防止产生有毒的氯气
【答案】D
11、在含有FeCl3、FeCl2、AlCl3、NaCl的混合溶液中,加入足量的Na2O2固体,搅拌充分反应后,再加入过量盐酸,溶液中离子数目无变化的是( )
A. Na+ B. Al3+ C. Fe2+ D. Fe3+
【答案】B
12、某溶液含有K+、Fe3+、SO42-、OH-、I-中的几种。取样,滴加KSCN溶液后显血红色。为确定该溶液的组成,还需检验的离子是( )
A. K+ B. I- C. SO42- D. OH-
【答案】A
13、某无色溶液能与铝反应放出氢气,则该溶液中肯定不能大量共存的离子组是( )
A. NH4+、Na+、Ba2+、Cl- B. Na+、I-、HCO3-、SO42-
C. K+、Cl-、SO32-、[Al(OH)4]- D. Na+、Mg2+、SO42-、Cl-
【答案】 B
14、常温时,将0.1 molFe(NO3)3和2molHCl溶于水得2L混合溶液,然后向该溶液投入m克铁粉使其充分反应后,滴加KSCN溶液不变红色。下列有关说法正确的是( )
A. 由于氧化性Fe3+>H+,首先发生的反应是:Fe+2Fe3+=3Fe2+
B. 当加入16.8g铁粉时,可生成标准状况下6.72L气体
C. 在铁粉充分反应后的溶液中,溶质含有硝酸亚铁和氯化铁
D. m至少等于28g,反应过程中溶液的质量一直在减小
【答案】B
二、非选择题。(4题)
15、铁是一种重要的金属材料,它的单质及化合物在生产生活中应用广泛。
(1)铁元素有三种常见的氧化物,分别是 FeO、Fe2O3、Fe3O4.其中具有磁性的是 ________,可作为红色颜料的是________。
(2)某补铁口服液中含有 Fe2+,为检验其是否被氧化变质,可取少量该口服液,向其中滴加 KSCN 溶液,若溶液变为________色,则说明其已变质。向该口服液中加入维生素 C 可防止其被氧化变质,此过程中利用了维生素 C 的________性。
(3)FeCl3可作为铜电路板的腐蚀液,其反应原理为Cu与FeCl3溶液反应生成FeCl2和CuCl2,该反应的化学方程式为________ 。
【答案】 (1)Fe3O4;Fe2O3 (2)红;还原性
(3)Cu+2FeCl3=2FeCl2+CuCl2
16、(1)在________ mol Al2(SO4)3中含0.3 mol SO42– , 含Al3+约________个。
(2)同温同压下,相同质量的SO2气体和SO3气体,其分子数之比为________,密度之比为________。
(3)质量同为46 g的两种气体,NO2和N2O4 , 物质的量之比为________,二者所含O原子个数之比为________。
【答案】(1)0.1;1.204×1023
(2)5︰4;4︰5 (3)2︰1;1︰1
17、(1)I.NaNO2和食盐外观很像,曾出现误把NaNO2当食盐而造成人员中毒的事情,在酸性溶液中它也是一种氧化剂,如NaNO2能把Fe2+氧化成Fe3+。已知NaNO2水溶液呈碱性,AgNO2是一种难溶于水白色固体。NaCl溶液呈中性。试回答下列问题:
人体正常的血红蛋白含有Fe2+。若误食亚硝酸盐,如NaNO2,则导致血红蛋白中的Fe2+转化为Fe3+而中毒(FeCl2溶液为浅绿色,FeCl3溶液为棕黄色),可以服用维生素C解毒,维生素C在解毒的过程中表现出________(填“氧化”或“还原”)性。
(2)下列方法中,不能用来区分NaNO2和NaCl的是__________。
A.测溶液的酸碱性
B.加入AgNO3溶液观察是否有沉淀生成
C.分别在它们的酸性溶液中加入FeCl2溶液,观察溶液颜色变化
(3)II.H3PO2是精细磷化工产品。工业制备原理如下:
a.2P4+3Ba(OH)2+6H2O=3Ba(H2PO2)2+2PH3↑
b.Ba(H2PO2)2+H2SO4=BaSO4↓+2H3PO2
下列推断正确的是__________
A.反应a是氧化还原反应,反应b是复分解反应
B.H3PO2中P化合价是+1
C.在反应a中发生氧化反应与还原反应的原子个数之比为1:1
(4)某离子反应涉及到H2O、ClO-、NH4+、OH-、N2、Cl-等微粒,其中N2、ClO-的粒子数随时间变化的曲线如图所示,请写出反应的离子方程________,ClO-表现出________性。
(5)用洁净的烧杯取少量蒸馏水,用酒精灯加热至沸腾,向烧杯中逐滴滴入物质M的饱和水溶液,继续煮沸至液体呈红褐色,停止加热。写出该过程反应的化学方程式________。
(【5的条件】)【答案】 (1)还原 (2)B (3)A,B
(4)2NH +3ClO-+2OH-=N2+3Cl-+5H2O;氧化
(5)FeCl3 +3H2O Fe(OH)3(胶体)+3HCl
18、将5 g钠铝合金投入一定量水中,固体完全溶解,产生4.48 L(标准状况下)气体,反应后所得溶液体积为200 mL且只有一种溶质。回答下列问题:
(1)处理计算问题,通常可以用图示分析的方法。
写出化学式:A ,B ,C 。
经过分析得出,钠铝合金中两金属的物质的量之比为 。
(2)所得溶液的物质的量浓度为 。(假设溶液体积变化忽略不计)
【答案】(1)H2 NaOH NaAlO2 1∶1 (2)0.5 mol·L-1
