1.1 原子结构精美课件
图片预览








文档简介
课件107张PPT。第一章 原子结构与性质第一节 原子结构第一章 原子结构与性质第一节 原子结构 (第1课时)问题:宇宙大爆炸是怎么回事?物质是由原子构成的,那么原子是怎样诞生的呢? 宇宙中最丰富的元素是那一种?
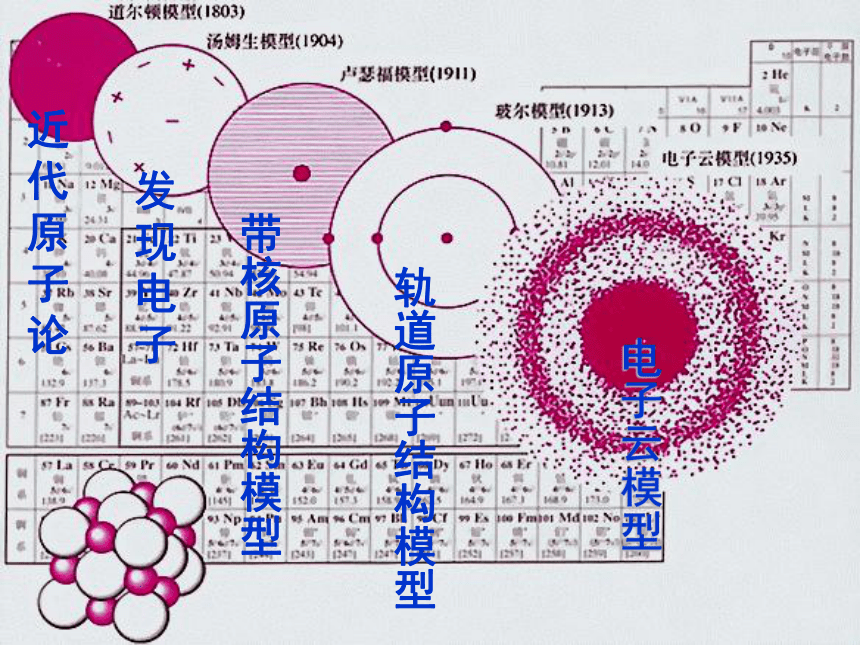
宇宙年龄有多大?地球年龄有多大? 氢元素是宇宙中最丰富的元素,占88.6%(氦约为氢的1/8),另外还有90多种元素,它们的原子总数加起来不足1%。宇宙年龄距近约140亿年,地球年龄已有46亿年。地球上的元素绝大多数是金属,非金属仅22种。一、开天辟地—原子的诞生一颗原子的时空之旅————从大爆炸到生命诞生的故事 人类认识原子的过程 人类在认识自然的过程中,经历了无数的艰辛,正是因为有了无数的探索者,才使人类对事物的认识一步步地走向深入,也越来越接近事物的本质。随着现代科学技术的发展,我们现在所学习的科学理论,还会随着人类对客观事物的认识而不断地深入和发展。近代原子论发现电子带核原子结构模型轨道原子结构模型电子云模型近代科学原子论(1803年)一切物质都是由最小的不能再分的粒子——原子构成。
原子模型:原子是坚实的、不可再分的实心球。英国化学家道尔顿
(J.Dalton , 1766~1844)道尔顿原子模型原子并不是构成物质的最小微粒 ——汤姆生发现了电子(1897年)电子是种带负电、有一定质量的微粒,普遍存在于各种原子之中。
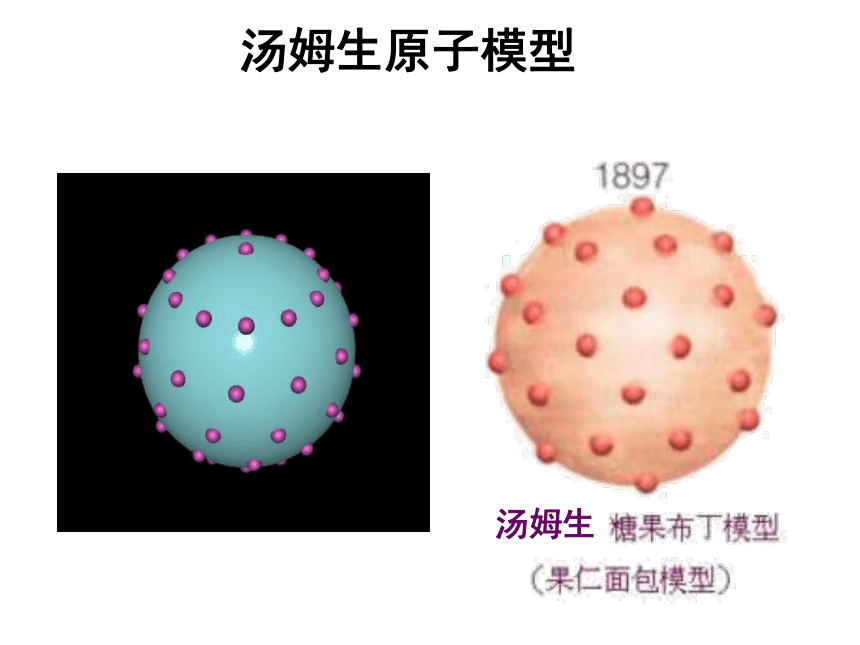
汤姆生原子模型:原子是一个平均分布着正电荷的粒子,其中镶嵌着许多电子,中和了电荷,从而形成了中性原子。原子是一个球体,正电荷均匀分布在整个球体内,电子像面包里的葡萄干镶嵌其中。英国物理学家汤姆生
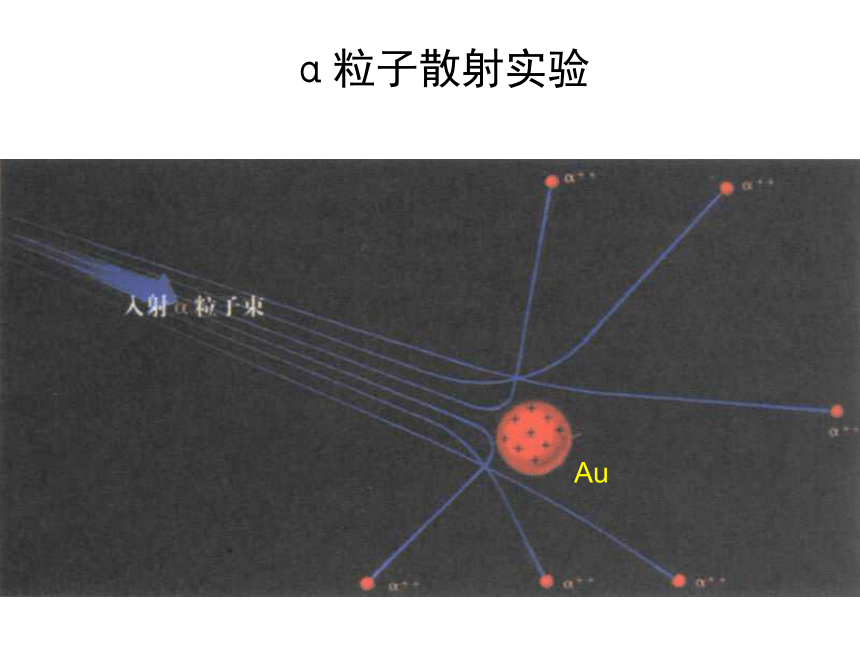
(J.J.Thomson ,1856~1940)汤姆生原子模型汤姆生原子模型汤姆生α粒子散射实验(1909年) ——原子有核卢瑟福和他的助手做了著名α粒子散射实验。根据实验,卢瑟福在1911年提出原子有核模型。
卢瑟福原子模型(又称行星原子模型):原子是由居于原子中心的带正电的原子核和核外带负电的电子构成。原子核的质量几乎等于原子的全部质量,电子在原子核外空间绕核做高速运动。英国科学家卢瑟福
(E.Rutherford,1871~1937)卢瑟福原子模型α粒子散射实验Au卢瑟福原子模型玻尔原子模型(1913年)玻尔借助诞生不久的量子理论改进了卢瑟福的模型。
玻尔原子模型(又称分层模型):当原子只有一个电子时,电子沿特定球形轨道运转;当原子有多个电子时,它们将分布在多个球壳中绕核运动。
不同的电子运转轨道是具有一定级差的稳定轨道。丹麦物理学家玻尔
(N.Bohr,1885~1962)玻尔原子模型玻尔原子模型(1913年)电子云模型电子云模型(1935年)现代物质结构学说氢原子电子云图二、能层与能级(1)能层 在多电子的原子核外电子的能量是不同的,按电子的能量差异,可以将核外电子分成不同的能层。依据核外电子的能量不同:
离核远近:近 远
能量高低:低 高核外电子分层排布(2)能级表示方法及各能级所容纳的最多电子数: 在多电子原子中,同一能层的电子,能量可以不同,还可以把它们分成能级。【学与问】2.不同的能层分别有多少个能级,与能层的序数(n)间存在什么关系?能层最多可容纳的电子数为2n2个。【学与问】1.原子核外电子的每一个能层最多可容纳的电子数与能层的序数(n)间存在什么关系?第一能层只有1个能级(1s),第二能层有2个能级(2s和2p),第3能层有3个能级(3s、3p和3d),依次类推。以s、p、d、f······排序的各能级可容纳的最多电子数依次为1、3、5、7的二倍!【学与问】3.英文字母相同的不同能级中所容纳的最多电子数是否相同? 不同能级中的s级,所容纳的电子数是相同的,但是能量是不同的。①能层的能级数等于该能层序数。
②任一能层的能级总是从s能级开始。
③在每一能层中,能级符号与能量大小的顺序是:ns<np<nd<nf…总结:A.前者大于后者 B.后者大于前者 C.前者等于后者 D.无法确定B练习1:在同一个原子中,M能层上的电子与Q能层上的电子的能量( )能表示核外电子排布【思考】怎样用能层,能级表示核外电子排布?练习2:依据以上各能级最多容纳电子数C原子的核外电子排布式可以表示为:1S22S22P2
依照上式请书写 N O F Na Mg Al 的电子排布式第一章 原子结构与性质第一节 原子结构 (第2课时)问题探究 根据已有知识,试写出K原子的可能电子排布式与原子结构示意图?猜想一: 1s22s22p63s23p63d1 猜想二: 1s22s22p63s23p64s1 三、构造原理与电子排布式 构造原理:P5
随原子核电荷数递增,绝大多数原子核外电子的排布遵循如右图的排布顺序,这个排布顺序被称为构造原理。【思考】:有何规律?能级交错核 外 电 子 填 充 顺 序 图构造原理: 1s;2s 2p;3s 3p;4s 3d 4p;
规律 5s 4d 5p; 6s 4f 5d 6p;7s 5f 6d问题解释: 猜想一: 1s22s22p63s23p63d1 猜想二: 1s22s22p63s23p64s1 各能层能级能量关系 构造原理中排布顺序的实质(1)相同能层的不同能级的能量高低顺序 :
(2)英文字母相同的不同能级的能量高低顺序:
(3) 不同层不同能级可由下面的公式得出:
-----各能级的能量高低顺序 ns<np<nd<nf1s<2s<3s<4s;2p<3p<4p; 3d<4dns<(n-2)f<(n-1)d<np (n为能层序数)2、根据2n2的规律推算第一到第四电子层最多可以容纳的电子数目为? ???????? 。1、按能量由低到高的顺序排列,正确的一组是:( )
A.1s、2p、3d、4s B.1s、2s、3s、2p
C.2s、2p、3s、3p D.4p、3d、4s、3p2、8、18、32C练习:钙Ca 1s22s22p63s23p64s2钙Ca4、电子排布式:氢 H
钠 Na
铝 Al1s22s22p63s11s22s22p63s23p11s1 用数字在能级符号右上角表明该能级上的排布的电子数。原子结构示意图电子排布式Li: 1s22s1请写出4~10号元素原子的电子排布式。 4 铍Be
5 硼B
6 碳C
7 氮N
8 氧O
9 氟F
10 氖Ne1s2 2s2
1s2 2s22p1
1s2 2s22p2
1s2 2s22p3
1s2 2s22p4
1s2 2s22p5
1s2 2s22p6【练习】试书写N、Cl、K、26Fe原子的核外电子排布式。 Cl:
K:
26Fe:1s2 2s22p6 3s23p51s2 2s22p6 3s23p6 4s11s2 2s22p6 3s23p63d6 4s2注意书写:1s2 2s22p6 3s23p64s2 3d6练习:请根据构造原理,写出下列元素基态原子的电子排布式:
(1)Ne?????????????? ??? ?? ???。
(2)S ???????????????? ??????。
(3)29Cu ????????? ??? ?????????。
(4)32Ge ????????????? ??????。1s22s22p61s22s22p63s23p41s22s22p63s23p63d104s11s22s22p63s23p63d104s24p2练习:请写出第四周期21—36号元素原子的基态电子排布式。钪Sc: ;
钛Ti: ;
钒V: ;
铬Cr: ;
锰Mn: ;
铁Fe: ;
钴Co: ;
镍Ni: ;1s22s22p63s23p63d14s21s22s22p63s23p63d24s21s22s22p63s23p63d34s21s22s22p63s23p63d54s11s22s22p63s23p63d54s21s22s22p63s23p63d64s21s22s22p63s23p63d74s21s22s22p63s23p63d84s2练习:请写出第四周期21—36号元素原子的基态电子排布式。铜Cu: ;
锌Zn: ;
镓Ga: ;
锗Ge: ;
砷As: ;
硒Se: ;
溴Br: ;
氪Kr: ;1s22s22p63s23p63d104s11s22s22p63s23p63d104s21s22s22p63s23p63d104s24p11s22s22p63s23p63d104s24p21s22s22p63s23p63d104s24p31s22s22p63s23p63d104s24p41s22s22p63s23p63d104s24p51s22s22p63s23p63d104s24p61s22s22p63s23p63d54s11s22s22p63s23p63d104s1练习:1~36号元素中是否都遵循构造原理?
举出能否具体的例子?注 意原子的简化电子排布:原子实[Ne]3s1练习:写出第8号元素氧、第14号元素硅和第26号元素铁的简化电子排布式吗?上式方括号里的符号的意义是:该元素前一个周期的惰性气体电子排布结构Na的简化电子排布:[He]2s22p4[Ne]3s23p2[Ar]3d64s2下列各原子或离子的电子排布式错误的是( )A. Ca2+ 1s22s22p63s23p6B. O2- 1s22s23p4C. Cl- 1s22s22p63s23p5D. Ar 1s22s22p63s23p6BC练习 1:练习2:
1.电子排布式为1s22s22p63s23p6 某原子, 则该元素的核电荷数是____________ 2.某元素原子的价电子构型为3s23p4, 则此元素在周期表的位置是____________18第3周期,第VIA族4.构造原理揭示的电子排布能级顺序,实质是 各能级能量高低,若以E 表示某能级的能量,下列能量大小顺序中正确的是 ( )
A.E(3s)>E(2s)>E(1s)
B.E(3s)>E(3p)>E(3d)
C.E(4f)>E(4s)>E(3d)
D.E(5s)>E(4s)>E(4f) 3.一个电子排布为1s22s22p63s23p1的元素最可能的价态是( )
A? +1 B? +2 C? +3 D? -1 CA5.下列各原子或离子的电子排布式错误的是( )
A.Al 1s22s22p63s23p1 B. O2- 1s22s22p6
C.Na+ 1s22s22p6 D. Si 1s22s22p2
6.下列表达方式错误的是( )
A.甲烷的电子式
B.氟化钠的电子式
C.硫离子的核外电子排布式 1s22s22p63s23p4
D.碳-12原子符号 126CDC第一章 原子结构与性质第一节 原子结构 (第3课时)四.能量最低原理、基态与激发态、光谱能量最低原理: 原子的电子排布遵循构造原理能使整个原子的能量处于最低状态。 基态原子: 处于最低能量的原子 (稳定)电子放出能量↓电子吸收能量↓如:Na 1s22s22p63s1如:Na 1s22s22p63p1 基态与激发态的关系原子光谱基态原子激发态原子吸收能量释放能量发射光谱吸收光谱能量较高能量最低基态与激发态相互转化的应用 焰色
反应 焰色反应就是某些金属原子的电子在高温火焰中,接受了能量,使原子外层的电子从基态激跃迁到激发态;处于激发态的电子是十分不稳定的,在极短的时间内(约10-8s)便跃迁到基态或较低的能级上,并在跃迁过程中将能量以一定波长(颜色)的光释放出来。由于各种元素的能级是被限定的,因此在向基态跃迁时释放的能量也就不同。碱金属及碱土金属的能级差正好对应于可见光范围,于是我们就看到了各种色彩。 焰火呈现五颜六色的原因处于最低能量的原子________________________________________________________ ,简称能量最低原理。
_____________________叫做基态原子。 当基态原子的电子吸收能量后,电子会______________,变成激发态原子。电子从较高能量的激发态跃迁到较低能量的激发态乃至基态时,将_________能量。光(辐射)是电子___________能量的重要形式之一。原子的电子排布遵循构造原理能使整个原子的能量处于最低状态 跃迁到较高能级 释放 释放
1.当镁原子由1s22s22p63s2 →1s22s22p63p2时,以下说法正确的是( )
A.镁原子由基态转化成激发态,这一过程中吸收能量
B.镁原子由激发态转化成基态,这一过程中释放能量
C.镁原子由基态转化成激发态,这一过程中释放能量
D.镁原子由激发态转化成基态,这一过程中吸收能量A课堂练习2.判断下列表达是正确还是错误?
(1) 1s22s2 2p63s2 3p63d54s2 属于激发态
(2) 1s22s2 2p63d1 属于激发态构造原理: 1s;2s 2p;3s 3p;4s 3d 4p;
5s 4d 5p; 6s 4f 5d 6p;7s 5f 6d光的色散光谱:按一定次序排列的彩色光带用光谱仪测定氢气放电管发射的氢的发射光谱锂、氦、汞的发射光谱 锂、氦、汞的吸收光谱 特征:暗背景,
亮线,
线状不连续特征:亮背景,
暗线,
线状不连续原子光谱 不同元素的原子发生跃迁时会吸收或释放不同的光,可以用光谱仪摄取各种元素的电子的吸收光谱或发射光谱,总称原子光谱。
光谱分析: 在现代化学中,常利用原子光谱上的特征谱线来鉴定元素,称为光谱分析。元素的发现等②化学研究中利用光谱分析检测一些物质的存在与含量等。 光谱分析的应用①通过原子光谱发现许多元素。如:铯(1860年)和铷(1861年),其光谱中有特征的篮光和红光。
又如:1868年科学家们通过太阳光谱的分析发现了稀有气体氦。下图是锂、氦、汞的吸收光谱和发射光谱。其中图_______是原子由基态转化为激发态时的吸收光谱,图_______是原子由激发态转化为基态时的发射光谱。不同元素的原子光谱上的特征谱线不同,请在下图中用线段将同种元素的吸收光谱和发射光谱连接。①③⑤②④⑥课堂练习2.关于光谱分析,下列说法错误的( )
A、光谱分析的依据是每种元素都有其独特的
特征谱线
B、光谱分析不能用连续光谱
C、光谱分析既可以用发射谱也可以用吸收光谱
D、分析月亮的光谱可得知月球的化学组成 D3.在太阳的光谱中有许多暗线,这表明( )
A、太阳内部含有这些暗线所对应的元素
B、太阳大气层中缺少这些暗线所对应的元素
C、太阳大气层中含有这些暗线所对应的元素
D、地球的大气层中含有这些暗线所对应的元素 课堂练习C第一章 原子结构与性质第一节 原子结构 (第4课时)思考:宏观物体的运动特征:可以准确地测出它们在某一时刻所处的 位置及运行的速度;
可以描画它们的运动轨迹。五、电子云与原子轨道⑴ 核外电子质量小(只有9.11×10-31 kg),运动空间小(相对于宏观物体而言),运动速率大(近光速)。
核外电子运动的特征⑵无确定的轨道,无法描述其运动轨迹。⑶无法计算电子在某一刻所在的位置,只能指出
其在核外空间某处出现的机会的多少(概率)。测不准原理(海森堡)电子云:电子在原子核外出现的概率分布图。1s电子在原子核外出现的概率分布图 核外电子运动状态的描述 电子云只是形象地表示 电子出现在各点的概率高低,而实际上并不存在。 小黑点不表示电子,只表示电子在这里出现过一次。小黑点的疏密表示电子在核外空间内出现的机会的多少。电子轮廓图的制作 常把电子出现的概率约为90%的空间圈出来,人们把这种电子云轮廓图称为原子轨道。 P10 最后一段电子云轮廓图——原子轨道S能级的原子轨道是球形对称的.电子云形状
①s电子云呈球形,在半径相同的球面上,电子出现的机会相同;
②p电子云呈哑铃形 (或纺锤形);
③d电子云是花瓣形;
④f电子云更为复杂。原子轨道S能级的原子轨道图* S能级的原子轨道是球形对称的* 能层序数n越大,原子轨道半径越大* P能级的原子轨道是哑铃形的,每个P能级有3个原子轨道,它们相互垂直,分别以Px,Py,PZ表示。 P能级的原子轨道图原子轨道图S能级的原子轨道图P能级的原子轨道图d能级的原子轨道图思考:回忆 s p d f 能级分别最多容纳电子个数?P5 第二段最后一句话观察下图,这些图称为原子的电子排布图。1.每个原子轨道最多只能容纳几个电子?2.当电子排在同一个能级内时,有什么规律?科学探究 1个原子轨道里最多只能容纳2个电子,且自旋方向相反(顺时针、逆时针)。 ---泡利原理 当电子排布在同一能级的不同轨道时,总是优先单独占据一个轨道,而且自旋方向相同。---洪特规则 泡利(Pauli),奥地利科学家,对于量子力学的形成以及原子结构理论的发展有重大的贡献,获得1945年诺贝尔物理奖。他对科学理论有着很深刻的洞察力,语锋犀利,被称为“理论物理学的心脏” 。 泡利原理 一个原子轨道中最多只能容纳两个电子,且这两个电子的自旋方向必须相反,此时体系最稳定,原子的总能量最低。 泡利不相容原理电子排布式1s 2s电子排布图 用一个○表示一个原子轨道,在○中用“↑”或“↓”表示该轨道上排入的电子。Li: 1s22s1洪特规则 对于基态原子,电子在能量相同的轨道上排布时,将尽可能分占不同的轨道并且自旋方向相同。 C :1s2 2s22p2
√1.每个原子轨道上最多能容纳____个电子,且自旋方向_______科学研究2.当电子排在同一能级时有什么规律?当电子排布在同一能级的不同轨道时,总是___________________,而且自旋方向______——洪特规则2不同——泡利原理首先单独占一个轨道相同NOC练习1:写出 24Cr 29Cu 电子排布式29Cu 1s22s22p63s23p63d104s124Cr 1s22s22p63s23p63d54s1洪特规则特例: 洪特规则特例: 相对稳定的状态全充满(p6,d10,f14)全空时(p0,d0,f0)半充满(p3,d5,f7)泡利原理:
洪特规则: 当电子排布在同一能级的不同轨道时,总是优先单独占一个轨道(即分占不同的轨道),而且自旋状态相同。 一个原子轨道最多容纳2个电子,而且自旋方向相反。洪特规则特例:全空、半充满、全充满时相对稳定铁原子的电子排布图↑↓↑↓↑↓↑↓↑↓↑↓↑↓↑↓↑↓↑↓↑↓↑↑↑↑洪特规则泡利原理能量最低原理1s2s2p3p3d3s4s 能量最低原理表述的是“整个原子处于能量最低状态”,而不是说电子填充到能量最低的轨道中去,泡利原理和洪特规则都使“整个原子处于能量最低状态”。注意:小结:核外电子排布规则1.能量最低原理 2.泡利不相容原理 3.洪特规则 ↑↑↑↑↑↑↑↑↑↑↑↓↑↓↑↓↑↓3.其中最能准确表示基态锰原子核外电子运动状态的是( )ABCDC想一想↑↓↑↓↑↑↓4.当碳原子的核外电子排布由转变为时,下列说法正确的是 ( )A.碳原子由基态变为激发态
B.碳原子由激发态变为基态
C.碳原子要从外界环境中吸收能量
D.碳原子要向外界环境释放能量A C 巩固1s2s2p3s3p3d5.下列有关原子轨道的叙述中不正确的( )
A.氢原子的3s轨道能量较3p能级低
B.锂原子的2s与5s 轨道皆为球形分布
C.p能级的原子轨道呈纺锤形,随着能层序数的增加,p能级原子轨道也在增多
D.能层n=4的原子轨道最多可容纳16个电子课堂练习CD6.基态碳原子的最外能层的各能级中,电子排布的方式正确的是( )
A B C D
C课堂练习7、以下是表示铁原子的3种不同化学用语。 请你通过比较、归纳,分别说出3种不同化学用语所能反映的粒子结构信息。 结构示意图:能直观地反映核内的质子数和核外的电子层数
及各能层上的电子数。
电子排布式:能直观地反映核外电子的能层、能级和各能级
上的电子数。
电子排布图:能反映各轨道的能量的高低及各轨道上的电子
分布情况,自旋方向。 小结:一、原子核外电子排布遵循的原理和规则二、原子核外电子排布的表示式能量最低原则泡利不相容原理洪特规则电子排布式电子排布图确定原子序数 解答基态原子电子排布问题的一般思路:能级排布电子排布小结:巩固练习1、某元素原子序数为24,试问:(1)该元素电子排布式:1s2 2s22p6 3s23p63d5 4s1(2)它有 个能层; 个能级;占有 个原子轨道。(3)此元素有 个未成对电子;它的价电子数是 。647156巩固练习2、填表:41s22s2第2周期第ⅡA族13第3周期第ⅢA族Al221s22s22p63s23p63d24s2TiCu第4周期第ⅣB族1s22s22p63s23p63d104s1第4周期第ⅠB族321s22s22p63s23p63d104s24p2第4周期第ⅣA族 鲍林(Pauling),卓越的美国化学家。主要研究结构化学,曾获1954年诺贝尔化学奖和1963年诺贝尔和平奖。
宇宙年龄有多大?地球年龄有多大? 氢元素是宇宙中最丰富的元素,占88.6%(氦约为氢的1/8),另外还有90多种元素,它们的原子总数加起来不足1%。宇宙年龄距近约140亿年,地球年龄已有46亿年。地球上的元素绝大多数是金属,非金属仅22种。一、开天辟地—原子的诞生一颗原子的时空之旅————从大爆炸到生命诞生的故事 人类认识原子的过程 人类在认识自然的过程中,经历了无数的艰辛,正是因为有了无数的探索者,才使人类对事物的认识一步步地走向深入,也越来越接近事物的本质。随着现代科学技术的发展,我们现在所学习的科学理论,还会随着人类对客观事物的认识而不断地深入和发展。近代原子论发现电子带核原子结构模型轨道原子结构模型电子云模型近代科学原子论(1803年)一切物质都是由最小的不能再分的粒子——原子构成。
原子模型:原子是坚实的、不可再分的实心球。英国化学家道尔顿
(J.Dalton , 1766~1844)道尔顿原子模型原子并不是构成物质的最小微粒 ——汤姆生发现了电子(1897年)电子是种带负电、有一定质量的微粒,普遍存在于各种原子之中。
汤姆生原子模型:原子是一个平均分布着正电荷的粒子,其中镶嵌着许多电子,中和了电荷,从而形成了中性原子。原子是一个球体,正电荷均匀分布在整个球体内,电子像面包里的葡萄干镶嵌其中。英国物理学家汤姆生
(J.J.Thomson ,1856~1940)汤姆生原子模型汤姆生原子模型汤姆生α粒子散射实验(1909年) ——原子有核卢瑟福和他的助手做了著名α粒子散射实验。根据实验,卢瑟福在1911年提出原子有核模型。
卢瑟福原子模型(又称行星原子模型):原子是由居于原子中心的带正电的原子核和核外带负电的电子构成。原子核的质量几乎等于原子的全部质量,电子在原子核外空间绕核做高速运动。英国科学家卢瑟福
(E.Rutherford,1871~1937)卢瑟福原子模型α粒子散射实验Au卢瑟福原子模型玻尔原子模型(1913年)玻尔借助诞生不久的量子理论改进了卢瑟福的模型。
玻尔原子模型(又称分层模型):当原子只有一个电子时,电子沿特定球形轨道运转;当原子有多个电子时,它们将分布在多个球壳中绕核运动。
不同的电子运转轨道是具有一定级差的稳定轨道。丹麦物理学家玻尔
(N.Bohr,1885~1962)玻尔原子模型玻尔原子模型(1913年)电子云模型电子云模型(1935年)现代物质结构学说氢原子电子云图二、能层与能级(1)能层 在多电子的原子核外电子的能量是不同的,按电子的能量差异,可以将核外电子分成不同的能层。依据核外电子的能量不同:
离核远近:近 远
能量高低:低 高核外电子分层排布(2)能级表示方法及各能级所容纳的最多电子数: 在多电子原子中,同一能层的电子,能量可以不同,还可以把它们分成能级。【学与问】2.不同的能层分别有多少个能级,与能层的序数(n)间存在什么关系?能层最多可容纳的电子数为2n2个。【学与问】1.原子核外电子的每一个能层最多可容纳的电子数与能层的序数(n)间存在什么关系?第一能层只有1个能级(1s),第二能层有2个能级(2s和2p),第3能层有3个能级(3s、3p和3d),依次类推。以s、p、d、f······排序的各能级可容纳的最多电子数依次为1、3、5、7的二倍!【学与问】3.英文字母相同的不同能级中所容纳的最多电子数是否相同? 不同能级中的s级,所容纳的电子数是相同的,但是能量是不同的。①能层的能级数等于该能层序数。
②任一能层的能级总是从s能级开始。
③在每一能层中,能级符号与能量大小的顺序是:ns<np<nd<nf…总结:A.前者大于后者 B.后者大于前者 C.前者等于后者 D.无法确定B练习1:在同一个原子中,M能层上的电子与Q能层上的电子的能量( )能表示核外电子排布【思考】怎样用能层,能级表示核外电子排布?练习2:依据以上各能级最多容纳电子数C原子的核外电子排布式可以表示为:1S22S22P2
依照上式请书写 N O F Na Mg Al 的电子排布式第一章 原子结构与性质第一节 原子结构 (第2课时)问题探究 根据已有知识,试写出K原子的可能电子排布式与原子结构示意图?猜想一: 1s22s22p63s23p63d1 猜想二: 1s22s22p63s23p64s1 三、构造原理与电子排布式 构造原理:P5
随原子核电荷数递增,绝大多数原子核外电子的排布遵循如右图的排布顺序,这个排布顺序被称为构造原理。【思考】:有何规律?能级交错核 外 电 子 填 充 顺 序 图构造原理: 1s;2s 2p;3s 3p;4s 3d 4p;
规律 5s 4d 5p; 6s 4f 5d 6p;7s 5f 6d问题解释: 猜想一: 1s22s22p63s23p63d1 猜想二: 1s22s22p63s23p64s1 各能层能级能量关系 构造原理中排布顺序的实质(1)相同能层的不同能级的能量高低顺序 :
(2)英文字母相同的不同能级的能量高低顺序:
(3) 不同层不同能级可由下面的公式得出:
-----各能级的能量高低顺序 ns<np<nd<nf1s<2s<3s<4s;2p<3p<4p; 3d<4dns<(n-2)f<(n-1)d<np (n为能层序数)2、根据2n2的规律推算第一到第四电子层最多可以容纳的电子数目为? ???????? 。1、按能量由低到高的顺序排列,正确的一组是:( )
A.1s、2p、3d、4s B.1s、2s、3s、2p
C.2s、2p、3s、3p D.4p、3d、4s、3p2、8、18、32C练习:钙Ca 1s22s22p63s23p64s2钙Ca4、电子排布式:氢 H
钠 Na
铝 Al1s22s22p63s11s22s22p63s23p11s1 用数字在能级符号右上角表明该能级上的排布的电子数。原子结构示意图电子排布式Li: 1s22s1请写出4~10号元素原子的电子排布式。 4 铍Be
5 硼B
6 碳C
7 氮N
8 氧O
9 氟F
10 氖Ne1s2 2s2
1s2 2s22p1
1s2 2s22p2
1s2 2s22p3
1s2 2s22p4
1s2 2s22p5
1s2 2s22p6【练习】试书写N、Cl、K、26Fe原子的核外电子排布式。 Cl:
K:
26Fe:1s2 2s22p6 3s23p51s2 2s22p6 3s23p6 4s11s2 2s22p6 3s23p63d6 4s2注意书写:1s2 2s22p6 3s23p64s2 3d6练习:请根据构造原理,写出下列元素基态原子的电子排布式:
(1)Ne?????????????? ??? ?? ???。
(2)S ???????????????? ??????。
(3)29Cu ????????? ??? ?????????。
(4)32Ge ????????????? ??????。1s22s22p61s22s22p63s23p41s22s22p63s23p63d104s11s22s22p63s23p63d104s24p2练习:请写出第四周期21—36号元素原子的基态电子排布式。钪Sc: ;
钛Ti: ;
钒V: ;
铬Cr: ;
锰Mn: ;
铁Fe: ;
钴Co: ;
镍Ni: ;1s22s22p63s23p63d14s21s22s22p63s23p63d24s21s22s22p63s23p63d34s21s22s22p63s23p63d54s11s22s22p63s23p63d54s21s22s22p63s23p63d64s21s22s22p63s23p63d74s21s22s22p63s23p63d84s2练习:请写出第四周期21—36号元素原子的基态电子排布式。铜Cu: ;
锌Zn: ;
镓Ga: ;
锗Ge: ;
砷As: ;
硒Se: ;
溴Br: ;
氪Kr: ;1s22s22p63s23p63d104s11s22s22p63s23p63d104s21s22s22p63s23p63d104s24p11s22s22p63s23p63d104s24p21s22s22p63s23p63d104s24p31s22s22p63s23p63d104s24p41s22s22p63s23p63d104s24p51s22s22p63s23p63d104s24p61s22s22p63s23p63d54s11s22s22p63s23p63d104s1练习:1~36号元素中是否都遵循构造原理?
举出能否具体的例子?注 意原子的简化电子排布:原子实[Ne]3s1练习:写出第8号元素氧、第14号元素硅和第26号元素铁的简化电子排布式吗?上式方括号里的符号的意义是:该元素前一个周期的惰性气体电子排布结构Na的简化电子排布:[He]2s22p4[Ne]3s23p2[Ar]3d64s2下列各原子或离子的电子排布式错误的是( )A. Ca2+ 1s22s22p63s23p6B. O2- 1s22s23p4C. Cl- 1s22s22p63s23p5D. Ar 1s22s22p63s23p6BC练习 1:练习2:
1.电子排布式为1s22s22p63s23p6 某原子, 则该元素的核电荷数是____________ 2.某元素原子的价电子构型为3s23p4, 则此元素在周期表的位置是____________18第3周期,第VIA族4.构造原理揭示的电子排布能级顺序,实质是 各能级能量高低,若以E 表示某能级的能量,下列能量大小顺序中正确的是 ( )
A.E(3s)>E(2s)>E(1s)
B.E(3s)>E(3p)>E(3d)
C.E(4f)>E(4s)>E(3d)
D.E(5s)>E(4s)>E(4f) 3.一个电子排布为1s22s22p63s23p1的元素最可能的价态是( )
A? +1 B? +2 C? +3 D? -1 CA5.下列各原子或离子的电子排布式错误的是( )
A.Al 1s22s22p63s23p1 B. O2- 1s22s22p6
C.Na+ 1s22s22p6 D. Si 1s22s22p2
6.下列表达方式错误的是( )
A.甲烷的电子式
B.氟化钠的电子式
C.硫离子的核外电子排布式 1s22s22p63s23p4
D.碳-12原子符号 126CDC第一章 原子结构与性质第一节 原子结构 (第3课时)四.能量最低原理、基态与激发态、光谱能量最低原理: 原子的电子排布遵循构造原理能使整个原子的能量处于最低状态。 基态原子: 处于最低能量的原子 (稳定)电子放出能量↓电子吸收能量↓如:Na 1s22s22p63s1如:Na 1s22s22p63p1 基态与激发态的关系原子光谱基态原子激发态原子吸收能量释放能量发射光谱吸收光谱能量较高能量最低基态与激发态相互转化的应用 焰色
反应 焰色反应就是某些金属原子的电子在高温火焰中,接受了能量,使原子外层的电子从基态激跃迁到激发态;处于激发态的电子是十分不稳定的,在极短的时间内(约10-8s)便跃迁到基态或较低的能级上,并在跃迁过程中将能量以一定波长(颜色)的光释放出来。由于各种元素的能级是被限定的,因此在向基态跃迁时释放的能量也就不同。碱金属及碱土金属的能级差正好对应于可见光范围,于是我们就看到了各种色彩。 焰火呈现五颜六色的原因处于最低能量的原子________________________________________________________ ,简称能量最低原理。
_____________________叫做基态原子。 当基态原子的电子吸收能量后,电子会______________,变成激发态原子。电子从较高能量的激发态跃迁到较低能量的激发态乃至基态时,将_________能量。光(辐射)是电子___________能量的重要形式之一。原子的电子排布遵循构造原理能使整个原子的能量处于最低状态 跃迁到较高能级 释放 释放
1.当镁原子由1s22s22p63s2 →1s22s22p63p2时,以下说法正确的是( )
A.镁原子由基态转化成激发态,这一过程中吸收能量
B.镁原子由激发态转化成基态,这一过程中释放能量
C.镁原子由基态转化成激发态,这一过程中释放能量
D.镁原子由激发态转化成基态,这一过程中吸收能量A课堂练习2.判断下列表达是正确还是错误?
(1) 1s22s2 2p63s2 3p63d54s2 属于激发态
(2) 1s22s2 2p63d1 属于激发态构造原理: 1s;2s 2p;3s 3p;4s 3d 4p;
5s 4d 5p; 6s 4f 5d 6p;7s 5f 6d光的色散光谱:按一定次序排列的彩色光带用光谱仪测定氢气放电管发射的氢的发射光谱锂、氦、汞的发射光谱 锂、氦、汞的吸收光谱 特征:暗背景,
亮线,
线状不连续特征:亮背景,
暗线,
线状不连续原子光谱 不同元素的原子发生跃迁时会吸收或释放不同的光,可以用光谱仪摄取各种元素的电子的吸收光谱或发射光谱,总称原子光谱。
光谱分析: 在现代化学中,常利用原子光谱上的特征谱线来鉴定元素,称为光谱分析。元素的发现等②化学研究中利用光谱分析检测一些物质的存在与含量等。 光谱分析的应用①通过原子光谱发现许多元素。如:铯(1860年)和铷(1861年),其光谱中有特征的篮光和红光。
又如:1868年科学家们通过太阳光谱的分析发现了稀有气体氦。下图是锂、氦、汞的吸收光谱和发射光谱。其中图_______是原子由基态转化为激发态时的吸收光谱,图_______是原子由激发态转化为基态时的发射光谱。不同元素的原子光谱上的特征谱线不同,请在下图中用线段将同种元素的吸收光谱和发射光谱连接。①③⑤②④⑥课堂练习2.关于光谱分析,下列说法错误的( )
A、光谱分析的依据是每种元素都有其独特的
特征谱线
B、光谱分析不能用连续光谱
C、光谱分析既可以用发射谱也可以用吸收光谱
D、分析月亮的光谱可得知月球的化学组成 D3.在太阳的光谱中有许多暗线,这表明( )
A、太阳内部含有这些暗线所对应的元素
B、太阳大气层中缺少这些暗线所对应的元素
C、太阳大气层中含有这些暗线所对应的元素
D、地球的大气层中含有这些暗线所对应的元素 课堂练习C第一章 原子结构与性质第一节 原子结构 (第4课时)思考:宏观物体的运动特征:可以准确地测出它们在某一时刻所处的 位置及运行的速度;
可以描画它们的运动轨迹。五、电子云与原子轨道⑴ 核外电子质量小(只有9.11×10-31 kg),运动空间小(相对于宏观物体而言),运动速率大(近光速)。
核外电子运动的特征⑵无确定的轨道,无法描述其运动轨迹。⑶无法计算电子在某一刻所在的位置,只能指出
其在核外空间某处出现的机会的多少(概率)。测不准原理(海森堡)电子云:电子在原子核外出现的概率分布图。1s电子在原子核外出现的概率分布图 核外电子运动状态的描述 电子云只是形象地表示 电子出现在各点的概率高低,而实际上并不存在。 小黑点不表示电子,只表示电子在这里出现过一次。小黑点的疏密表示电子在核外空间内出现的机会的多少。电子轮廓图的制作 常把电子出现的概率约为90%的空间圈出来,人们把这种电子云轮廓图称为原子轨道。 P10 最后一段电子云轮廓图——原子轨道S能级的原子轨道是球形对称的.电子云形状
①s电子云呈球形,在半径相同的球面上,电子出现的机会相同;
②p电子云呈哑铃形 (或纺锤形);
③d电子云是花瓣形;
④f电子云更为复杂。原子轨道S能级的原子轨道图* S能级的原子轨道是球形对称的* 能层序数n越大,原子轨道半径越大* P能级的原子轨道是哑铃形的,每个P能级有3个原子轨道,它们相互垂直,分别以Px,Py,PZ表示。 P能级的原子轨道图原子轨道图S能级的原子轨道图P能级的原子轨道图d能级的原子轨道图思考:回忆 s p d f 能级分别最多容纳电子个数?P5 第二段最后一句话观察下图,这些图称为原子的电子排布图。1.每个原子轨道最多只能容纳几个电子?2.当电子排在同一个能级内时,有什么规律?科学探究 1个原子轨道里最多只能容纳2个电子,且自旋方向相反(顺时针、逆时针)。 ---泡利原理 当电子排布在同一能级的不同轨道时,总是优先单独占据一个轨道,而且自旋方向相同。---洪特规则 泡利(Pauli),奥地利科学家,对于量子力学的形成以及原子结构理论的发展有重大的贡献,获得1945年诺贝尔物理奖。他对科学理论有着很深刻的洞察力,语锋犀利,被称为“理论物理学的心脏” 。 泡利原理 一个原子轨道中最多只能容纳两个电子,且这两个电子的自旋方向必须相反,此时体系最稳定,原子的总能量最低。 泡利不相容原理电子排布式1s 2s电子排布图 用一个○表示一个原子轨道,在○中用“↑”或“↓”表示该轨道上排入的电子。Li: 1s22s1洪特规则 对于基态原子,电子在能量相同的轨道上排布时,将尽可能分占不同的轨道并且自旋方向相同。 C :1s2 2s22p2
√1.每个原子轨道上最多能容纳____个电子,且自旋方向_______科学研究2.当电子排在同一能级时有什么规律?当电子排布在同一能级的不同轨道时,总是___________________,而且自旋方向______——洪特规则2不同——泡利原理首先单独占一个轨道相同NOC练习1:写出 24Cr 29Cu 电子排布式29Cu 1s22s22p63s23p63d104s124Cr 1s22s22p63s23p63d54s1洪特规则特例: 洪特规则特例: 相对稳定的状态全充满(p6,d10,f14)全空时(p0,d0,f0)半充满(p3,d5,f7)泡利原理:
洪特规则: 当电子排布在同一能级的不同轨道时,总是优先单独占一个轨道(即分占不同的轨道),而且自旋状态相同。 一个原子轨道最多容纳2个电子,而且自旋方向相反。洪特规则特例:全空、半充满、全充满时相对稳定铁原子的电子排布图↑↓↑↓↑↓↑↓↑↓↑↓↑↓↑↓↑↓↑↓↑↓↑↑↑↑洪特规则泡利原理能量最低原理1s2s2p3p3d3s4s 能量最低原理表述的是“整个原子处于能量最低状态”,而不是说电子填充到能量最低的轨道中去,泡利原理和洪特规则都使“整个原子处于能量最低状态”。注意:小结:核外电子排布规则1.能量最低原理 2.泡利不相容原理 3.洪特规则 ↑↑↑↑↑↑↑↑↑↑↑↓↑↓↑↓↑↓3.其中最能准确表示基态锰原子核外电子运动状态的是( )ABCDC想一想↑↓↑↓↑↑↓4.当碳原子的核外电子排布由转变为时,下列说法正确的是 ( )A.碳原子由基态变为激发态
B.碳原子由激发态变为基态
C.碳原子要从外界环境中吸收能量
D.碳原子要向外界环境释放能量A C 巩固1s2s2p3s3p3d5.下列有关原子轨道的叙述中不正确的( )
A.氢原子的3s轨道能量较3p能级低
B.锂原子的2s与5s 轨道皆为球形分布
C.p能级的原子轨道呈纺锤形,随着能层序数的增加,p能级原子轨道也在增多
D.能层n=4的原子轨道最多可容纳16个电子课堂练习CD6.基态碳原子的最外能层的各能级中,电子排布的方式正确的是( )
A B C D
C课堂练习7、以下是表示铁原子的3种不同化学用语。 请你通过比较、归纳,分别说出3种不同化学用语所能反映的粒子结构信息。 结构示意图:能直观地反映核内的质子数和核外的电子层数
及各能层上的电子数。
电子排布式:能直观地反映核外电子的能层、能级和各能级
上的电子数。
电子排布图:能反映各轨道的能量的高低及各轨道上的电子
分布情况,自旋方向。 小结:一、原子核外电子排布遵循的原理和规则二、原子核外电子排布的表示式能量最低原则泡利不相容原理洪特规则电子排布式电子排布图确定原子序数 解答基态原子电子排布问题的一般思路:能级排布电子排布小结:巩固练习1、某元素原子序数为24,试问:(1)该元素电子排布式:1s2 2s22p6 3s23p63d5 4s1(2)它有 个能层; 个能级;占有 个原子轨道。(3)此元素有 个未成对电子;它的价电子数是 。647156巩固练习2、填表:41s22s2第2周期第ⅡA族13第3周期第ⅢA族Al221s22s22p63s23p63d24s2TiCu第4周期第ⅣB族1s22s22p63s23p63d104s1第4周期第ⅠB族321s22s22p63s23p63d104s24p2第4周期第ⅣA族 鲍林(Pauling),卓越的美国化学家。主要研究结构化学,曾获1954年诺贝尔化学奖和1963年诺贝尔和平奖。
