化学人教版(2019)选择性必修3 2.2 乙炔(共28张ppt)
文档属性
| 名称 | 化学人教版(2019)选择性必修3 2.2 乙炔(共28张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 272.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-07-13 12:25:11 | ||
图片预览


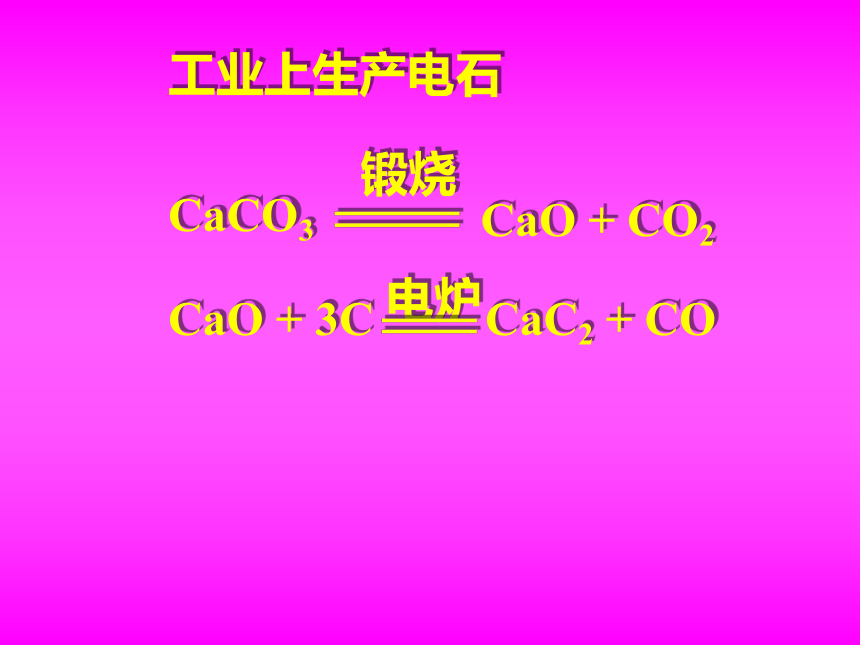



文档简介
(共28张PPT)
乙 炔
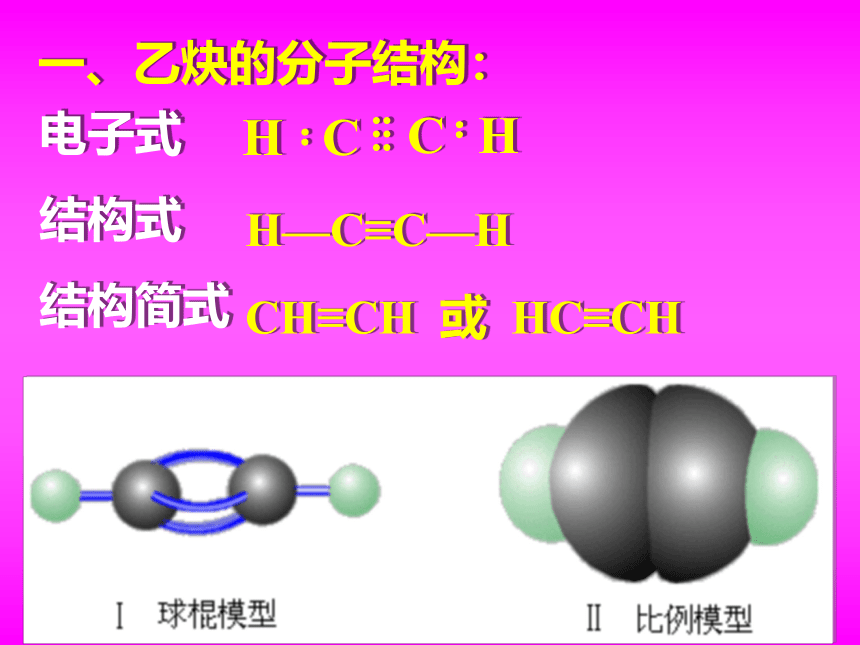
一、乙炔的分子结构:
电子式
结构式
结构简式
H—C≡C—H
CH≡CH 或 HC≡CH
:
H
..
C
:
H
C
..
..
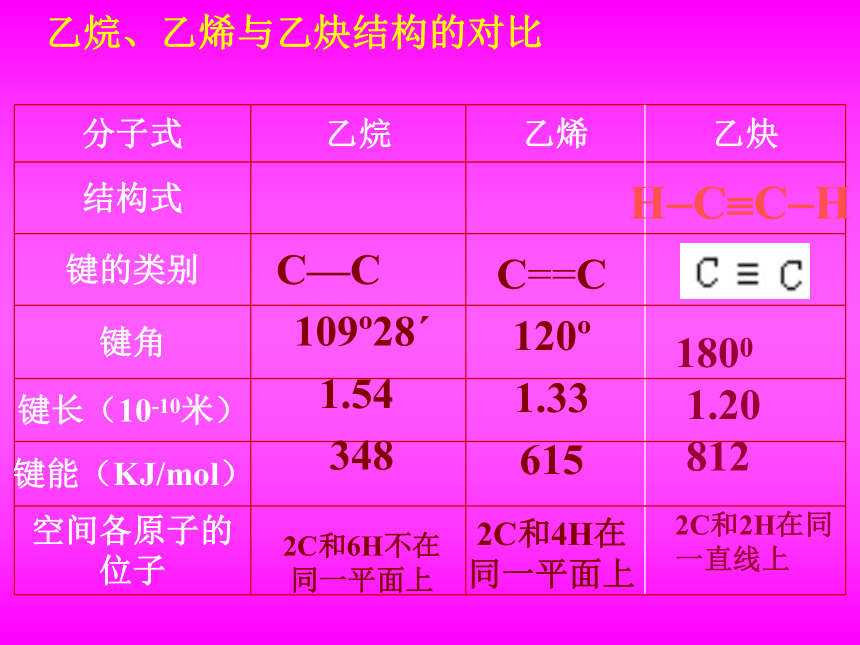
乙烷、乙烯与乙炔结构的对比
分子式 乙烷 乙烯 乙炔
结构式
键的类别
键角
键长(10-10米)
键能(KJ/mol)
空间各原子的位子
C—C
109 28ˊ
1.54
348
2C和6H不在同一平面上
C==C
120
1.33
615
2C和4H在同一平面上
1800
1.20
812
2C和2H在同一直线上
H C C H
二、乙炔的实验室制法:
俗称:电石气
1、原料:
电石(主要成分CaC2)、饱和食盐水
2、反应原理:
CaC2+2H2O→HC≡CH↑+Ca(OH)2
反应实质:水解反应,剧烈放热
工业上生产电石
CaCO3
CaO + CO2
锻烧
CaO + 3C
CaC2 + CO
电炉
练:CaC2和ZnC2、Al4C3、Mg2C3、Li2C2等都同属离子型碳化物,请通过对CaC2制C2H2的反应进行思考,从中得到必要的启示,写出下列反应的产物:
A.ZnC2水解生成 ( )
B.Al4C3水解生成( )
C.Mg2C3水解生成( )
D.Li2C2水解生成 ( )
C2H2
CH4
C3H4
C2H2
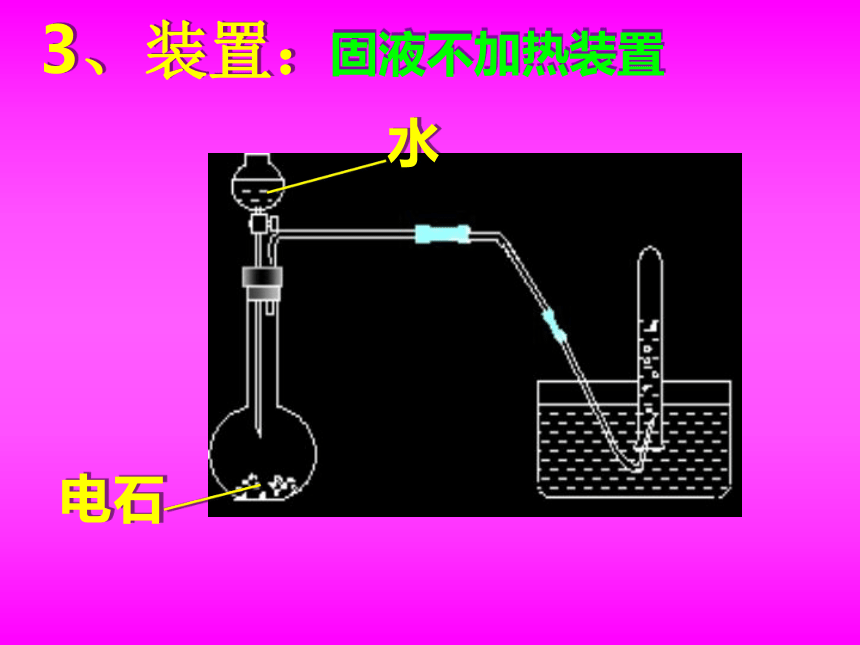
3、装置:
电石
水
固液不加热装置
注意事项:
1、不能用启普发生器。
⑴碳化钙与水反应较剧烈,难以控制反应速率;
⑵反应会放出大量热量,如操作不当,会使启普发生器炸裂。
⑶反应的产物中还有糊状的Ca(OH)2,它能夹带未反应的碳化钙进入发生器底部,或堵住球型漏斗和底部容器间的空隙,使发生器失去作用。
4、纯净乙炔气体是无色无味的气体。用电石和水反应制取的乙炔,常闻到有恶臭气味,是因为在电石中含有少量硫化钙、砷化钙、磷化钙等杂质,跟水作用时生成H2S、AsH3、PH3等气体有特殊的气味所致。
3、常用饱和食盐水代替水,以降低水的含量,得到平稳的气流。
2、不能使用长颈漏斗代替分液漏斗
因为:长颈漏斗不能控制水的用量。水加太多,反应会太剧烈
3、制取:
4、演示实验
①将乙炔气体通入酸性高锰酸钾中
②将乙炔气体通入溴水中
③将乙炔气体点燃,观察火焰颜色及燃烧情况
三、乙炔的物理性质
纯的乙炔是没有颜色、没有臭味的气体。密度是1.16克/升,比空气稍轻。微溶于水,易溶于有机溶剂。
四、乙炔的化学性质:
A、可燃性:
2C2H2+5O2 点燃 4CO2+2H2O(液)+2600KJ
火焰明亮,并伴有浓烟。
1、氧化反应:
氧炔焰:放出大量的热,温度达3000℃以上,用于气割气焊。
乙炔跟空气的混合物遇火会发生爆炸,在生产和使用乙炔时,必须注意安全。
C2H6+ 7/2O2 点燃 2CO2+3H2O+1561KJ
CH2=CH2+3O2 点燃 2CO2+2H2O+1411KJ
C2H2+5/2O2 点燃 2CO2+H2O+1300KJ
为何乙炔火焰温度最高?
乙炔完全燃烧所需氧的物质的量最少,生成水的物质的量也最少,因此燃烧时用以提高氧温度以及水气化所需的消耗的反应热也最少,所以乙炔火焰温度最高。
B、乙炔能使酸性KMnO4溶液褪色。
2、 加成反应:
(1)X2
1,1,2,2-四溴乙烷
H-C=C-H
Br
Br
1,2-二溴乙烯
H-C≡C-H+Br—Br →
+Br—Br →
H-C=C-H
Br
Br
H-C—C-H
Br
Br
Br
Br
使溴水褪色
(2)催化加氢
制聚乙烯塑料
CH2=CH2
CH CH + H2
催化剂
CH2=CH2 + H2
催化剂
CH3 CH3
(3)与HX、H2O反应
制备塑料、纤维
CH2=CHCl
CH CH + HCl
催化剂
nCH2=CH
Cl
加温、加压
催化剂
CH2 CH
Cl
n
CH≡CH+H2O CH3CHO(制乙醛)
3、加聚反应
nCH≡CH
加温、加压
催化剂
CH=CH
n
乙炔的用途
1、乙炔燃烧时产生的氧炔焰可用来切割或 焊接金属。
2、 乙炔是一种重要的基本有机原料,可以用来制备氯乙烯、 聚氯乙烯和乙醛等。
CH2=CHCl
CH CH + HCl
催化剂
聚氯乙烯薄膜
nCH2=CHCl
加温、加压
催化剂
Cl
CH2 CH
n
3、导电塑料——聚乙炔
nCH CH
CH=CH
n
加温、加压
催化剂
我国市场上目前大量使用的塑料制品都是不可降解塑料,以发泡聚氯乙烯、聚乙烯或聚丙烯为原料,分子量达2万以上。只有分子量降低到2000以下,才能被自然环境中的微生物所利用,变成水和其它有机质,而这一过程需要200年;如果将其填埋,将会影响农作物吸收养分和水分,导致减产;对其焚烧会释放出多种化学有毒气体,其中有一种叫二恶英的化合物,毒性极大,即使在摄入很小量的情况下,也能使鸟类和鱼类出现畸形和死亡,对生态环境造成破坏,同时对人体有着很大危害。
白色警告
当前治理白色污染主要使用的可降解塑料、以纸代塑、生物全降解等新技术中,以纸代塑被认为是目前综合评价最好的替代技术。用这种方法制作的塑料袋、餐具因其无毒无害、易回收、可再生利用、可降解等优点而被冠以“环保产品”的称号
—— 绝缘体变导体
一般在人们的印象中,塑料是不导电的,通常用于普通的电缆中作导电铜丝外面的绝缘层。但是,2000年3名诺贝尔化学奖获得者勇敢地向传统观念提出了挑战。他们通过长期精心地研究,经过对聚合物特殊的改性,使塑料能够表现得像金属一样,具有导电性。这不能不说是一种原创性的开发。
2000年的诺贝尔化学奖授予了美国加利福尼亚大学的物理学家黑格、美国宾夕法尼亚大学的化学家马克迪亚米德和日本筑波大学的化学家白川英树,因为他们发现了导电塑料。
五、炔烃
1、概念:链烃分子里含有碳碳叁键的不饱烃叫做炔烃。
2、炔烃的通式: CnH2n-2 (n≥2)
3、炔烃的通性:
(1)物理性质:
随着碳原子数的增多,沸点逐渐升高,液态时的密度逐渐增加。
C小于等于4时为气态
(2)化学性质:
与乙炔相似,能发生氧化反应,加成反应。
帮你记忆
电石遇水太凶猛,我从溶液急上冲;
若要得到稳气流,换成饱和食盐水;
乙炔分子直线型,碳碳三键有个性;
既能氧化又加成,炔类家族共特征。
练习:
1、某气态烃0.5mol能与1mol HCl氯化氢完全加成,加成产物分子上的氢原子又可被3mol Cl2取代,则气态烃可能是
A、CH ≡CH
B、CH2=CH2
C、CH≡C—CH3
D、CH2=C(CH3)CH3
2、在标准状况下将11.2升乙烯和乙炔的混合气通入到溴水中充分反应,测得有128克溴参加了反应,测乙烯、乙炔的物质的量之比为( )
A.1∶2 B.2∶3 C.3∶4 D.4∶5
B
3、描述CH3—CH = CH—C≡C—CF3分子结构的下列叙述中正确的是( )
A.6个碳原子有可能都在一条直线上
B.6个碳原子不可能都在一条直线上
C.6个碳原子有可能都在同一平面上
D.6个碳原子不可能都在同一平面上
B、C
4、含一叁键的炔烃,氢化后的产物结构简式为
此炔烃可能有的结构有( )
A.1种 B.2种 C.3种 D.4种
再见
乙 炔
一、乙炔的分子结构:
电子式
结构式
结构简式
H—C≡C—H
CH≡CH 或 HC≡CH
:
H
..
C
:
H
C
..
..
乙烷、乙烯与乙炔结构的对比
分子式 乙烷 乙烯 乙炔
结构式
键的类别
键角
键长(10-10米)
键能(KJ/mol)
空间各原子的位子
C—C
109 28ˊ
1.54
348
2C和6H不在同一平面上
C==C
120
1.33
615
2C和4H在同一平面上
1800
1.20
812
2C和2H在同一直线上
H C C H
二、乙炔的实验室制法:
俗称:电石气
1、原料:
电石(主要成分CaC2)、饱和食盐水
2、反应原理:
CaC2+2H2O→HC≡CH↑+Ca(OH)2
反应实质:水解反应,剧烈放热
工业上生产电石
CaCO3
CaO + CO2
锻烧
CaO + 3C
CaC2 + CO
电炉
练:CaC2和ZnC2、Al4C3、Mg2C3、Li2C2等都同属离子型碳化物,请通过对CaC2制C2H2的反应进行思考,从中得到必要的启示,写出下列反应的产物:
A.ZnC2水解生成 ( )
B.Al4C3水解生成( )
C.Mg2C3水解生成( )
D.Li2C2水解生成 ( )
C2H2
CH4
C3H4
C2H2
3、装置:
电石
水
固液不加热装置
注意事项:
1、不能用启普发生器。
⑴碳化钙与水反应较剧烈,难以控制反应速率;
⑵反应会放出大量热量,如操作不当,会使启普发生器炸裂。
⑶反应的产物中还有糊状的Ca(OH)2,它能夹带未反应的碳化钙进入发生器底部,或堵住球型漏斗和底部容器间的空隙,使发生器失去作用。
4、纯净乙炔气体是无色无味的气体。用电石和水反应制取的乙炔,常闻到有恶臭气味,是因为在电石中含有少量硫化钙、砷化钙、磷化钙等杂质,跟水作用时生成H2S、AsH3、PH3等气体有特殊的气味所致。
3、常用饱和食盐水代替水,以降低水的含量,得到平稳的气流。
2、不能使用长颈漏斗代替分液漏斗
因为:长颈漏斗不能控制水的用量。水加太多,反应会太剧烈
3、制取:
4、演示实验
①将乙炔气体通入酸性高锰酸钾中
②将乙炔气体通入溴水中
③将乙炔气体点燃,观察火焰颜色及燃烧情况
三、乙炔的物理性质
纯的乙炔是没有颜色、没有臭味的气体。密度是1.16克/升,比空气稍轻。微溶于水,易溶于有机溶剂。
四、乙炔的化学性质:
A、可燃性:
2C2H2+5O2 点燃 4CO2+2H2O(液)+2600KJ
火焰明亮,并伴有浓烟。
1、氧化反应:
氧炔焰:放出大量的热,温度达3000℃以上,用于气割气焊。
乙炔跟空气的混合物遇火会发生爆炸,在生产和使用乙炔时,必须注意安全。
C2H6+ 7/2O2 点燃 2CO2+3H2O+1561KJ
CH2=CH2+3O2 点燃 2CO2+2H2O+1411KJ
C2H2+5/2O2 点燃 2CO2+H2O+1300KJ
为何乙炔火焰温度最高?
乙炔完全燃烧所需氧的物质的量最少,生成水的物质的量也最少,因此燃烧时用以提高氧温度以及水气化所需的消耗的反应热也最少,所以乙炔火焰温度最高。
B、乙炔能使酸性KMnO4溶液褪色。
2、 加成反应:
(1)X2
1,1,2,2-四溴乙烷
H-C=C-H
Br
Br
1,2-二溴乙烯
H-C≡C-H+Br—Br →
+Br—Br →
H-C=C-H
Br
Br
H-C—C-H
Br
Br
Br
Br
使溴水褪色
(2)催化加氢
制聚乙烯塑料
CH2=CH2
CH CH + H2
催化剂
CH2=CH2 + H2
催化剂
CH3 CH3
(3)与HX、H2O反应
制备塑料、纤维
CH2=CHCl
CH CH + HCl
催化剂
nCH2=CH
Cl
加温、加压
催化剂
CH2 CH
Cl
n
CH≡CH+H2O CH3CHO(制乙醛)
3、加聚反应
nCH≡CH
加温、加压
催化剂
CH=CH
n
乙炔的用途
1、乙炔燃烧时产生的氧炔焰可用来切割或 焊接金属。
2、 乙炔是一种重要的基本有机原料,可以用来制备氯乙烯、 聚氯乙烯和乙醛等。
CH2=CHCl
CH CH + HCl
催化剂
聚氯乙烯薄膜
nCH2=CHCl
加温、加压
催化剂
Cl
CH2 CH
n
3、导电塑料——聚乙炔
nCH CH
CH=CH
n
加温、加压
催化剂
我国市场上目前大量使用的塑料制品都是不可降解塑料,以发泡聚氯乙烯、聚乙烯或聚丙烯为原料,分子量达2万以上。只有分子量降低到2000以下,才能被自然环境中的微生物所利用,变成水和其它有机质,而这一过程需要200年;如果将其填埋,将会影响农作物吸收养分和水分,导致减产;对其焚烧会释放出多种化学有毒气体,其中有一种叫二恶英的化合物,毒性极大,即使在摄入很小量的情况下,也能使鸟类和鱼类出现畸形和死亡,对生态环境造成破坏,同时对人体有着很大危害。
白色警告
当前治理白色污染主要使用的可降解塑料、以纸代塑、生物全降解等新技术中,以纸代塑被认为是目前综合评价最好的替代技术。用这种方法制作的塑料袋、餐具因其无毒无害、易回收、可再生利用、可降解等优点而被冠以“环保产品”的称号
—— 绝缘体变导体
一般在人们的印象中,塑料是不导电的,通常用于普通的电缆中作导电铜丝外面的绝缘层。但是,2000年3名诺贝尔化学奖获得者勇敢地向传统观念提出了挑战。他们通过长期精心地研究,经过对聚合物特殊的改性,使塑料能够表现得像金属一样,具有导电性。这不能不说是一种原创性的开发。
2000年的诺贝尔化学奖授予了美国加利福尼亚大学的物理学家黑格、美国宾夕法尼亚大学的化学家马克迪亚米德和日本筑波大学的化学家白川英树,因为他们发现了导电塑料。
五、炔烃
1、概念:链烃分子里含有碳碳叁键的不饱烃叫做炔烃。
2、炔烃的通式: CnH2n-2 (n≥2)
3、炔烃的通性:
(1)物理性质:
随着碳原子数的增多,沸点逐渐升高,液态时的密度逐渐增加。
C小于等于4时为气态
(2)化学性质:
与乙炔相似,能发生氧化反应,加成反应。
帮你记忆
电石遇水太凶猛,我从溶液急上冲;
若要得到稳气流,换成饱和食盐水;
乙炔分子直线型,碳碳三键有个性;
既能氧化又加成,炔类家族共特征。
练习:
1、某气态烃0.5mol能与1mol HCl氯化氢完全加成,加成产物分子上的氢原子又可被3mol Cl2取代,则气态烃可能是
A、CH ≡CH
B、CH2=CH2
C、CH≡C—CH3
D、CH2=C(CH3)CH3
2、在标准状况下将11.2升乙烯和乙炔的混合气通入到溴水中充分反应,测得有128克溴参加了反应,测乙烯、乙炔的物质的量之比为( )
A.1∶2 B.2∶3 C.3∶4 D.4∶5
B
3、描述CH3—CH = CH—C≡C—CF3分子结构的下列叙述中正确的是( )
A.6个碳原子有可能都在一条直线上
B.6个碳原子不可能都在一条直线上
C.6个碳原子有可能都在同一平面上
D.6个碳原子不可能都在同一平面上
B、C
4、含一叁键的炔烃,氢化后的产物结构简式为
此炔烃可能有的结构有( )
A.1种 B.2种 C.3种 D.4种
再见
