【原创精美课件】3.4 离子晶体(人教版选修3)
文档属性
| 名称 | 【原创精美课件】3.4 离子晶体(人教版选修3) |  | |
| 格式 | zip | ||
| 文件大小 | 639.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2013-07-12 17:07:27 | ||
图片预览




文档简介
课件12张PPT。第四节 离子晶体第三章 晶体结构与性质2、晶体中存在的微粒:阴、阳离子3、微粒间的作用力:离子键4、哪些类物质属于离子晶体?大多数盐、强碱、活泼金属氧化物离子键无饱和性 、无方向性一、离子晶体1、定义:由阴、阳离子通过离子键结合而成的晶体。离子键:阴、阳离子间强烈的静电作用。判断正误:
1、离子晶体一定是离子化合物。
2、含有离子的晶体一定是离子晶体。
3、离子晶体中只含离子键。
4、离子晶体中一定含金属阳离子。
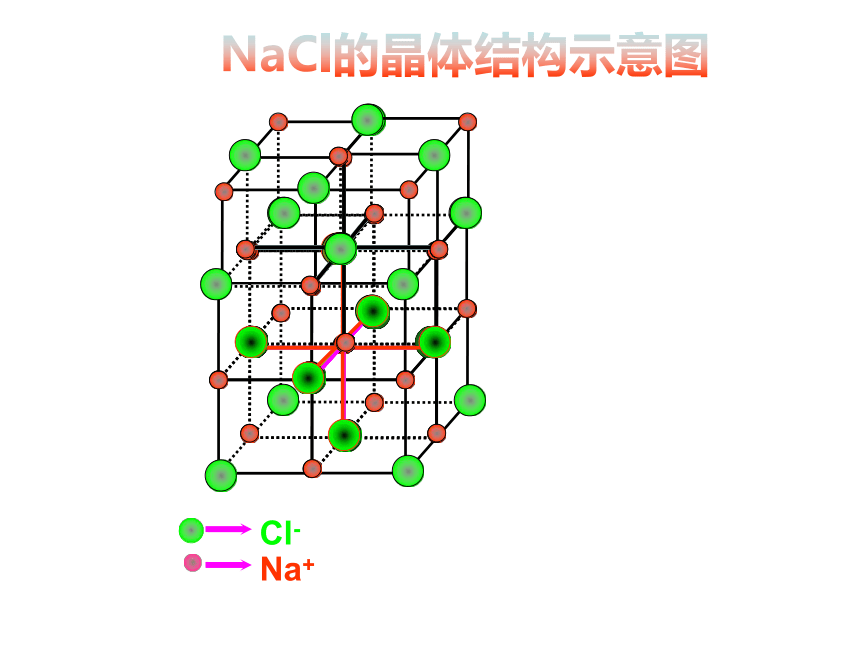
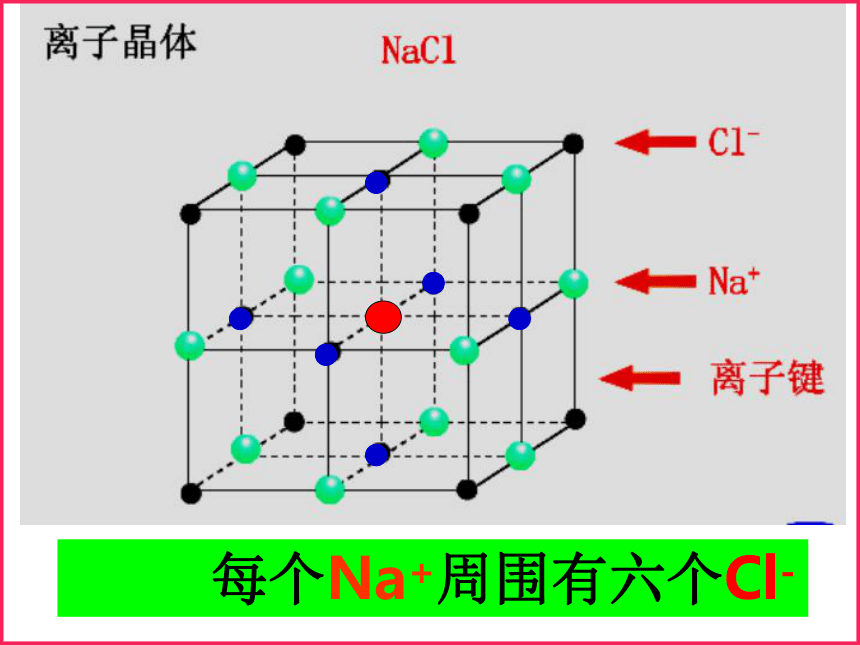
5、由金属元素与非金属元素组成的晶体一定是离子晶体。×√×××配位数:离子晶体中,一个离子周围最邻近的异电性离子的 数目。缩写为C. N.。NaCl的晶体结构示意图5、几种离子晶体
(1)NaCl晶体
每个Na+周围最近且等距离的Cl-有 个,每个Cl-周围最近且等距离的Na+有 个;在每个Na+周围最近且等距离的Na+有 个,在每个Cl-周围最近等距离的Cl-有 个。 Na+和Cl-的配位数分别为 、 。一个NaCl晶胞中含 个Na+和 个Cl-。 NaCl晶体中 NaCl分子,化学式NaCl表示 。6612446无126Na+和Cl-的最简个数比 每个Na+周围有六个Cl- 每个Cl-周围有六个Na+(2)CsCl晶体
每个Cs+周围最近且等距离的Cl-有 个,每个Cl-周围最近且等距离的Cs+有 个;在每个Cs+周围最近且等距离的Cs+有 个,在每个Cl-周围最近等距离的Cl-有 个。一个CsCl晶胞中含 个Cs+和 个Cl-。 Cs+和Cl-的配位数分别为 、 。88661188(3)CaF2晶体
每个Ca2+周围最近且等距离的F-有 个,每个F-周围最近且等距离的Ca2+有 个;在每个Ca2+周围最近且等距离的Ca2+有 个,在每个F-周围最近等距离的F-有 个。一个CaF2晶胞中含 个Ca2+和 个F-; Ca2+和F-的配位数分别为 、 。841264884Ca2+F-6、影响离子晶体结构的因素:(1)几何因素(2)电荷因素(3)键性因素7、离子晶体的物理性质二、晶格能1、晶格能的定义:气态离子形成1mol离子晶体释放的能量。3、晶格能的作用:晶格能越大,形成的离子晶体越稳定,而且熔点越高,硬度越大。2、影响晶格能大小的因素:阴、阳离子的半径越小,晶格能越大。
阴、阳离子所带电荷越多,晶格能越大。练习:比较下列晶体熔沸点高低:
(1)NaF KCl NaCl (2)MgO Al2O3(1)NaF>NaCl>KCl(2) Al2O3 >MgO
1、离子晶体一定是离子化合物。
2、含有离子的晶体一定是离子晶体。
3、离子晶体中只含离子键。
4、离子晶体中一定含金属阳离子。
5、由金属元素与非金属元素组成的晶体一定是离子晶体。×√×××配位数:离子晶体中,一个离子周围最邻近的异电性离子的 数目。缩写为C. N.。NaCl的晶体结构示意图5、几种离子晶体
(1)NaCl晶体
每个Na+周围最近且等距离的Cl-有 个,每个Cl-周围最近且等距离的Na+有 个;在每个Na+周围最近且等距离的Na+有 个,在每个Cl-周围最近等距离的Cl-有 个。 Na+和Cl-的配位数分别为 、 。一个NaCl晶胞中含 个Na+和 个Cl-。 NaCl晶体中 NaCl分子,化学式NaCl表示 。6612446无126Na+和Cl-的最简个数比 每个Na+周围有六个Cl- 每个Cl-周围有六个Na+(2)CsCl晶体
每个Cs+周围最近且等距离的Cl-有 个,每个Cl-周围最近且等距离的Cs+有 个;在每个Cs+周围最近且等距离的Cs+有 个,在每个Cl-周围最近等距离的Cl-有 个。一个CsCl晶胞中含 个Cs+和 个Cl-。 Cs+和Cl-的配位数分别为 、 。88661188(3)CaF2晶体
每个Ca2+周围最近且等距离的F-有 个,每个F-周围最近且等距离的Ca2+有 个;在每个Ca2+周围最近且等距离的Ca2+有 个,在每个F-周围最近等距离的F-有 个。一个CaF2晶胞中含 个Ca2+和 个F-; Ca2+和F-的配位数分别为 、 。841264884Ca2+F-6、影响离子晶体结构的因素:(1)几何因素(2)电荷因素(3)键性因素7、离子晶体的物理性质二、晶格能1、晶格能的定义:气态离子形成1mol离子晶体释放的能量。3、晶格能的作用:晶格能越大,形成的离子晶体越稳定,而且熔点越高,硬度越大。2、影响晶格能大小的因素:阴、阳离子的半径越小,晶格能越大。
阴、阳离子所带电荷越多,晶格能越大。练习:比较下列晶体熔沸点高低:
(1)NaF KCl NaCl (2)MgO Al2O3(1)NaF>NaCl>KCl(2) Al2O3 >MgO
