初中常见离子的检验
图片预览








文档简介
课件35张PPT。初中常见离子
的检验 H+ OH-
CO32- Cl- SO42- NH4+
离子检验的一般方法:
1、选试剂(根据离子间的特殊反应确定试剂)
2、防干扰(防止共存离子之间的相互干扰)
3、定组成(用已有的离子排除与之不能共存
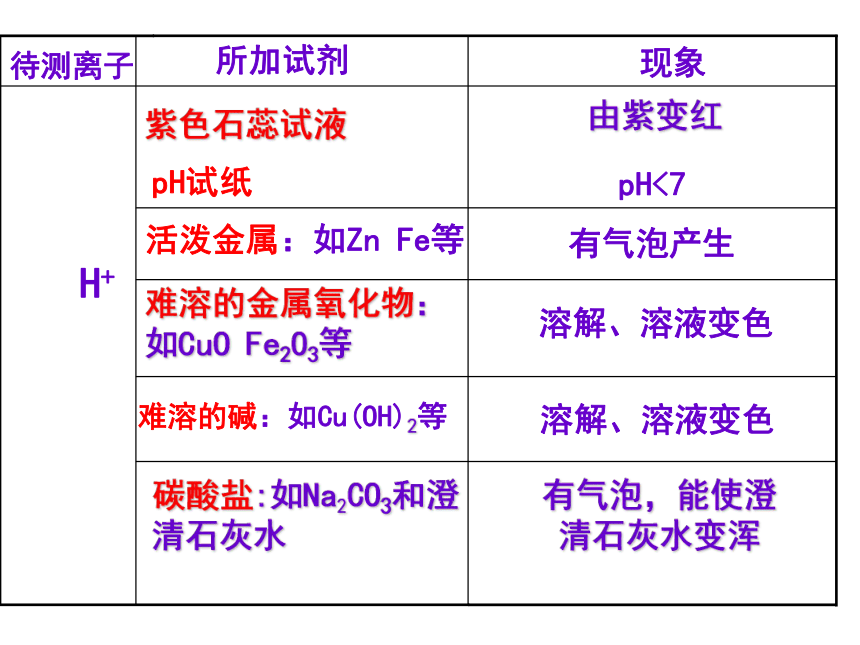
的离子)操作简便、现象明显、叙述规范现象所加试剂待测离子
H+pH试纸pH<7活泼金属:如Zn Fe等有气泡产生难溶的碱:如Cu(OH)2等难溶的金属氧化物:如CuO Fe2O3等溶解、溶液变色紫色石蕊试液由紫变红碳酸盐:如Na2CO3和澄清石灰水有气泡,能使澄清石灰水变浑溶解、溶液变色待测离子所加试剂现象
OH-
紫色石蕊试液由紫变蓝无色酚酞试液由无色变红pH试纸pH>7加入铜盐溶液:如CuSO4有蓝色沉淀生成加入铁盐溶液:如FeCl3有红褐色沉淀生成加入铵盐、研磨、湿润的红色石蕊试纸产生刺激性气味的气体;试纸变蓝●凡是含有碳酸根的盐,都能与酸反应,
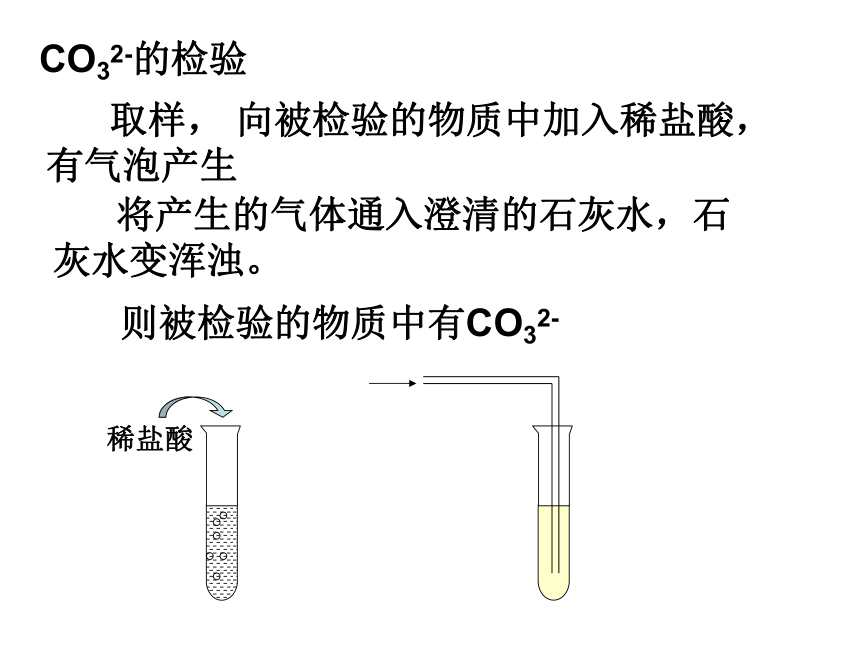
生成二氧化碳气体。●能与酸反应生成二氧化碳气体的,
都含有碳酸根离子。离子的检验:①检验CO32- :结论:CO32-的检验●凡是含有氯离子的都能与硝酸银反应生成
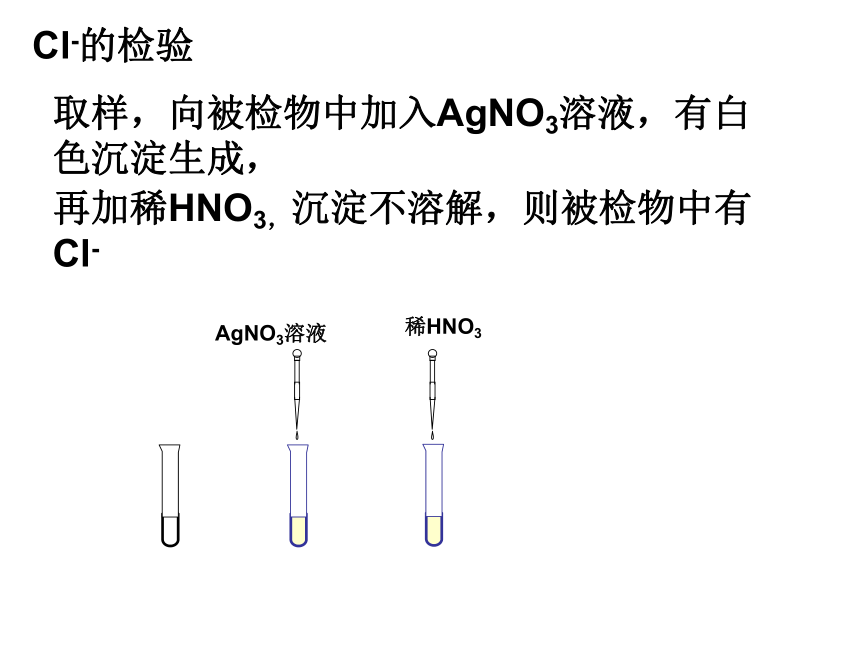
不溶于稀硝酸的白色沉淀。●能与硝酸银反应生成不溶于稀硝酸的
白色沉淀的,都含有氯离子。氯离子的鉴定:加硝酸银和稀硝酸,
看是否生成白色沉淀。②检验Cl- :结论:取样,向被检物中加入AgNO3溶液,有白色沉淀生成,Cl-的检验再加稀HNO3,沉淀不溶解,则被检物中有Cl-●凡是含有硫酸根离子的都能与硝酸钡反应
生成不溶于稀硝酸的白色沉淀。
●能与硝酸钡反应生成不溶于稀硝酸的
白色沉淀的,都含有硫酸根离子。硫酸根离子的鉴定:加硝酸钡和稀硝酸,
看是否生成白色沉淀。
③检验SO42-:结论:取样,向被检物中加入BaCl2溶液,有白色沉淀生成,SO42-的检验再加稀HNO3沉淀不溶解,则被检物中有SO42- 向被检物中加入NaOH溶液,加热,有刺激性气味的气体生成, NH4+的检验生成的气体能使湿润的红色的石蕊试纸变蓝,则被检物中有NH4+。待测离子所加试剂现象CO32-稀盐酸和澄清石灰水有气泡产生,能使澄清石灰水变浑Cl-AgNO3溶液和稀硝酸白色沉淀SO42-Ba(NO3)2溶液和稀硝酸白色沉淀NH4+与碱混合研磨,再用湿润的红色石蕊试纸测试有刺鼻气味的气体产生,试纸变蓝例1 某农技人员在整理化肥时发现一瓶钾肥的标签缺损(如图所示)。请你对该试剂做出猜想,并设计实验验证。1、猜想:此钾肥溶液可能是 ,也可能是 。
2、实验验证(请写出操作步骤、实验现象、结 论) 。 K2
酸钾K2SO4K2CO3取样,加入稀盐酸,如果有气泡产生,该溶液就是K2CO3,如果无明显现象,就是K2SO4二、混合溶液中常见离子的检验 1、CO32-和Cl-:
一般来说先检验CO32-,应该加入稍过量的稀硝酸,检验的同时,除尽CO32-,以防止干扰Cl-的检验;再用硝酸银溶液检验Cl- 。
如先滴加硝酸银溶液,观察到白色沉淀后,继续加入稍过量的稀硝酸,看到有较多气泡产生,且沉淀不能完全溶解,也能说明两种离子都有。
2、CO32-和SO42-:
先检验CO32-,应该加入稍过量的稀硝酸,检验的同时,除尽CO32-,以防止干扰SO42-的检验;再用硝酸钡溶液检验SO42- 。
如先滴加硝酸钡溶液,观察到白色沉淀后,继续加入稍过量的稀硝酸,看到有较多气泡产生,且沉淀不能完全溶解,说明两种离子都有。
感悟
1当多种离子需要检验时通常顺序为:
CO32- OH- SO42- Cl-
2检验时要排除干扰离子
3检验时更不要带入新的干扰离子
4注意所加试剂的量
5 取样分析
将珍珠加入稀HCl中有气泡产生,生成的气
体能使使澄清石灰水变浑浊,则珍珠中含
有下列离子中的-----------( )
A、SO42- B、Cl-
C、OH- D、CO32-考考你D 可一次鉴别蒸馏水、稀盐酸、石灰水的试剂是( )
A、酚酞试液 B、石蕊试液
C、碳酸钠溶液 D、氯化钠溶液B1、有一种钠盐,在其溶液中滴加AgNO3溶液,生成白色沉淀,再加稀硝酸,沉淀不溶解,该钠盐是 (写化学式),
有关化学方程式
。NaClAgNO3+NaCl=AgCl +NaNO32、有一种溶液,滴加紫色的石蕊试液,
石蕊变红。另取这种溶液少量,
滴加BaCl2溶液,有白色沉淀生成,
滴加稀硝酸沉淀不溶解,
这种溶液是 的溶液,
有关化学方程式
。H2SO4H2SO4+BaCl2=BaSO4 +2HCl3、有一种钙盐,取少量固体加稀盐酸,
发现有无色气体生成,将该气体通入
澄清石灰水中,石灰水变浑浊。
该钙盐是 (写化学式),
有关方程式
。CaCO3CaCO3+2HCl=CaCl2+H2O+CO2例2 某电镀厂在对金属镀件表面除锈、除污过程中,使用了盐酸、硫酸、氢氧化钠、碳酸钠。该厂经处理后排放的废水,仍有H+ 、 OH- 、 Na+ 、 Fe3+ 、 Cu2+ 、 Cl- CO32- 、 SO42- 中的几种离子。某中学环保志愿组对该废水中的部分成分进行检测。实验步骤及现象如下表所示。请完成下表根据以上信息分析,推测该废水中溶有的物质为 ,不能确定的物质是 。Fe3+ 、 Cu2+OH-CO32-√氢氧化钠氯化钠、硫酸钠例4:下列各组的离子,能大量共存于同一溶液的是 ( )
A.H+、Na+、CO32- B.Cu2+、Cl-、SO42-
C.Fe3+、SO42-、OH- D.Ca2+、NO3-、CO32-
注意:有关于此类离子共存的习题,一般考虑如下离子不能大量共存:
H+:
OH-:
CO32-:
Cl-:
SO42-:B共存=不发生反应
即不会产生气体、沉淀、水OH-、CO32-;H+、Mg2+、Fe3+、Cu2+、Zn2+、NH4+H+、Ca2+、Cu2+、Ba2+;Ag+Ba2+;例题一:
下列各组物质能够共存的是: ( )
A、FeCl3溶液、NaOH溶液
B、Ca(OH)2溶液、Na2CO3溶液
C、BaCl2溶液、HCl溶液
D、CaCO3、稀HNO3 C讨论二:
如何鉴别稀硫酸和稀盐酸?例题二:
“清水”变“牛奶”.在无色液体C中倒入无色液体B,立即产生“牛奶”般的白色沉淀.如果C是稀硫酸, B是 ______
(填序号)
①氢氧化钠溶液②氯化钡溶液③氯化钠溶液 ②优先检验SO42-例题三:某瓶盐溶液标签已被腐蚀,只知其可能是NaCl溶液,也可能是Na2CO3溶液.
请你对这瓶溶液进行鉴定,以确定是NaCl溶液,还是Na2CO3溶液.
(1)鉴定该溶液可用两种不同类别的试剂?
(2)简述其中一种鉴定方法.(包括步骤,现象及结论)优先检验CO32-酸:
碱:
盐:HCl、H2SO4Ca(OH)2、Ba(OH)2可溶性钙盐(钡盐)CaCl2、BaCl2指示剂Ca(NO3)2、Ba(NO3)2例题四:
为了检测长期暴露在空气的氢氧化钠是否变质,可选用酸、碱、盐试剂来鉴别,可用的相应物质的化学式可以为______,______,_______
HCl、H2SO4Ca(OH)2、Ba(OH)2CaCl2、BaCl2Ca(NO3)2、Ba(NO3)24、某溶液中加入硝酸银溶液产生白色沉淀证明溶液是盐酸。2、NaOH溶液能使无色酚酞变红,将Cu(OH)2或Fe(OH)3放入盛有蒸馏水的试管中,滴加无色酚酞也变红。3、硫酸钾和硫酸铵可以用加熟石灰研磨后闻气味的方法区分。1、要验证烧碱溶液是否含有Cl-,先加盐酸除去OH-,再加硝酸银溶液有白色沉淀出现,证明有Cl-。是对还是错?某溶液中含有Na+、Cl-、H+、SO42-欲证明两种阴离子确实存在,选用的最佳方案是;先向溶液中滴加足量的 ,溶液至沉淀完全,再取上层清液滴加 溶液,又出现白色沉淀,则可得出结论。Ba(NO3)2AgNO3优先检验SO42-甲乙两位同学分别设计了两个实验方案验证某溶液中含
有SO42- ,你认为正确的是
+氯化钡溶液 加足量的稀硝酸
甲:溶液 白色沉淀 沉淀不消失
+足量的盐酸 加氯化钡溶液
乙:溶液 无沉淀 白色沉淀
√跟上,
别掉队了
的检验 H+ OH-
CO32- Cl- SO42- NH4+
离子检验的一般方法:
1、选试剂(根据离子间的特殊反应确定试剂)
2、防干扰(防止共存离子之间的相互干扰)
3、定组成(用已有的离子排除与之不能共存
的离子)操作简便、现象明显、叙述规范现象所加试剂待测离子
H+pH试纸pH<7活泼金属:如Zn Fe等有气泡产生难溶的碱:如Cu(OH)2等难溶的金属氧化物:如CuO Fe2O3等溶解、溶液变色紫色石蕊试液由紫变红碳酸盐:如Na2CO3和澄清石灰水有气泡,能使澄清石灰水变浑溶解、溶液变色待测离子所加试剂现象
OH-
紫色石蕊试液由紫变蓝无色酚酞试液由无色变红pH试纸pH>7加入铜盐溶液:如CuSO4有蓝色沉淀生成加入铁盐溶液:如FeCl3有红褐色沉淀生成加入铵盐、研磨、湿润的红色石蕊试纸产生刺激性气味的气体;试纸变蓝●凡是含有碳酸根的盐,都能与酸反应,
生成二氧化碳气体。●能与酸反应生成二氧化碳气体的,
都含有碳酸根离子。离子的检验:①检验CO32- :结论:CO32-的检验●凡是含有氯离子的都能与硝酸银反应生成
不溶于稀硝酸的白色沉淀。●能与硝酸银反应生成不溶于稀硝酸的
白色沉淀的,都含有氯离子。氯离子的鉴定:加硝酸银和稀硝酸,
看是否生成白色沉淀。②检验Cl- :结论:取样,向被检物中加入AgNO3溶液,有白色沉淀生成,Cl-的检验再加稀HNO3,沉淀不溶解,则被检物中有Cl-●凡是含有硫酸根离子的都能与硝酸钡反应
生成不溶于稀硝酸的白色沉淀。
●能与硝酸钡反应生成不溶于稀硝酸的
白色沉淀的,都含有硫酸根离子。硫酸根离子的鉴定:加硝酸钡和稀硝酸,
看是否生成白色沉淀。
③检验SO42-:结论:取样,向被检物中加入BaCl2溶液,有白色沉淀生成,SO42-的检验再加稀HNO3沉淀不溶解,则被检物中有SO42- 向被检物中加入NaOH溶液,加热,有刺激性气味的气体生成, NH4+的检验生成的气体能使湿润的红色的石蕊试纸变蓝,则被检物中有NH4+。待测离子所加试剂现象CO32-稀盐酸和澄清石灰水有气泡产生,能使澄清石灰水变浑Cl-AgNO3溶液和稀硝酸白色沉淀SO42-Ba(NO3)2溶液和稀硝酸白色沉淀NH4+与碱混合研磨,再用湿润的红色石蕊试纸测试有刺鼻气味的气体产生,试纸变蓝例1 某农技人员在整理化肥时发现一瓶钾肥的标签缺损(如图所示)。请你对该试剂做出猜想,并设计实验验证。1、猜想:此钾肥溶液可能是 ,也可能是 。
2、实验验证(请写出操作步骤、实验现象、结 论) 。 K2
酸钾K2SO4K2CO3取样,加入稀盐酸,如果有气泡产生,该溶液就是K2CO3,如果无明显现象,就是K2SO4二、混合溶液中常见离子的检验 1、CO32-和Cl-:
一般来说先检验CO32-,应该加入稍过量的稀硝酸,检验的同时,除尽CO32-,以防止干扰Cl-的检验;再用硝酸银溶液检验Cl- 。
如先滴加硝酸银溶液,观察到白色沉淀后,继续加入稍过量的稀硝酸,看到有较多气泡产生,且沉淀不能完全溶解,也能说明两种离子都有。
2、CO32-和SO42-:
先检验CO32-,应该加入稍过量的稀硝酸,检验的同时,除尽CO32-,以防止干扰SO42-的检验;再用硝酸钡溶液检验SO42- 。
如先滴加硝酸钡溶液,观察到白色沉淀后,继续加入稍过量的稀硝酸,看到有较多气泡产生,且沉淀不能完全溶解,说明两种离子都有。
感悟
1当多种离子需要检验时通常顺序为:
CO32- OH- SO42- Cl-
2检验时要排除干扰离子
3检验时更不要带入新的干扰离子
4注意所加试剂的量
5 取样分析
将珍珠加入稀HCl中有气泡产生,生成的气
体能使使澄清石灰水变浑浊,则珍珠中含
有下列离子中的-----------( )
A、SO42- B、Cl-
C、OH- D、CO32-考考你D 可一次鉴别蒸馏水、稀盐酸、石灰水的试剂是( )
A、酚酞试液 B、石蕊试液
C、碳酸钠溶液 D、氯化钠溶液B1、有一种钠盐,在其溶液中滴加AgNO3溶液,生成白色沉淀,再加稀硝酸,沉淀不溶解,该钠盐是 (写化学式),
有关化学方程式
。NaClAgNO3+NaCl=AgCl +NaNO32、有一种溶液,滴加紫色的石蕊试液,
石蕊变红。另取这种溶液少量,
滴加BaCl2溶液,有白色沉淀生成,
滴加稀硝酸沉淀不溶解,
这种溶液是 的溶液,
有关化学方程式
。H2SO4H2SO4+BaCl2=BaSO4 +2HCl3、有一种钙盐,取少量固体加稀盐酸,
发现有无色气体生成,将该气体通入
澄清石灰水中,石灰水变浑浊。
该钙盐是 (写化学式),
有关方程式
。CaCO3CaCO3+2HCl=CaCl2+H2O+CO2例2 某电镀厂在对金属镀件表面除锈、除污过程中,使用了盐酸、硫酸、氢氧化钠、碳酸钠。该厂经处理后排放的废水,仍有H+ 、 OH- 、 Na+ 、 Fe3+ 、 Cu2+ 、 Cl- CO32- 、 SO42- 中的几种离子。某中学环保志愿组对该废水中的部分成分进行检测。实验步骤及现象如下表所示。请完成下表根据以上信息分析,推测该废水中溶有的物质为 ,不能确定的物质是 。Fe3+ 、 Cu2+OH-CO32-√氢氧化钠氯化钠、硫酸钠例4:下列各组的离子,能大量共存于同一溶液的是 ( )
A.H+、Na+、CO32- B.Cu2+、Cl-、SO42-
C.Fe3+、SO42-、OH- D.Ca2+、NO3-、CO32-
注意:有关于此类离子共存的习题,一般考虑如下离子不能大量共存:
H+:
OH-:
CO32-:
Cl-:
SO42-:B共存=不发生反应
即不会产生气体、沉淀、水OH-、CO32-;H+、Mg2+、Fe3+、Cu2+、Zn2+、NH4+H+、Ca2+、Cu2+、Ba2+;Ag+Ba2+;例题一:
下列各组物质能够共存的是: ( )
A、FeCl3溶液、NaOH溶液
B、Ca(OH)2溶液、Na2CO3溶液
C、BaCl2溶液、HCl溶液
D、CaCO3、稀HNO3 C讨论二:
如何鉴别稀硫酸和稀盐酸?例题二:
“清水”变“牛奶”.在无色液体C中倒入无色液体B,立即产生“牛奶”般的白色沉淀.如果C是稀硫酸, B是 ______
(填序号)
①氢氧化钠溶液②氯化钡溶液③氯化钠溶液 ②优先检验SO42-例题三:某瓶盐溶液标签已被腐蚀,只知其可能是NaCl溶液,也可能是Na2CO3溶液.
请你对这瓶溶液进行鉴定,以确定是NaCl溶液,还是Na2CO3溶液.
(1)鉴定该溶液可用两种不同类别的试剂?
(2)简述其中一种鉴定方法.(包括步骤,现象及结论)优先检验CO32-酸:
碱:
盐:HCl、H2SO4Ca(OH)2、Ba(OH)2可溶性钙盐(钡盐)CaCl2、BaCl2指示剂Ca(NO3)2、Ba(NO3)2例题四:
为了检测长期暴露在空气的氢氧化钠是否变质,可选用酸、碱、盐试剂来鉴别,可用的相应物质的化学式可以为______,______,_______
HCl、H2SO4Ca(OH)2、Ba(OH)2CaCl2、BaCl2Ca(NO3)2、Ba(NO3)24、某溶液中加入硝酸银溶液产生白色沉淀证明溶液是盐酸。2、NaOH溶液能使无色酚酞变红,将Cu(OH)2或Fe(OH)3放入盛有蒸馏水的试管中,滴加无色酚酞也变红。3、硫酸钾和硫酸铵可以用加熟石灰研磨后闻气味的方法区分。1、要验证烧碱溶液是否含有Cl-,先加盐酸除去OH-,再加硝酸银溶液有白色沉淀出现,证明有Cl-。是对还是错?某溶液中含有Na+、Cl-、H+、SO42-欲证明两种阴离子确实存在,选用的最佳方案是;先向溶液中滴加足量的 ,溶液至沉淀完全,再取上层清液滴加 溶液,又出现白色沉淀,则可得出结论。Ba(NO3)2AgNO3优先检验SO42-甲乙两位同学分别设计了两个实验方案验证某溶液中含
有SO42- ,你认为正确的是
+氯化钡溶液 加足量的稀硝酸
甲:溶液 白色沉淀 沉淀不消失
+足量的盐酸 加氯化钡溶液
乙:溶液 无沉淀 白色沉淀
√跟上,
别掉队了
