化学(2019)必修第二册7.1 认识有机化合物(共57张ppt)
文档属性
| 名称 | 化学(2019)必修第二册7.1 认识有机化合物(共57张ppt) |  | |
| 格式 | pptx | ||
| 文件大小 | 3.8MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-07-14 11:04:32 | ||
图片预览




文档简介
(共57张PPT)
认识有机化合物
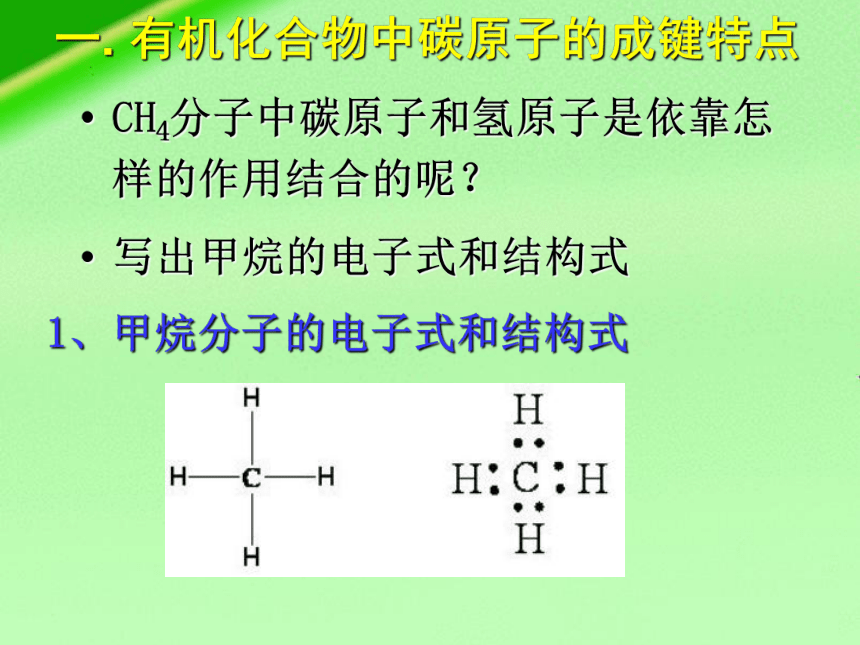
CH4分子中碳原子和氢原子是依靠怎样的作用结合的呢?
写出甲烷的电子式和结构式
一. 有机化合物中碳原子的成键特点
1、甲烷分子的电子式和结构式
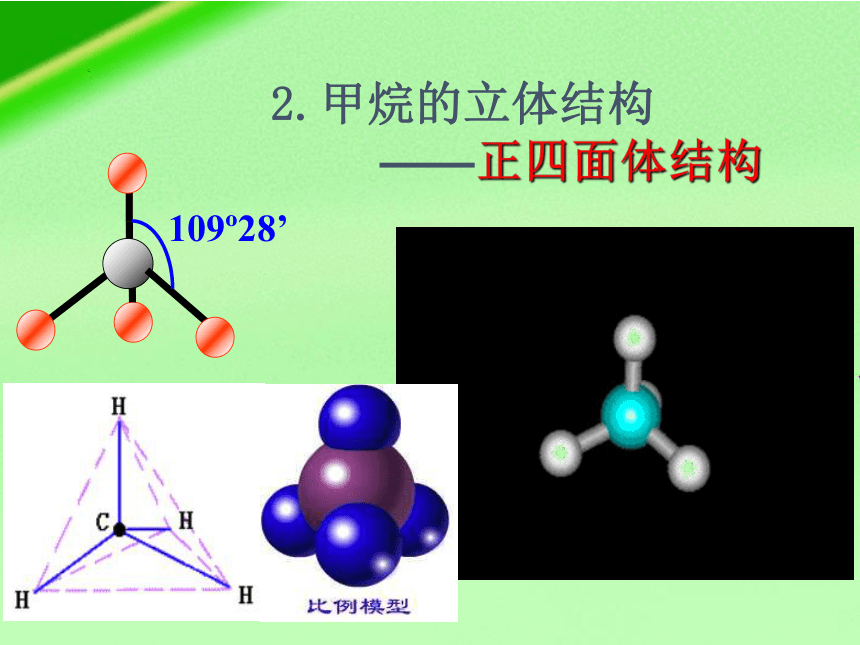
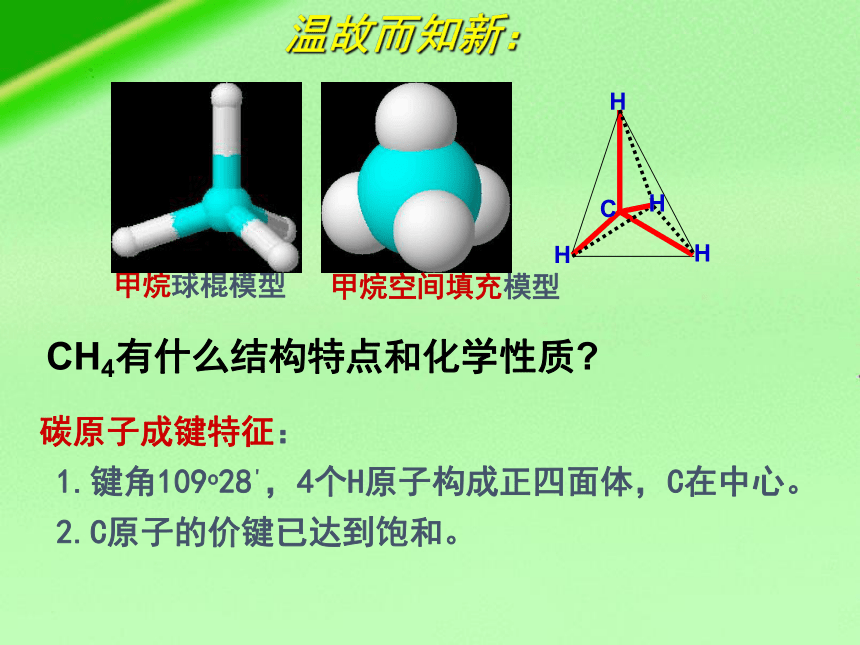
2.甲烷的立体结构
——正四面体结构
109 28’
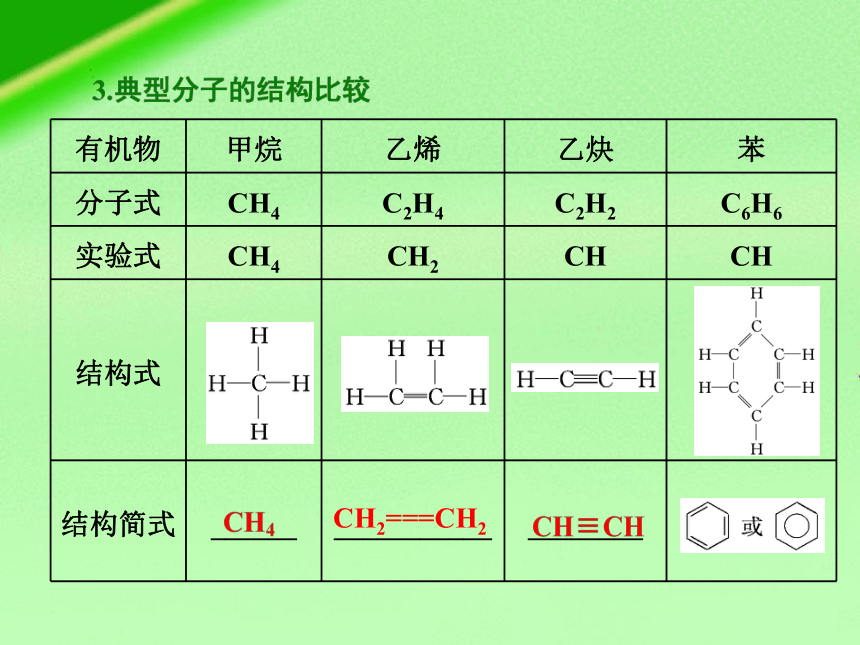
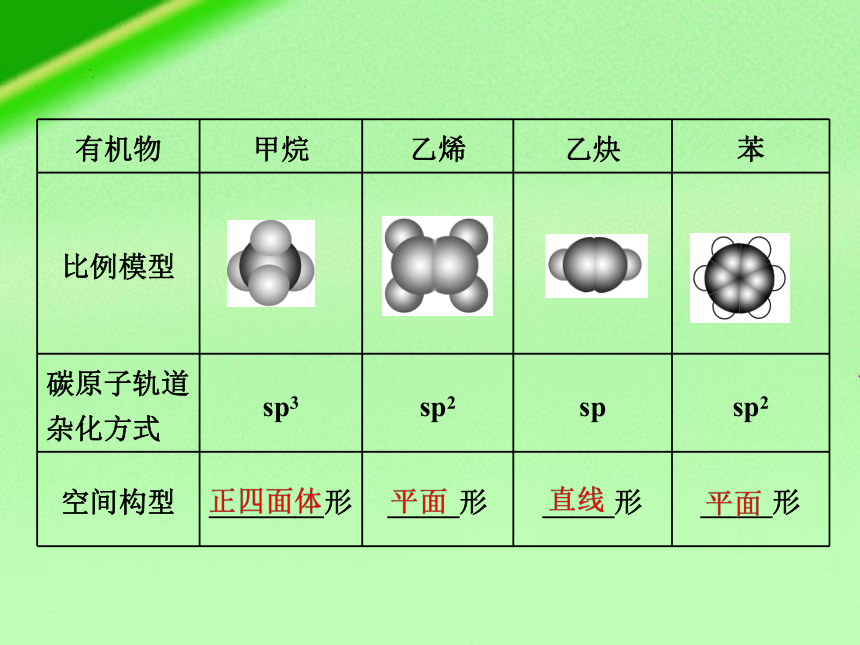
有机物 甲烷 乙烯 乙炔 苯
分子式 CH4 C2H4 C2H2 C6H6
实验式 CH4 CH2 CH CH
结构式
结构简式 ______ ___________ ________
CH2===CH2
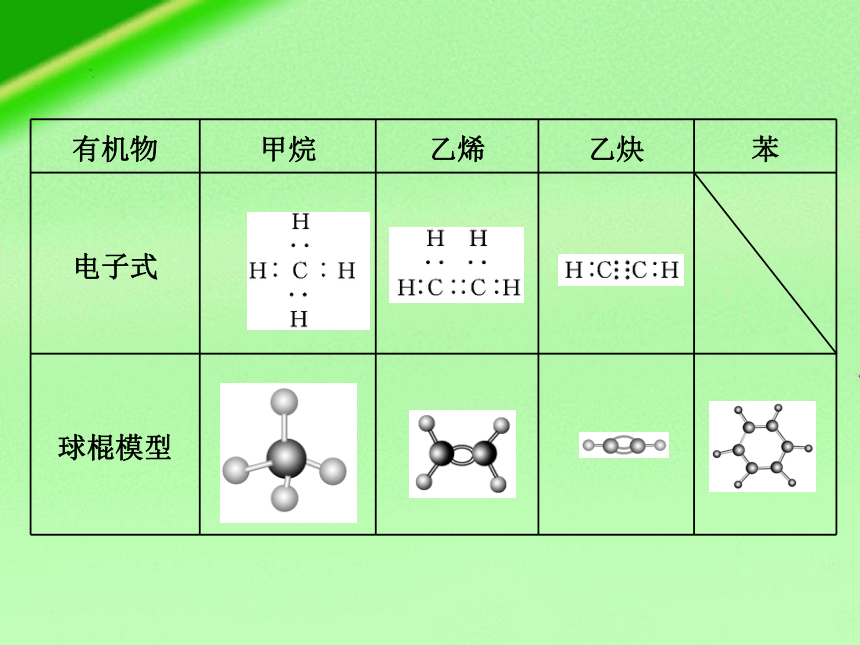
有机物 甲烷 乙烯 乙炔 苯
电子式
球棍模型
有机物 甲烷 乙烯 乙炔 苯
比例模型
碳原子轨道杂化方式 sp3 sp2 sp sp2
空间构型 ________形 _____形 _____形 _____形
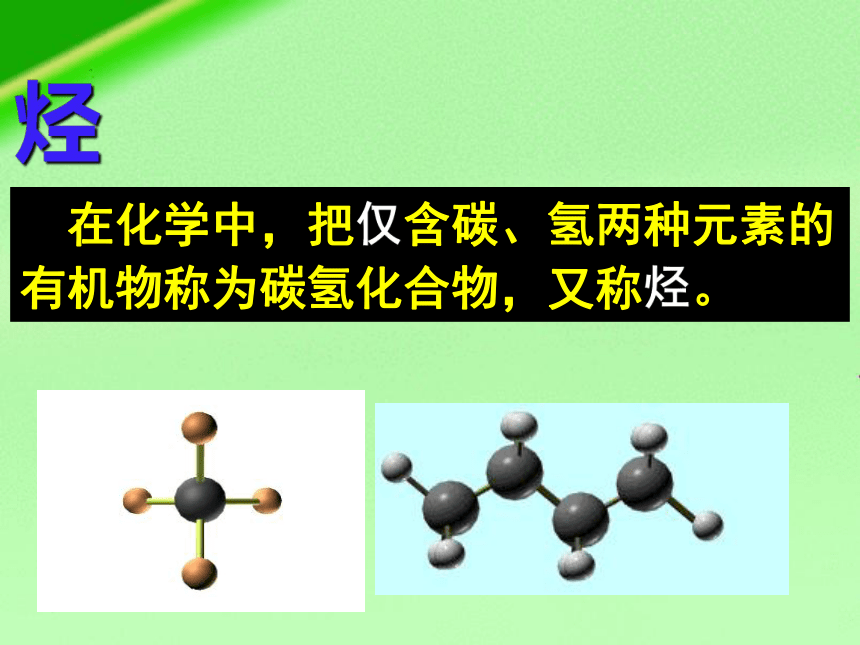
烃
在化学中,把仅含碳、氢两种元素的有机物称为碳氢化合物,又称烃。
甲烷球棍模型
碳原子成键特征:
1.键角109o28',4个H原子构成正四面体,C在中心。
2.C原子的价键已达到饱和。
甲烷空间填充模型
温故而知新:
C
H
H
H
H
CH4有什么结构特点和化学性质
C
H
H
H
H
C
H
H
乙烷
C
C
C
H
H
H
H
H
H
H
H
丙烷
C
C
C
C
H
H
H
H
H
H
H
H
H
H
丁烷
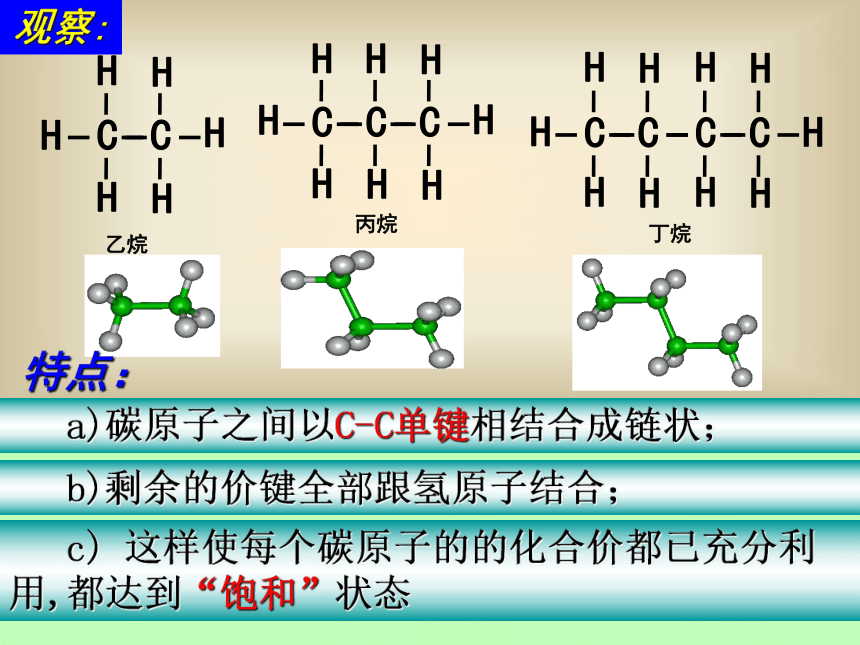
a)碳原子之间以C-C单键相结合成链状;
c) 这样使每个碳原子的的化合价都已充分利用,都达到“饱和”状态
b)剩余的价键全部跟氢原子结合;
观察:
特点:
碳原子之间以单键 相结合成链状,碳原子剩余的价键全部跟氢原子结合,达到“饱和”,这样的烃叫饱和烃,又叫烷烃。
1)C原子间都以C-C相连、其余都是C-H键;
2)C原子都形成4个共价键;
3)碳链不是一条直线,呈锯齿状
2、烷烃的结构特点:
烷烃通式:CnH2n+2
(n≥1的正整数)
1、概念:
二、烷 烃
结构简式
C
H
H
H
H
C
H
H
乙烷
C
C
C
H
H
H
H
H
H
H
H
丙烷
C
C
C
C
H
H
H
H
H
H
H
H
H
H
丁烷
为了方便书写还可以用 表示:
CH3CH3 、 CH3CH2CH3 、 CH3CH2CH2CH3
或
CH3-CH3、 CH3-CH2-CH3 、 CH3-CH2-CH2-CH3
结构简式:
例: H H H H H
| | | | |
H—C—C—C—C—C—H
| | | | |
HH—C—H H H H
|
H
省略C—H键
把同一C上的H合并
省略横线上C—C键
CH3-CH-CH2-CH2-CH3
CH3
CH3CHCH2CH2CH3
CH3
或者:CH3CH(CH3)CH2CH2CH3
【应用1】
下列物质中是否属于烷烃?
B:CH3-CH2-CH2-CH2-CH3
A:CH2=CH2
C:CH3-C(CH3)2-CH2-CH2-CH3
D:CH3-CH=CH2
BC
3、烷烃的习惯命名法
(1)C原子数在1~10之间的,依次用天干:
甲、乙、丙、丁、戊、
己、庚、辛、壬、癸 表示。
(2)C原子数大于10时,用汉字数字表示
(3)C原子数相同
正——不带支链
异——链一端第二个碳上有一个甲基
新——链一端第二个碳上有两个甲基
如:十一烷、十七烷等
→正戊烷、异戊烷、新戊烷
【应用2】
试写出戊烷、己烷、辛烷的分子式
C5H12、 C6H14、 C8H18
试给下列物质命名
C4H10、C11H24、 C8H18、 C15H32
甲基:-CH3 亚甲基: -CH2 -
次甲基: -CH - 乙基:-CH2CH3
丙基:-CH2CH2CH3
∣
烃基:烃分子失去一个或几个氢原子后剩
余部分。用“R—”来表示。
烷基通式:—CnH2n+1(n≥1)
(4)烃基
甲烷 CH4
乙烷 CH3CH3
丙烷 CH3CH2CH3
丁烷 CH3CH2CH2CH3
戊烷 CH3(CH2)3CH3
癸烷 CH3(CH2)8CH3
十七烷 CH3(CH2)15CH3
分析上述分子式,我们可以发现它们在结构和组成上有什么异同?
结构上相似,在分子组成上相差一个或若干个“-CH2-”原子团
结构上相似,在分子组成上相差一个或若干个“-CH2-”原子团的物质互相称为同系物。
4、同系物
(1)定义:
①通式_____(填“同”或“不同”,以下相同)
②是______一类物质;
③组成元素_____;
④分子式不同,相对分子质量相差 ;
⑤结构相似但不完全相同;
⑥物理性质 递变 ,化学性质 相似 。
(2)特点:
相同
同
同
14n
【应用3】
1、在同一系列中,所有同系物都具有( )
A、相同的相对分子质量和相同的物理性质
B、相同的物理性质和相似的化学性质
C、相似的化学性质和相同的分子式
D、相同的通式,相似的化学性质,分子组成
上相差一个或若干个—CH2—原子团
D
2、下列哪组是同系物?( )
A、CH3CH2CH2CH3 CH3CH(CH3)CH3
B、CH3CH3 CH3CH(CH3)CH3
CH2
C、CH3-CH=CH2 CH2 CH2
【应用3】
B
丁烷
异丁烷
写出丁烷和异丁烷的结构式和结构简式、分子式
H H H H H
| | | | |
H-C-C-C-C-H H--C--H
| | | | H H
H H H H | |
H-C——C——C-H
| | |
H H H
[CH3CH2CH2CH3]
[CH3CH(CH3 )CH3]
(C4H10)
(C4H10)
思考:丁烷和异丁烷之间有什么特点?这种现象在我们有机化学是一种什么现象?它们之间有什么关系呢?
想想为什么有机物的种类远远多于无机物的种类
(1)同分异构体现象:
化合物具有相同的分子式,但具有不同的结构现象,叫做同分异构体现象。
(2)同分异构体:
具有同分异构体现象的化合物互称为同分异构体。
5、同分异构现象、同分异构体
同分异构体的特点:
①组成元素_____(填“同”或“不同”,以下相同)
②化学式_____ ;
③化学式量_____;
④结构______(可能相似也可能完全不同);
⑤化学性质______(可能相似也可能完全不同)。
相同
同
同
不同
不同
理解:
三个相同:
二个不同:
分子组成相同、分子量相同、分子式相同
结构不同、性质不同
物理性质不同,性质不同的原因是结构不同。
正戊烷
例1:写出C5H12的同分异构体
CH3CH2CH2CH2CH3
异戊烷
CH3CH2CH(CH3)CH3
新戊烷
CH3(CH3)C(CH3)CH3
同一种物质
同分异构体
同系物
例2:
附表:烷烃的碳原子数与其对应的同分异构体数
碳原子数 1 2 3 4 5 6 7 8 9 10
同分异体数 1 1 1 2 3 5 9 18 35 75
同分异构现象是有机化合物中普遍存在的一种现象,碳原子数越多,同分异构体就越多。
同分异构现象的普遍存在,是有机化合物种类繁多的主要原因之一,并且碳原子数越多,同分异构体就越多。
7、同分异构体,同系物,同位素,同素异形体比较
定义 适用范围 实例
同系物 结构相似,组成上相差一个或多个CH2原子团的物质 同一类有机物 CH4, C3H8,
同分异 构体 分子式相同,结构不同的物质 有机物 正丁烷和异丁烷
同位素 同种元素的不同原子之间互称 原子(同种元素) 11H, 21H, 31H
同素异 形体 由同种元素形成的不同种单质 单质(同种元素) 金刚石和石墨
下列五组物质中___互为同位素,___是同素异形体,
___ 是同分异构体,___是同系物,___是同一物质。
1、 2、白磷、红磷
3、 H H 4、CH3CH3、CH3CHCH3
| | |
H-C-Cl 、 Cl-C-Cl CH3
| |
Cl H
5、CH3CH(CH3)CH2CH3 C(CH3)4
1 2
5 4 3
【应用5】
今天学习了那些内容
【小结】
1、烷烃的概念和结构特点
2、烷烃的习惯命名
3、同系物
4、同分异构现象和同分异构体
1、下列说法中错误的是 ( )
①化学性质相似的有机物是同系物
②分子组成相差一个或几个CH2原子团的有机物是同系物
③若烃中碳、氢元素的质量分数相同,它们必定是同系物
④互为同分异构体的两种有机物的物理性质有差别,但化学性质必定相似
A.①②③④ B.只有②③
C.只有③④ D. 只有①②③
A
名称 结构简式 状态 熔点/℃ 沸点/ ℃ 相对 密度 水溶性
甲烷 CH4 气 -182.5 -161.5 0.466 不溶
乙烷 CH3CH3 气 -182.8 -88.6 0.572 不溶
丙烷 CH3CH2CH3 气 -188.0 -42.1 0.5005 不溶
丁烷 CH3(CH2)2CH3 气 -138.4 -0.5 0.5788 不溶
戊烷 CH3(CH2)3CH3 液 -129.7 36.0 0.5572 不溶
十七烷 CH3(CH2)15CH3 固 22.0 302.2 0.7767 不溶
气 液 固
逐 渐 升 高
逐 渐 增 大
如图是几种烷烃的物理性质,归纳烷烃物理性质的变化规律。
2)熔沸点、密度随C原子序数递增而递增
1-4:气态
5-16:液态
17以上:固态
C原子数
3)均不溶于水,且密度比水小
规律:CnH2n+2(n≥1)状态:气 液 固;熔沸点依次升高,相对密度依次增大均不溶于水。
1)常温下状态:
物理性质的相似性和递变性
6、烷烃的性质
1、物理性质
色 味的 体,密度 ,
溶于水。
无
气
无
比空气小
极难
向下排气法
排水法
收集
收集
二.甲烷的性质
结构决定性质,请根据甲烷的结构推测甲烷的性质?
通常情况下,甲烷稳定,不易与其它物质反应。
2、化学性质
二.甲烷的性质
与强酸、强碱、强氧化剂如高锰酸钾、溴水等都不起反应。
(1)、氧化反应(可燃性)
CH4+2O2 CO2+2H2O
点燃
用“→” 不用“=”
注意:点燃甲烷前必须验纯,否则会爆炸
氧化反应
均不能使KMnO4褪色,不与强酸,强碱反应
(与甲烷类似)
化学性质
烷烃的化学性质
天然气的主要成分是甲烷
天然气是一种高效、低耗、污染小的清洁能源
瓦斯气的主要成分是甲烷
CH4爆炸极限:
5%~15.4%
相关新闻约24,500篇
一定浓度——通风;
着火点——避免明火
甲烷:
高效清洁能源,必须科学合理使用
甲烷在自然界的存在
沼气
煤矿坑道气
天然气
油田气
1mol的某气态烃CxHy完全燃烧,需用3molO2,则( )
A、 x=2,y=2 B、 x=2,y=4
C 、 x=3,y=6 D、 x=3,y=8
练习
2、等物质的量的下列烃完全燃烧时,消耗氧气最多的是( )
A、CH4 B 、C2H6 C、C3H6 D、C6H6
B
D
隔绝空气并加热至1000℃的高温下,甲烷分解
CH4 C + 2H2
高温
合成氨的原料
橡胶工业的原料
可以用于制造颜料、油墨、油漆等
烷烃受热分解
烷烃的取代反应
一个试管预先用铝箔套上,另一个试管放在光亮处。
预先在试管中收集
一半甲烷和一半氯气。
两个倒置在烧杯中(饱和食盐水)的试管。
打开铝箔,对比观察这两个试管。颜色 水面 试管壁
实验现象:
颜色:
水面:
试管壁:
黄绿色变浅
水面上升
壁上有油状液体
结论:
甲烷与氯气在光照条件下发生了反应。
放在光亮处的试管比用铝箔套上的:
CH4 + Cl2 CH3Cl + HCl
光照
一氯甲烷
思考与交流
经检测甲烷与氯气在光照下反应,生成5种化合物。
请你结合观察到的实验现象预测:除了CH3Cl和HCl外还有什么物质生成,请写出它们的结构式。
光照
光照
光照
二氯甲烷
液态
一氯甲烷
气态
三氯甲烷(氯仿)
液态
四氯甲烷(四氯化碳)
液态
仿照生成一氯甲烷的化学方程式,你能尝试写出一氯甲烷与氯气进一步反应的化学方程式吗?
CH4 + Cl2 CH3Cl + HCl
光照
CH3Cl+Cl2
光照
CH2Cl2+HCl
CH2Cl2+Cl2
光照
CHCl3+HCl
CHCl3+Cl2
光照
CCl4+HCl
产物为混合物
有机化合物分子中某些原子(或原子团)被其它原子或原子团代替的反应叫取代反应
取代反应与置换反应的区别
取代反应
适用于有机反应
适用于无机反应
反应物、生成物中不一定有单质
反应物、生成物中一定有单质
逐步取代 ,很多反应是可逆的
反应一般是单向进行
反应能否进行受催化剂、温度、光照等外界条件影响较大
在水溶液中进行的置换反应遵循金属或非金属的活动顺序
置换反应
讨论
1、在光照条件下,将等体积的甲烷和氯气混合,得到的产物中物质的量最多的是
A、CH3Cl B、CH2Cl2 C、CCl4 D、HCl
D
2、在光照条件下,将等体积的甲烷和氯气混合,得到的产物有多少种( )
A、2 B、3 C、4 D、5
D
【知识应用】
3、与甲烷的分子结构相同的物质是( )
A、NH3 B、CCl4 C、CH2Cl2 D、H2O
4、将下列气体通入酸性高锰酸钾,酸性高锰酸钾褪色的是( )
A、CH4 B、CO2 C、SO2 D、H2
B
C
【应用4】
5、下列化学性质中,烷烃不具备的是
A、一定条件下发生分解反应
B、可以在空气中燃烧
C、可以与氯气或溴蒸汽发生取代反应
D、 能使酸性高锰酸钾溶液褪色
D
【知识小结】
一. 甲烷的结构
——正四面体结构
二. 烷烃的性质
1、物理性质
2、化学性质
(1)、氧化反应(可燃性)
(2)、受热分解
(3)、甲烷的取代反应
千年的希望
—— “可燃冰”
可燃冰是天然气(甲烷等)的水合物,它易燃烧,外形似冰,被称为“可燃冰”。“可燃冰”储量较大,可燃冰将成为最理想替代能源.
认识有机化合物
CH4分子中碳原子和氢原子是依靠怎样的作用结合的呢?
写出甲烷的电子式和结构式
一. 有机化合物中碳原子的成键特点
1、甲烷分子的电子式和结构式
2.甲烷的立体结构
——正四面体结构
109 28’
有机物 甲烷 乙烯 乙炔 苯
分子式 CH4 C2H4 C2H2 C6H6
实验式 CH4 CH2 CH CH
结构式
结构简式 ______ ___________ ________
CH2===CH2
有机物 甲烷 乙烯 乙炔 苯
电子式
球棍模型
有机物 甲烷 乙烯 乙炔 苯
比例模型
碳原子轨道杂化方式 sp3 sp2 sp sp2
空间构型 ________形 _____形 _____形 _____形
烃
在化学中,把仅含碳、氢两种元素的有机物称为碳氢化合物,又称烃。
甲烷球棍模型
碳原子成键特征:
1.键角109o28',4个H原子构成正四面体,C在中心。
2.C原子的价键已达到饱和。
甲烷空间填充模型
温故而知新:
C
H
H
H
H
CH4有什么结构特点和化学性质
C
H
H
H
H
C
H
H
乙烷
C
C
C
H
H
H
H
H
H
H
H
丙烷
C
C
C
C
H
H
H
H
H
H
H
H
H
H
丁烷
a)碳原子之间以C-C单键相结合成链状;
c) 这样使每个碳原子的的化合价都已充分利用,都达到“饱和”状态
b)剩余的价键全部跟氢原子结合;
观察:
特点:
碳原子之间以单键 相结合成链状,碳原子剩余的价键全部跟氢原子结合,达到“饱和”,这样的烃叫饱和烃,又叫烷烃。
1)C原子间都以C-C相连、其余都是C-H键;
2)C原子都形成4个共价键;
3)碳链不是一条直线,呈锯齿状
2、烷烃的结构特点:
烷烃通式:CnH2n+2
(n≥1的正整数)
1、概念:
二、烷 烃
结构简式
C
H
H
H
H
C
H
H
乙烷
C
C
C
H
H
H
H
H
H
H
H
丙烷
C
C
C
C
H
H
H
H
H
H
H
H
H
H
丁烷
为了方便书写还可以用 表示:
CH3CH3 、 CH3CH2CH3 、 CH3CH2CH2CH3
或
CH3-CH3、 CH3-CH2-CH3 、 CH3-CH2-CH2-CH3
结构简式:
例: H H H H H
| | | | |
H—C—C—C—C—C—H
| | | | |
HH—C—H H H H
|
H
省略C—H键
把同一C上的H合并
省略横线上C—C键
CH3-CH-CH2-CH2-CH3
CH3
CH3CHCH2CH2CH3
CH3
或者:CH3CH(CH3)CH2CH2CH3
【应用1】
下列物质中是否属于烷烃?
B:CH3-CH2-CH2-CH2-CH3
A:CH2=CH2
C:CH3-C(CH3)2-CH2-CH2-CH3
D:CH3-CH=CH2
BC
3、烷烃的习惯命名法
(1)C原子数在1~10之间的,依次用天干:
甲、乙、丙、丁、戊、
己、庚、辛、壬、癸 表示。
(2)C原子数大于10时,用汉字数字表示
(3)C原子数相同
正——不带支链
异——链一端第二个碳上有一个甲基
新——链一端第二个碳上有两个甲基
如:十一烷、十七烷等
→正戊烷、异戊烷、新戊烷
【应用2】
试写出戊烷、己烷、辛烷的分子式
C5H12、 C6H14、 C8H18
试给下列物质命名
C4H10、C11H24、 C8H18、 C15H32
甲基:-CH3 亚甲基: -CH2 -
次甲基: -CH - 乙基:-CH2CH3
丙基:-CH2CH2CH3
∣
烃基:烃分子失去一个或几个氢原子后剩
余部分。用“R—”来表示。
烷基通式:—CnH2n+1(n≥1)
(4)烃基
甲烷 CH4
乙烷 CH3CH3
丙烷 CH3CH2CH3
丁烷 CH3CH2CH2CH3
戊烷 CH3(CH2)3CH3
癸烷 CH3(CH2)8CH3
十七烷 CH3(CH2)15CH3
分析上述分子式,我们可以发现它们在结构和组成上有什么异同?
结构上相似,在分子组成上相差一个或若干个“-CH2-”原子团
结构上相似,在分子组成上相差一个或若干个“-CH2-”原子团的物质互相称为同系物。
4、同系物
(1)定义:
①通式_____(填“同”或“不同”,以下相同)
②是______一类物质;
③组成元素_____;
④分子式不同,相对分子质量相差 ;
⑤结构相似但不完全相同;
⑥物理性质 递变 ,化学性质 相似 。
(2)特点:
相同
同
同
14n
【应用3】
1、在同一系列中,所有同系物都具有( )
A、相同的相对分子质量和相同的物理性质
B、相同的物理性质和相似的化学性质
C、相似的化学性质和相同的分子式
D、相同的通式,相似的化学性质,分子组成
上相差一个或若干个—CH2—原子团
D
2、下列哪组是同系物?( )
A、CH3CH2CH2CH3 CH3CH(CH3)CH3
B、CH3CH3 CH3CH(CH3)CH3
CH2
C、CH3-CH=CH2 CH2 CH2
【应用3】
B
丁烷
异丁烷
写出丁烷和异丁烷的结构式和结构简式、分子式
H H H H H
| | | | |
H-C-C-C-C-H H--C--H
| | | | H H
H H H H | |
H-C——C——C-H
| | |
H H H
[CH3CH2CH2CH3]
[CH3CH(CH3 )CH3]
(C4H10)
(C4H10)
思考:丁烷和异丁烷之间有什么特点?这种现象在我们有机化学是一种什么现象?它们之间有什么关系呢?
想想为什么有机物的种类远远多于无机物的种类
(1)同分异构体现象:
化合物具有相同的分子式,但具有不同的结构现象,叫做同分异构体现象。
(2)同分异构体:
具有同分异构体现象的化合物互称为同分异构体。
5、同分异构现象、同分异构体
同分异构体的特点:
①组成元素_____(填“同”或“不同”,以下相同)
②化学式_____ ;
③化学式量_____;
④结构______(可能相似也可能完全不同);
⑤化学性质______(可能相似也可能完全不同)。
相同
同
同
不同
不同
理解:
三个相同:
二个不同:
分子组成相同、分子量相同、分子式相同
结构不同、性质不同
物理性质不同,性质不同的原因是结构不同。
正戊烷
例1:写出C5H12的同分异构体
CH3CH2CH2CH2CH3
异戊烷
CH3CH2CH(CH3)CH3
新戊烷
CH3(CH3)C(CH3)CH3
同一种物质
同分异构体
同系物
例2:
附表:烷烃的碳原子数与其对应的同分异构体数
碳原子数 1 2 3 4 5 6 7 8 9 10
同分异体数 1 1 1 2 3 5 9 18 35 75
同分异构现象是有机化合物中普遍存在的一种现象,碳原子数越多,同分异构体就越多。
同分异构现象的普遍存在,是有机化合物种类繁多的主要原因之一,并且碳原子数越多,同分异构体就越多。
7、同分异构体,同系物,同位素,同素异形体比较
定义 适用范围 实例
同系物 结构相似,组成上相差一个或多个CH2原子团的物质 同一类有机物 CH4, C3H8,
同分异 构体 分子式相同,结构不同的物质 有机物 正丁烷和异丁烷
同位素 同种元素的不同原子之间互称 原子(同种元素) 11H, 21H, 31H
同素异 形体 由同种元素形成的不同种单质 单质(同种元素) 金刚石和石墨
下列五组物质中___互为同位素,___是同素异形体,
___ 是同分异构体,___是同系物,___是同一物质。
1、 2、白磷、红磷
3、 H H 4、CH3CH3、CH3CHCH3
| | |
H-C-Cl 、 Cl-C-Cl CH3
| |
Cl H
5、CH3CH(CH3)CH2CH3 C(CH3)4
1 2
5 4 3
【应用5】
今天学习了那些内容
【小结】
1、烷烃的概念和结构特点
2、烷烃的习惯命名
3、同系物
4、同分异构现象和同分异构体
1、下列说法中错误的是 ( )
①化学性质相似的有机物是同系物
②分子组成相差一个或几个CH2原子团的有机物是同系物
③若烃中碳、氢元素的质量分数相同,它们必定是同系物
④互为同分异构体的两种有机物的物理性质有差别,但化学性质必定相似
A.①②③④ B.只有②③
C.只有③④ D. 只有①②③
A
名称 结构简式 状态 熔点/℃ 沸点/ ℃ 相对 密度 水溶性
甲烷 CH4 气 -182.5 -161.5 0.466 不溶
乙烷 CH3CH3 气 -182.8 -88.6 0.572 不溶
丙烷 CH3CH2CH3 气 -188.0 -42.1 0.5005 不溶
丁烷 CH3(CH2)2CH3 气 -138.4 -0.5 0.5788 不溶
戊烷 CH3(CH2)3CH3 液 -129.7 36.0 0.5572 不溶
十七烷 CH3(CH2)15CH3 固 22.0 302.2 0.7767 不溶
气 液 固
逐 渐 升 高
逐 渐 增 大
如图是几种烷烃的物理性质,归纳烷烃物理性质的变化规律。
2)熔沸点、密度随C原子序数递增而递增
1-4:气态
5-16:液态
17以上:固态
C原子数
3)均不溶于水,且密度比水小
规律:CnH2n+2(n≥1)状态:气 液 固;熔沸点依次升高,相对密度依次增大均不溶于水。
1)常温下状态:
物理性质的相似性和递变性
6、烷烃的性质
1、物理性质
色 味的 体,密度 ,
溶于水。
无
气
无
比空气小
极难
向下排气法
排水法
收集
收集
二.甲烷的性质
结构决定性质,请根据甲烷的结构推测甲烷的性质?
通常情况下,甲烷稳定,不易与其它物质反应。
2、化学性质
二.甲烷的性质
与强酸、强碱、强氧化剂如高锰酸钾、溴水等都不起反应。
(1)、氧化反应(可燃性)
CH4+2O2 CO2+2H2O
点燃
用“→” 不用“=”
注意:点燃甲烷前必须验纯,否则会爆炸
氧化反应
均不能使KMnO4褪色,不与强酸,强碱反应
(与甲烷类似)
化学性质
烷烃的化学性质
天然气的主要成分是甲烷
天然气是一种高效、低耗、污染小的清洁能源
瓦斯气的主要成分是甲烷
CH4爆炸极限:
5%~15.4%
相关新闻约24,500篇
一定浓度——通风;
着火点——避免明火
甲烷:
高效清洁能源,必须科学合理使用
甲烷在自然界的存在
沼气
煤矿坑道气
天然气
油田气
1mol的某气态烃CxHy完全燃烧,需用3molO2,则( )
A、 x=2,y=2 B、 x=2,y=4
C 、 x=3,y=6 D、 x=3,y=8
练习
2、等物质的量的下列烃完全燃烧时,消耗氧气最多的是( )
A、CH4 B 、C2H6 C、C3H6 D、C6H6
B
D
隔绝空气并加热至1000℃的高温下,甲烷分解
CH4 C + 2H2
高温
合成氨的原料
橡胶工业的原料
可以用于制造颜料、油墨、油漆等
烷烃受热分解
烷烃的取代反应
一个试管预先用铝箔套上,另一个试管放在光亮处。
预先在试管中收集
一半甲烷和一半氯气。
两个倒置在烧杯中(饱和食盐水)的试管。
打开铝箔,对比观察这两个试管。颜色 水面 试管壁
实验现象:
颜色:
水面:
试管壁:
黄绿色变浅
水面上升
壁上有油状液体
结论:
甲烷与氯气在光照条件下发生了反应。
放在光亮处的试管比用铝箔套上的:
CH4 + Cl2 CH3Cl + HCl
光照
一氯甲烷
思考与交流
经检测甲烷与氯气在光照下反应,生成5种化合物。
请你结合观察到的实验现象预测:除了CH3Cl和HCl外还有什么物质生成,请写出它们的结构式。
光照
光照
光照
二氯甲烷
液态
一氯甲烷
气态
三氯甲烷(氯仿)
液态
四氯甲烷(四氯化碳)
液态
仿照生成一氯甲烷的化学方程式,你能尝试写出一氯甲烷与氯气进一步反应的化学方程式吗?
CH4 + Cl2 CH3Cl + HCl
光照
CH3Cl+Cl2
光照
CH2Cl2+HCl
CH2Cl2+Cl2
光照
CHCl3+HCl
CHCl3+Cl2
光照
CCl4+HCl
产物为混合物
有机化合物分子中某些原子(或原子团)被其它原子或原子团代替的反应叫取代反应
取代反应与置换反应的区别
取代反应
适用于有机反应
适用于无机反应
反应物、生成物中不一定有单质
反应物、生成物中一定有单质
逐步取代 ,很多反应是可逆的
反应一般是单向进行
反应能否进行受催化剂、温度、光照等外界条件影响较大
在水溶液中进行的置换反应遵循金属或非金属的活动顺序
置换反应
讨论
1、在光照条件下,将等体积的甲烷和氯气混合,得到的产物中物质的量最多的是
A、CH3Cl B、CH2Cl2 C、CCl4 D、HCl
D
2、在光照条件下,将等体积的甲烷和氯气混合,得到的产物有多少种( )
A、2 B、3 C、4 D、5
D
【知识应用】
3、与甲烷的分子结构相同的物质是( )
A、NH3 B、CCl4 C、CH2Cl2 D、H2O
4、将下列气体通入酸性高锰酸钾,酸性高锰酸钾褪色的是( )
A、CH4 B、CO2 C、SO2 D、H2
B
C
【应用4】
5、下列化学性质中,烷烃不具备的是
A、一定条件下发生分解反应
B、可以在空气中燃烧
C、可以与氯气或溴蒸汽发生取代反应
D、 能使酸性高锰酸钾溶液褪色
D
【知识小结】
一. 甲烷的结构
——正四面体结构
二. 烷烃的性质
1、物理性质
2、化学性质
(1)、氧化反应(可燃性)
(2)、受热分解
(3)、甲烷的取代反应
千年的希望
—— “可燃冰”
可燃冰是天然气(甲烷等)的水合物,它易燃烧,外形似冰,被称为“可燃冰”。“可燃冰”储量较大,可燃冰将成为最理想替代能源.
同课章节目录
- 第五章 化工生产中的重要非金属元素
- 第一节 硫及其化合物
- 第二节 氮及其化合物
- 第三节 无机非金属材料
- 实验活动4 用化学沉淀法去除粗盐中的杂质离子
- 实验活动5 不同价态含硫物质的转化
- 第六章 化学反应与能量
- 第一节 化学反应与能量变化
- 第二节 化学反应的速率与限度
- 实验活动6 化学能转化成电能
- 实验活动7 化学反应速率的影响因素
- 第七章 有机化合物
- 第一节 认识有机化合物
- 第二节 乙烯与有机高分子材料
- 第三节 乙醇与乙酸
- 第四节 基本营养物质
- 实验活动8 搭建球棍模型认识有机化合物分子结构的特点
- 实验活动9 乙醇、乙酸的主要性质
- 第八章 化学与可持续发展
- 第一节 自然资源的开发利用
- 第二节 化学品的合理使用
- 第三节 环境保护与绿色化学
