1.3 氧化还原反应(第2课时 氧化剂和还原剂)-2022-2023学年高一化学同步教学精品课件(人教版2019必修第一册)
文档属性
| 名称 | 1.3 氧化还原反应(第2课时 氧化剂和还原剂)-2022-2023学年高一化学同步教学精品课件(人教版2019必修第一册) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.3MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-07-14 14:54:50 | ||
图片预览







文档简介
(共29张PPT)
氧化剂和还原剂
Fe2O3 + 3CO ==== 2Fe + 3CO2
高温
2CuO + C ==== 2Cu + CO2
高温
H2O + C ==== H2 + CO
高温
2KMnO4 === K2MnO4+MnO2+O2 ↑
Δ
SO2 + 2H2S === 3S↓+2H2O
NaNO2+NH4Cl === NaCl +N2↑+2H2O
判断下列反应是否是氧化还原反应,是氧化还原反应的表示出电子转移情况。
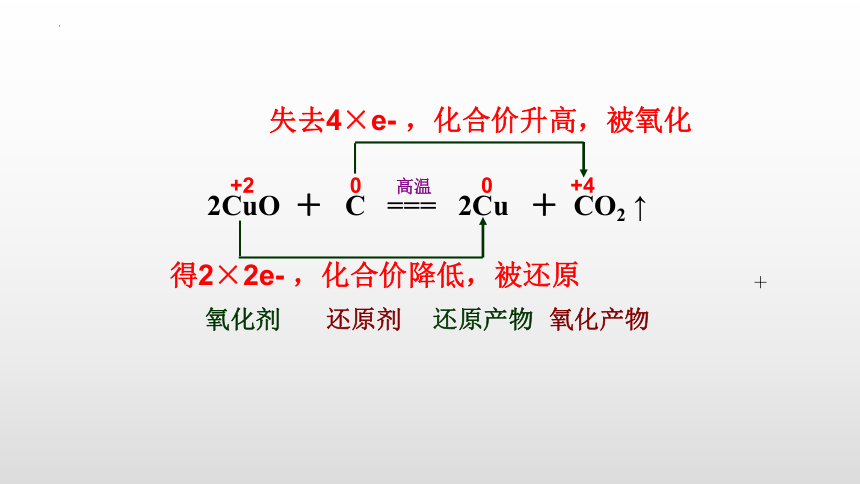
失去4×e- ,化合价升高,被氧化
得2×2e- ,化合价降低,被还原
2CuO + C === 2Cu + CO2 ↑
高温
氧化剂
氧化产物
还原产物
还原剂
+2 0 0 +4
+
组织建设
第三节 氧化还原反应
(第2课时 氧化剂和还原剂)
第一章 物质及其变化
中心原子:发生氧化还原反应的物质中发生化合价变化的原子。
还原剂:失去电子(或电子对偏离)的反应物,有化合价升高的中心原子所在
的物质。
一、氧化剂和还原剂
1、定义
氧化剂具有氧化性(氧化剂得电子的能力)
还原剂具有还原性(还原剂失电子的能力)
氧化剂:得到电子(或电子对偏向)的反应物,有化合价降低的中心原子所在
的物质。
氧化产物:还原剂失去电子被氧化的产物。
还原产物:氧化剂得到电子被还原的产物。
失电子,化合价升高,被氧化
得电子,化合价降低,被还原
记忆口诀:
升→失→氧化→还原剂,降→得→还原→氧化剂;
氧化剂(被还原)对应还原产物,还原剂(被氧化)对应氧化产物。
【例题1】用双线桥法分析下列反应电子得失、化合价升降、被氧化 被还原情况,指出氧化剂、还原剂、氧化产物和还原产物。
-2
-1
0
+5
化合价降低6×2,得12e-,被还原
化合价升3×2×2,失12e-,被氧化
氧化剂:KClO3
还原产物:KCl
还原剂:KClO3
氧化产物:O2
2KClO3 2KCl+3O2↑
MnO2
△
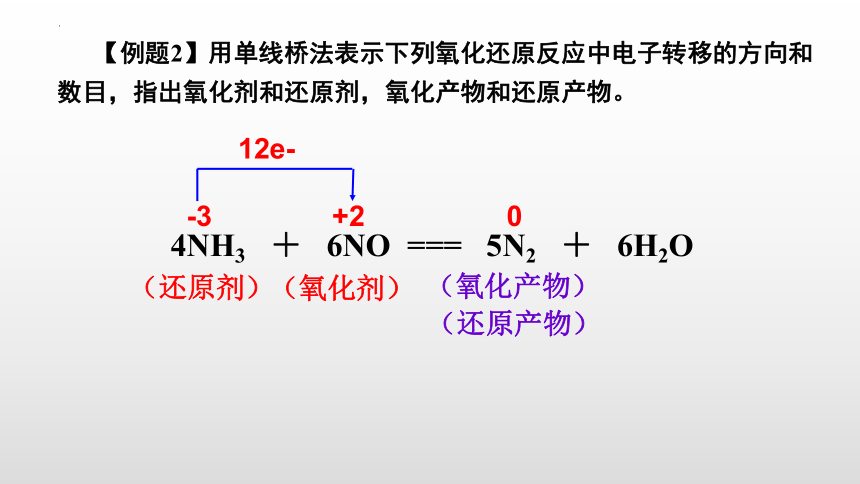
【例题2】用单线桥法表示下列氧化还原反应中电子转移的方向和数目,指出氧化剂和还原剂,氧化产物和还原产物。
4NH3 + 6NO === 5N2 + 6H2O
12e-
(氧化剂)
(还原剂)
(氧化产物)
(还原产物)
-3
+2
0
【小试牛刀】判断下列反应中哪些是氧化剂、哪些是还原剂、哪些是氧化产物、哪些是还原产物?
Zn + 2HCl === ZnCl2 + H2↑
Fe + CuSO4 === Cu + FeSO4
点燃
2CO + O2=== 2CO2
2KMnO4 === K2MnO4 + MnO2 + O2↑
△
(还原剂)
(氧化剂、还原剂)
(还原剂)
(还原剂)
(氧化剂)
(氧化剂)
(氧化剂)
(氧化产物、还原产物)
(氧化产物)
(氧化产物)
(氧化产物)
(还原产物)
(还原产物)
(还原产物)
【再来一刀】实验室中所用少量氯气是用下列方法制取的:
4HCl(浓)+MnO2==Cl2↑+MnCl2+2H2O
试回答下列问题:
(1)请指出_____ 是氧化剂,_____是还原剂,
写出该反应的离子方程式:_______________________________________。
(2)盐酸表现的性质是_____________。
(3)每生成1mol Cl2,转移的电子数为_____ mol。
△
MnO2
HCl
4H+ + 2Cl-+MnO2==Cl2↑+Mn2++2H2O
△
还原性、酸性
2
(1)常 见 的 氧 化 剂
第一类
第二类
第三类
其它
HClO Na2O2 H2O2 MnO2 等
KMnO4 FeCl3 KClO3
HNO3 H2SO4(浓)
O2 Cl2 Br2
2、常见的氧化剂和还原剂
活泼的 非金属单质
较高价态元素的含氧酸
较高价态元素的盐
(2)常 见 的 还 原 剂
第一类
第二类
第三类
K、Ca、Na、Mg、Al、Zn、Fe 等
H2 C 等
CO SO2 FeSO4
KI H2S Na2SO3
较低价态元素的
氧化物和盐
某些非金属单质
活泼的金属单质
1、根据氧化还原方程式进行判断
对于反应:
氧化性:氧化剂>氧化产物
还原性:还原剂>还原产物
二、物质氧化性、还原性强弱的判断
氧化性:CuSO4>FeSO4 还原性:Fe>Cu
例如:Fe + CuSO4 = FeSO4 + Cu
还原剂 氧化剂 氧化产物 还原产物
【小试牛刀】根据下面两个化学方程式判断Fe2+、Cu2+、Fe3+氧化性由强到弱的顺序是( )
①2FeCl3+Cu=2FeCl2+CuCl2,
②CuCl2+Fe=FeCl2+Cu
A.Fe3+>Fe2+>Cu2+ B.Fe2+>Cu2+>Fe3+
C.Cu2+>Fe3+>Fe2+ D.Fe3+>Cu2+>Fe2+
D
【再来一刀】(双选)已知X2,Y2,Z2,W2四种物质的氧化性强弱为: W2>Z2>X2>Y2,下列氧化还原反应能发生的是( )
A. 2W— + Z2 = 2Z —+ W2
B. 2X — + Z2 = 2Z — + X2
C. 2Y — + W2= 2W — + Y2
D. 2Z — + X2 = 2X — + Z2
BC
2、根据元素化合价进行判断
浓H2SO4
强还原性
强氧化性
既有氧化性又有还原性
SO2
S
H2S
+6
-2
0
+4
【小试牛刀】在:①S2-;②Fe3+;③Fe2+;④Mg2+;⑤S;⑥Cl-; ⑦H+;⑧SO2;⑨Fe;⑩HCl 粒子中,
只有氧化性的是 ,
只有还原性的是 ,
既有氧化性又有还原性的是 。
②④⑦
①⑥⑨
③⑤⑧⑩
3、根据物质活动性顺序进行判断
(1)根据金属活动性顺序判断
(2)根据非金属活动性顺序判断
2 2 2 2
4、根据反应条件来判断
【小试牛刀】(双选)下列变化中,需加入氧化剂才能实现的是( )
【再来一刀】(双选)下列变化中,需加入还原剂才能实现的是( )
A、Ag+ Ag B、CuO Cu
C、FeO Fe2O3 D、NO O2
A、HCl H2 B、CO CO2
C、SO2 SO3 D、Fe3+ Fe2+
BC
AB
三、氧化还原反应的规律
1.守恒规律
化合价升高总数=化合价降低总数
失电子总数=得电子总数。
【例题3】24 mL 0.05 mol·L-1的Na2SO3溶液恰好与20 mL 0.02 mol·L-1的K2Cr2O7溶液完全反应。已知Na2SO3被 K2Cr2O7 氧化为Na2SO4,则元素Cr在还原产物中的化合价为( )
A.+2 B.+3 C.+4 D.+5
B
2.价态规律
(1)元素处于最高价态,只有氧化性(只针对该元素),如Fe3+等;
(2) 元素处于最低价态,只有还原性(只针对该元素),如S2-等;
(3) 元素处于中间价态,既有氧化性又有还原性,如Fe2+等。
3.先后规律
氧化还原反应中,强者优先。即氧化性(或还原性)强,优先发生反应。
4.不交叉规律
即同种元素不同价态之间,相邻价态不反应,发生反应时化合价向中间靠拢,但不交叉。
【例题4】在KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O的反应中,被氧化的氯与被还原的氯的原子个数比为( )
A.1∶6 B.6∶1 C.1∶5 D.5∶1
D
1、在3NO2+H2O=2HNO3+NO↑反应中,氧化剂与还原剂的分子数之比为( )
A. 2∶1 B. 1∶2 C. 1∶1 D. 1∶3
2、在Cu+4HNO3(浓)=Cu(NO3)2+2NO2+2H2O反应中,若有32g铜被氧化,则被还原的HNO3的质量是( )
A.63g B.32g C.94.5g D.126g
3、在2H2S+SO2=3S+2H2O的反应中,还原产物和氧化产物的质量比是( )
A.1∶1 B.2∶1 C.1∶2 D.2∶3
A
C
B
作还原剂
4、下列四个反应中有一个反应中的H2O表现出来的性质与其他三组有本质区别,它是 。
(1)3NO2+H2O===2HNO3+NO
(2)Cl2+H2O===HClO+HCl
(3)2F2+2H2O===4HF+O2
(4)2Na2O2+2H2O===4NaOH+O2↑
+4 +5 +2
0 -2 -1 0
-1 -2 0
(3)
歧化反应
快速正确的标出变价元素的化合价是正确分析氧化还原反应的前提。
既不是氧化剂又不是还原剂
既不是氧化剂又是不是还原剂
既不是氧化剂又不是还原剂
0 +1 -1
(2)砒霜在上述反应中显示出来的性质是____(填字母)。
A.氧化性 B.还原性 C.酸性 D.碱性
(3)该反应的氧化产物是________,还原产物是_______。
5、已知砒霜(As2O3)与锌可以发生如下反应:
As2O3+6Zn+6H2SO4===2AsH3+6ZnSO4+3H2O
(1)请用“双线桥法”标出电子转移的方向和数目:
__________________________________________。
+3H2O
A
ZnSO4
AsH3
谢谢
21世纪教育网(www.21cnjy.com)
中小学教育资源网站
兼职招聘:
https://www.21cnjy.com/recruitment/home/admin
氧化剂和还原剂
Fe2O3 + 3CO ==== 2Fe + 3CO2
高温
2CuO + C ==== 2Cu + CO2
高温
H2O + C ==== H2 + CO
高温
2KMnO4 === K2MnO4+MnO2+O2 ↑
Δ
SO2 + 2H2S === 3S↓+2H2O
NaNO2+NH4Cl === NaCl +N2↑+2H2O
判断下列反应是否是氧化还原反应,是氧化还原反应的表示出电子转移情况。
失去4×e- ,化合价升高,被氧化
得2×2e- ,化合价降低,被还原
2CuO + C === 2Cu + CO2 ↑
高温
氧化剂
氧化产物
还原产物
还原剂
+2 0 0 +4
+
组织建设
第三节 氧化还原反应
(第2课时 氧化剂和还原剂)
第一章 物质及其变化
中心原子:发生氧化还原反应的物质中发生化合价变化的原子。
还原剂:失去电子(或电子对偏离)的反应物,有化合价升高的中心原子所在
的物质。
一、氧化剂和还原剂
1、定义
氧化剂具有氧化性(氧化剂得电子的能力)
还原剂具有还原性(还原剂失电子的能力)
氧化剂:得到电子(或电子对偏向)的反应物,有化合价降低的中心原子所在
的物质。
氧化产物:还原剂失去电子被氧化的产物。
还原产物:氧化剂得到电子被还原的产物。
失电子,化合价升高,被氧化
得电子,化合价降低,被还原
记忆口诀:
升→失→氧化→还原剂,降→得→还原→氧化剂;
氧化剂(被还原)对应还原产物,还原剂(被氧化)对应氧化产物。
【例题1】用双线桥法分析下列反应电子得失、化合价升降、被氧化 被还原情况,指出氧化剂、还原剂、氧化产物和还原产物。
-2
-1
0
+5
化合价降低6×2,得12e-,被还原
化合价升3×2×2,失12e-,被氧化
氧化剂:KClO3
还原产物:KCl
还原剂:KClO3
氧化产物:O2
2KClO3 2KCl+3O2↑
MnO2
△
【例题2】用单线桥法表示下列氧化还原反应中电子转移的方向和数目,指出氧化剂和还原剂,氧化产物和还原产物。
4NH3 + 6NO === 5N2 + 6H2O
12e-
(氧化剂)
(还原剂)
(氧化产物)
(还原产物)
-3
+2
0
【小试牛刀】判断下列反应中哪些是氧化剂、哪些是还原剂、哪些是氧化产物、哪些是还原产物?
Zn + 2HCl === ZnCl2 + H2↑
Fe + CuSO4 === Cu + FeSO4
点燃
2CO + O2=== 2CO2
2KMnO4 === K2MnO4 + MnO2 + O2↑
△
(还原剂)
(氧化剂、还原剂)
(还原剂)
(还原剂)
(氧化剂)
(氧化剂)
(氧化剂)
(氧化产物、还原产物)
(氧化产物)
(氧化产物)
(氧化产物)
(还原产物)
(还原产物)
(还原产物)
【再来一刀】实验室中所用少量氯气是用下列方法制取的:
4HCl(浓)+MnO2==Cl2↑+MnCl2+2H2O
试回答下列问题:
(1)请指出_____ 是氧化剂,_____是还原剂,
写出该反应的离子方程式:_______________________________________。
(2)盐酸表现的性质是_____________。
(3)每生成1mol Cl2,转移的电子数为_____ mol。
△
MnO2
HCl
4H+ + 2Cl-+MnO2==Cl2↑+Mn2++2H2O
△
还原性、酸性
2
(1)常 见 的 氧 化 剂
第一类
第二类
第三类
其它
HClO Na2O2 H2O2 MnO2 等
KMnO4 FeCl3 KClO3
HNO3 H2SO4(浓)
O2 Cl2 Br2
2、常见的氧化剂和还原剂
活泼的 非金属单质
较高价态元素的含氧酸
较高价态元素的盐
(2)常 见 的 还 原 剂
第一类
第二类
第三类
K、Ca、Na、Mg、Al、Zn、Fe 等
H2 C 等
CO SO2 FeSO4
KI H2S Na2SO3
较低价态元素的
氧化物和盐
某些非金属单质
活泼的金属单质
1、根据氧化还原方程式进行判断
对于反应:
氧化性:氧化剂>氧化产物
还原性:还原剂>还原产物
二、物质氧化性、还原性强弱的判断
氧化性:CuSO4>FeSO4 还原性:Fe>Cu
例如:Fe + CuSO4 = FeSO4 + Cu
还原剂 氧化剂 氧化产物 还原产物
【小试牛刀】根据下面两个化学方程式判断Fe2+、Cu2+、Fe3+氧化性由强到弱的顺序是( )
①2FeCl3+Cu=2FeCl2+CuCl2,
②CuCl2+Fe=FeCl2+Cu
A.Fe3+>Fe2+>Cu2+ B.Fe2+>Cu2+>Fe3+
C.Cu2+>Fe3+>Fe2+ D.Fe3+>Cu2+>Fe2+
D
【再来一刀】(双选)已知X2,Y2,Z2,W2四种物质的氧化性强弱为: W2>Z2>X2>Y2,下列氧化还原反应能发生的是( )
A. 2W— + Z2 = 2Z —+ W2
B. 2X — + Z2 = 2Z — + X2
C. 2Y — + W2= 2W — + Y2
D. 2Z — + X2 = 2X — + Z2
BC
2、根据元素化合价进行判断
浓H2SO4
强还原性
强氧化性
既有氧化性又有还原性
SO2
S
H2S
+6
-2
0
+4
【小试牛刀】在:①S2-;②Fe3+;③Fe2+;④Mg2+;⑤S;⑥Cl-; ⑦H+;⑧SO2;⑨Fe;⑩HCl 粒子中,
只有氧化性的是 ,
只有还原性的是 ,
既有氧化性又有还原性的是 。
②④⑦
①⑥⑨
③⑤⑧⑩
3、根据物质活动性顺序进行判断
(1)根据金属活动性顺序判断
(2)根据非金属活动性顺序判断
2 2 2 2
4、根据反应条件来判断
【小试牛刀】(双选)下列变化中,需加入氧化剂才能实现的是( )
【再来一刀】(双选)下列变化中,需加入还原剂才能实现的是( )
A、Ag+ Ag B、CuO Cu
C、FeO Fe2O3 D、NO O2
A、HCl H2 B、CO CO2
C、SO2 SO3 D、Fe3+ Fe2+
BC
AB
三、氧化还原反应的规律
1.守恒规律
化合价升高总数=化合价降低总数
失电子总数=得电子总数。
【例题3】24 mL 0.05 mol·L-1的Na2SO3溶液恰好与20 mL 0.02 mol·L-1的K2Cr2O7溶液完全反应。已知Na2SO3被 K2Cr2O7 氧化为Na2SO4,则元素Cr在还原产物中的化合价为( )
A.+2 B.+3 C.+4 D.+5
B
2.价态规律
(1)元素处于最高价态,只有氧化性(只针对该元素),如Fe3+等;
(2) 元素处于最低价态,只有还原性(只针对该元素),如S2-等;
(3) 元素处于中间价态,既有氧化性又有还原性,如Fe2+等。
3.先后规律
氧化还原反应中,强者优先。即氧化性(或还原性)强,优先发生反应。
4.不交叉规律
即同种元素不同价态之间,相邻价态不反应,发生反应时化合价向中间靠拢,但不交叉。
【例题4】在KClO3+6HCl(浓)=KCl+3Cl2↑+3H2O的反应中,被氧化的氯与被还原的氯的原子个数比为( )
A.1∶6 B.6∶1 C.1∶5 D.5∶1
D
1、在3NO2+H2O=2HNO3+NO↑反应中,氧化剂与还原剂的分子数之比为( )
A. 2∶1 B. 1∶2 C. 1∶1 D. 1∶3
2、在Cu+4HNO3(浓)=Cu(NO3)2+2NO2+2H2O反应中,若有32g铜被氧化,则被还原的HNO3的质量是( )
A.63g B.32g C.94.5g D.126g
3、在2H2S+SO2=3S+2H2O的反应中,还原产物和氧化产物的质量比是( )
A.1∶1 B.2∶1 C.1∶2 D.2∶3
A
C
B
作还原剂
4、下列四个反应中有一个反应中的H2O表现出来的性质与其他三组有本质区别,它是 。
(1)3NO2+H2O===2HNO3+NO
(2)Cl2+H2O===HClO+HCl
(3)2F2+2H2O===4HF+O2
(4)2Na2O2+2H2O===4NaOH+O2↑
+4 +5 +2
0 -2 -1 0
-1 -2 0
(3)
歧化反应
快速正确的标出变价元素的化合价是正确分析氧化还原反应的前提。
既不是氧化剂又不是还原剂
既不是氧化剂又是不是还原剂
既不是氧化剂又不是还原剂
0 +1 -1
(2)砒霜在上述反应中显示出来的性质是____(填字母)。
A.氧化性 B.还原性 C.酸性 D.碱性
(3)该反应的氧化产物是________,还原产物是_______。
5、已知砒霜(As2O3)与锌可以发生如下反应:
As2O3+6Zn+6H2SO4===2AsH3+6ZnSO4+3H2O
(1)请用“双线桥法”标出电子转移的方向和数目:
__________________________________________。
+3H2O
A
ZnSO4
AsH3
谢谢
21世纪教育网(www.21cnjy.com)
中小学教育资源网站
兼职招聘:
https://www.21cnjy.com/recruitment/home/admin
