2022-2023学年人教版2019高中化学必修1 第二章 海水中的重要元素—钠和氯 知识体系构建与核心素养提升(学案 word版含解析)
文档属性
| 名称 | 2022-2023学年人教版2019高中化学必修1 第二章 海水中的重要元素—钠和氯 知识体系构建与核心素养提升(学案 word版含解析) |
|
|
| 格式 | docx | ||
| 文件大小 | 933.2KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-07-14 16:54:02 | ||
图片预览


文档简介
本章知识体系构建与核心素养提升
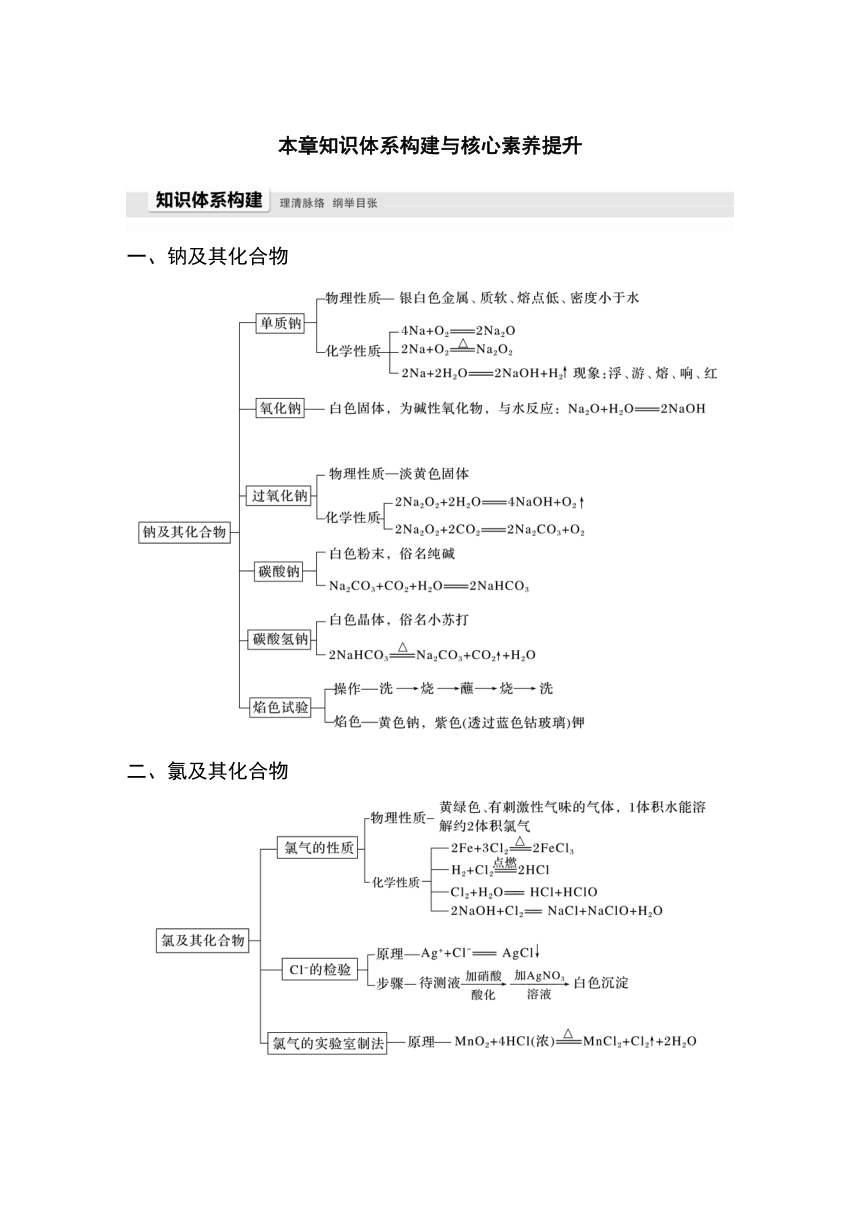
一、钠及其化合物
二、氯及其化合物
三、物质的量
通过本章的学习,能结合真实情境中的应用实例和实验探究归纳钠及其重要化合物的性质,并能从原子结构、化合价、物质分类,物质的转化角度解释钠、氧化钠和过氧化钠、碳酸钠和碳酸氢钠性质差别的本质原因,形成结构决定性质的理念。
能结合真实情境中的应用实例和实验探究氯及其重要化合物的主要性质,认识这些物质在生产中的应用和对生态环境的影响。能从微观和化合价角度分析氯气及其重要化合物具有氧化性的原因,能用化学方程式描述氯及其重要化合物的转化及制备方法。
以物质的量为核心,把宏观物质(气、固、溶液)的相关量经过计算转换成物质的量,然后通过分析物质微观的构成,计算出某种微粒的数目。即通过物质的量这一物理量,借助阿伏加德罗常数、摩尔质量、气体摩尔体积和物质的量浓度,可以把物质的宏观量与构成物质的微观粒子的数量联系起来。
学会一定物质的量浓度溶液配制的基本技能,能针对实验中的操作进行分析讨论形成误差的原因,并能分享自己的探究结果。
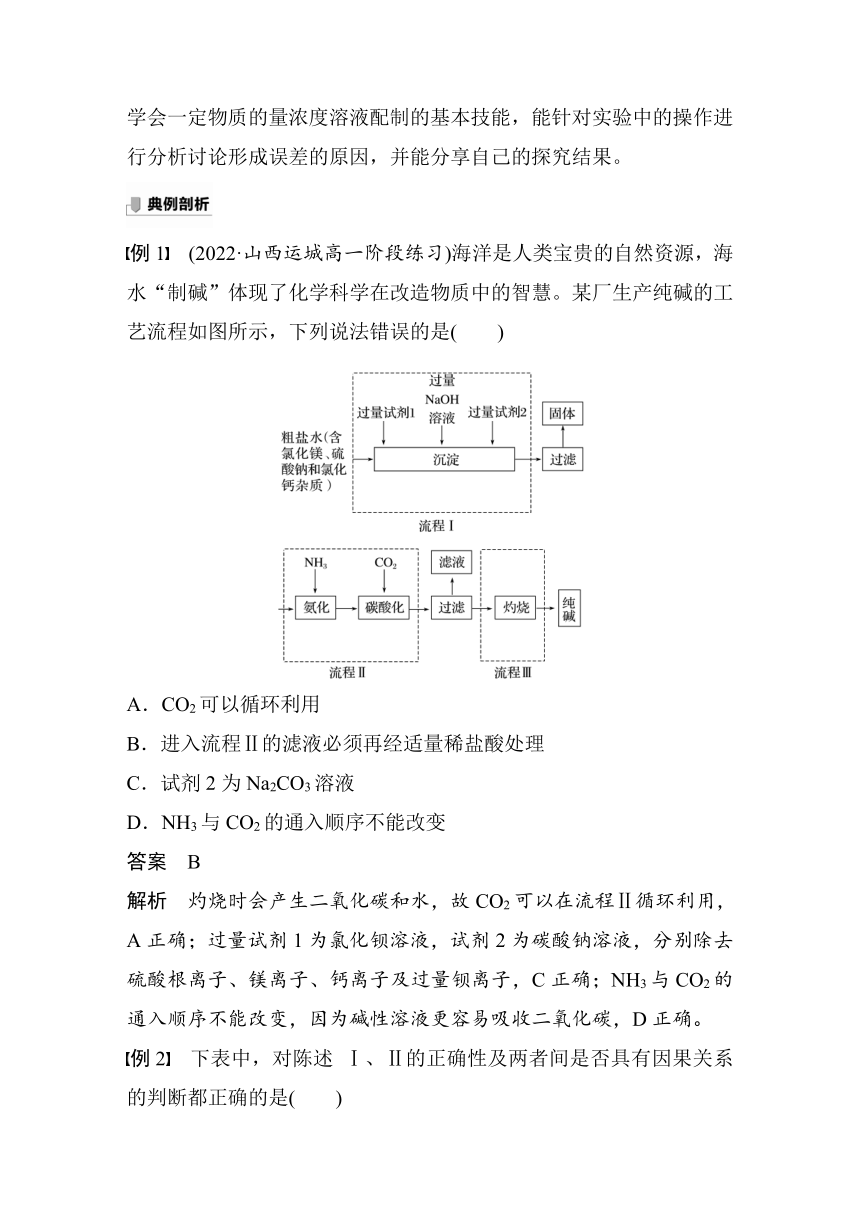
例1 (2022·山西运城高一阶段练习)海洋是人类宝贵的自然资源,海水“制碱”体现了化学科学在改造物质中的智慧。某厂生产纯碱的工艺流程如图所示,下列说法错误的是( )
A.CO2可以循环利用
B.进入流程Ⅱ的滤液必须再经适量稀盐酸处理
C.试剂2为Na2CO3溶液
D.NH3与CO2的通入顺序不能改变
答案 B
解析 灼烧时会产生二氧化碳和水,故CO2可以在流程Ⅱ循环利用,A正确;过量试剂1为氯化钡溶液,试剂2为碳酸钠溶液,分别除去硫酸根离子、镁离子、钙离子及过量钡离子,C正确;NH3与CO2的通入顺序不能改变,因为碱性溶液更容易吸收二氧化碳,D正确。
例2 下表中,对陈述 Ⅰ、Ⅱ的正确性及两者间是否具有因果关系的判断都正确的是( )
选项 陈述 Ⅰ 陈述 Ⅱ 判断
A 碳酸钠溶液可用于治疗胃酸过多 碳酸钠可与硫酸反应 Ⅰ对,Ⅱ对,有
B 将Na2O2加入酚酞溶液中,酚酞变红色 过氧化钠与水反应生成氢氧化钠 Ⅰ对,Ⅱ错,无
C 金属钠保存在煤油中以隔绝空气 常温下,金属钠在空气中会生成过氧化钠 Ⅰ对,Ⅱ对,有
D 过氧化钠可用作航天员的供氧剂 过氧化钠能和CO2、H2O反应生成氧气 Ⅰ对,Ⅱ对,有
答案 D
解析 碳酸钠溶液具有较强的碱性,不可用于治疗胃酸过多,A项错误;Na2O2与水反应生成NaOH,酚酞变红,但又迅速被Na2O2氧化漂白而褪色,B项错误;常温下钠在空气中生成的氧化物为氧化钠,C项错误;过氧化钠可以消耗CO2、H2O,产生O2,因此可用作航天员的供氧剂,D项正确。
例3 (2021·浙江宁波高一期末)设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.常温下NA个Cl2分子所占有的体积为22.4 L
B.1 mol O2做氧化剂时转移电子数一定为4NA
C.23 g Na与O2充分反应生成Na2O和Na2O2的混合物,消耗O2分子数在0.25NA和0.5NA之间
D.在Na2O2与CO2的反应中,固体质量每增重28 g,转移电子数2NA
答案 C
解析 氧气在参加反应时一般做氧化剂,但是还原产物不一定是-2价的氧,有可能是-1价的氧,比如氧气与钠反应生成过氧化钠时,1 mol O2参加反应转移电子数为2NA,则1 mol O2做氧化剂时转移电子数不一定为4NA,B项错误;23 g Na物质的量为1 mol,1 mol Na完全反应生成Na2O时,消耗氧气0.25 mol,若完全生成Na2O2则消耗氧气0.5 mol,生成混合物则消耗氧气在0.25 mol与0.5 mol之间,则消耗O2的分子数在0.25NA和0.5NA之间,C项正确;在Na2O2与CO2的反应2Na2O2+2CO2===2Na2CO3+O2中,固体增加的质量相当于CO的质量,根据化学方程式可得关系式:2CO2~O2~2CO~2e-,则固体质量每增重28 g,即
1 mol CO,转移电子1 mol,转移电子数为NA,D项错误。
例4 如图为某市售盐酸试剂瓶标签上的部分数据。
(1)该盐酸的物质的量浓度为________。
(2)下列实验操作会导致实验结果偏低的是______(填字母)。
①配制100 g 10%的CuSO4溶液,称取10 g硫酸铜晶体溶于90 g水中
②测定碳酸钠晶体中结晶水的百分含量时,所用的晶体已经受潮
③配制一定物质的量浓度的溶液时,药品与砝码放反了,游码读数为0.2 g
A.只有① B.只有②
C.②③ D.①③
答案 (1)11.8 mol·L-1 (2)D
解析 (1)该盐酸的物质的量浓度为c== mol·L-1=11.8 mol·L-1。
(2)①硫酸铜晶体为CuSO4·5H2O,则称取10 g硫酸铜晶体溶于90 g水中形成硫酸铜溶液,硫酸铜的实际质量小于10 g,所配硫酸铜溶液的质量分数小于10%,实验结果偏低,正确;
②测定碳酸钠晶体中结晶水的百分含量时,所用的晶体已经受潮,称取的碳酸钠晶体中水的质量增大,实验测量结果偏高,错误;③配制一定物质的量浓度的溶液时,药品与砝码放反了,游码读数为0.2 g,实际称取的药品质量减小,所配溶液的浓度偏低,正确。
一、钠及其化合物
二、氯及其化合物
三、物质的量
通过本章的学习,能结合真实情境中的应用实例和实验探究归纳钠及其重要化合物的性质,并能从原子结构、化合价、物质分类,物质的转化角度解释钠、氧化钠和过氧化钠、碳酸钠和碳酸氢钠性质差别的本质原因,形成结构决定性质的理念。
能结合真实情境中的应用实例和实验探究氯及其重要化合物的主要性质,认识这些物质在生产中的应用和对生态环境的影响。能从微观和化合价角度分析氯气及其重要化合物具有氧化性的原因,能用化学方程式描述氯及其重要化合物的转化及制备方法。
以物质的量为核心,把宏观物质(气、固、溶液)的相关量经过计算转换成物质的量,然后通过分析物质微观的构成,计算出某种微粒的数目。即通过物质的量这一物理量,借助阿伏加德罗常数、摩尔质量、气体摩尔体积和物质的量浓度,可以把物质的宏观量与构成物质的微观粒子的数量联系起来。
学会一定物质的量浓度溶液配制的基本技能,能针对实验中的操作进行分析讨论形成误差的原因,并能分享自己的探究结果。
例1 (2022·山西运城高一阶段练习)海洋是人类宝贵的自然资源,海水“制碱”体现了化学科学在改造物质中的智慧。某厂生产纯碱的工艺流程如图所示,下列说法错误的是( )
A.CO2可以循环利用
B.进入流程Ⅱ的滤液必须再经适量稀盐酸处理
C.试剂2为Na2CO3溶液
D.NH3与CO2的通入顺序不能改变
答案 B
解析 灼烧时会产生二氧化碳和水,故CO2可以在流程Ⅱ循环利用,A正确;过量试剂1为氯化钡溶液,试剂2为碳酸钠溶液,分别除去硫酸根离子、镁离子、钙离子及过量钡离子,C正确;NH3与CO2的通入顺序不能改变,因为碱性溶液更容易吸收二氧化碳,D正确。
例2 下表中,对陈述 Ⅰ、Ⅱ的正确性及两者间是否具有因果关系的判断都正确的是( )
选项 陈述 Ⅰ 陈述 Ⅱ 判断
A 碳酸钠溶液可用于治疗胃酸过多 碳酸钠可与硫酸反应 Ⅰ对,Ⅱ对,有
B 将Na2O2加入酚酞溶液中,酚酞变红色 过氧化钠与水反应生成氢氧化钠 Ⅰ对,Ⅱ错,无
C 金属钠保存在煤油中以隔绝空气 常温下,金属钠在空气中会生成过氧化钠 Ⅰ对,Ⅱ对,有
D 过氧化钠可用作航天员的供氧剂 过氧化钠能和CO2、H2O反应生成氧气 Ⅰ对,Ⅱ对,有
答案 D
解析 碳酸钠溶液具有较强的碱性,不可用于治疗胃酸过多,A项错误;Na2O2与水反应生成NaOH,酚酞变红,但又迅速被Na2O2氧化漂白而褪色,B项错误;常温下钠在空气中生成的氧化物为氧化钠,C项错误;过氧化钠可以消耗CO2、H2O,产生O2,因此可用作航天员的供氧剂,D项正确。
例3 (2021·浙江宁波高一期末)设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.常温下NA个Cl2分子所占有的体积为22.4 L
B.1 mol O2做氧化剂时转移电子数一定为4NA
C.23 g Na与O2充分反应生成Na2O和Na2O2的混合物,消耗O2分子数在0.25NA和0.5NA之间
D.在Na2O2与CO2的反应中,固体质量每增重28 g,转移电子数2NA
答案 C
解析 氧气在参加反应时一般做氧化剂,但是还原产物不一定是-2价的氧,有可能是-1价的氧,比如氧气与钠反应生成过氧化钠时,1 mol O2参加反应转移电子数为2NA,则1 mol O2做氧化剂时转移电子数不一定为4NA,B项错误;23 g Na物质的量为1 mol,1 mol Na完全反应生成Na2O时,消耗氧气0.25 mol,若完全生成Na2O2则消耗氧气0.5 mol,生成混合物则消耗氧气在0.25 mol与0.5 mol之间,则消耗O2的分子数在0.25NA和0.5NA之间,C项正确;在Na2O2与CO2的反应2Na2O2+2CO2===2Na2CO3+O2中,固体增加的质量相当于CO的质量,根据化学方程式可得关系式:2CO2~O2~2CO~2e-,则固体质量每增重28 g,即
1 mol CO,转移电子1 mol,转移电子数为NA,D项错误。
例4 如图为某市售盐酸试剂瓶标签上的部分数据。
(1)该盐酸的物质的量浓度为________。
(2)下列实验操作会导致实验结果偏低的是______(填字母)。
①配制100 g 10%的CuSO4溶液,称取10 g硫酸铜晶体溶于90 g水中
②测定碳酸钠晶体中结晶水的百分含量时,所用的晶体已经受潮
③配制一定物质的量浓度的溶液时,药品与砝码放反了,游码读数为0.2 g
A.只有① B.只有②
C.②③ D.①③
答案 (1)11.8 mol·L-1 (2)D
解析 (1)该盐酸的物质的量浓度为c== mol·L-1=11.8 mol·L-1。
(2)①硫酸铜晶体为CuSO4·5H2O,则称取10 g硫酸铜晶体溶于90 g水中形成硫酸铜溶液,硫酸铜的实际质量小于10 g,所配硫酸铜溶液的质量分数小于10%,实验结果偏低,正确;
②测定碳酸钠晶体中结晶水的百分含量时,所用的晶体已经受潮,称取的碳酸钠晶体中水的质量增大,实验测量结果偏高,错误;③配制一定物质的量浓度的溶液时,药品与砝码放反了,游码读数为0.2 g,实际称取的药品质量减小,所配溶液的浓度偏低,正确。
