2022-2023学年人教版2019高中化学必修1 第三章 第一节 第1课时 铁的单质、氧化物和氢氧化物(学案+课时对点练 word版含解析)
文档属性
| 名称 | 2022-2023学年人教版2019高中化学必修1 第三章 第一节 第1课时 铁的单质、氧化物和氢氧化物(学案+课时对点练 word版含解析) |

|
|
| 格式 | docx | ||
| 文件大小 | 2.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-07-14 18:15:53 | ||
图片预览




文档简介
第一节 铁及其化合物
第1课时 铁的单质、氧化物和氢氧化物
[核心素养发展目标] 1.结合生活中的铁制品应用,了解单质铁、铁的氧化物的性质及用途,培养化学服务社会的责任意识。2.通过实验探究,认识铁单质与水蒸气反应的条件,对比钠与水的反应,加深对微观原子结构决定物质宏观性质的认识,培养宏观辨识与微观探析的能力。3.通过实验掌握Fe(OH)2、Fe(OH)3的制备原理及化学性质。
一、铁的单质
1.铁的存在和冶炼
(1)存在
铁在自然界中可以以单质形态(如陨铁)存在,但主要以+2价和+3价化合物的形态存在于矿石中,在地壳中的含量居第四位,仅次于氧、硅和铝。
(2)冶炼
工业炼铁的原理是利用还原的方法把铁从铁矿石中提炼出来,化学方程式:3CO+Fe2O32Fe+3CO2(以Fe2O3为例)。
2.铁的物理性质
铁有延展性、导热性。铁能导电,但其导电性不如铜和铝,铁还能被磁体吸引,其熔、沸点较高。
3.铁的化学性质
根据学过的铁与一些物质的反应写出有关的化学方程式,是离子反应的写出离子方程式。
(1)与某些非金属单质、酸和盐溶液反应
①Fe与非金属单质反应
②Fe与非氧化性酸反应(稀H2SO4)
Fe+2H+===Fe2++H2↑。
③Fe与盐溶液反应(CuSO4)
Fe+Cu2+===Cu+Fe2+。
小结
(2)实验探究铁粉与水蒸气的反应
实验装置
操作现象 用火柴点燃肥皂液,听到爆鸣声,证明生成了H2
实验结论 在高温下,铁能与水蒸气反应,化学方程式为3Fe+4H2O(g)Fe3O4+4H2
提示 湿棉花的作用是受热时提供反应所需的水蒸气。
(1)由于铁性质比较活泼,所以自然界中没有游离态的铁单质( )
(2)氯化亚铁既可由铁与盐酸反应制取也可由铁与氯气化合制取( )
(3)由于钠与水反应生成NaOH和H2,所以铁与水蒸气反应生成Fe(OH)3和H2( )
(4)分离铁粉与铜粉的混合物时,只能用化学方法( )
(5)1 mol Fe与水蒸气高温下反应转移 mol电子( )
答案 (1)× (2)× (3)× (4)× (5)√
1.下列有关铁及其化合物的说法正确的是( )
A.铁的化学性质比较活泼,所以铁在自然界中全部以化合态存在
B.铁在纯氧中燃烧或在氯气中燃烧所得产物中铁元素的化合价均为+3
C.铁在氯气中燃烧,如果铁过量会生成FeCl2
D.工业上用CO在高温条件下还原含Fe2O3的铁矿石炼铁
答案 D
解析 自然界中有少量铁以单质形式存在(如陨铁),A错;铁在纯氧中燃烧产物是Fe3O4,其中铁元素的化合价有+2和+3两种价态,B错;铁在氯气中燃烧,无论铁是否过量都生成FeCl3,C错。
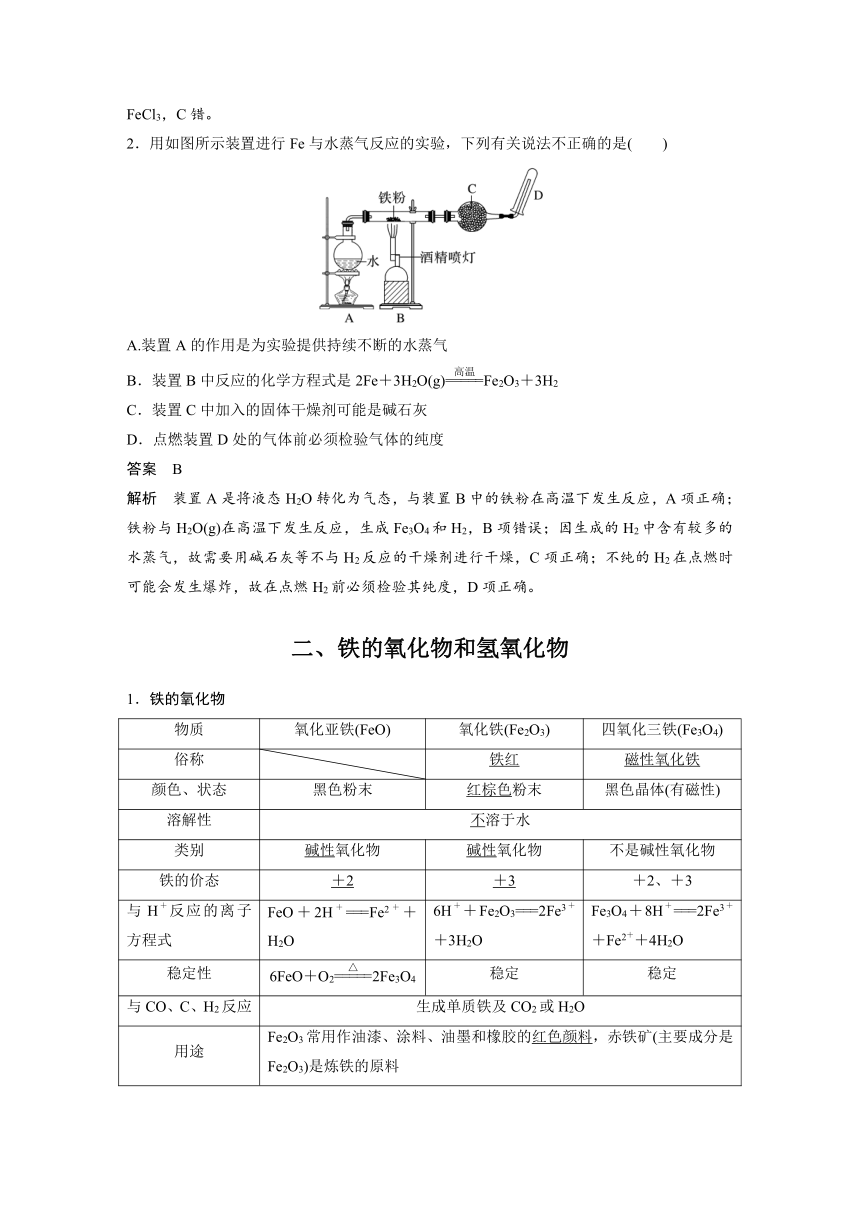
2.用如图所示装置进行Fe与水蒸气反应的实验,下列有关说法不正确的是( )
A.装置A的作用是为实验提供持续不断的水蒸气
B.装置B中反应的化学方程式是2Fe+3H2O(g)Fe2O3+3H2
C.装置C中加入的固体干燥剂可能是碱石灰
D.点燃装置D处的气体前必须检验气体的纯度
答案 B
解析 装置A是将液态H2O转化为气态,与装置B中的铁粉在高温下发生反应,A项正确;铁粉与H2O(g)在高温下发生反应,生成Fe3O4和H2,B项错误;因生成的H2中含有较多的水蒸气,故需要用碱石灰等不与H2反应的干燥剂进行干燥,C项正确;不纯的H2在点燃时可能会发生爆炸,故在点燃H2前必须检验其纯度,D项正确。
二、铁的氧化物和氢氧化物
1.铁的氧化物
物质 氧化亚铁(FeO) 氧化铁(Fe2O3) 四氧化三铁(Fe3O4)
俗称 铁红 磁性氧化铁
颜色、状态 黑色粉末 红棕色粉末 黑色晶体(有磁性)
溶解性 不溶于水
类别 碱性氧化物 碱性氧化物 不是碱性氧化物
铁的价态 +2 +3 +2、+3
与H+反应的离子方程式 FeO+2H+===Fe2++H2O 6H++Fe2O3===2Fe3++3H2O Fe3O4+8H+===2Fe3++Fe2++4H2O
稳定性 6FeO+O22Fe3O4 稳定 稳定
与CO、C、H2反应 生成单质铁及CO2或H2O
用途 Fe2O3常用作油漆、涂料、油墨和橡胶的红色颜料,赤铁矿(主要成分是Fe2O3)是炼铁的原料
2.铁的氢氧化物
(1)铁的氢氧化物的制备
反应原理:Fe(OH)3与Fe(OH)2分别可用相应的可溶性盐与碱溶液反应制得。
Fe(OH)2 Fe(OH)3
操作
现象 产生白色絮状沉淀,迅速变为灰绿色,最终变为红褐色沉淀 生成红褐色沉淀
离子方程式 Fe2++2OH-===Fe(OH)2↓; 4Fe(OH)2+O2+2H2O===4Fe(OH)3 Fe3++3OH-===Fe(OH)3↓
实验结论 Fe(OH)2很不稳定,极易转化为Fe(OH)3
(2)Fe(OH)2和Fe(OH)3的比较
化学式 Fe(OH)2 Fe(OH)3
颜色状态 白色固体 红褐色固体
溶解性 不溶于水 不溶于水
与非氧化性强酸反应的离子方程式 Fe(OH)2+2H+=== Fe2++2H2O Fe(OH)3+3H+===Fe3++3H2O
稳定性 Fe(OH)2FeO+H2O(隔绝空气) 2Fe(OH)3Fe2O3+3H2O
(1)磁铁矿的主要成分是Fe3O4( )
(2)FeO在空气中加热生成Fe2O3( )
(3)Fe3O4中铁的化合价有+2价和+3价,是一种混合物( )
(4)Fe(OH)3不能利用化合反应生成( )
(5)由于Fe(OH)2易被氧化,所以在制备时要隔绝空气( )
答案 (1)√ (2)× (3)× (4)× (5)√
1.Fe3O4中Fe元素有+2、+3两种价态,可表示成FeO·Fe2O3形式,请类比写出Fe4O5的表示形式。
提示 2FeO·Fe2O3
2.铁屑溶于过量稀硫酸,过滤后向滤液中加入过量氢氧化钠,有白色沉淀生成,过滤,在空气中加热沉淀至质量不再发生变化为止,得到红棕色残渣,上述白色沉淀和残渣分别是______、________。
提示 Fe(OH)2 Fe2O3
1.下列说法正确的是( )
A.我国在战国中期就开始使用铁制品
B.自然界中的铁元素只存在于化合物中
C.铁能与所有金属的盐溶液反应生成亚铁盐和金属
D.高炉炼铁是用还原剂将铁从它的化合物中还原出来
答案 D
解析 我国目前发现最早的人工冶铁制品是春秋初年秦国的铜柄铁剑,A项错误;自然界中的陨铁中的Fe以单质形态存在,B项错误;Fe只能将金属活动性比它弱的金属从其盐溶液中置换出来,C项错误;高炉炼铁是用CO等还原剂把Fe从铁矿石中还原出来,D项正确。
2.下列有关铁的化合物的说法不正确的是( )
A.Fe(OH)2不稳定,具有较强的氧化性
B.FeO、Fe2O3均为碱性氧化物,均可与盐酸反应
C.Fe(OH)3可通过化合反应得到,Fe(OH)2则不能
D.Fe3O4为磁性氧化铁,其中铁的化合价为+2价和+3价
答案 A
解析 Fe(OH)2中的Fe2+具有还原性,可被空气中的O2氧化为Fe(OH)3,A项错误;FeO、Fe2O3均为碱性氧化物,故具有碱性氧化物的通性,都能与盐酸反应,B项正确;Fe(OH)2只能通过复分解反应得到,Fe(OH)3可由Fe(OH)2与O2、H2O发生化合反应得到,C项正确;Fe3O4俗称磁性氧化铁,其组成可表示为FeO·Fe2O3,Fe元素的化合价为+2、+3价,D项正确。
3.下列关于铁与水蒸气反应的说法不正确的是( )
A.反应中有氢气产生
B.此反应需在高温条件下才能发生
C.生成的铁的化合物中铁全部呈+3价
D.该反应中水做氧化剂
答案 C
解析 Fe与水蒸气反应生成四氧化三铁和氢气,A正确;此反应需要在高温条件下才能发生,B正确;四氧化三铁中铁的价态为+2价和+3价,C错误;水中氢元素化合价降低,在该反应中水做氧化剂,D正确。
4.化合物A、B组成元素相同,且B为白色。C是一种与B含有相同价态该金属元素的硫酸盐,向C中加入适量的NaOH溶液,可观察到生成的沉淀迅速变为灰绿色,最后变为红褐色沉淀A,加热A可得红棕色粉末D。回答下列问题:
(1)写出各物质的化学式:
A________、B________、C________、D________。
(2)写出B转化为A的化学方程式:_______________________________________________。
写出A受热分解的化学方程式:__________________________________________________。
答案 (1)Fe(OH)3 Fe(OH)2 FeSO4 Fe2O3
(2)4Fe(OH)2+O2+2H2O===4Fe(OH)3
2Fe(OH)3Fe2O3+3H2O
解析 解答本题的关键是抓住C与NaOH溶液反应的特征现象,确定A为Fe(OH)3,C为FeSO4,B为Fe(OH)2,D为Fe2O3。
题组一 铁的单质
1.市场上销售的食品包装有多种方式,其中一种为真空包装,如香肠、盐水鸭、月饼等食品,抽出包装袋内空气并放入一小包铁粉,那么其中铁粉主要表现的性质是( )
A.氧化性 B.还原性
C.碱性 D.酸性
答案 B
解析 包装袋内放入的铁粉与空气中的氧气反应,防止食品被氧化,起到还原剂的作用。
2.下列关于铁的叙述错误的是( )
A.纯净的铁是光亮的银白色金属
B.铁能被磁体吸引
C.铁是地壳中含量最多的金属元素
D.铁具有延展性和导热性,可制作炊具
答案 C
解析 铁元素在地壳中的含量是金属元素的第二位。
3.铁片投入下列溶液,溶液质量减轻,但无气体产生的是( )
A.盐酸 B.CuSO4溶液
C.稀硫酸 D.Na2SO4溶液
答案 B
解析 铁片投入盐酸、稀硫酸中,均发生置换反应生成H2,A、C均错误;铁片投入Na2SO4溶液中,不发生反应,D错误;铁片投入CuSO4溶液中发生置换反应:Fe+CuSO4===FeSO4+Cu,消耗56 g Fe的同时生成64 g Cu,溶液质量减轻,且无气体生成,B正确。
4.(2022·桂林高一检测)下列各项物质间的转化不能通过反应一步完成的是( )
A.Fe→Fe3O4 B.Fe→FeCl3
C.Fe→FeCl2 D.Fe→Fe(OH)3
答案 D
解析 Fe与O2点燃可得到Fe3O4,能一步反应完成,A不符合题意;Fe与Cl2点燃可得到FeCl3,能一步反应完成,B不符合题意;Fe与盐酸反应可得到FeCl2,能一步反应完成,C不符合题意;Fe不能一步反应生成Fe(OH)3,D符合题意。
5.还原铁粉与水蒸气反应的装置如图所示,下列有关该实验的说法正确的是( )
A.反应生成FeO
B.湿棉花的主要作用是冷却试管,防止炸裂
C.肥皂液的主要作用是检验生成的H2
D.铁粉与水蒸气反应后,可立即用磁体将剩余铁粉分离出来
答案 C
解析 铁与水蒸气反应生成Fe3O4和H2,A错;湿棉花的作用是提供水蒸气,B错;使用肥皂液的作用是检验反应中生成的H2,反应一段时间后,有肥皂泡吹起时,用点燃的火柴靠近肥皂泡,当听到爆鸣声时,说明铁与水蒸气反应生成了H2,C对;铁粉与水蒸气反应生成的四氧化三铁也可以被磁体吸引,不能分离出铁,D错。
题组二 铁的氧化物
6.我国科学家参与研制的阿尔法磁谱仪已随美国“发现号”航天飞船升入太空,开始了探索宇宙中是否存在“反物质”的研究工作。根据你所学的知识推测用于制造阿尔法磁谱仪的核心部件的材料是( )
A.FeO B.Fe2O3
C.Fe3O4 D.Fe(OH)3
答案 C
解析 根据磁谱仪所用物质具有磁性确定用于制造阿尔法磁谱仪的核心部件的材料为Fe3O4。
7.下列有关铁矿石与铁的氧化物的说法正确的是( )
A.赤铁矿的主要成分是Fe3O4,磁铁矿的主要成分是Fe2O3,FeO俗称铁红
B.铁矿石的主要成分与铁锈的主要成分相同
C.铁的氧化物都不溶于水,也不与水反应
D.铁的氧化物能与酸反应生成盐和水,因此Fe3O4、Fe2O3、FeO都是碱性氧化物
答案 C
解析 赤铁矿的主要成分是Fe2O3,Fe2O3俗称铁红,磁铁矿的主要成分是Fe3O4,A项错误;铁矿石的成分与矿石的种类有关,铁锈的主要成分是Fe2O3,B项错误;Fe2O3、FeO是碱性氧化物,Fe3O4不是碱性氧化物,D项错误。
题组三 铁的氢氧化物
8.实验室制取氢氧化铁的一组试剂是( )
A.氯化铁溶液和烧碱溶液
B.氧化铁和烧碱溶液
C.氧化铁和水
D.铁和水蒸气
答案 A
解析 实验室常用可溶性铁盐溶液(如氯化铁溶液)与碱溶液(如烧碱溶液)反应来制取氢氧化铁沉淀。
9.(2022·上海高一检测)下列有关铁的氢氧化物的说法中,错误的是( )
A.Fe(OH)2是一种黑色固体,不稳定,在空气中易被氧化为红褐色固体
B.Fe(OH)2具有还原性,在空气中易被氧化为Fe(OH)3
C.Fe(OH)2、Fe(OH)3都具有不稳定性,受热能分解
D.Fe(OH)3胶体呈红褐色、透明,能产生丁达尔效应
答案 A
解析 Fe(OH)2是一种白色固体,不稳定,具有还原性,在空气中易被氧化为红褐色固体Fe(OH)3:4Fe(OH)2+O2+2H2O===4Fe(OH)3,故A错误、B正确;Fe(OH)2、Fe(OH)3都具有不稳定性,受热能分解为氧化物和水,故C正确。
10.类比是研究物质的常用方法之一,可预测许多物质的性质。下列类比推测的说法中正确的是( )
A.Fe和O2能直接化合生成Fe3O4,推测Cu和O2可直接化合生成Cu3O4
B.Na和H2O反应生成NaOH和H2,推测Fe和H2O反应生成Fe(OH)3和H2
C.Fe能与CuSO4溶液发生反应,推测Fe能与AgNO3溶液发生反应
D.Na在常温下能与H2O反应,推测Fe在常温下也能与H2O反应
答案 C
解析 Fe和O2反应能生成Fe3O4,Cu和O2反应生成CuO,A项错误;Fe和H2O(g)反应生成Fe3O4和H2,B项错误;Fe与H2O(g)在高温下才能反应,D项错误。
11.(2021·海南中学高一质检)等量的铁分别与足量的盐酸、水蒸气在一定条件下充分反应,则在相同的条件下,产生氢气的体积比是( )
A.1∶1 B.3∶4
C.2∶3 D.4∶3
答案 B
解析 根据反应的化学方程式:Fe+2HCl===FeCl2+H2↑、3Fe+4H2O(g)Fe3O4+4H2可知,1 mol Fe与盐酸反应生成1 mol H2,1 mol Fe与水蒸气反应生成 mol H2,故在相同条件下,产生H2的体积比是3∶4。
12.(2022·内蒙古赤峰二中高一月考)将磁性氧化铁放入稀HNO3中可发生如下反应:
3Fe3O4+28HNO3===9Fe(NO3)x+NO↑+14H2O,下列判断正确的是( )
A.Fe(NO3)x中的x为2
B.反应中每生成0.2 mol还原产物,就有0.6 mol电子转移
C.HNO3在反应中全部被还原
D.磁性氧化铁中的铁元素全部被氧化
答案 B
解析 由N原子守恒可知,28=9x+1,解得x=3,故A项错误;N元素的化合价由+5价降低为+2价,则反应中每生成0.2 mol还原产物,就有0.2 mol×(5-2)=0.6 mol电子转移,故B项正确;稀HNO3在反应中生成硝酸盐和NO,则HNO3在反应中部分被还原,故C项错误;磁性氧化铁中的Fe元素有+2价和+3价,则铁元素部分被氧化,故D项错误。
13.(2022·河南信阳高一月考)某实验小组测定铁的氧化物FexOy的化学式,已知该氧化物中铁元素只有+2价和+3价两种价态,实验步骤如图,下列说法正确的是( )
A.步骤①和步骤②都发生了氧化还原反应
B.溶液a中阳离子只有Fe3+和Fe2+
C.溶液b中n(Fe3+)∶n(Cl-)=1∶3
D.通过计算可得该氧化物的化学式为Fe4O5
答案 D
解析 步骤①中铁的氧化物和盐酸反应生成Fe2+和Fe3+,无化合价变化,没有发生氧化还原反应,A错误;由于盐酸是过量的,则溶液a中阳离子有Fe3+、Fe2+和H+,B错误;由于步骤①中盐酸是过量的,则n(Cl-)未知,C错误;溶液a中通入0.1 mol Cl2,发生反应:2Fe2++Cl2===2Fe3++2Cl-,则a中含有0.2 mol Fe2+,因此氧化物FexOy中相当于FeO的质量为0.2 mol×72 g·mol-1=14.4 g,Fe2O3的质量为30.4 g-14.4 g=16.0 g,则n(Fe2O3)=0.1 mol,n(FeO)=0.2 mol。故该氧化物可以看作2FeO·Fe2O3,则化学式为Fe4O5,D正确。
14.金属单质A可发生以下反应。试推断:
(1)A、B、C、D、E分别是(写化学式,B写主要成分):
A____________、B____________、C_____________、D____________、E__________。
(2)写出反应③和⑤的离子方程式:
③________________________________________________________________________;
⑤________________________________________________________________________。
答案 (1)Fe Fe2O3 Fe3O4 Cu H2
(2)Fe+Cu2+===Fe2++Cu Fe+2H+===Fe2++H2↑
解析 推断题的解题思路:根据物质的物理性质(特别是色、态)和化学性质(相互转化关系、反应条件等),找出具有特征条件的物质,再由相互转化关系逐步推断。例如,本题中结合B、C的颜色及单质A与CuCl2溶液、盐酸反应的性质可推知A为Fe。
15.(2022·广东梅州高一检测)某化学兴趣小组利用如图所示装置进行铁粉与水蒸气反应的实验,并检验产物的性质。请回答下列问题:
(1)A装置的作用是_______________________,D装置的作用是_______________________。
(2)写出B装置中发生反应的化学方程式:_________________________________________。
(3)A、B、E装置中应先点燃________________处的酒精灯,点燃E处酒精灯之前应进行的操作是________________。
(4)铁粉与水蒸气发生了反应,则E处的实验现象是________________。
答案 (1)提供水蒸气 除去未反应的水蒸气(或干燥生成的气体)
(2)3Fe+4H2O(g)Fe3O4+4H2
(3)A 检验氢气纯度
(4)黑色氧化铜粉末变红色
解析 A处提供水蒸气,B处铁与水蒸气发生反应,C处冷凝水蒸气,D处干燥氢气,E处氢气还原氧化铜,注意要检验氢气的纯度防止发生爆炸。(1)铁与水蒸气反应的条件是高温,水的状态是气体,所以A装置的作用是提供水蒸气;E是氢气还原氧化铜的装置,气体进入E装置前要干燥,否则会有危险,硬质玻璃管可能炸裂,因此D装置的作用是除去未反应的水蒸气(或干燥生成的气体)。(2)B装置中铁与水蒸气反应生成氢气和四氧化三铁,反应的化学方程式为3Fe+4H2O(g)Fe3O4+4H2。(3)若先点燃B处酒精灯,铁会与氧气发生反应,所以须先点燃A处酒精灯;氢气是可燃性气体,混有空气加热时会发生爆炸,所以点燃E处酒精灯之前应进行的操作是收集H2并检验其纯度,具体操作:收集一试管气体,将试管口靠近酒精灯火焰,若发出噗的声音,说明气体纯净;若发生尖锐的爆鸣声,说明气体不纯。
(4)氢气还原氧化铜得到铜和水,即H2+CuOCu+H2O,所以E装置中的实验现象是硬质玻璃管中黑色氧化铜粉末变红色。
第1课时 铁的单质、氧化物和氢氧化物
[核心素养发展目标] 1.结合生活中的铁制品应用,了解单质铁、铁的氧化物的性质及用途,培养化学服务社会的责任意识。2.通过实验探究,认识铁单质与水蒸气反应的条件,对比钠与水的反应,加深对微观原子结构决定物质宏观性质的认识,培养宏观辨识与微观探析的能力。3.通过实验掌握Fe(OH)2、Fe(OH)3的制备原理及化学性质。
一、铁的单质
1.铁的存在和冶炼
(1)存在
铁在自然界中可以以单质形态(如陨铁)存在,但主要以+2价和+3价化合物的形态存在于矿石中,在地壳中的含量居第四位,仅次于氧、硅和铝。
(2)冶炼
工业炼铁的原理是利用还原的方法把铁从铁矿石中提炼出来,化学方程式:3CO+Fe2O32Fe+3CO2(以Fe2O3为例)。
2.铁的物理性质
铁有延展性、导热性。铁能导电,但其导电性不如铜和铝,铁还能被磁体吸引,其熔、沸点较高。
3.铁的化学性质
根据学过的铁与一些物质的反应写出有关的化学方程式,是离子反应的写出离子方程式。
(1)与某些非金属单质、酸和盐溶液反应
①Fe与非金属单质反应
②Fe与非氧化性酸反应(稀H2SO4)
Fe+2H+===Fe2++H2↑。
③Fe与盐溶液反应(CuSO4)
Fe+Cu2+===Cu+Fe2+。
小结
(2)实验探究铁粉与水蒸气的反应
实验装置
操作现象 用火柴点燃肥皂液,听到爆鸣声,证明生成了H2
实验结论 在高温下,铁能与水蒸气反应,化学方程式为3Fe+4H2O(g)Fe3O4+4H2
提示 湿棉花的作用是受热时提供反应所需的水蒸气。
(1)由于铁性质比较活泼,所以自然界中没有游离态的铁单质( )
(2)氯化亚铁既可由铁与盐酸反应制取也可由铁与氯气化合制取( )
(3)由于钠与水反应生成NaOH和H2,所以铁与水蒸气反应生成Fe(OH)3和H2( )
(4)分离铁粉与铜粉的混合物时,只能用化学方法( )
(5)1 mol Fe与水蒸气高温下反应转移 mol电子( )
答案 (1)× (2)× (3)× (4)× (5)√
1.下列有关铁及其化合物的说法正确的是( )
A.铁的化学性质比较活泼,所以铁在自然界中全部以化合态存在
B.铁在纯氧中燃烧或在氯气中燃烧所得产物中铁元素的化合价均为+3
C.铁在氯气中燃烧,如果铁过量会生成FeCl2
D.工业上用CO在高温条件下还原含Fe2O3的铁矿石炼铁
答案 D
解析 自然界中有少量铁以单质形式存在(如陨铁),A错;铁在纯氧中燃烧产物是Fe3O4,其中铁元素的化合价有+2和+3两种价态,B错;铁在氯气中燃烧,无论铁是否过量都生成FeCl3,C错。
2.用如图所示装置进行Fe与水蒸气反应的实验,下列有关说法不正确的是( )
A.装置A的作用是为实验提供持续不断的水蒸气
B.装置B中反应的化学方程式是2Fe+3H2O(g)Fe2O3+3H2
C.装置C中加入的固体干燥剂可能是碱石灰
D.点燃装置D处的气体前必须检验气体的纯度
答案 B
解析 装置A是将液态H2O转化为气态,与装置B中的铁粉在高温下发生反应,A项正确;铁粉与H2O(g)在高温下发生反应,生成Fe3O4和H2,B项错误;因生成的H2中含有较多的水蒸气,故需要用碱石灰等不与H2反应的干燥剂进行干燥,C项正确;不纯的H2在点燃时可能会发生爆炸,故在点燃H2前必须检验其纯度,D项正确。
二、铁的氧化物和氢氧化物
1.铁的氧化物
物质 氧化亚铁(FeO) 氧化铁(Fe2O3) 四氧化三铁(Fe3O4)
俗称 铁红 磁性氧化铁
颜色、状态 黑色粉末 红棕色粉末 黑色晶体(有磁性)
溶解性 不溶于水
类别 碱性氧化物 碱性氧化物 不是碱性氧化物
铁的价态 +2 +3 +2、+3
与H+反应的离子方程式 FeO+2H+===Fe2++H2O 6H++Fe2O3===2Fe3++3H2O Fe3O4+8H+===2Fe3++Fe2++4H2O
稳定性 6FeO+O22Fe3O4 稳定 稳定
与CO、C、H2反应 生成单质铁及CO2或H2O
用途 Fe2O3常用作油漆、涂料、油墨和橡胶的红色颜料,赤铁矿(主要成分是Fe2O3)是炼铁的原料
2.铁的氢氧化物
(1)铁的氢氧化物的制备
反应原理:Fe(OH)3与Fe(OH)2分别可用相应的可溶性盐与碱溶液反应制得。
Fe(OH)2 Fe(OH)3
操作
现象 产生白色絮状沉淀,迅速变为灰绿色,最终变为红褐色沉淀 生成红褐色沉淀
离子方程式 Fe2++2OH-===Fe(OH)2↓; 4Fe(OH)2+O2+2H2O===4Fe(OH)3 Fe3++3OH-===Fe(OH)3↓
实验结论 Fe(OH)2很不稳定,极易转化为Fe(OH)3
(2)Fe(OH)2和Fe(OH)3的比较
化学式 Fe(OH)2 Fe(OH)3
颜色状态 白色固体 红褐色固体
溶解性 不溶于水 不溶于水
与非氧化性强酸反应的离子方程式 Fe(OH)2+2H+=== Fe2++2H2O Fe(OH)3+3H+===Fe3++3H2O
稳定性 Fe(OH)2FeO+H2O(隔绝空气) 2Fe(OH)3Fe2O3+3H2O
(1)磁铁矿的主要成分是Fe3O4( )
(2)FeO在空气中加热生成Fe2O3( )
(3)Fe3O4中铁的化合价有+2价和+3价,是一种混合物( )
(4)Fe(OH)3不能利用化合反应生成( )
(5)由于Fe(OH)2易被氧化,所以在制备时要隔绝空气( )
答案 (1)√ (2)× (3)× (4)× (5)√
1.Fe3O4中Fe元素有+2、+3两种价态,可表示成FeO·Fe2O3形式,请类比写出Fe4O5的表示形式。
提示 2FeO·Fe2O3
2.铁屑溶于过量稀硫酸,过滤后向滤液中加入过量氢氧化钠,有白色沉淀生成,过滤,在空气中加热沉淀至质量不再发生变化为止,得到红棕色残渣,上述白色沉淀和残渣分别是______、________。
提示 Fe(OH)2 Fe2O3
1.下列说法正确的是( )
A.我国在战国中期就开始使用铁制品
B.自然界中的铁元素只存在于化合物中
C.铁能与所有金属的盐溶液反应生成亚铁盐和金属
D.高炉炼铁是用还原剂将铁从它的化合物中还原出来
答案 D
解析 我国目前发现最早的人工冶铁制品是春秋初年秦国的铜柄铁剑,A项错误;自然界中的陨铁中的Fe以单质形态存在,B项错误;Fe只能将金属活动性比它弱的金属从其盐溶液中置换出来,C项错误;高炉炼铁是用CO等还原剂把Fe从铁矿石中还原出来,D项正确。
2.下列有关铁的化合物的说法不正确的是( )
A.Fe(OH)2不稳定,具有较强的氧化性
B.FeO、Fe2O3均为碱性氧化物,均可与盐酸反应
C.Fe(OH)3可通过化合反应得到,Fe(OH)2则不能
D.Fe3O4为磁性氧化铁,其中铁的化合价为+2价和+3价
答案 A
解析 Fe(OH)2中的Fe2+具有还原性,可被空气中的O2氧化为Fe(OH)3,A项错误;FeO、Fe2O3均为碱性氧化物,故具有碱性氧化物的通性,都能与盐酸反应,B项正确;Fe(OH)2只能通过复分解反应得到,Fe(OH)3可由Fe(OH)2与O2、H2O发生化合反应得到,C项正确;Fe3O4俗称磁性氧化铁,其组成可表示为FeO·Fe2O3,Fe元素的化合价为+2、+3价,D项正确。
3.下列关于铁与水蒸气反应的说法不正确的是( )
A.反应中有氢气产生
B.此反应需在高温条件下才能发生
C.生成的铁的化合物中铁全部呈+3价
D.该反应中水做氧化剂
答案 C
解析 Fe与水蒸气反应生成四氧化三铁和氢气,A正确;此反应需要在高温条件下才能发生,B正确;四氧化三铁中铁的价态为+2价和+3价,C错误;水中氢元素化合价降低,在该反应中水做氧化剂,D正确。
4.化合物A、B组成元素相同,且B为白色。C是一种与B含有相同价态该金属元素的硫酸盐,向C中加入适量的NaOH溶液,可观察到生成的沉淀迅速变为灰绿色,最后变为红褐色沉淀A,加热A可得红棕色粉末D。回答下列问题:
(1)写出各物质的化学式:
A________、B________、C________、D________。
(2)写出B转化为A的化学方程式:_______________________________________________。
写出A受热分解的化学方程式:__________________________________________________。
答案 (1)Fe(OH)3 Fe(OH)2 FeSO4 Fe2O3
(2)4Fe(OH)2+O2+2H2O===4Fe(OH)3
2Fe(OH)3Fe2O3+3H2O
解析 解答本题的关键是抓住C与NaOH溶液反应的特征现象,确定A为Fe(OH)3,C为FeSO4,B为Fe(OH)2,D为Fe2O3。
题组一 铁的单质
1.市场上销售的食品包装有多种方式,其中一种为真空包装,如香肠、盐水鸭、月饼等食品,抽出包装袋内空气并放入一小包铁粉,那么其中铁粉主要表现的性质是( )
A.氧化性 B.还原性
C.碱性 D.酸性
答案 B
解析 包装袋内放入的铁粉与空气中的氧气反应,防止食品被氧化,起到还原剂的作用。
2.下列关于铁的叙述错误的是( )
A.纯净的铁是光亮的银白色金属
B.铁能被磁体吸引
C.铁是地壳中含量最多的金属元素
D.铁具有延展性和导热性,可制作炊具
答案 C
解析 铁元素在地壳中的含量是金属元素的第二位。
3.铁片投入下列溶液,溶液质量减轻,但无气体产生的是( )
A.盐酸 B.CuSO4溶液
C.稀硫酸 D.Na2SO4溶液
答案 B
解析 铁片投入盐酸、稀硫酸中,均发生置换反应生成H2,A、C均错误;铁片投入Na2SO4溶液中,不发生反应,D错误;铁片投入CuSO4溶液中发生置换反应:Fe+CuSO4===FeSO4+Cu,消耗56 g Fe的同时生成64 g Cu,溶液质量减轻,且无气体生成,B正确。
4.(2022·桂林高一检测)下列各项物质间的转化不能通过反应一步完成的是( )
A.Fe→Fe3O4 B.Fe→FeCl3
C.Fe→FeCl2 D.Fe→Fe(OH)3
答案 D
解析 Fe与O2点燃可得到Fe3O4,能一步反应完成,A不符合题意;Fe与Cl2点燃可得到FeCl3,能一步反应完成,B不符合题意;Fe与盐酸反应可得到FeCl2,能一步反应完成,C不符合题意;Fe不能一步反应生成Fe(OH)3,D符合题意。
5.还原铁粉与水蒸气反应的装置如图所示,下列有关该实验的说法正确的是( )
A.反应生成FeO
B.湿棉花的主要作用是冷却试管,防止炸裂
C.肥皂液的主要作用是检验生成的H2
D.铁粉与水蒸气反应后,可立即用磁体将剩余铁粉分离出来
答案 C
解析 铁与水蒸气反应生成Fe3O4和H2,A错;湿棉花的作用是提供水蒸气,B错;使用肥皂液的作用是检验反应中生成的H2,反应一段时间后,有肥皂泡吹起时,用点燃的火柴靠近肥皂泡,当听到爆鸣声时,说明铁与水蒸气反应生成了H2,C对;铁粉与水蒸气反应生成的四氧化三铁也可以被磁体吸引,不能分离出铁,D错。
题组二 铁的氧化物
6.我国科学家参与研制的阿尔法磁谱仪已随美国“发现号”航天飞船升入太空,开始了探索宇宙中是否存在“反物质”的研究工作。根据你所学的知识推测用于制造阿尔法磁谱仪的核心部件的材料是( )
A.FeO B.Fe2O3
C.Fe3O4 D.Fe(OH)3
答案 C
解析 根据磁谱仪所用物质具有磁性确定用于制造阿尔法磁谱仪的核心部件的材料为Fe3O4。
7.下列有关铁矿石与铁的氧化物的说法正确的是( )
A.赤铁矿的主要成分是Fe3O4,磁铁矿的主要成分是Fe2O3,FeO俗称铁红
B.铁矿石的主要成分与铁锈的主要成分相同
C.铁的氧化物都不溶于水,也不与水反应
D.铁的氧化物能与酸反应生成盐和水,因此Fe3O4、Fe2O3、FeO都是碱性氧化物
答案 C
解析 赤铁矿的主要成分是Fe2O3,Fe2O3俗称铁红,磁铁矿的主要成分是Fe3O4,A项错误;铁矿石的成分与矿石的种类有关,铁锈的主要成分是Fe2O3,B项错误;Fe2O3、FeO是碱性氧化物,Fe3O4不是碱性氧化物,D项错误。
题组三 铁的氢氧化物
8.实验室制取氢氧化铁的一组试剂是( )
A.氯化铁溶液和烧碱溶液
B.氧化铁和烧碱溶液
C.氧化铁和水
D.铁和水蒸气
答案 A
解析 实验室常用可溶性铁盐溶液(如氯化铁溶液)与碱溶液(如烧碱溶液)反应来制取氢氧化铁沉淀。
9.(2022·上海高一检测)下列有关铁的氢氧化物的说法中,错误的是( )
A.Fe(OH)2是一种黑色固体,不稳定,在空气中易被氧化为红褐色固体
B.Fe(OH)2具有还原性,在空气中易被氧化为Fe(OH)3
C.Fe(OH)2、Fe(OH)3都具有不稳定性,受热能分解
D.Fe(OH)3胶体呈红褐色、透明,能产生丁达尔效应
答案 A
解析 Fe(OH)2是一种白色固体,不稳定,具有还原性,在空气中易被氧化为红褐色固体Fe(OH)3:4Fe(OH)2+O2+2H2O===4Fe(OH)3,故A错误、B正确;Fe(OH)2、Fe(OH)3都具有不稳定性,受热能分解为氧化物和水,故C正确。
10.类比是研究物质的常用方法之一,可预测许多物质的性质。下列类比推测的说法中正确的是( )
A.Fe和O2能直接化合生成Fe3O4,推测Cu和O2可直接化合生成Cu3O4
B.Na和H2O反应生成NaOH和H2,推测Fe和H2O反应生成Fe(OH)3和H2
C.Fe能与CuSO4溶液发生反应,推测Fe能与AgNO3溶液发生反应
D.Na在常温下能与H2O反应,推测Fe在常温下也能与H2O反应
答案 C
解析 Fe和O2反应能生成Fe3O4,Cu和O2反应生成CuO,A项错误;Fe和H2O(g)反应生成Fe3O4和H2,B项错误;Fe与H2O(g)在高温下才能反应,D项错误。
11.(2021·海南中学高一质检)等量的铁分别与足量的盐酸、水蒸气在一定条件下充分反应,则在相同的条件下,产生氢气的体积比是( )
A.1∶1 B.3∶4
C.2∶3 D.4∶3
答案 B
解析 根据反应的化学方程式:Fe+2HCl===FeCl2+H2↑、3Fe+4H2O(g)Fe3O4+4H2可知,1 mol Fe与盐酸反应生成1 mol H2,1 mol Fe与水蒸气反应生成 mol H2,故在相同条件下,产生H2的体积比是3∶4。
12.(2022·内蒙古赤峰二中高一月考)将磁性氧化铁放入稀HNO3中可发生如下反应:
3Fe3O4+28HNO3===9Fe(NO3)x+NO↑+14H2O,下列判断正确的是( )
A.Fe(NO3)x中的x为2
B.反应中每生成0.2 mol还原产物,就有0.6 mol电子转移
C.HNO3在反应中全部被还原
D.磁性氧化铁中的铁元素全部被氧化
答案 B
解析 由N原子守恒可知,28=9x+1,解得x=3,故A项错误;N元素的化合价由+5价降低为+2价,则反应中每生成0.2 mol还原产物,就有0.2 mol×(5-2)=0.6 mol电子转移,故B项正确;稀HNO3在反应中生成硝酸盐和NO,则HNO3在反应中部分被还原,故C项错误;磁性氧化铁中的Fe元素有+2价和+3价,则铁元素部分被氧化,故D项错误。
13.(2022·河南信阳高一月考)某实验小组测定铁的氧化物FexOy的化学式,已知该氧化物中铁元素只有+2价和+3价两种价态,实验步骤如图,下列说法正确的是( )
A.步骤①和步骤②都发生了氧化还原反应
B.溶液a中阳离子只有Fe3+和Fe2+
C.溶液b中n(Fe3+)∶n(Cl-)=1∶3
D.通过计算可得该氧化物的化学式为Fe4O5
答案 D
解析 步骤①中铁的氧化物和盐酸反应生成Fe2+和Fe3+,无化合价变化,没有发生氧化还原反应,A错误;由于盐酸是过量的,则溶液a中阳离子有Fe3+、Fe2+和H+,B错误;由于步骤①中盐酸是过量的,则n(Cl-)未知,C错误;溶液a中通入0.1 mol Cl2,发生反应:2Fe2++Cl2===2Fe3++2Cl-,则a中含有0.2 mol Fe2+,因此氧化物FexOy中相当于FeO的质量为0.2 mol×72 g·mol-1=14.4 g,Fe2O3的质量为30.4 g-14.4 g=16.0 g,则n(Fe2O3)=0.1 mol,n(FeO)=0.2 mol。故该氧化物可以看作2FeO·Fe2O3,则化学式为Fe4O5,D正确。
14.金属单质A可发生以下反应。试推断:
(1)A、B、C、D、E分别是(写化学式,B写主要成分):
A____________、B____________、C_____________、D____________、E__________。
(2)写出反应③和⑤的离子方程式:
③________________________________________________________________________;
⑤________________________________________________________________________。
答案 (1)Fe Fe2O3 Fe3O4 Cu H2
(2)Fe+Cu2+===Fe2++Cu Fe+2H+===Fe2++H2↑
解析 推断题的解题思路:根据物质的物理性质(特别是色、态)和化学性质(相互转化关系、反应条件等),找出具有特征条件的物质,再由相互转化关系逐步推断。例如,本题中结合B、C的颜色及单质A与CuCl2溶液、盐酸反应的性质可推知A为Fe。
15.(2022·广东梅州高一检测)某化学兴趣小组利用如图所示装置进行铁粉与水蒸气反应的实验,并检验产物的性质。请回答下列问题:
(1)A装置的作用是_______________________,D装置的作用是_______________________。
(2)写出B装置中发生反应的化学方程式:_________________________________________。
(3)A、B、E装置中应先点燃________________处的酒精灯,点燃E处酒精灯之前应进行的操作是________________。
(4)铁粉与水蒸气发生了反应,则E处的实验现象是________________。
答案 (1)提供水蒸气 除去未反应的水蒸气(或干燥生成的气体)
(2)3Fe+4H2O(g)Fe3O4+4H2
(3)A 检验氢气纯度
(4)黑色氧化铜粉末变红色
解析 A处提供水蒸气,B处铁与水蒸气发生反应,C处冷凝水蒸气,D处干燥氢气,E处氢气还原氧化铜,注意要检验氢气的纯度防止发生爆炸。(1)铁与水蒸气反应的条件是高温,水的状态是气体,所以A装置的作用是提供水蒸气;E是氢气还原氧化铜的装置,气体进入E装置前要干燥,否则会有危险,硬质玻璃管可能炸裂,因此D装置的作用是除去未反应的水蒸气(或干燥生成的气体)。(2)B装置中铁与水蒸气反应生成氢气和四氧化三铁,反应的化学方程式为3Fe+4H2O(g)Fe3O4+4H2。(3)若先点燃B处酒精灯,铁会与氧气发生反应,所以须先点燃A处酒精灯;氢气是可燃性气体,混有空气加热时会发生爆炸,所以点燃E处酒精灯之前应进行的操作是收集H2并检验其纯度,具体操作:收集一试管气体,将试管口靠近酒精灯火焰,若发出噗的声音,说明气体纯净;若发生尖锐的爆鸣声,说明气体不纯。
(4)氢气还原氧化铜得到铜和水,即H2+CuOCu+H2O,所以E装置中的实验现象是硬质玻璃管中黑色氧化铜粉末变红色。
