鲁教版九年级化学上册 2.4 元素课件(共31张PPT)
文档属性
| 名称 | 鲁教版九年级化学上册 2.4 元素课件(共31张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 388.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-07-14 20:32:01 | ||
图片预览








文档简介
(共31张PPT)
第四节 元素
1、电解水的实验说明水是由什么组成的?什么是元素?
2、什么是相对原子质量?其中一种碳原子是指哪一种碳原子?有没有别的碳原子呢?
介绍:几种碳原子
质子数为6,中子数为6
质子数为6,中子数为7
思考
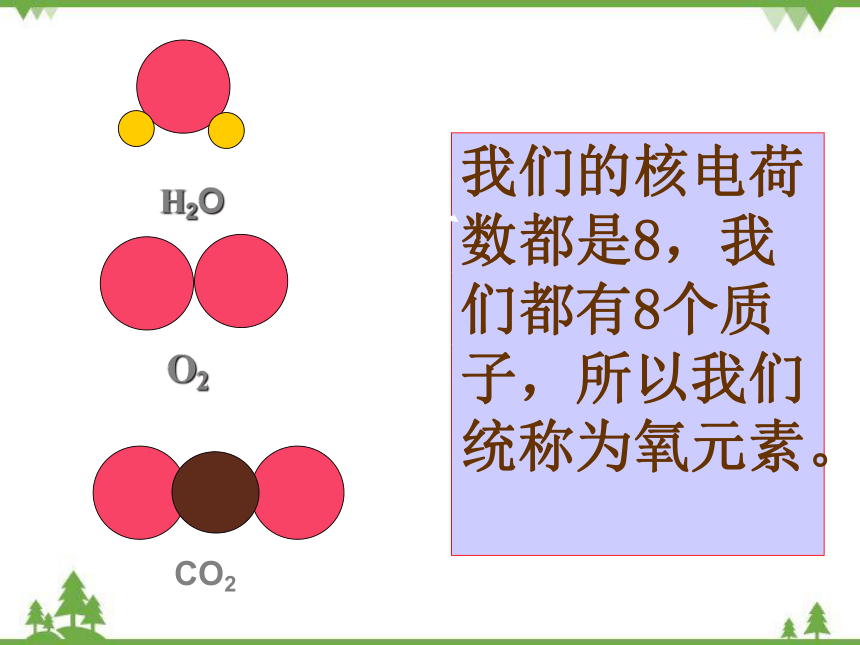
我们的核电荷数都是8,我们都有8个质子,所以我们统称为氧元素。
H2O
CO2
O2
一、元素的概念:
说明:1、具有相同的质子数(核电荷数)
——质子数决定种类
2、同一类原子(中子数、电子数可以不同)
3、总称:元素是一个宏观概念。
定义:具有相同的质子数(核电荷数)的一类原子的总称
深入理解“同一类原子” :
几种碳原子
C-12质子数为6,中子数6
C-13质子数为6,中子数为7
C-14质子数为6,中子数为8
几种氢原子
H-1质子数为1,中子数为0
H-2质子数为1,中子数为1
H-3质子数为1,中子数为2
①中子数不同:
中子数不同只影响原子质量,不影响原子种类.
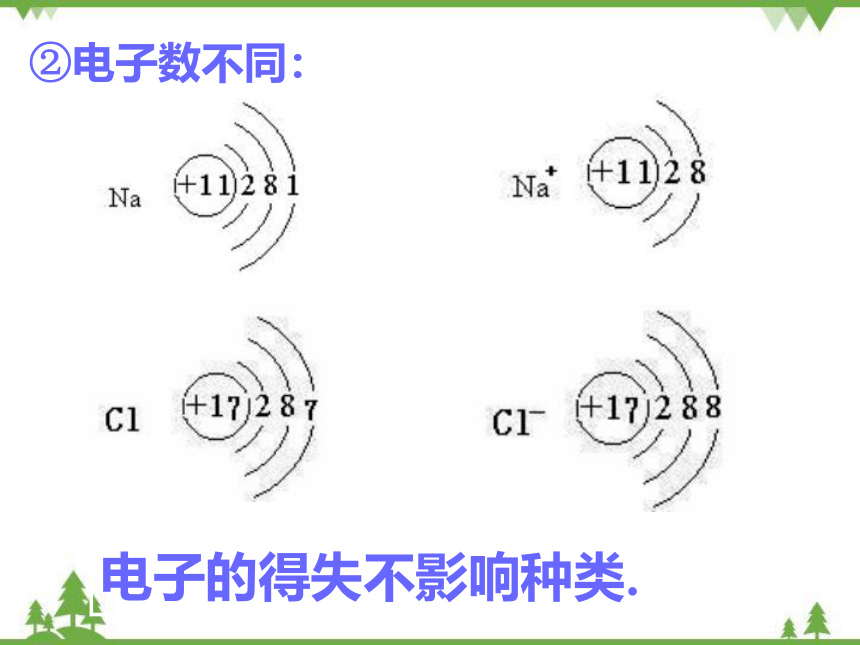
②电子数不同:
电子的得失不影响种类.
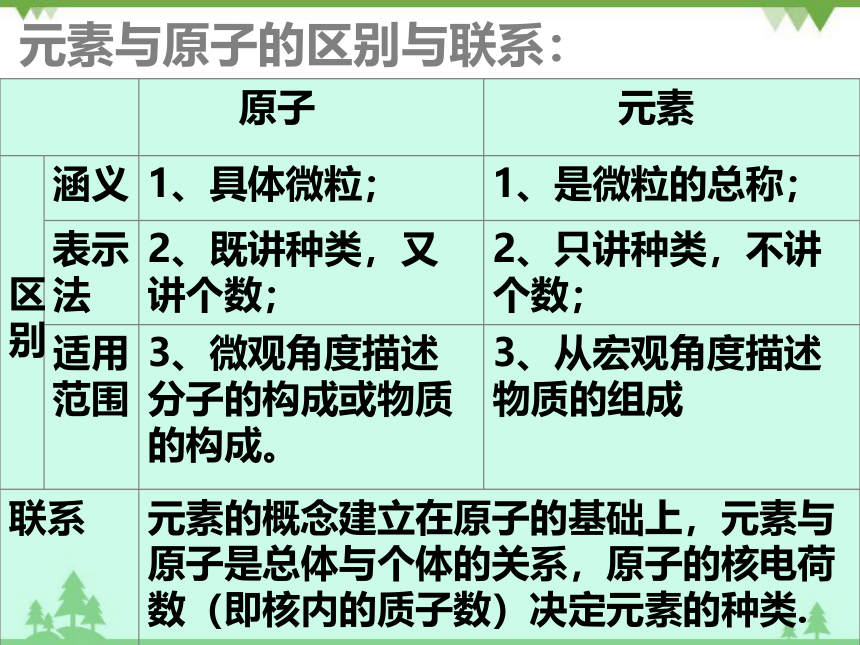
元素与原子的区别与联系:
原子 元素
区别 涵义 1、具体微粒; 1、是微粒的总称;
表示法 2、既讲种类,又讲个数; 2、只讲种类,不讲个数;
适用范围 3、微观角度描述分子的构成或物质的构成。 3、从宏观角度描述物质的组成
联系 元素的概念建立在原子的基础上,元素与原子是总体与个体的关系,原子的核电荷数(即核内的质子数)决定元素的种类.
下列说法有没有错误?将错误的说法加以改正:
⑴水是由一个氧元素和两个氢元素组成的。
⑵二氧化硫中有硫和氧两个元素。
⑶水是由氢原子和氧原子构成的.
⑷水分子是由氢元素和氧元素组成的
⑸一个水分子是由2个氢原子和1个氧原子构成的
分析问题:
二.自然界中元素的存在
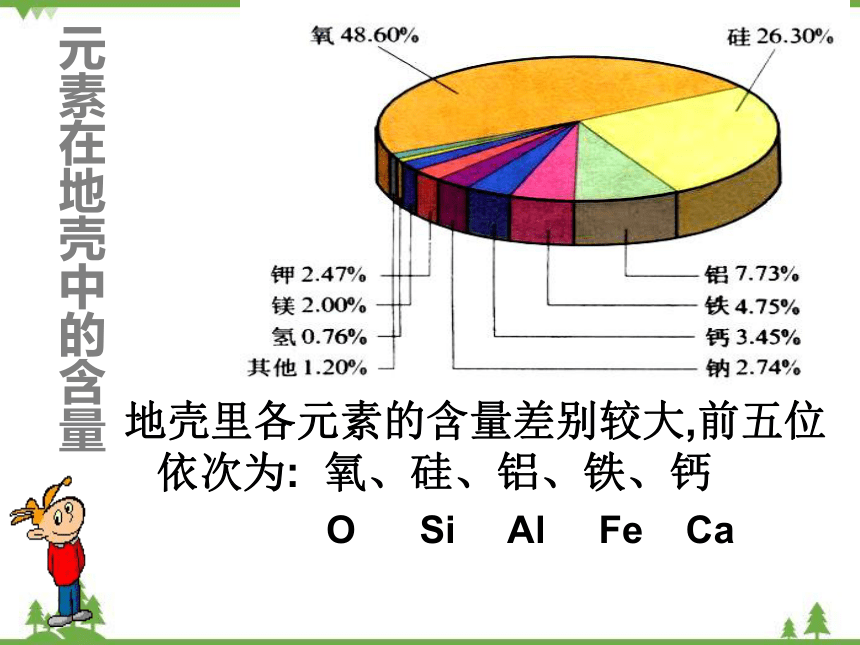
地壳里各种元素的含量
元素在地壳中的含量
地壳里各元素的含量差别较大,前五位依次为: 氧、硅、铝、铁、钙
O Si Al Fe Ca
⑷生物细胞中含量最多的元素
氧元素
⑴地壳中含量最多的元素是:
⑶地壳中含量最多的金属元素
氧元素
铝元素
⑵地壳中含量最多的非金属元素
氧元素
联系生活:小华用凉开水养鱼,不久鱼全死了,下列哪个是合理的解释
A、凉开水中几乎不含氧元素
B、凉开水中几乎不含氧原子
C、凉开水中几乎不含水分子
D、凉开水中几乎不含氧气
D
根据组成物质的元素种类将纯净物分类
单质:由一种元素组成 如 O2 C He Fe
化合物:由两种或两种以上元素组成 如 H2O CO2 NaCl CaCO3
你记得吗?
区分混合物和纯净物的根据是什么
元素在自然界中的存在形式:单质和化合物
三、物质的分类
物质
纯净物
单质
化合物
混合物
多种物质组成
单一物质组成
单一元素组成
多种元素组成
下列物质中,属于混合物的有 属于纯净物的有 属于单质的有 属于化合物的有
①铁 ②雪水 ③二氧化碳 ④稀硫酸 ⑤水 ⑥氖气 ⑦铁矿石 ⑧氯化钠 ⑨碳酸氢铵 ⑩矿泉水 ⑾臭氧 ⑿ 汽水 ⒀氧化铜 ⒁ 酚酞试液 ⒂硫磺 ⒃白糖水 ⒄镁条
②④⑦⑩⑿⒁⒃
①③⑤⑥⑧⑨⑾⒀⒂⒄
①⑥⑾⒂⒄
③⑤⑧⑨⒀
下列各组物质按混合物、化合物、单质顺序排列是
A.冰水共存物、干冰、氮气 B.石油、煤、天然气
D.纯碱、酒精、水银
C.洁净的空气、氧化镁、液态氧
第四节元素
第二课时
学习目标:
1、正确书写常见的元素符号,知道元 素符号的读法及意义
2、知道元素的简单分类,元素周期表 的结构。
学习重点和难点
元素符号的意义及正确的书写
一、元素的分类:
1、稀有气体:气字头
2、金属元素:“钅”字旁
固态非金属元素(“石”字旁)
液态非金属元素(“氵”字旁)
气态非金属元素(“气”字头除稀有气体)
3、非
金
属
元
素
练习:说出下列元素属于何种类别
硅____、磷_____、氢_____、氮_____
氖____、镁_____、钠_____、碘_____
钙____、金_____、汞_____、氯_____
溴__ __ 、碳__ __
历史上,近代化学之父道尔顿曾用图形加字母的方式作为元素符号.
二、元素符号
1.为什么要使用元素符号?
2.元素符号的读法
O--氧元素
Fe--铁元素
H--氢元素
3 .元素符号的书写
判断:钙 CA 氯 CL 氦 He 镁 mg 银 ag 钠 Na
(1)由一个字母表示的元素符号要大写如:H 氢 O 氧 N 氮
(2)由两个字母表示的元素符号第一个字母要大写,第二个字母要小写如He Fe Zn
记住并会正确书写下列元素符号:
氢 氦 碳 氮 氧 氟 氖
H He C N O F Ne
钠 镁 铝 硅 磷 硫 氯
Na Mg Al Si P S Cl
氩 钾 钙 锰 铁 铜 锌
Ar K Ca Mn Fe Cu Zn
银 钡 汞 金
Ag Ba Hg Au
4.元素符号的意义
(1)表示一种元素 (宏观)
(2)表示该元素的一个原子(微观)
【(3)有些还表示一种物质】
例: H 氢元素 一个氢原子
Fe 铁元素 一个铁原子 (此外还可表示铁)
物质原子和元素,金属稀有气体来相助,碳硅硫磷也算数。
注意:在元素符号前面加上计量数后,就只能表示若干原子,不再表示某元素。
如3H只表示三个氢原子.
请说出下列符号的含义:
1,O_____、2O_______、O2________
2,nMn_____、10S________、7P________
3,Al___、Cl___、Ar___、Ag___、Au____
4,C_____、Ca_______、Cu________
5,Mg_____、Mn_______、Zn________
三.元素周期表
姓名:门捷列夫 出生年月:1834-1907 出生地:俄国西伯利亚的托波尔斯克市 国籍:俄国
在化学教科书中,都附有一张“元素周期表”。这张表揭示了物质世界的秘密,把一些看来似乎互不相关的元素统一起来,组成了一个完整的自然体系。它的发明,是近代化学史上的一个创举,对于促进化学的发展,起了巨大的作用。看到这张表,人们便会想到它的最早发明者——门捷列夫。
元素周期表的结构简介(门捷列夫)
1、周期:每一横行叫一周期,共7个周期。
2、族:每一纵行叫一族,7个主族(A), 7 个副族(B),1个0族,(8、9、10)三个纵行共同组成一个第Ⅷ族
3、原子序数:
原子序数=核内质子数
横行(7)-周期(7) 纵行(18)—族(16)
周期数=电子层数 族序数=最外层电子数
元素的化学性质与最外层电子数有关
金属元素的原子易失电子,形成阳离子
非金属元素的原子易得电子,形成阴离子
离子,原子结构的示意图
第四节 元素
1、电解水的实验说明水是由什么组成的?什么是元素?
2、什么是相对原子质量?其中一种碳原子是指哪一种碳原子?有没有别的碳原子呢?
介绍:几种碳原子
质子数为6,中子数为6
质子数为6,中子数为7
思考
我们的核电荷数都是8,我们都有8个质子,所以我们统称为氧元素。
H2O
CO2
O2
一、元素的概念:
说明:1、具有相同的质子数(核电荷数)
——质子数决定种类
2、同一类原子(中子数、电子数可以不同)
3、总称:元素是一个宏观概念。
定义:具有相同的质子数(核电荷数)的一类原子的总称
深入理解“同一类原子” :
几种碳原子
C-12质子数为6,中子数6
C-13质子数为6,中子数为7
C-14质子数为6,中子数为8
几种氢原子
H-1质子数为1,中子数为0
H-2质子数为1,中子数为1
H-3质子数为1,中子数为2
①中子数不同:
中子数不同只影响原子质量,不影响原子种类.
②电子数不同:
电子的得失不影响种类.
元素与原子的区别与联系:
原子 元素
区别 涵义 1、具体微粒; 1、是微粒的总称;
表示法 2、既讲种类,又讲个数; 2、只讲种类,不讲个数;
适用范围 3、微观角度描述分子的构成或物质的构成。 3、从宏观角度描述物质的组成
联系 元素的概念建立在原子的基础上,元素与原子是总体与个体的关系,原子的核电荷数(即核内的质子数)决定元素的种类.
下列说法有没有错误?将错误的说法加以改正:
⑴水是由一个氧元素和两个氢元素组成的。
⑵二氧化硫中有硫和氧两个元素。
⑶水是由氢原子和氧原子构成的.
⑷水分子是由氢元素和氧元素组成的
⑸一个水分子是由2个氢原子和1个氧原子构成的
分析问题:
二.自然界中元素的存在
地壳里各种元素的含量
元素在地壳中的含量
地壳里各元素的含量差别较大,前五位依次为: 氧、硅、铝、铁、钙
O Si Al Fe Ca
⑷生物细胞中含量最多的元素
氧元素
⑴地壳中含量最多的元素是:
⑶地壳中含量最多的金属元素
氧元素
铝元素
⑵地壳中含量最多的非金属元素
氧元素
联系生活:小华用凉开水养鱼,不久鱼全死了,下列哪个是合理的解释
A、凉开水中几乎不含氧元素
B、凉开水中几乎不含氧原子
C、凉开水中几乎不含水分子
D、凉开水中几乎不含氧气
D
根据组成物质的元素种类将纯净物分类
单质:由一种元素组成 如 O2 C He Fe
化合物:由两种或两种以上元素组成 如 H2O CO2 NaCl CaCO3
你记得吗?
区分混合物和纯净物的根据是什么
元素在自然界中的存在形式:单质和化合物
三、物质的分类
物质
纯净物
单质
化合物
混合物
多种物质组成
单一物质组成
单一元素组成
多种元素组成
下列物质中,属于混合物的有 属于纯净物的有 属于单质的有 属于化合物的有
①铁 ②雪水 ③二氧化碳 ④稀硫酸 ⑤水 ⑥氖气 ⑦铁矿石 ⑧氯化钠 ⑨碳酸氢铵 ⑩矿泉水 ⑾臭氧 ⑿ 汽水 ⒀氧化铜 ⒁ 酚酞试液 ⒂硫磺 ⒃白糖水 ⒄镁条
②④⑦⑩⑿⒁⒃
①③⑤⑥⑧⑨⑾⒀⒂⒄
①⑥⑾⒂⒄
③⑤⑧⑨⒀
下列各组物质按混合物、化合物、单质顺序排列是
A.冰水共存物、干冰、氮气 B.石油、煤、天然气
D.纯碱、酒精、水银
C.洁净的空气、氧化镁、液态氧
第四节元素
第二课时
学习目标:
1、正确书写常见的元素符号,知道元 素符号的读法及意义
2、知道元素的简单分类,元素周期表 的结构。
学习重点和难点
元素符号的意义及正确的书写
一、元素的分类:
1、稀有气体:气字头
2、金属元素:“钅”字旁
固态非金属元素(“石”字旁)
液态非金属元素(“氵”字旁)
气态非金属元素(“气”字头除稀有气体)
3、非
金
属
元
素
练习:说出下列元素属于何种类别
硅____、磷_____、氢_____、氮_____
氖____、镁_____、钠_____、碘_____
钙____、金_____、汞_____、氯_____
溴__ __ 、碳__ __
历史上,近代化学之父道尔顿曾用图形加字母的方式作为元素符号.
二、元素符号
1.为什么要使用元素符号?
2.元素符号的读法
O--氧元素
Fe--铁元素
H--氢元素
3 .元素符号的书写
判断:钙 CA 氯 CL 氦 He 镁 mg 银 ag 钠 Na
(1)由一个字母表示的元素符号要大写如:H 氢 O 氧 N 氮
(2)由两个字母表示的元素符号第一个字母要大写,第二个字母要小写如He Fe Zn
记住并会正确书写下列元素符号:
氢 氦 碳 氮 氧 氟 氖
H He C N O F Ne
钠 镁 铝 硅 磷 硫 氯
Na Mg Al Si P S Cl
氩 钾 钙 锰 铁 铜 锌
Ar K Ca Mn Fe Cu Zn
银 钡 汞 金
Ag Ba Hg Au
4.元素符号的意义
(1)表示一种元素 (宏观)
(2)表示该元素的一个原子(微观)
【(3)有些还表示一种物质】
例: H 氢元素 一个氢原子
Fe 铁元素 一个铁原子 (此外还可表示铁)
物质原子和元素,金属稀有气体来相助,碳硅硫磷也算数。
注意:在元素符号前面加上计量数后,就只能表示若干原子,不再表示某元素。
如3H只表示三个氢原子.
请说出下列符号的含义:
1,O_____、2O_______、O2________
2,nMn_____、10S________、7P________
3,Al___、Cl___、Ar___、Ag___、Au____
4,C_____、Ca_______、Cu________
5,Mg_____、Mn_______、Zn________
三.元素周期表
姓名:门捷列夫 出生年月:1834-1907 出生地:俄国西伯利亚的托波尔斯克市 国籍:俄国
在化学教科书中,都附有一张“元素周期表”。这张表揭示了物质世界的秘密,把一些看来似乎互不相关的元素统一起来,组成了一个完整的自然体系。它的发明,是近代化学史上的一个创举,对于促进化学的发展,起了巨大的作用。看到这张表,人们便会想到它的最早发明者——门捷列夫。
元素周期表的结构简介(门捷列夫)
1、周期:每一横行叫一周期,共7个周期。
2、族:每一纵行叫一族,7个主族(A), 7 个副族(B),1个0族,(8、9、10)三个纵行共同组成一个第Ⅷ族
3、原子序数:
原子序数=核内质子数
横行(7)-周期(7) 纵行(18)—族(16)
周期数=电子层数 族序数=最外层电子数
元素的化学性质与最外层电子数有关
金属元素的原子易失电子,形成阳离子
非金属元素的原子易得电子,形成阴离子
离子,原子结构的示意图
同课章节目录
- 第一单元 步入化学殿堂
- 第一节 化学真奇妙
- 第二节 体验化学探究
- 到实验室去:化学实验基本技能训练(一)
- 第二单元 探秘水世界
- 第一节 运动的水分子
- 第二节 水分子的变化
- 第三节 原子的构成
- 第四节 元素
- 到实验室去:化学实验基本技能训练(二)
- 第三单元 溶液
- 第一节 溶液的形成
- 第二节 溶液组成的定量表示
- 到实验室去:配制一定溶质质量分数的溶液
- 第四单元 我们周围的空气
- 第一节 空气的成分
- 第二节 物质组成的表示
- 第三节 氧气
- 到实验室去:氧气的实验室制取与性质
- 第五单元 定量研究化学反应
- 第一节 化学反应中的质量守恒
- 第二节 化学反应的表示
- 第三节 化学反应中的有关计算
- 到实验室去:探究燃烧的条件
- 第六单元 燃烧与燃料
- 第一节 燃烧与灭火
- 第二节 化石燃料的利用
- 第三节 大自然中的二氧化碳
- 到实验室去:二氧化碳的实验室制取与性质
