2022-2023学年人教版2019高中化学必修1 第四章 物质结构 元素周期律 知识体系构建与核心素养提升(学案 word版含解析)
文档属性
| 名称 | 2022-2023学年人教版2019高中化学必修1 第四章 物质结构 元素周期律 知识体系构建与核心素养提升(学案 word版含解析) |
|
|
| 格式 | docx | ||
| 文件大小 | 543.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-07-14 22:17:44 | ||
图片预览

文档简介
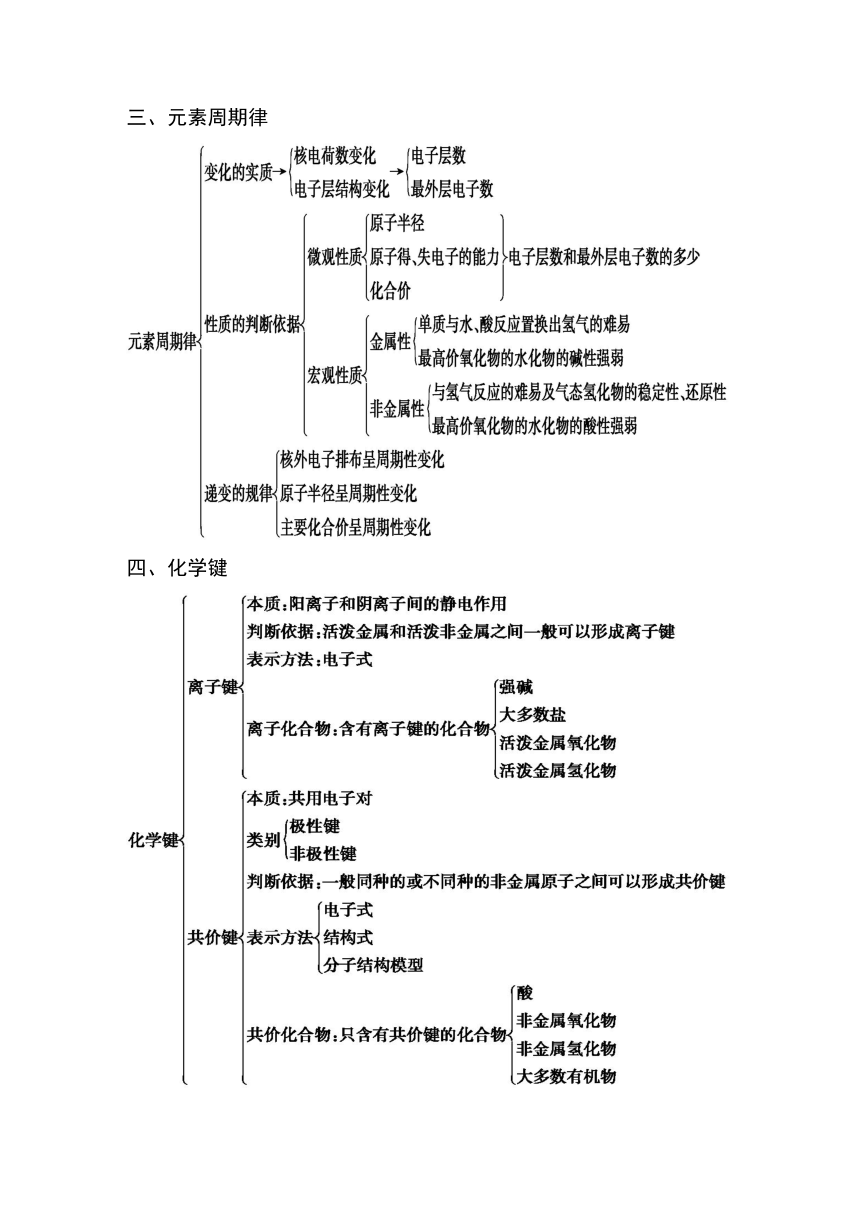
本章知识体系构建与核心素养提升
一、原子结构
二、元素周期表
三、元素周期律
四、化学键
例1 “玉兔”号月球车用Pu作为热源材料,下列关于Pu的说法正确的是( )
A.Pu与U互为同位素
B.Pu与Pu具有完全相同的物理性质
C.Pu与U具有完全相同的化学性质
D.Pu与Pu具有相同的最外层电子数
答案 D
解析 质子数相同、中子数不同的同一元素的不同核素互为同位素,Pu与U的质子数不同,不互为同位素,故A错误;Pu与Pu互为同位素,其物理性质不同,故B错误;
Pu与U的质子数不同,属于不同的元素,其化学性质不同,故C错误;Pu与Pu具有相同的质子数,所以其核外电子数相同,则具有相同的最外层电子数,故D正确。
例2 (2022·青岛高一检测)短周期主族元素甲~戊在元素周期表中的相对位置如图所示,下列判断正确的是( )
甲 乙
丙 丁 戊
A.原子半径:丙<丁<戊
B.金属性:甲>丙
C.氢氧化物碱性:丙>丁>戊
D.最外层电子数:甲>乙
答案 C
解析 同周期主族元素原子半径从左至右是依次减小的,故A项错误;同主族元素自上而下金属性是依次增强的,故B项错误;同周期元素的金属性从左至右越来越弱,故对应氢氧化物的碱性是逐渐减弱的,故C项正确;同周期元素的原子最外层电子数从左至右越来越多,故D项错误。
例3 下列关于铯及其化合物的说法不正确的是( )
A.氢氧化铯是一种强碱,比KOH的碱性强
B.铯与水或酸溶液反应剧烈,都生成氢气
C.Cs的还原性比Na强,故Na+的氧化性大于Cs+
D.Cs2CO3不易溶于水
答案 D
解析 Cs的最外层电子数是1,电子层数比K的多,故Cs的金属性比K强,CsOH的碱性比KOH强,A项正确;Cs与Na性质相似,与水或酸反应更剧烈,都生成H2,B项正确;Cs的还原性比Na强,所以Na+得电子的能力比Cs+强,C项正确;因为Na2CO3、K2CO3均易溶于水,所以Cs2CO3也易溶于水,D项错误。
例4 元素在元素周期表中的位置,反映了元素的原子结构和元素的性质,如氮族元素是位于元素周期表第ⅤA族的元素,在生活中有广泛的应用,如N2作防腐气体,液氮还可用作制冷剂,P可用于制造农药等。如图是元素周期表的一部分。
(1)写出N元素在元素周期表中的位置:________。根据元素周期律,预测H3AsO4与H3PO4酸性强弱:______________________________________________。
(2)在一定条件下,S与H2反应有一定难度,请判断:在相同条件下Se和H2反应的难度比S与H2反应难度更大还是更小?________________。
(3)下列说法正确的是________(填字母)。
A.C、N、O、F的原子半径随着原子序数的增大而减小
B.氯气能置换出NaBr溶液中的溴
C.HF、HCl、HBr、HI的热稳定性依次减弱
答案 (1)第二周期第ⅤA族 H3PO4>H3AsO4 (2)更大 (3)ABC
解析 (1)同一主族,元素的非金属性从上到下逐渐减弱,故酸性:H3PO4>H3AsO4。(2)元素的非金属性越强,与氢气化合越容易。
例5 A、B、D、E、F、G为短周期元素,且原子序数依次递增。A、F同主族,E、G同主族。A与其他非金属元素化合时易形成共价键,F与其他非金属元素化合时易形成离子键,且F+与E2-核外电子排布相同。由以上元素组成的物质BE和D2具有相同的电子数。请回答以下问题:
(1)由A、E、F三种元素形成的化合物的化学式为__________,含有的化学键有__________(填写完整化学键类型),属于________化合物。
(2)B的最高价是________,由A、E组成的18电子微粒的化合物的化学式是A2E2,含有的化学键有____________(填写完整化学键类型),有________对共用电子。
答案 (1)NaOH 离子键和极性共价键 离子
(2)+4 极性共价键和非极性共价键 3
一、原子结构
二、元素周期表
三、元素周期律
四、化学键
例1 “玉兔”号月球车用Pu作为热源材料,下列关于Pu的说法正确的是( )
A.Pu与U互为同位素
B.Pu与Pu具有完全相同的物理性质
C.Pu与U具有完全相同的化学性质
D.Pu与Pu具有相同的最外层电子数
答案 D
解析 质子数相同、中子数不同的同一元素的不同核素互为同位素,Pu与U的质子数不同,不互为同位素,故A错误;Pu与Pu互为同位素,其物理性质不同,故B错误;
Pu与U的质子数不同,属于不同的元素,其化学性质不同,故C错误;Pu与Pu具有相同的质子数,所以其核外电子数相同,则具有相同的最外层电子数,故D正确。
例2 (2022·青岛高一检测)短周期主族元素甲~戊在元素周期表中的相对位置如图所示,下列判断正确的是( )
甲 乙
丙 丁 戊
A.原子半径:丙<丁<戊
B.金属性:甲>丙
C.氢氧化物碱性:丙>丁>戊
D.最外层电子数:甲>乙
答案 C
解析 同周期主族元素原子半径从左至右是依次减小的,故A项错误;同主族元素自上而下金属性是依次增强的,故B项错误;同周期元素的金属性从左至右越来越弱,故对应氢氧化物的碱性是逐渐减弱的,故C项正确;同周期元素的原子最外层电子数从左至右越来越多,故D项错误。
例3 下列关于铯及其化合物的说法不正确的是( )
A.氢氧化铯是一种强碱,比KOH的碱性强
B.铯与水或酸溶液反应剧烈,都生成氢气
C.Cs的还原性比Na强,故Na+的氧化性大于Cs+
D.Cs2CO3不易溶于水
答案 D
解析 Cs的最外层电子数是1,电子层数比K的多,故Cs的金属性比K强,CsOH的碱性比KOH强,A项正确;Cs与Na性质相似,与水或酸反应更剧烈,都生成H2,B项正确;Cs的还原性比Na强,所以Na+得电子的能力比Cs+强,C项正确;因为Na2CO3、K2CO3均易溶于水,所以Cs2CO3也易溶于水,D项错误。
例4 元素在元素周期表中的位置,反映了元素的原子结构和元素的性质,如氮族元素是位于元素周期表第ⅤA族的元素,在生活中有广泛的应用,如N2作防腐气体,液氮还可用作制冷剂,P可用于制造农药等。如图是元素周期表的一部分。
(1)写出N元素在元素周期表中的位置:________。根据元素周期律,预测H3AsO4与H3PO4酸性强弱:______________________________________________。
(2)在一定条件下,S与H2反应有一定难度,请判断:在相同条件下Se和H2反应的难度比S与H2反应难度更大还是更小?________________。
(3)下列说法正确的是________(填字母)。
A.C、N、O、F的原子半径随着原子序数的增大而减小
B.氯气能置换出NaBr溶液中的溴
C.HF、HCl、HBr、HI的热稳定性依次减弱
答案 (1)第二周期第ⅤA族 H3PO4>H3AsO4 (2)更大 (3)ABC
解析 (1)同一主族,元素的非金属性从上到下逐渐减弱,故酸性:H3PO4>H3AsO4。(2)元素的非金属性越强,与氢气化合越容易。
例5 A、B、D、E、F、G为短周期元素,且原子序数依次递增。A、F同主族,E、G同主族。A与其他非金属元素化合时易形成共价键,F与其他非金属元素化合时易形成离子键,且F+与E2-核外电子排布相同。由以上元素组成的物质BE和D2具有相同的电子数。请回答以下问题:
(1)由A、E、F三种元素形成的化合物的化学式为__________,含有的化学键有__________(填写完整化学键类型),属于________化合物。
(2)B的最高价是________,由A、E组成的18电子微粒的化合物的化学式是A2E2,含有的化学键有____________(填写完整化学键类型),有________对共用电子。
答案 (1)NaOH 离子键和极性共价键 离子
(2)+4 极性共价键和非极性共价键 3
