2021-2022学年下学期高一化学鲁科版(2019)必修第二册1.1.1原子结构课件(15张ppt)
文档属性
| 名称 | 2021-2022学年下学期高一化学鲁科版(2019)必修第二册1.1.1原子结构课件(15张ppt) |  | |
| 格式 | zip | ||
| 文件大小 | 1.2MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 鲁科版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-07-15 14:20:57 | ||
图片预览



文档简介
(共15张PPT)
必修2第1章 原子结构与元素周期律
第一节 原子结构
本节核心素养发展目标
1.认识原子结构,了解构成原子的微粒的基本性质,知道质量数A和 的含义,掌握核电荷数、质子数、中子数、质量数之间的相互关系。
2.知道元素、核素、同位素的含义,并能比较它们的不同,促进“宏观辨识与微观探析”化学学科核心素养的发展。
原子
化学变化中的最小微粒是什么?
卢瑟福(英国物理学家)通过α粒子散射实验认识了原子核的存在,提出了核式原子模型――
1.原子中心有一个原子核,它集中了原子全部正电荷和几乎全部质量;
2.原子内部的绝大部分空间都是空荡荡的,带负电荷的电子在核外空间饶核高速运动。
绝大多数α粒子直线通过;
少数α粒子转向;
个别α粒子反弹。
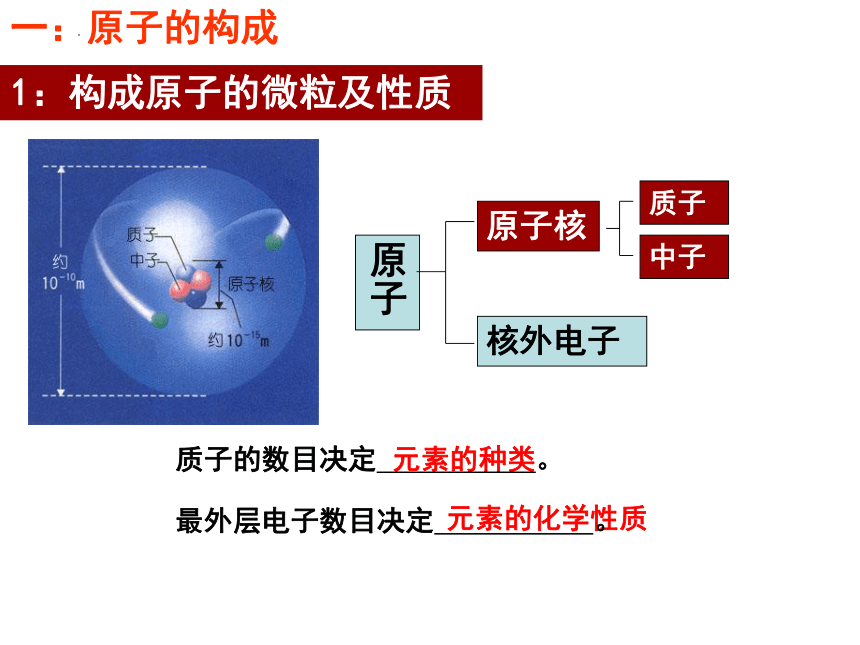
原子核
原子
核外电子
质子
中子
一:原子的构成
1:构成原子的微粒及性质
元素的种类
元素的化学性质
质子的数目决定 。
最外层电子数目决定 。
附:碳-12原子质量的1/12为1.6606×10-27 kg
质子的相对质量 =
质子的实际质量
1.6606×10-27Kg
=1.007
中子的相对质量 =
中子的实际质量
1.6606×10-27Kg
=1.008
相对质量
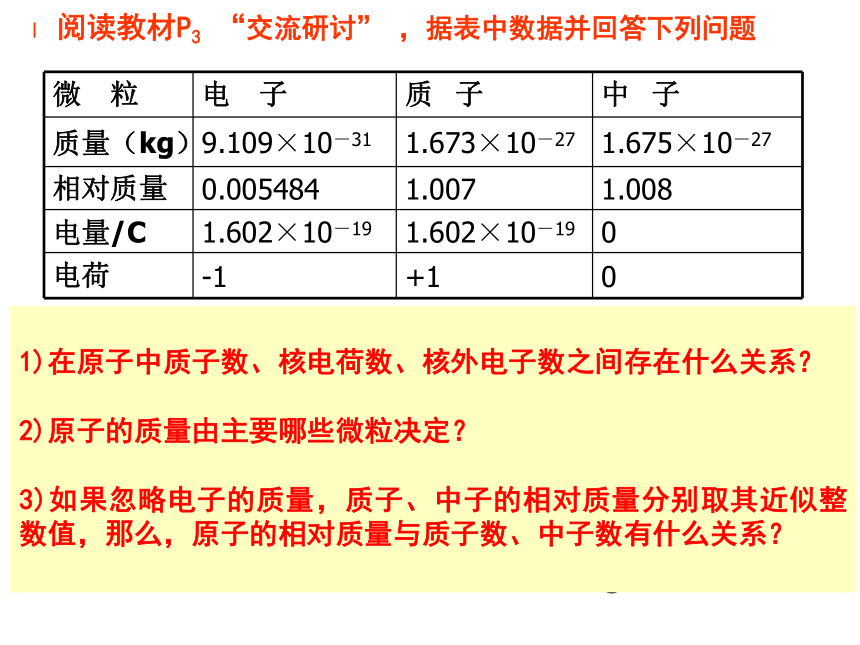
阅读教材P3 “交流研讨” ,据表中数据并回答下列问题
微 粒 电 子 质 子 中 子
质量(kg) 9.109×10-31 1.673×10-27 1.675×10-27
相对质量 0.005484 1.007 1.008
电量/C 1.602×10-19 1.602×10-19 0
电荷 -1 +1 0
1)在原子中质子数、核电荷数、核外电子数之间存在什么关系?
2)原子的质量由主要哪些微粒决定?
3)如果忽略电子的质量,质子、中子的相对质量分别取其近似整数值,那么,原子的相对质量与质子数、中子数有什么关系?
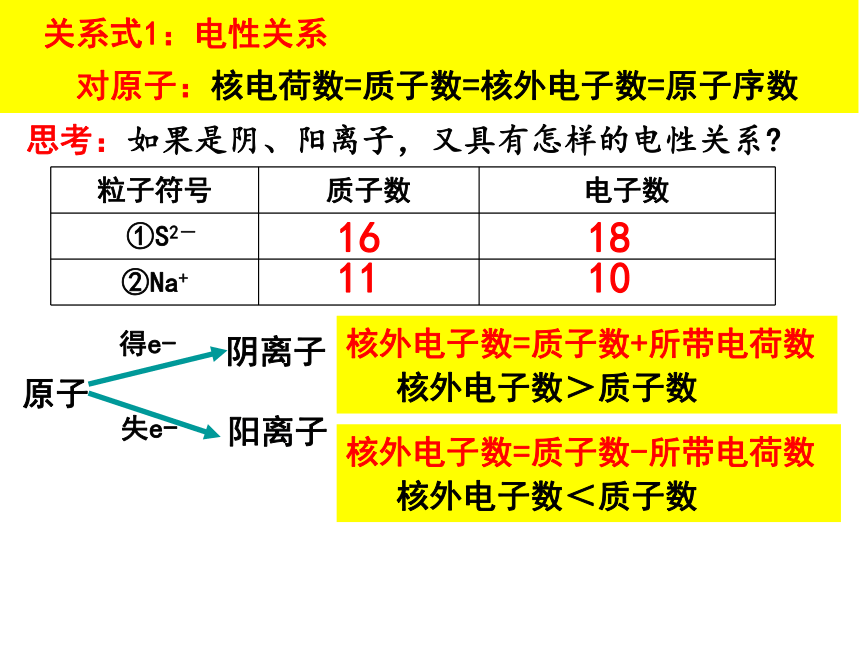
关系式1:电性关系
对原子:核电荷数=质子数=核外电子数=原子序数
思考:如果是阴、阳离子,又具有怎样的电性关系
原子
得e-
阴离子
失e-
阳离子
核外电子数=质子数+所带电荷数
核外电子数>质子数
粒子符号 质子数 电子数
①S2-
②Na+
16
18
11
10
核外电子数=质子数-所带电荷数
核外电子数<质子数
注意:(1)质量数是一种原子的质量数,不是元素的质量数。一种元素可以有多种不同的原子,每种原子都有自己的质量数(如146C、136C、126C)。
(2)在数值上:原子的相对原子质量≈质量数
关系式2:质量关系
原子的质量几乎全部集中在原子核上,也就是说,原子的质量可以看作原子核中质子和中子的质量之和。
定义:人们将原子核内质子数和中子数的之和称为质量数。
2:质量数
质量数(A)=质子数(Z)+中子数(N)
X
A
Z
——元素符号
质量数 ——
质子数 ——
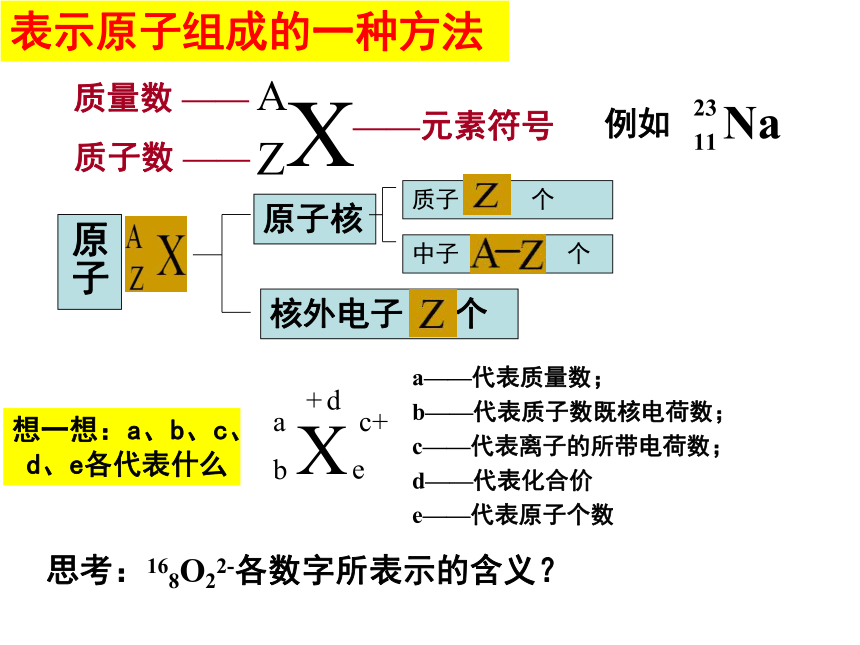
表示原子组成的一种方法
Na
23
11
例如
a
b
+
d
X
c+
e
a——代表质量数;
b——代表质子数既核电荷数;
c——代表离子的所带电荷数;
d——代表化合价
e——代表原子个数
思考:168O22-各数字所表示的含义?
原子核
核外电子 个
质子 个
中子 个
原子
想一想:a、b、c、
d、e各代表什么
练习:
微粒 质量数 质子数 中子数 电子数 所带电荷
32
17 18 17
a b
H
S2-
Na+
18
16
16
35
12
10
1
1
23
Cl
35
17
【思考】到目前为止,人类已经发现的元素有112种,也就是发现了112种原子(或一种元素对应只有一种原子),对吗?
Xn-
a+b
a
a+n
a+b
不是所有的原子都由质子、中子、电子构成
1
1
0
1
0
+1
-2
0
-n
23
11
P4 “观察思考”
1. 氕、氘、氚的原子结构有何异同,如何用符号表示这三种原子?
2.它们属于同一种元素吗?
原 子 氕( ) 氘( ) 氚( )
俗 称 氢 重氢 超重氢
符 号 H D T
质子数 1 1 1
中子数 0 1 2
质量数 1 2 3
H
1
1
元素:具有相同核电荷数(质子数)的同一类原子的总称。
核素:具有相同数目的质子和相同数目的中子的一类原子。
同位素:质子数相同而中子数不同的同一元素的不同核素(原子)互为同位素。(在元素周期表占同一位置)
2、元素、核素、同位素
元素
同位素
核素1
核素n
…
注意:1、一种元素可以有多种核素,也可以只有一种核素;有多少种核素就有多少种原子。
2、多数元素都有同位素,所以核素(原子)的种类总是大于元素的种类。元素只有100多种,而核素有1800余种。
深度思考--- p3
同位素特征:
a.同位素的化学性质几乎相同,物理性质有差异。
b.同种元素的不同的同位素原子也可组成不同的单质或化合物的分子。
如 单质:H2、D2、T2、H-D、H-T、D-T
化合物:H2O、D2O、T2O、HDO、DTO
c.在天然存在的某种元素里,不论是游离态还是化合态,同位素相互之间保持一定的 比率。(某种核素在这种 元素的所有天然核素中所占的比例一般为定值——丰度)
常见同位素的用途:(同位素与用途之间连线)
知识拓展:几种相对原子质量和近似相对原子质量
(1)原子(核素)的相对原子质量
一个原子的实际质量与一个12C原子质量的1/12的比值
氯元素的核素(原子) 35Cl 37Cl
相对原子质量 34.97 36.97
丰度(原子个数的百分含量) 75.77% 24.23%
(2)元素的相对原子质量
按天然元素的各种核素的相对原子质量及其原子百分比算 出来的平均值。
各种核素的相对原子质量分别与各种核素在自然界中的丰度(某种核素在这种元素的所有天然核素中所占的比例(原子个数百分比))的乘积之和。
34.97×75.77%+36.97×24.23%≈35.45。
(4)元素的近似相对原子质量
用核素的质量数替代其相对原子质量进行计算
(3)原子(核素)的近似相对原子质量
原子的相对原子质量的近似整数值,数值上等于该原子的质量数
氯元素的核素(原子) 35Cl 37Cl
质量数 35 37
相对原子质量 34.97 36.97
近似相对原子质量 35 37
丰度(原子个数的百分含量) 75.77% 24.23%
35×75.77%+37×24.23%≈35.48
同位素与同素异形体的对比
同位素 同素异形体
对象 原子 单质
定义 质子数相同,中子数不同的同一元素的不同核素 由同种元素组成的结构和性质不同的单质
实例 11H、21H、31H 金刚石与石墨
氧气与臭氧
性质 物理性质差异较大; 化学性质基本相同。 物理性质不同;
化学性质相似。
H2、D2、T2、H-D、H-T、D-T
必修2第1章 原子结构与元素周期律
第一节 原子结构
本节核心素养发展目标
1.认识原子结构,了解构成原子的微粒的基本性质,知道质量数A和 的含义,掌握核电荷数、质子数、中子数、质量数之间的相互关系。
2.知道元素、核素、同位素的含义,并能比较它们的不同,促进“宏观辨识与微观探析”化学学科核心素养的发展。
原子
化学变化中的最小微粒是什么?
卢瑟福(英国物理学家)通过α粒子散射实验认识了原子核的存在,提出了核式原子模型――
1.原子中心有一个原子核,它集中了原子全部正电荷和几乎全部质量;
2.原子内部的绝大部分空间都是空荡荡的,带负电荷的电子在核外空间饶核高速运动。
绝大多数α粒子直线通过;
少数α粒子转向;
个别α粒子反弹。
原子核
原子
核外电子
质子
中子
一:原子的构成
1:构成原子的微粒及性质
元素的种类
元素的化学性质
质子的数目决定 。
最外层电子数目决定 。
附:碳-12原子质量的1/12为1.6606×10-27 kg
质子的相对质量 =
质子的实际质量
1.6606×10-27Kg
=1.007
中子的相对质量 =
中子的实际质量
1.6606×10-27Kg
=1.008
相对质量
阅读教材P3 “交流研讨” ,据表中数据并回答下列问题
微 粒 电 子 质 子 中 子
质量(kg) 9.109×10-31 1.673×10-27 1.675×10-27
相对质量 0.005484 1.007 1.008
电量/C 1.602×10-19 1.602×10-19 0
电荷 -1 +1 0
1)在原子中质子数、核电荷数、核外电子数之间存在什么关系?
2)原子的质量由主要哪些微粒决定?
3)如果忽略电子的质量,质子、中子的相对质量分别取其近似整数值,那么,原子的相对质量与质子数、中子数有什么关系?
关系式1:电性关系
对原子:核电荷数=质子数=核外电子数=原子序数
思考:如果是阴、阳离子,又具有怎样的电性关系
原子
得e-
阴离子
失e-
阳离子
核外电子数=质子数+所带电荷数
核外电子数>质子数
粒子符号 质子数 电子数
①S2-
②Na+
16
18
11
10
核外电子数=质子数-所带电荷数
核外电子数<质子数
注意:(1)质量数是一种原子的质量数,不是元素的质量数。一种元素可以有多种不同的原子,每种原子都有自己的质量数(如146C、136C、126C)。
(2)在数值上:原子的相对原子质量≈质量数
关系式2:质量关系
原子的质量几乎全部集中在原子核上,也就是说,原子的质量可以看作原子核中质子和中子的质量之和。
定义:人们将原子核内质子数和中子数的之和称为质量数。
2:质量数
质量数(A)=质子数(Z)+中子数(N)
X
A
Z
——元素符号
质量数 ——
质子数 ——
表示原子组成的一种方法
Na
23
11
例如
a
b
+
d
X
c+
e
a——代表质量数;
b——代表质子数既核电荷数;
c——代表离子的所带电荷数;
d——代表化合价
e——代表原子个数
思考:168O22-各数字所表示的含义?
原子核
核外电子 个
质子 个
中子 个
原子
想一想:a、b、c、
d、e各代表什么
练习:
微粒 质量数 质子数 中子数 电子数 所带电荷
32
17 18 17
a b
H
S2-
Na+
18
16
16
35
12
10
1
1
23
Cl
35
17
【思考】到目前为止,人类已经发现的元素有112种,也就是发现了112种原子(或一种元素对应只有一种原子),对吗?
Xn-
a+b
a
a+n
a+b
不是所有的原子都由质子、中子、电子构成
1
1
0
1
0
+1
-2
0
-n
23
11
P4 “观察思考”
1. 氕、氘、氚的原子结构有何异同,如何用符号表示这三种原子?
2.它们属于同一种元素吗?
原 子 氕( ) 氘( ) 氚( )
俗 称 氢 重氢 超重氢
符 号 H D T
质子数 1 1 1
中子数 0 1 2
质量数 1 2 3
H
1
1
元素:具有相同核电荷数(质子数)的同一类原子的总称。
核素:具有相同数目的质子和相同数目的中子的一类原子。
同位素:质子数相同而中子数不同的同一元素的不同核素(原子)互为同位素。(在元素周期表占同一位置)
2、元素、核素、同位素
元素
同位素
核素1
核素n
…
注意:1、一种元素可以有多种核素,也可以只有一种核素;有多少种核素就有多少种原子。
2、多数元素都有同位素,所以核素(原子)的种类总是大于元素的种类。元素只有100多种,而核素有1800余种。
深度思考--- p3
同位素特征:
a.同位素的化学性质几乎相同,物理性质有差异。
b.同种元素的不同的同位素原子也可组成不同的单质或化合物的分子。
如 单质:H2、D2、T2、H-D、H-T、D-T
化合物:H2O、D2O、T2O、HDO、DTO
c.在天然存在的某种元素里,不论是游离态还是化合态,同位素相互之间保持一定的 比率。(某种核素在这种 元素的所有天然核素中所占的比例一般为定值——丰度)
常见同位素的用途:(同位素与用途之间连线)
知识拓展:几种相对原子质量和近似相对原子质量
(1)原子(核素)的相对原子质量
一个原子的实际质量与一个12C原子质量的1/12的比值
氯元素的核素(原子) 35Cl 37Cl
相对原子质量 34.97 36.97
丰度(原子个数的百分含量) 75.77% 24.23%
(2)元素的相对原子质量
按天然元素的各种核素的相对原子质量及其原子百分比算 出来的平均值。
各种核素的相对原子质量分别与各种核素在自然界中的丰度(某种核素在这种元素的所有天然核素中所占的比例(原子个数百分比))的乘积之和。
34.97×75.77%+36.97×24.23%≈35.45。
(4)元素的近似相对原子质量
用核素的质量数替代其相对原子质量进行计算
(3)原子(核素)的近似相对原子质量
原子的相对原子质量的近似整数值,数值上等于该原子的质量数
氯元素的核素(原子) 35Cl 37Cl
质量数 35 37
相对原子质量 34.97 36.97
近似相对原子质量 35 37
丰度(原子个数的百分含量) 75.77% 24.23%
35×75.77%+37×24.23%≈35.48
同位素与同素异形体的对比
同位素 同素异形体
对象 原子 单质
定义 质子数相同,中子数不同的同一元素的不同核素 由同种元素组成的结构和性质不同的单质
实例 11H、21H、31H 金刚石与石墨
氧气与臭氧
性质 物理性质差异较大; 化学性质基本相同。 物理性质不同;
化学性质相似。
H2、D2、T2、H-D、H-T、D-T
