2022-2023学年苏教版2019高中化学必修1 专题2 研究物质的基本方法 第三单元 第2课时 原子核外电子排布 课件(62张PPT)
文档属性
| 名称 | 2022-2023学年苏教版2019高中化学必修1 专题2 研究物质的基本方法 第三单元 第2课时 原子核外电子排布 课件(62张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 961.3KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-07-15 20:00:25 | ||
图片预览











文档简介
(共62张PPT)
第2课时
DIERKESHI
核外电子排布 / 元素性质与原子核外电子排布的关系 / 随堂演练 知识落实 / 课时对点练
原子核外电子排布
专题2
核心素养
发展目标
1.了解原子核外电子的运动特点。
2.掌握原子核外电子的排布规律。
3.能用原子(离子)结构示意图表示常见原子(离子)的核外电子排布。
4.掌握元素性质与原子核外电子排布的关系。
内容索引
一、核外电子排布
二、元素性质与原子核外电子排布的关系
随堂演练 知识落实
课时对点练
核外电子排布
一
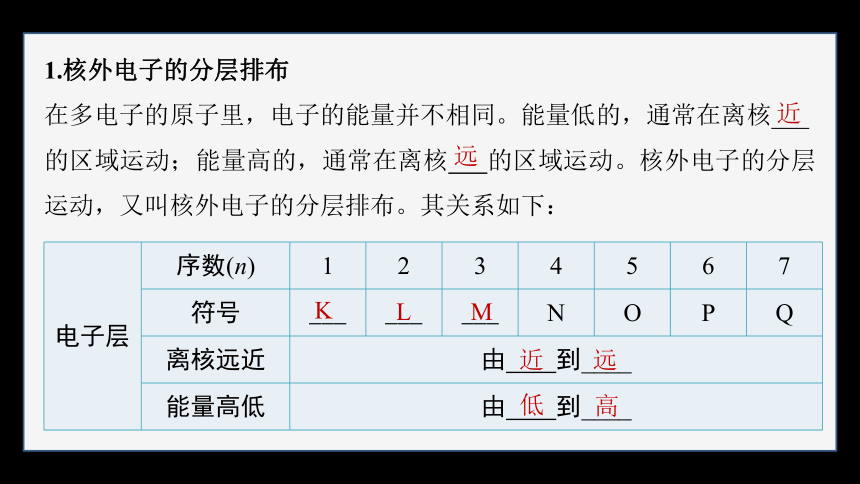
1.核外电子的分层排布
在多电子的原子里,电子的能量并不相同。能量低的,通常在离核___
的区域运动;能量高的,通常在离核 的区域运动。核外电子的分层运动,又叫核外电子的分层排布。其关系如下:
近
远
电子层 序数(n) 1 2 3 4 5 6 7
符号 ___ ___ ___ N O P Q
离核远近 由 到____ 能量高低 由 到____ K
L
M
近
低
远
高
2.原子核外电子排布的一般规律
能量最低
由内向外
能量较高
2n2
8
2
18
32
3.核外电子排布的表示方法——原子结构示意图
(1)钠原子的结构示意图如下,请注明其意义:
电子层
原子核
电子数
核电荷数
(2)离子结构示意图
①阳离子:元素的原子失去最外层所有电子变为离子时,电子层数减少一层,形成与上一周期稀有气体元素原子相同的电子层结构,其核外电子数= 。
如
质子数-所带电荷数
②阴离子:元素的原子得到电子变成简单阴离子时,形成和同周期稀有气体元素原子相同的电子层结构,其核外电子数=___________
。
如
质子数+
所带电荷数
(1)电子的能量越低,运动区域离核越远( )
(2)Mg2+、O2-、Ne电子层排布相同,所含电子总数相等( )
(3)钾原子的结构示意图为 ( )
(4)M层为最外层时,最多容纳18个电子( )
(5)原子的次外层电子数都为8( )
×
√
×
正误判断
×
×
应用体验
1.某元素原子的原子核外有三个电子层,最外层电子数是4,该原子核内的质子数是
A.14 B.15 C.16 D.17
√
由题知,该原子的结构示意图为 ,故选A。
2.X、Y、Z为1~18号元素中的三种元素,X原子的最外层电子数是次外层电子数的2倍,Y原子的次外层电子数是最外层电子数的2倍,Z原子的次外层电子数是最外层电子数的4倍。则X、Y、Z三种元素可能的组合是
A.C、Si、Mg B.Li、C、Mg
C.C、Mg、Li D.C、O、Mg
√
1~18号元素中最外层电子数是次外层电子数的2倍的元素是C,次外层电子数是最外层电子数2倍的有Li和Si,次外层电子数是最外层电子数4倍的是Mg。
3.根据下列叙述,画出对应微粒的结构示意图。
(1)A元素原子的最外层电子数为电子层数的3倍:________。
(2)与Ar原子电子层结构相同的-1价阴离子:________。
(3)质量数为23、中子数为12的原子:_______。
返回
元素性质与原子核外电子排布的关系
二
1.原子结构与原子核外电子排布的关系
(1)活泼金属元素原子的最外层电子数 ,容易 电子,形成稳定的电子层结构。
(2)活泼非金属元素原子的最外层电子数 ,容易 电子,形成稳定的电子层结构。
较少 失去
较多 得到
2.元素化合价与核外电子排布的关系
(1)填写下表空格
元素 最外层 电子数 氯化物和氧 化物化学式 失去或得到 的电子数 化合物中
的化合价
Na ___ 、______ ___ ____
Mg ___ 、_____ ___ ____
O ___ — ___ ____
Cl ___ — ___ ____
NaCl
Na2O
MgCl2
MgO
1
1
1
2
2
2
6
7
+1
+2
-2
-1
(2)结论:①活泼金属元素原子在反应中,一般失去电子,形成阳离子,在生成的化合物中呈现 化合价;
②活泼非金属元素原子在反应中,一般得到电子,形成阴离子,在生成的化合物中呈现 化合价。
正
负
(1)元素的化学性质主要取决于原子的最外层电子排布( )
(2)最外层电子数是次外层电子数2倍的元素的原子容易失去电子成为阳离子
( )
(3)S原子的最外层电子数为6,故其最高正价为+6 ( )
(4)Na+的结构示意图为 ,最外层达到8电子稳定结构,不易得失电子
( )
(5)稀有气体元素原子最外层电子都达到2或8个,所以稀有气体都很稳定
( )
√
×
正误判断
√
√
√
应用体验
1.下列说法正确的是
A.某微粒核外电子排布为2、8、8结构,则该微粒一定是氩原子
B.最外层电子达到稳定结构的微粒只能是稀有气体的原子
C.F-、Na+、Mg2+、Al3+是与Ne原子具有相同电子层结构的离子
D.某元素原子的最外层只有2个电子,则该元素一定是金属元素
√
电子排布为2、8、8结构的微粒还可能为S2-、Cl-等,A项错误;
O2-、F-、Cl-、Li+、Na+、Mg2+等微粒最外层电子数均达到了稳定结构,B项错误;
F-、Na+、Mg2+、Al3+核外电子排布均为2、8结构,与Ne原子的电子层结构相同,C项正确;
He原子的最外层只有2个电子,但He元素是稀有气体元素,不是金属元素,D项错误。
2.观察下列A、B、C、D、E五种粒子(原子或离子)的结构示意图,回答有关问题:
(1)属于离子结构示意图的是_____、_____(填字母,下同)。
B E
根据结构示意图可知A是氯原子,B是氧离子,C是氖原子,D是钠原子,E是镁离子。
结构示意图中质子数与核外电子数不相等的是离子。
(2)性质最稳定的原子是_____,最容易失去电子的原子是_____,最容易得到电子的原子是_____。
C D
稀有气体元素原子最外层已达到稳定结构,性质最稳定;金属元素的原子易失去电子,非金属元素的原子易得到电子。
A
(3)A、D两种元素形成的化合物在水溶液中的电离方程式:__________________。
NaCl===Na++Cl-
A、D两种元素形成的化合物为NaCl,NaCl在水溶液中电离出钠离子和氯离子,电离方程式为NaCl===Na++Cl-。
(4)在核电荷数1~18的元素内,列举两个与B核外电子层排布相同的离子,写出离子的符号:_____、_______________。
F- Al3+(合理即可)
核外有10个电子的离子有氧离子、氟离子、钠离子、镁离子、铝离子等。
归纳总结
(1)元素的化学性质主要取决于原子的最外层电子排布,元素化合价的数值也与原子的电子层结构特别是最外层电子数有关。
(2)通常把最外层有8个电子(最外层为K层时,只有2个电子)的结构,称为相对稳定结构。稀有气体的原子就是上述结构,一般不与其他物质发生化学反应。在化学反应中,不稳定结构总是通过各种方式(如得失电子、共用电子对等)趋向达到相对稳定结构。
返回
随堂演练 知识落实
1.下列叙述正确的是
A.两种微粒若核外电子排布相同,则其化学性质一定相同
B.单原子形成的离子一定有稀有气体元素原子的核外电子排布
C.两种原子的核外电子排布相同,则一定属于同种元素
D.存在两种质子数和电子数均相同的阳离子和阴离子
√
1
2
3
4
1
2
3
4
两种微粒,核外电子排布相同,核电荷数不一定相同,则化学性质不一定相同,如O2-、F-、Ne、Na+、Mg2+的核外电子排布相同,但化学性质不同,A错误;
有些单原子形成的离子并不一定具有稀有气体元素原子的核外电子排布,如H+,B错误;
核外电子排布相同的原子,其质子数必相等,则一定属于同种元素,C正确;
质子数和电子数均分别相同,则粒子所带的电荷数必相等,不可能一个是阳离子(带正电荷),一个是阴离子(带负电荷),D错误。
2.下列微粒的表达式正确的是
A.铍原子的结构示意图: B.S2-的结构示意图:
C.氟原子的结构示意图: D.Na+的结构示意图:
1
2
3
4
√
A项,铍原子为4号元素;
C项,为氟离子;
D项,钠原子的质子数应该为11。
3.今有A、B两种原子,A原子的M层比B原子的M层少3个电子,B原子的L层电子数恰为A原子L层电子数的2倍,A和B分别是
A.硅原子和钠原子 B.硼原子和氢原子
C.氯原子和碳原子 D.碳原子和铝原子
√
1
2
3
4
1
2
3
4
设A原子L、M层电子数分别为x、y,依题意,A、B两原子的电子层结构为
电子层 原子 K L M
A原子 2 x y
B原子 2 2x y+3
B原子的M层至少有3个电子,因而其L层的电子数必然是8,求得x=4。
对A原子来说,L层有4个电子时只能是最外层,即y=0,y+3=3。
因此,这两个原子分别为碳原子和铝原子,故D项正确。
4.写出1~18号元素中符合下列条件的原子(或离子)的微粒符号,并画出其结构示意图。
(1)某元素原子L层上的电子数为K层的3倍:_________。
(2)某元素原子L层上的电子数为K层的一半:___________。
(3)某元素原子得到2个电子后所形成的电子总数与氩原子的电子总数
相同的离子:___________。
1
2
3
4
O:
Li:
S2-:
(4)某元素原子的最外层电子数等于次外层电子数的2倍:_________。
1
2
3
4
C:
返回
课时对点练
题组一 原子核外电子排布
1.下列说法一定错误的是
A.某原子K层上只有1个电子
B.某原子M层上电子数为L层电子数的4倍
C.某离子M层上和L层上的电子数均为K层的4倍
D.某离子的核电荷数与最外层电子数相等
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
K、L、M层上最多容纳的电子数分别为2、8、18,K层上可以有1~2个电子,A正确;
当M层上排有电子时,L层上一定排满电子,即L层上的电子数为8,由于18<8×4,故B错误;
当K、L层排满电子,即电子数分别是2、8时,M层上的电子数也可以是8,例如Cl-、K+均属于这种情况,C正确;
O2-的核电荷数与最外层电子数均为8,故D正确。
2.具有下列结构示意图的微粒,既可以是原子又可以是阴离子和阳离子的是
A. B.
C. D.
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
A项,x=13,为铝原子,不符合题意;
B项,只能为氮原子,x=7;
C项,若x=18,为氩原子,若x=17,为Cl-,若x=19,为K+,符合题意;
D项,只能为氯原子,x=17,不符合题意。
3.某元素的原子结构示意图为 ,下列关于该元素的说法错误的是
A.它的阳离子带3个单位正电荷
B.它是一种金属元素
C.它的阳离子有10个质子
D.其原子核外有13个电子
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
题给原子结构示意图是铝原子的结构示意图,铝原子失去3个电子形成铝离子,铝离子带3个单位正电荷,A正确;
铝是金属元素,B正确;
铝离子的质子数与铝原子相同,为13个,C错误;
从题图看出该原子核外有13个电子,D正确。
4.下列离子中,所带电荷数与该离子的核外电子层数相等的是
A.Al3+ B.Mg2+ C.Be2+ D.H+
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
四种离子的核外电子层数分别是2、2、1、0。
5.(2022·全国高一单元测试)下列叙述错误的是
A.原子最外层电子数不超过8个
B.原子中易失去的电子能量一定最低
C.原子的次外层电子数不超过18个
D.M层电子的能量比L层电子的能量高
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
原子结构中最外层电子数不超过8个,次外层不超过18个,倒数第三层不超过32个,A、C项正确;
能量越高的电子在离核越远的区域内运动,也就越容易失去,B项错误;
离核越远,电子能量越高,因此M层电子的能量比L层电子的能量高,D项正确。
题组二 原子结构与元素性质的关系
6.下列结构示意图表示的原子中,易变为阳离子并能够与氯离子组成XY2型化合物的是
A. B.
C. D.
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
A是非金属元素氧的原子结构示意图,其形成的离子是阴离子;
B是稀有气体氖的原子结构示意图,其不易变为离子;
C是金属元素钠的原子结构示意图,其形成的离子是Na+,Na+与Cl-组成的化合物是NaCl;
D是金属元素镁的原子结构示意图,其形成的离子是Mg2+,Mg2+与Cl-组成的化合物是MgCl2。
7.根据下列结构示意图判断,化学性质最稳定的是
A. B.
C. D.
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
最外层电子数决定元素的化学性质,当最外层电子数大于或等于4且小于8时,易得到电子;
当最外层电子数小于4时,易失去电子;
当最外层电子数等于8时,处于稳定结构。
当然解题时还要注意特例:稀有气体中的氦,最外层只有2个电子,但为稳定结构。
8.核电荷数为1~18的元素中,下列叙述正确的是
A.最外层只有6个电子的元素最高正价为+6价
B.核电荷数是7的元素原子容易获得1个电子
C.原子核外各层电子数相等的元素一定是金属元素
D.最外层只有4个电子的元素一定是金属元素
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
核电荷数为1~18的元素中,最外层只有6个电子的元素有氧和硫,氧无最高正价,A项错误;
核电荷数是7的元素为氮元素,它容易获得3个电子而达到稳定结构,B项错误;
原子核外各层电子数相等的元素为铍元素,它是金属元素,C项正确;
最外层有4个电子的元素有碳和硅,它们均是非金属元素,D项错误。
9.下列关于Fe、Fe2+、Fe3+的说法正确的是
①它们的质子数不同 ②它们的核外电子排布不同 ③它们的最外层电子数不同 ④它们的相对原子质量相同 ⑤它们的化学性质相同 ⑥它们是同种元素
A.①③⑤⑥ B.②④⑤⑥
C.②③④⑥ D.①②③⑥
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
Fe、Fe2+、Fe3+属于同种元素的不同粒子,因为核外电子排布不同,所以它们的化学性质不同。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
10.(2022·江苏高一上检测)两种元素原子X和Y,Y原子的第三层比氩原子的第三层少6个电子,Y原子的第二层电子数恰好为X原子第二层电子数的2倍,则X、Y的质子数分别为
A.14和12 B.6和12
C.12和6 D.8和12
√
Y原子的第三层比氩原子的第三层少6个电子,则Y是Mg元素,Y原子的第二层电子数恰好为X原子第二层电子数的2倍,
则X原子第二层有4个电子,X是碳元素,故B项正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
11.不符合原子核外电子排布基本规律的是
A.核外电子总是优先排在能量最低的电子层上
B.K层是能量最低的电子层
C.N电子层为次外层时,最多可容纳的电子数为18
D.各电子层(n)最多可容纳的电子数为n2
√
K层离原子核最近,能量最低,B正确;
次外层电子数不超过18,C正确;
各电子层(n)最多容纳的电子数为2n2,D错误。
12.A元素的原子最外层电子数是a,次外层电子数是b;B元素的原子M层电子数是a-b,L层电子数是a+b,则A、B两元素形成化合物的化学式最可能表示为
A.B3A2 B.BA2
C.A3B2 D.AB2
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
因为B的L层电子数为a+b且有M层,所以a+b=8,
又因A原子最外层电子数为a,次外层电子数为b,且满足a+b=8,所以A原子有两个电子层,
且K层为2个电子,L层为6个电子,所以a=6,b=2。
进而推知B的各电子层上的电子数分别为2、8、4。即A为O,B为Si。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
13.下列说法正确的是
A.某单核粒子的核外电子排布为 ,则该微粒一定是Ne
B.原子最外层只有1个电子的元素一定是金属元素
C. 与H3O+具有相同的质子数和电子数
D.最外层电子数是次外层电子数2倍的原子容易失去电子成为阳离子
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
A项中的微粒还可以是Na+、Mg2+、F-、O2-等,错误;
D项中最外层电子数是次外层电子数2倍的元素是碳元素,而碳元素的原子最外层有4个电子,既难得到电子,也难失去电子,错误。
14.有A、B、C、D、E五种微粒。已知:
①当A微粒失去3个电子后,其电子层结构与氖原子相同;
②当B微粒得到1个电子后,其电子层结构与氩原子相同;
③C微粒带两个单位正电荷,核电荷数为12;
④D微粒有18个电子,当失去2个电子后显电中性;
⑤E微粒不带电,原子核中只有一个质子。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
请回答:
(1)写出这五种微粒的化学符号:
A_______,B_______,C_______,D_______,E_______。
(2)B微粒的结构示意图为________,C微粒的结构示意图为_______。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
Al Cl Mg2+ S2- H
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
氖原子核外有10个电子,故A的核外有13个电子,A为Al;
氩原子核外有18个电子,B微粒得到1个电子后核外有18个电子,故B为Cl;
C为Mg2+;
D微粒有18个电子,失去2个电子后显电中性,故D为S2-;
E原子核内只有一个质子,故E为H。
15.有A、B、C三种元素,核电荷数均小于18。已知A元素原子的核电荷数大于B元素原子的核电荷数,但两种元素的原子具有相同数目的电子层,A元素最外层电子数为B元素最外层电子数的两倍,A元素原子第三层电子数为第一层电子数的三倍,C元素原子的核电荷数是电子层数的4倍,其质子数为最外层电子数的6倍。请回答下列问题:
(1)A的原子结构示意图:________;A元素的名称:______。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
硫
(2)B的原子结构示意图:_________;B元素的名称:______。
(3)C的离子结构示意图:_______;C元素的符号:______。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
铝
Mg
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
因为最内层最多容纳2个电子,又已知A元素第三层电子数是第一层电子数的3倍,所以第三层电子数为2×3=6,则A为硫;
又A、B两种元素的原子具有相同数目的电子层,且B元素最外层的电子数为 =3,则B为铝。
已知C元素原子的核电荷数是电子层数的4倍,质子数为最外层电子数的6倍,4与6的最小公倍数为12,可见该元素原子的核内质子数应为12的倍数,又因为核电荷数小于18,故为Mg元素。
返回
第2课时
DIERKESHI
核外电子排布 / 元素性质与原子核外电子排布的关系 / 随堂演练 知识落实 / 课时对点练
原子核外电子排布
专题2
核心素养
发展目标
1.了解原子核外电子的运动特点。
2.掌握原子核外电子的排布规律。
3.能用原子(离子)结构示意图表示常见原子(离子)的核外电子排布。
4.掌握元素性质与原子核外电子排布的关系。
内容索引
一、核外电子排布
二、元素性质与原子核外电子排布的关系
随堂演练 知识落实
课时对点练
核外电子排布
一
1.核外电子的分层排布
在多电子的原子里,电子的能量并不相同。能量低的,通常在离核___
的区域运动;能量高的,通常在离核 的区域运动。核外电子的分层运动,又叫核外电子的分层排布。其关系如下:
近
远
电子层 序数(n) 1 2 3 4 5 6 7
符号 ___ ___ ___ N O P Q
离核远近 由 到____ 能量高低 由 到____ K
L
M
近
低
远
高
2.原子核外电子排布的一般规律
能量最低
由内向外
能量较高
2n2
8
2
18
32
3.核外电子排布的表示方法——原子结构示意图
(1)钠原子的结构示意图如下,请注明其意义:
电子层
原子核
电子数
核电荷数
(2)离子结构示意图
①阳离子:元素的原子失去最外层所有电子变为离子时,电子层数减少一层,形成与上一周期稀有气体元素原子相同的电子层结构,其核外电子数= 。
如
质子数-所带电荷数
②阴离子:元素的原子得到电子变成简单阴离子时,形成和同周期稀有气体元素原子相同的电子层结构,其核外电子数=___________
。
如
质子数+
所带电荷数
(1)电子的能量越低,运动区域离核越远( )
(2)Mg2+、O2-、Ne电子层排布相同,所含电子总数相等( )
(3)钾原子的结构示意图为 ( )
(4)M层为最外层时,最多容纳18个电子( )
(5)原子的次外层电子数都为8( )
×
√
×
正误判断
×
×
应用体验
1.某元素原子的原子核外有三个电子层,最外层电子数是4,该原子核内的质子数是
A.14 B.15 C.16 D.17
√
由题知,该原子的结构示意图为 ,故选A。
2.X、Y、Z为1~18号元素中的三种元素,X原子的最外层电子数是次外层电子数的2倍,Y原子的次外层电子数是最外层电子数的2倍,Z原子的次外层电子数是最外层电子数的4倍。则X、Y、Z三种元素可能的组合是
A.C、Si、Mg B.Li、C、Mg
C.C、Mg、Li D.C、O、Mg
√
1~18号元素中最外层电子数是次外层电子数的2倍的元素是C,次外层电子数是最外层电子数2倍的有Li和Si,次外层电子数是最外层电子数4倍的是Mg。
3.根据下列叙述,画出对应微粒的结构示意图。
(1)A元素原子的最外层电子数为电子层数的3倍:________。
(2)与Ar原子电子层结构相同的-1价阴离子:________。
(3)质量数为23、中子数为12的原子:_______。
返回
元素性质与原子核外电子排布的关系
二
1.原子结构与原子核外电子排布的关系
(1)活泼金属元素原子的最外层电子数 ,容易 电子,形成稳定的电子层结构。
(2)活泼非金属元素原子的最外层电子数 ,容易 电子,形成稳定的电子层结构。
较少 失去
较多 得到
2.元素化合价与核外电子排布的关系
(1)填写下表空格
元素 最外层 电子数 氯化物和氧 化物化学式 失去或得到 的电子数 化合物中
的化合价
Na ___ 、______ ___ ____
Mg ___ 、_____ ___ ____
O ___ — ___ ____
Cl ___ — ___ ____
NaCl
Na2O
MgCl2
MgO
1
1
1
2
2
2
6
7
+1
+2
-2
-1
(2)结论:①活泼金属元素原子在反应中,一般失去电子,形成阳离子,在生成的化合物中呈现 化合价;
②活泼非金属元素原子在反应中,一般得到电子,形成阴离子,在生成的化合物中呈现 化合价。
正
负
(1)元素的化学性质主要取决于原子的最外层电子排布( )
(2)最外层电子数是次外层电子数2倍的元素的原子容易失去电子成为阳离子
( )
(3)S原子的最外层电子数为6,故其最高正价为+6 ( )
(4)Na+的结构示意图为 ,最外层达到8电子稳定结构,不易得失电子
( )
(5)稀有气体元素原子最外层电子都达到2或8个,所以稀有气体都很稳定
( )
√
×
正误判断
√
√
√
应用体验
1.下列说法正确的是
A.某微粒核外电子排布为2、8、8结构,则该微粒一定是氩原子
B.最外层电子达到稳定结构的微粒只能是稀有气体的原子
C.F-、Na+、Mg2+、Al3+是与Ne原子具有相同电子层结构的离子
D.某元素原子的最外层只有2个电子,则该元素一定是金属元素
√
电子排布为2、8、8结构的微粒还可能为S2-、Cl-等,A项错误;
O2-、F-、Cl-、Li+、Na+、Mg2+等微粒最外层电子数均达到了稳定结构,B项错误;
F-、Na+、Mg2+、Al3+核外电子排布均为2、8结构,与Ne原子的电子层结构相同,C项正确;
He原子的最外层只有2个电子,但He元素是稀有气体元素,不是金属元素,D项错误。
2.观察下列A、B、C、D、E五种粒子(原子或离子)的结构示意图,回答有关问题:
(1)属于离子结构示意图的是_____、_____(填字母,下同)。
B E
根据结构示意图可知A是氯原子,B是氧离子,C是氖原子,D是钠原子,E是镁离子。
结构示意图中质子数与核外电子数不相等的是离子。
(2)性质最稳定的原子是_____,最容易失去电子的原子是_____,最容易得到电子的原子是_____。
C D
稀有气体元素原子最外层已达到稳定结构,性质最稳定;金属元素的原子易失去电子,非金属元素的原子易得到电子。
A
(3)A、D两种元素形成的化合物在水溶液中的电离方程式:__________________。
NaCl===Na++Cl-
A、D两种元素形成的化合物为NaCl,NaCl在水溶液中电离出钠离子和氯离子,电离方程式为NaCl===Na++Cl-。
(4)在核电荷数1~18的元素内,列举两个与B核外电子层排布相同的离子,写出离子的符号:_____、_______________。
F- Al3+(合理即可)
核外有10个电子的离子有氧离子、氟离子、钠离子、镁离子、铝离子等。
归纳总结
(1)元素的化学性质主要取决于原子的最外层电子排布,元素化合价的数值也与原子的电子层结构特别是最外层电子数有关。
(2)通常把最外层有8个电子(最外层为K层时,只有2个电子)的结构,称为相对稳定结构。稀有气体的原子就是上述结构,一般不与其他物质发生化学反应。在化学反应中,不稳定结构总是通过各种方式(如得失电子、共用电子对等)趋向达到相对稳定结构。
返回
随堂演练 知识落实
1.下列叙述正确的是
A.两种微粒若核外电子排布相同,则其化学性质一定相同
B.单原子形成的离子一定有稀有气体元素原子的核外电子排布
C.两种原子的核外电子排布相同,则一定属于同种元素
D.存在两种质子数和电子数均相同的阳离子和阴离子
√
1
2
3
4
1
2
3
4
两种微粒,核外电子排布相同,核电荷数不一定相同,则化学性质不一定相同,如O2-、F-、Ne、Na+、Mg2+的核外电子排布相同,但化学性质不同,A错误;
有些单原子形成的离子并不一定具有稀有气体元素原子的核外电子排布,如H+,B错误;
核外电子排布相同的原子,其质子数必相等,则一定属于同种元素,C正确;
质子数和电子数均分别相同,则粒子所带的电荷数必相等,不可能一个是阳离子(带正电荷),一个是阴离子(带负电荷),D错误。
2.下列微粒的表达式正确的是
A.铍原子的结构示意图: B.S2-的结构示意图:
C.氟原子的结构示意图: D.Na+的结构示意图:
1
2
3
4
√
A项,铍原子为4号元素;
C项,为氟离子;
D项,钠原子的质子数应该为11。
3.今有A、B两种原子,A原子的M层比B原子的M层少3个电子,B原子的L层电子数恰为A原子L层电子数的2倍,A和B分别是
A.硅原子和钠原子 B.硼原子和氢原子
C.氯原子和碳原子 D.碳原子和铝原子
√
1
2
3
4
1
2
3
4
设A原子L、M层电子数分别为x、y,依题意,A、B两原子的电子层结构为
电子层 原子 K L M
A原子 2 x y
B原子 2 2x y+3
B原子的M层至少有3个电子,因而其L层的电子数必然是8,求得x=4。
对A原子来说,L层有4个电子时只能是最外层,即y=0,y+3=3。
因此,这两个原子分别为碳原子和铝原子,故D项正确。
4.写出1~18号元素中符合下列条件的原子(或离子)的微粒符号,并画出其结构示意图。
(1)某元素原子L层上的电子数为K层的3倍:_________。
(2)某元素原子L层上的电子数为K层的一半:___________。
(3)某元素原子得到2个电子后所形成的电子总数与氩原子的电子总数
相同的离子:___________。
1
2
3
4
O:
Li:
S2-:
(4)某元素原子的最外层电子数等于次外层电子数的2倍:_________。
1
2
3
4
C:
返回
课时对点练
题组一 原子核外电子排布
1.下列说法一定错误的是
A.某原子K层上只有1个电子
B.某原子M层上电子数为L层电子数的4倍
C.某离子M层上和L层上的电子数均为K层的4倍
D.某离子的核电荷数与最外层电子数相等
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
K、L、M层上最多容纳的电子数分别为2、8、18,K层上可以有1~2个电子,A正确;
当M层上排有电子时,L层上一定排满电子,即L层上的电子数为8,由于18<8×4,故B错误;
当K、L层排满电子,即电子数分别是2、8时,M层上的电子数也可以是8,例如Cl-、K+均属于这种情况,C正确;
O2-的核电荷数与最外层电子数均为8,故D正确。
2.具有下列结构示意图的微粒,既可以是原子又可以是阴离子和阳离子的是
A. B.
C. D.
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
A项,x=13,为铝原子,不符合题意;
B项,只能为氮原子,x=7;
C项,若x=18,为氩原子,若x=17,为Cl-,若x=19,为K+,符合题意;
D项,只能为氯原子,x=17,不符合题意。
3.某元素的原子结构示意图为 ,下列关于该元素的说法错误的是
A.它的阳离子带3个单位正电荷
B.它是一种金属元素
C.它的阳离子有10个质子
D.其原子核外有13个电子
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
题给原子结构示意图是铝原子的结构示意图,铝原子失去3个电子形成铝离子,铝离子带3个单位正电荷,A正确;
铝是金属元素,B正确;
铝离子的质子数与铝原子相同,为13个,C错误;
从题图看出该原子核外有13个电子,D正确。
4.下列离子中,所带电荷数与该离子的核外电子层数相等的是
A.Al3+ B.Mg2+ C.Be2+ D.H+
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
四种离子的核外电子层数分别是2、2、1、0。
5.(2022·全国高一单元测试)下列叙述错误的是
A.原子最外层电子数不超过8个
B.原子中易失去的电子能量一定最低
C.原子的次外层电子数不超过18个
D.M层电子的能量比L层电子的能量高
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
原子结构中最外层电子数不超过8个,次外层不超过18个,倒数第三层不超过32个,A、C项正确;
能量越高的电子在离核越远的区域内运动,也就越容易失去,B项错误;
离核越远,电子能量越高,因此M层电子的能量比L层电子的能量高,D项正确。
题组二 原子结构与元素性质的关系
6.下列结构示意图表示的原子中,易变为阳离子并能够与氯离子组成XY2型化合物的是
A. B.
C. D.
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
A是非金属元素氧的原子结构示意图,其形成的离子是阴离子;
B是稀有气体氖的原子结构示意图,其不易变为离子;
C是金属元素钠的原子结构示意图,其形成的离子是Na+,Na+与Cl-组成的化合物是NaCl;
D是金属元素镁的原子结构示意图,其形成的离子是Mg2+,Mg2+与Cl-组成的化合物是MgCl2。
7.根据下列结构示意图判断,化学性质最稳定的是
A. B.
C. D.
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
最外层电子数决定元素的化学性质,当最外层电子数大于或等于4且小于8时,易得到电子;
当最外层电子数小于4时,易失去电子;
当最外层电子数等于8时,处于稳定结构。
当然解题时还要注意特例:稀有气体中的氦,最外层只有2个电子,但为稳定结构。
8.核电荷数为1~18的元素中,下列叙述正确的是
A.最外层只有6个电子的元素最高正价为+6价
B.核电荷数是7的元素原子容易获得1个电子
C.原子核外各层电子数相等的元素一定是金属元素
D.最外层只有4个电子的元素一定是金属元素
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
核电荷数为1~18的元素中,最外层只有6个电子的元素有氧和硫,氧无最高正价,A项错误;
核电荷数是7的元素为氮元素,它容易获得3个电子而达到稳定结构,B项错误;
原子核外各层电子数相等的元素为铍元素,它是金属元素,C项正确;
最外层有4个电子的元素有碳和硅,它们均是非金属元素,D项错误。
9.下列关于Fe、Fe2+、Fe3+的说法正确的是
①它们的质子数不同 ②它们的核外电子排布不同 ③它们的最外层电子数不同 ④它们的相对原子质量相同 ⑤它们的化学性质相同 ⑥它们是同种元素
A.①③⑤⑥ B.②④⑤⑥
C.②③④⑥ D.①②③⑥
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
Fe、Fe2+、Fe3+属于同种元素的不同粒子,因为核外电子排布不同,所以它们的化学性质不同。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
10.(2022·江苏高一上检测)两种元素原子X和Y,Y原子的第三层比氩原子的第三层少6个电子,Y原子的第二层电子数恰好为X原子第二层电子数的2倍,则X、Y的质子数分别为
A.14和12 B.6和12
C.12和6 D.8和12
√
Y原子的第三层比氩原子的第三层少6个电子,则Y是Mg元素,Y原子的第二层电子数恰好为X原子第二层电子数的2倍,
则X原子第二层有4个电子,X是碳元素,故B项正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
11.不符合原子核外电子排布基本规律的是
A.核外电子总是优先排在能量最低的电子层上
B.K层是能量最低的电子层
C.N电子层为次外层时,最多可容纳的电子数为18
D.各电子层(n)最多可容纳的电子数为n2
√
K层离原子核最近,能量最低,B正确;
次外层电子数不超过18,C正确;
各电子层(n)最多容纳的电子数为2n2,D错误。
12.A元素的原子最外层电子数是a,次外层电子数是b;B元素的原子M层电子数是a-b,L层电子数是a+b,则A、B两元素形成化合物的化学式最可能表示为
A.B3A2 B.BA2
C.A3B2 D.AB2
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
因为B的L层电子数为a+b且有M层,所以a+b=8,
又因A原子最外层电子数为a,次外层电子数为b,且满足a+b=8,所以A原子有两个电子层,
且K层为2个电子,L层为6个电子,所以a=6,b=2。
进而推知B的各电子层上的电子数分别为2、8、4。即A为O,B为Si。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
13.下列说法正确的是
A.某单核粒子的核外电子排布为 ,则该微粒一定是Ne
B.原子最外层只有1个电子的元素一定是金属元素
C. 与H3O+具有相同的质子数和电子数
D.最外层电子数是次外层电子数2倍的原子容易失去电子成为阳离子
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
A项中的微粒还可以是Na+、Mg2+、F-、O2-等,错误;
D项中最外层电子数是次外层电子数2倍的元素是碳元素,而碳元素的原子最外层有4个电子,既难得到电子,也难失去电子,错误。
14.有A、B、C、D、E五种微粒。已知:
①当A微粒失去3个电子后,其电子层结构与氖原子相同;
②当B微粒得到1个电子后,其电子层结构与氩原子相同;
③C微粒带两个单位正电荷,核电荷数为12;
④D微粒有18个电子,当失去2个电子后显电中性;
⑤E微粒不带电,原子核中只有一个质子。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
请回答:
(1)写出这五种微粒的化学符号:
A_______,B_______,C_______,D_______,E_______。
(2)B微粒的结构示意图为________,C微粒的结构示意图为_______。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
Al Cl Mg2+ S2- H
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
氖原子核外有10个电子,故A的核外有13个电子,A为Al;
氩原子核外有18个电子,B微粒得到1个电子后核外有18个电子,故B为Cl;
C为Mg2+;
D微粒有18个电子,失去2个电子后显电中性,故D为S2-;
E原子核内只有一个质子,故E为H。
15.有A、B、C三种元素,核电荷数均小于18。已知A元素原子的核电荷数大于B元素原子的核电荷数,但两种元素的原子具有相同数目的电子层,A元素最外层电子数为B元素最外层电子数的两倍,A元素原子第三层电子数为第一层电子数的三倍,C元素原子的核电荷数是电子层数的4倍,其质子数为最外层电子数的6倍。请回答下列问题:
(1)A的原子结构示意图:________;A元素的名称:______。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
硫
(2)B的原子结构示意图:_________;B元素的名称:______。
(3)C的离子结构示意图:_______;C元素的符号:______。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
铝
Mg
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
因为最内层最多容纳2个电子,又已知A元素第三层电子数是第一层电子数的3倍,所以第三层电子数为2×3=6,则A为硫;
又A、B两种元素的原子具有相同数目的电子层,且B元素最外层的电子数为 =3,则B为铝。
已知C元素原子的核电荷数是电子层数的4倍,质子数为最外层电子数的6倍,4与6的最小公倍数为12,可见该元素原子的核内质子数应为12的倍数,又因为核电荷数小于18,故为Mg元素。
返回
