2022-2023学年苏教版2019高中化学必修1 专题2 研究物质的基本方法 第一单元 第3课时 物质的检验 物质性质和变化的探究 课件(72张PPT)
文档属性
| 名称 | 2022-2023学年苏教版2019高中化学必修1 专题2 研究物质的基本方法 第一单元 第3课时 物质的检验 物质性质和变化的探究 课件(72张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 3.0MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-07-15 20:02:47 | ||
图片预览











文档简介
(共72张PPT)
第3课时
DISANKESHI
物质的检验 / 物质性质和变化的探究 / 随堂演练 知识落实 / 课时对点练
物质的检验 物质性质和变化的探究
专题2
核心素养
发展目标
1.了解常见物质的检验方法,学会Cl-、
等离子的检验方法。
2.了解常见的仪器分析法,会用焰色反应检验金属或金属离子的存在。
3.能设计简单的实验方案,确定常见物质的组成成分。
4.发展对化学实验探究的兴趣,养成严谨求实的科学态度,增强合作探究和勇于创新的意识。
内容索引
一、物质的检验
二、物质性质和变化的探究
随堂演练 知识落实
课时对点练
物质的检验
一
1.物质检验的方法——特征反应法
二氧化碳
蓝色
特征反应检验法多用于验证性检验,即验证是否存在该物质。
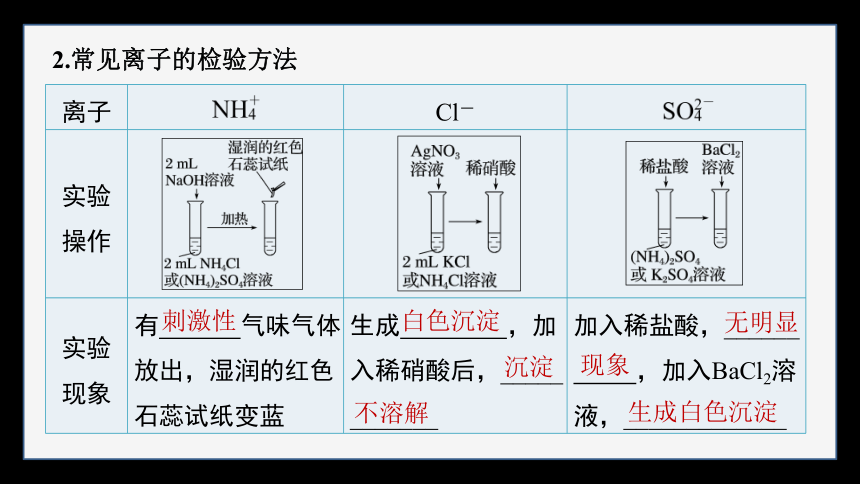
2.常见离子的检验方法
离子 Cl-
实验
操作
实验
现象 有 气味气体放出,湿润的红色石蕊试纸变蓝 生成 ,加入稀硝酸后,_____
_______ 加入稀盐酸,______
,加入BaCl2溶液,_____________
刺激性
白色沉淀
沉淀
不溶解
无明显
现象
生成白色沉淀
化学方程式(各写一个) ________________
________________________ __________________________________ ____________________________________________
NH4Cl+NaOH
+NH3↑
NH4Cl+AgNO3===
AgCl↓+NH4NO3
(NH4)2 SO4+BaCl2
===BaSO4↓+2NH4Cl
特别提醒 离子检验操作常分为以下四步:取样(取待测液)→操作→现象→结论。
3.物质组成元素的检验
(1)焰色反应
①定义:许多 在火焰上灼烧时都会使火焰呈现特殊的颜色,这叫作焰色反应。
②操作
洗——将铂丝(或光洁的铁丝)用稀盐酸洗净
烧——将洗净的铂丝(或铁丝)在火焰上灼烧至无色
蘸——蘸取待测样品(固体或溶液)
烧——在火焰上灼烧,并观察火焰的颜色
洗——再用稀盐酸洗净铂丝(或铁丝),并在火焰上灼烧至无色
金属或它们的化合物
③应用
在中学实验中,焰色反应主要用于检验Na+和K+。
元素 钠 钾 锂 钙 锶 钡
焰色 _____ _____ 紫红色 砖红色 洋红色 _______
黄色
紫色
黄绿色
特别提醒 ①焰色反应是元素的物理性质,如NaCl、Na2CO3、NaOH,无论固体或溶液,焰色反应均为黄色。
②观察钾的焰色时,要透过蓝色钴玻璃观察,这样可以滤去黄光,避免含钠杂质的干扰。可以用铁丝代替铂丝,铁丝灼烧时不呈现特殊颜色。
③五颜六色的烟花也是焰色反应的应用。
(2)仪器分析法
仪器分析法常用来研究物质的元素组成及其结构。
碳、氢、氧、氮、硫、
某些原子团
金属元素
(1)向某溶液中加入氯化钡溶液,若有白色沉淀生成,则溶液中一定含有
( )
(2)某溶液中加入NaOH溶液,湿润的红色石蕊试纸未变色,说明原溶液中不存在 ( )
(3)做焰色反应实验时,可以用盐酸清洗铂丝,但不可以用硫酸( )
(4)对某溶液做焰色反应实验时,未看到紫色,证明无K+( )
×
×
√
×
(1)已知该方案不够严谨,请说明理由。
(2)请你设计一个严谨的方案。
2.有5瓶白色固体试剂,分别是氯化钡、氢氧化钠、硫酸钠、硫酸铵、无水硫酸铜。现只提供蒸馏水,通过下面的实验步骤即可鉴别它们。请填写下列空白:
(1)取适量固体试剂,分别加入5支试管中,加入适量蒸馏水,振荡试管,观察到的现象是_________________________________________________
_______________,被检出的化学物质是____________________。
5种固体全部溶解,4支试管中得到无色溶液,1支试管中得到蓝色溶液 CuSO4(或无水硫酸铜)
(2)分别取未检出的溶液,向其中加入上述已检出的溶液,根据观察到的现象写出相应的化学方程式:
第1支试管中有白色沉淀生成:_________________________________;
第2支试管中有蓝色沉淀生成:___________________________________。
被检出物质的化学式分别是_______、________。
BaCl2+CuSO4===BaSO4↓+CuCl2
2NaOH+CuSO4===Cu(OH)2↓+Na2SO4
BaCl2 NaOH
(3)鉴别余下未检出物质的方法和观察到的现象是_____________________
______________________________________________________________________________________________________________________________________。
分别另取少量未检出的
溶液,向其中加入NaOH溶液并加热,若产生刺激性气味的气体(或使湿润的红色石蕊试纸变蓝的气体),说明该物质是(NH4)2SO4,另一瓶为Na2SO4
将BaCl2、NaOH、Na2SO4、(NH4)2SO4、CuSO4(无水)这五种物质分别加入蒸馏水溶解,这五种物质都能溶于水,且CuSO4溶于水后形成蓝色溶液,其他四种物质溶于水都形成无色溶液,由此可检验出CuSO4;
再将CuSO4溶液滴加到其余四种物质的溶液中:BaCl2+CuSO4===
BaSO4↓(白)+CuCl2,2NaOH+CuSO4===Cu(OH)2↓(蓝)+Na2SO4,Na2SO4+CuSO4(不反应),(NH4)2SO4+CuSO4(不反应),从而又检验出BaCl2和NaOH;
剩余的为Na2SO4、(NH4)2SO4,可利用NaOH溶液再检验出(NH4)2SO4,因为(NH4)2SO4+2NaOH Na2SO4+2H2O+2NH3↑,会产生有刺激性气味或使湿润的红色石蕊试纸变蓝的气体。
归纳总结
物质检验的基本要求
(1)反应要有明显的现象。
(2)排除干扰物的影响。
返回
物质性质和变化的探究
二
1.实验探究物质的性质和变化
(1)CO2的性质和变化
实验
现象 溶液变成红色 气泡逸出,溶液变成 色
结论 有 物质生成 物质________
紫
酸性
酸性
不稳定
(2)通过实验研究铝的性质
实验操作 主要现象 结论
打磨铝片,观察 打磨后为 色 铝是 色金属,铝在空气中易被氧化,形成一层氧化膜:
____________________
加热未打磨的铝片 铝片内部熔融但不下滴 表层有一层Al2O3,且熔点高于Al
单质
银白
银白
4Al+3O2===2Al2O3
铝片均溶解,且均有气泡产生 Al既能与盐酸反应,又能与NaOH溶液反应:2Al+6HCl===2AlCl3+3H2↑、2Al+2NaOH+2H2O===
2NaAlO2+3H2↑
2.设计实验方案探究影响双氧水分解速率的因素(提示:控制单一变量)
实验序号 实验方案 现象 结论
① 气泡产生较慢 实验①②说明浓度越大,H2O2分解速率 ;
实验①③说明温度越高,H2O2分解速率 ;
实验①④说明在MnO2催化作用下,H2O2分解速率______
② 气泡产生非常慢
③ 气泡产生较快
④ 气泡产生非常快
越快
越快
加快
归纳总结
物质变化往往受到多个因素的影响,在研究化学反应与外界因素之间的关系时,对影响物质变化规律的因素或条件加以人为控制,使其他几个因素不变,集中研究其中一个因素的变化所产生的影响,有利于在研究过程中,迅速寻找到物质变化的规律。
(1)化学实验是探究物质性质和变化的主要方法( )
(2)确定要研究的化学问题之后,提出假设,假设是有化学原理作为依据的,不是凭空臆测( )
(3)将CO2通入水中,滴入几滴紫色石蕊试液,溶液变红色,说明CO2的水溶液显酸性( )
(4)铝是金属,只与酸反应,放出H2( )
(5)MnO2在H2O2的分解反应中起催化剂作用,故加入MnO2能加快H2O2的分解速率( )
√
√
×
√
√
草木灰是草本和木本植物燃烧后的残余物,含有碳酸钾,可用作肥料。现有一份草木灰样品,请设计实验检验其中含有碳酸钾。
答案
实验步骤 实验现象 结论
(1)将草木灰样品溶于蒸馏水中 液体浑浊 -
(2)将(1)得到的浑浊液体过滤 得到澄清滤液 -
(3)将滤液加热浓缩 - -
(4)用铂丝蘸取溶液,在酒精灯火焰上灼烧,透过蓝色钴玻璃观察 火焰呈紫色 溶液中含K+
(5)取适量溶液于一个小烧杯中,倒入足量的CaCl2溶液,过滤取滤渣,加入足量的稀盐酸并在烧杯口盖上涂有澄清石灰水的玻璃片 产生白色沉淀,产生大量无色无味的气体,澄清石灰水变浑浊 溶液中含 ,草木灰中含K2CO3
返回
随堂演练 知识落实
1.下列溶液中离子检验的结论正确的是
A.加稀盐酸产生无色无味气体,将气体通入澄清石灰水,石灰水变浑
浊,原溶液可能含有
B.加入BaCl2溶液有白色沉淀产生,再加盐酸,沉淀不溶解,原溶液
一定含有
C.加入AgNO3溶液有白色沉淀产生,原溶液一定含有Cl-
D.加入Na2CO3溶液有白色沉淀产生,再加盐酸,白色沉淀消失,原溶
液一定含有Ba2+
√
1
2
3
4
1
2
3
4
2.某物质灼烧时,焰色反应为黄色,下列判断正确的是
A.该物质一定是钠的化合物 B.该物质一定含钠元素
C.该物质一定是金属钠 D.该物质中不含钾元素
1
2
3
4
√
焰色反应是元素的性质。焰色反应为黄色,说明该物质一定含钠元素,既可能是金属钠,也可能是钠的化合物,B正确。
3.下列实验可实现鉴别目的的是
A.用稀硫酸鉴别银和铝两种金属
B.用硝酸银溶液鉴别氯化钾溶液和氯化钠溶液
C.用二氧化碳鉴别氢氧化钠溶液和氯化钠溶液
D.用氯化钡溶液鉴别硝酸银溶液和碳酸钠溶液
√
1
2
3
4
1
2
3
4
用稀硫酸能鉴别银(不溶解,无气体产生)和铝(能溶解,产生气体);
用硝酸银溶液不能鉴别氯化钾溶液(产生白色沉淀)和氯化钠溶液(产生白色沉淀);
用二氧化碳不能鉴别氢氧化钠溶液(无明显现象)和氯化钠溶液(无明显现象);
用氯化钡溶液不能鉴别硝酸银溶液(产生白色沉淀)和碳酸钠溶液(产生白色沉淀)。
4.有一包白色粉末,其中可能含有硝酸钡、氯化钙、碳酸钾。
现做以下实验:
①将部分粉末加入水中,振荡,有白色沉淀生成;
②向①的悬浊液中加入过量的稀硝酸,白色沉淀消失,并有气泡产生;
③取少量②的溶液滴入硝酸银溶液中,有白色沉淀生成。
根据上述实验现象,回答下列问题:
(1)原白色粉末中肯定含有______________(填化学式)。
1
2
3
4
K2CO3、CaCl2
(2)写出硝酸钡与碳酸钾反应的化学方程式:______________________
_________________。
(3)写出氯化钙与碳酸钾反应的化学方程式:______________________
________。
(4)写出碳酸钙跟硝酸反应的化学方程式:________________________
_____________。
1
2
3
4
Ba(NO3)2+K2CO3===
CaCl2+K2CO3===CaCO3↓
BaCO3↓+2KNO3
+2KCl
CaCO3+2HNO3===Ca(NO3)2
+H2O+CO2↑
1
2
3
4
返回
①将部分粉末加入水中,振荡,有白色沉淀生成,白色沉淀可能是碳酸钡或碳酸钙,一定含有碳酸钾,其余两种中至少含有一种;
②向①的悬浊液中加入过量稀硝酸,白色沉淀消失,并有气泡产生,证明沉淀是碳酸钙或碳酸钡;
③取少量②的溶液滴入硝酸银溶液,有白色沉淀生成,证明含有氯离子,混合物中一定含有氯化钙;说明白色粉末中一定含有碳酸钾、氯化钙,可能含有硝酸钡。
课时对点练
题组一 常见物质的检验
1.下列检验Cl-的方法正确的是
A.向某溶液中滴加AgNO3溶液,若产生白色沉淀说明该溶液中有Cl-
B.向某溶液中先滴加盐酸,再滴加AgNO3溶液,若产生白色沉淀,说
明溶液中有Cl-
C.向某溶液中先滴加AgNO3溶液,产生白色沉淀,再滴加盐酸,沉淀
不消失,说明溶液中有Cl-
D.向某溶液中滴加用HNO3酸化的AgNO3溶液,若产生白色沉淀,说明
溶液中有Cl-
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
加入盐酸,引入Cl-,B、C错误;
2.检验某溶液中是否含有 ,常用的方法是
A.取样,滴加BaCl2溶液,看是否有白色沉淀生成
B.取样,滴加稀盐酸酸化的BaCl2溶液,看是否有白色沉淀生成
C.取样,滴加稀盐酸,无明显现象,再滴加BaCl2溶液,看是否有白色
沉淀生成
D.取样,滴加稀硫酸,再滴加BaCl2溶液,看是否有白色沉淀生成
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
B项中不能排除Ag+的干扰;
3.可以确定溶液中存在 的实验事实是
A.加入硝酸银溶液,有白色沉淀产生
B.加入盐酸,有无色无味气体产生
C.加入氯化钙溶液,有白色沉淀生成,再加稀盐酸,白色沉淀溶解,
产生可使澄清石灰水变浑浊的无色无味气体
D.加入氢氧化钡溶液,有白色沉淀生成,再加稀盐酸,白色沉淀溶解,
产生可使澄清石灰水变浑浊的无色无味气体
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
4.下列离子检验的方法正确的是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
题组二 焰色反应
5.下列对焰色反应的实验操作注意事项的说法正确的是
①先将铂丝灼烧至无色,再蘸取被检验的物质
②每次实验后,要将铂丝用稀盐酸洗净
③实验时最好选择本身颜色较浅的火焰
④没有铂丝时,也可以用光洁无锈的铁丝代替
A.①②④ B.①②③
C.②③④ D.①②③④
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
实验前必须用稀盐酸洗净铂丝,并且在酒精灯(或煤气灯)火焰上灼烧至无色;火焰本身的颜色浅,便于对金属焰色的观察;铂丝、铁丝本身没有焰色,可用于蘸取试样完成实验。
6.下列有关焰色反应实验的叙述正确的是
A.可用铜丝代替铂丝进行实验
B.观察钾的焰色要透过蓝色钴玻璃
C.实验结束后,要用碳酸钠溶液洗净铂丝
D.焰色反应是指金属在加热灼烧时火焰呈现特殊的颜色,是物质的化
学性质
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
铜丝在灼烧时有颜色,不能用铜丝代替铂丝,A项错误;
实验结束后,用盐酸洗净铂丝,C项错误;
焰色反应是指金属元素在灼烧时火焰呈现特殊的颜色,不是化学性质,D项错误。
7.(2022·太原高一检测)下列说法正确的是
A.某物质的焰色为黄色,说明该物质中含有钠元素
B.某物质的焰色不显紫色,说明该物质中肯定不含钾元素
C.焰色反应不能用于物质的鉴别
D.用于焰色反应的金属丝可以是铜丝、光洁无锈的铁丝
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
钠的焰色为黄色,A项正确;
钾的焰色为紫色(必须透过蓝色钴玻璃观察),B项错误;
焰色反应可用于物质的鉴别,如鉴别钠盐和钾盐,C项错误;
焰色反应的金属丝可以用铂丝、光洁无锈的铁丝,但不可以用铜丝,铜的焰色为绿色,会干扰检测,D项错误。
题组三 物质性质和变化的探究
8.控制变量是科学研究的重要方法。相同质量的铁与足量稀硫酸分别在下列条件下发生反应,其中反应放出气体最快的是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
选项 硫酸 反应温度 铁的状态
A 20% 20 ℃ 块状
B 5% 20 ℃ 粉末状
C 10% 40 ℃ 块状
D 20% 40 ℃ 粉末状
√
9.为了探究温度对化学反应速率的影响,下列实验方案可行的是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
A.
B.
C.
D.
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
探究温度对化学反应速率的影响,要求在催化剂相同,H2O2浓度相同,而温度不同的条件下做对比实验,通过产生气泡的快慢来体现温度对化学反应速率的影响。
10.向四支试管中分别加入少量不同的无色溶液进行如下操作,结论正确的是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
选项 操作 现象 结论
A 滴加BaCl2溶液 生成白色沉淀 原溶液中有
B 先滴加足量稀硝酸,再滴入AgNO3溶液 开始无明显现象,后产生白色沉淀 原溶液中有Cl-
C 用洁净铂丝蘸取溶液进行焰色反应 火焰呈黄色 原溶液中有Na+,无K+
D 滴加稀NaOH溶液,将湿润的红色石蕊试纸置于试管口 试纸不变蓝 原溶液中无
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
与BaCl2溶液反应生成的白色沉淀可能是BaSO4、BaCO3或AgCl,A项错误;
黄色火焰可以覆盖钾的紫色火焰,故检验钾需透过蓝色钴玻璃观察火焰颜色,C项错误;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
11.下列各组溶液不用任何试剂就可以鉴别出来的是
A.HCl、AgNO3、Na2CO3、NaOH
B.NH4Cl、AgNO3、CaCl2、HNO3
C.(NH4)2SO4、Na2SO4、NaCl、NH4Cl
D.MgCl2、Na2SO4、NaCl、NH4Cl
√
对各组溶液,分别采用两两混合法进行鉴别。以A组为例,实验现象记录如下表(“↑”表示产生气体、“↓”表示生成沉淀或微溶物,括号内是气体或沉淀的颜色;“—”表示无明显现象)。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
HCl AgNO3 Na2CO3 NaOH
HCl ↓(白) ↑(无) —
AgNO3 ↓(白) ↓(白) ↓(褐)
Na2CO3 ↑(无) ↓(白) —
NaOH — ↓(褐) —
由此可鉴别出AgNO3溶液和NaOH溶液,Na2CO3溶液和盐酸可用“滴加顺序法”加以鉴别;
B项,NH4Cl和CaCl2遇AgNO3均产生白色沉淀,遇HNO3均无现象,可以鉴别出AgNO3和HNO3,但无法鉴别出NH4Cl和CaCl2;
C项和D项,任意两种溶液混合均无明显现象,无法鉴别。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
12.某同学想用实验证明硫酸铜溶液显蓝色与 无关,进行下列实验无意义的是
A.观察硫酸钠溶液没有颜色
B.向硫酸铜溶液中滴加适量的氯化钡溶液,振荡后静置,溶液蓝色未
消失
C.向硫酸铜溶液中滴加适量的氢氧化钠溶液,振荡后静置,溶液蓝色
消失
D.加水稀释硫酸铜溶液,溶液蓝色变浅
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
A做对照实验;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
A.取少量晶体放入试管中,加热,若试管口上蘸有少量无水硫酸铜粉
末的脱脂棉变蓝,则可证明晶体中含有结晶水
B.取少量晶体溶于水,加入少量NaOH溶液,加热,在试管口用湿润的
蓝色石蕊试纸检验,若变红,则可证明晶体的成分中含有
C.取少量晶体溶于水,加适量稀盐酸,无现象,再滴入几滴BaCl2溶液,
有白色沉淀生成,则可证明晶体的成分中含有
D.取少量晶体溶于水,用洁净的铂丝蘸取少量溶液在酒精灯火焰上灼
烧,火焰呈黄色,不能证明晶体中无K+
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
14.(2021·重庆高一期中)对一份稀溶液作初步分析发现,溶液无色、澄清,其中可能含有 、Cl-、Ca2+等离子中的若干种。然后又做了如下实验,以确认这些离子是否大量存在。
①取少量该溶液加入BaCl2溶液有白色沉淀生成,再加入足量盐酸后,沉淀部分溶解,并有气体生成。
②在实验①的溶液中再加入硝酸银溶液,结果又生成了不溶于稀硝酸的白色沉淀。
③用铂丝蘸取少量该溶液置于无色酒精灯火焰上灼烧,火焰呈黄色。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
回答下列问题:
(1)上述实验可以确定溶液中一定含有__________________,一定没有______。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
Ca2+
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
②不能证明含有氯离子,因前面加入的氯化钡溶液中含氯离子;
③说明含Na+。
(2)从以上操作中,不能判断是否存在的离子是_____,为了检验该离子是否存在,请你写出进一步检验的操作步骤和实验现象:________
__________________________________________________________________________________________________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
Cl-
另取少量
原溶液,先加入足量的Ba(NO3)2溶液,过滤,再向滤液中加入硝酸酸化的AgNO3溶液,若有白色沉淀产生,则存在Cl-
根据以上分析可知氯离子不能确定是否存在,需进一步取原溶液检验氯离子的存在,检验时需先排除硫酸根离子和碳酸根离子的干扰。
(3)有同学认为实验③可以省略,你认为呢?________(填“可以”或“不可以”),并说明理由:___________________________________
________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
可以
溶液显电中性,有阴离子存在必有阳离
子存在
根据溶液呈电中性,有阴离子存在必有阳离子存在,又因为钙离子一定不存在,故钠离子一定存在,因此实验③可以省略。
15.实验室里需要纯净的氯化钠溶液,但手边只有混有硫酸钠的氯化钠。某学生设计了如下方案:
如果此方案正确,那么:
(1)操作①是否可改为加硝
酸钡溶液?____,为什么?
_______________________
_______________________________________。
(2)进行操作①后,如何判断 已除尽,方法是__________________
__________________________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
否
因为改用Ba(NO3)2溶液会
取上层清液加入BaCl2
(3)操作②的目的是________________,为什么不先过滤后再加碳酸钠溶液?理由是________________________________________________
____________________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
除去过量的Ba2+
上一步产生的BaSO4沉淀对加碳酸钠溶液除去Ba2+无影
响,故可以减少一次过滤操作
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
NaCl、Na2SO4均为易溶于水的物质,要得到纯净的氯化钠溶液,可向溶液中加入BaCl2溶液,除去 ,
但此过程中引入了Ba2+,故需在后续过程中把Ba2+除去,可加入Na2CO3溶液。
返回
第3课时
DISANKESHI
物质的检验 / 物质性质和变化的探究 / 随堂演练 知识落实 / 课时对点练
物质的检验 物质性质和变化的探究
专题2
核心素养
发展目标
1.了解常见物质的检验方法,学会Cl-、
等离子的检验方法。
2.了解常见的仪器分析法,会用焰色反应检验金属或金属离子的存在。
3.能设计简单的实验方案,确定常见物质的组成成分。
4.发展对化学实验探究的兴趣,养成严谨求实的科学态度,增强合作探究和勇于创新的意识。
内容索引
一、物质的检验
二、物质性质和变化的探究
随堂演练 知识落实
课时对点练
物质的检验
一
1.物质检验的方法——特征反应法
二氧化碳
蓝色
特征反应检验法多用于验证性检验,即验证是否存在该物质。
2.常见离子的检验方法
离子 Cl-
实验
操作
实验
现象 有 气味气体放出,湿润的红色石蕊试纸变蓝 生成 ,加入稀硝酸后,_____
_______ 加入稀盐酸,______
,加入BaCl2溶液,_____________
刺激性
白色沉淀
沉淀
不溶解
无明显
现象
生成白色沉淀
化学方程式(各写一个) ________________
________________________ __________________________________ ____________________________________________
NH4Cl+NaOH
+NH3↑
NH4Cl+AgNO3===
AgCl↓+NH4NO3
(NH4)2 SO4+BaCl2
===BaSO4↓+2NH4Cl
特别提醒 离子检验操作常分为以下四步:取样(取待测液)→操作→现象→结论。
3.物质组成元素的检验
(1)焰色反应
①定义:许多 在火焰上灼烧时都会使火焰呈现特殊的颜色,这叫作焰色反应。
②操作
洗——将铂丝(或光洁的铁丝)用稀盐酸洗净
烧——将洗净的铂丝(或铁丝)在火焰上灼烧至无色
蘸——蘸取待测样品(固体或溶液)
烧——在火焰上灼烧,并观察火焰的颜色
洗——再用稀盐酸洗净铂丝(或铁丝),并在火焰上灼烧至无色
金属或它们的化合物
③应用
在中学实验中,焰色反应主要用于检验Na+和K+。
元素 钠 钾 锂 钙 锶 钡
焰色 _____ _____ 紫红色 砖红色 洋红色 _______
黄色
紫色
黄绿色
特别提醒 ①焰色反应是元素的物理性质,如NaCl、Na2CO3、NaOH,无论固体或溶液,焰色反应均为黄色。
②观察钾的焰色时,要透过蓝色钴玻璃观察,这样可以滤去黄光,避免含钠杂质的干扰。可以用铁丝代替铂丝,铁丝灼烧时不呈现特殊颜色。
③五颜六色的烟花也是焰色反应的应用。
(2)仪器分析法
仪器分析法常用来研究物质的元素组成及其结构。
碳、氢、氧、氮、硫、
某些原子团
金属元素
(1)向某溶液中加入氯化钡溶液,若有白色沉淀生成,则溶液中一定含有
( )
(2)某溶液中加入NaOH溶液,湿润的红色石蕊试纸未变色,说明原溶液中不存在 ( )
(3)做焰色反应实验时,可以用盐酸清洗铂丝,但不可以用硫酸( )
(4)对某溶液做焰色反应实验时,未看到紫色,证明无K+( )
×
×
√
×
(1)已知该方案不够严谨,请说明理由。
(2)请你设计一个严谨的方案。
2.有5瓶白色固体试剂,分别是氯化钡、氢氧化钠、硫酸钠、硫酸铵、无水硫酸铜。现只提供蒸馏水,通过下面的实验步骤即可鉴别它们。请填写下列空白:
(1)取适量固体试剂,分别加入5支试管中,加入适量蒸馏水,振荡试管,观察到的现象是_________________________________________________
_______________,被检出的化学物质是____________________。
5种固体全部溶解,4支试管中得到无色溶液,1支试管中得到蓝色溶液 CuSO4(或无水硫酸铜)
(2)分别取未检出的溶液,向其中加入上述已检出的溶液,根据观察到的现象写出相应的化学方程式:
第1支试管中有白色沉淀生成:_________________________________;
第2支试管中有蓝色沉淀生成:___________________________________。
被检出物质的化学式分别是_______、________。
BaCl2+CuSO4===BaSO4↓+CuCl2
2NaOH+CuSO4===Cu(OH)2↓+Na2SO4
BaCl2 NaOH
(3)鉴别余下未检出物质的方法和观察到的现象是_____________________
______________________________________________________________________________________________________________________________________。
分别另取少量未检出的
溶液,向其中加入NaOH溶液并加热,若产生刺激性气味的气体(或使湿润的红色石蕊试纸变蓝的气体),说明该物质是(NH4)2SO4,另一瓶为Na2SO4
将BaCl2、NaOH、Na2SO4、(NH4)2SO4、CuSO4(无水)这五种物质分别加入蒸馏水溶解,这五种物质都能溶于水,且CuSO4溶于水后形成蓝色溶液,其他四种物质溶于水都形成无色溶液,由此可检验出CuSO4;
再将CuSO4溶液滴加到其余四种物质的溶液中:BaCl2+CuSO4===
BaSO4↓(白)+CuCl2,2NaOH+CuSO4===Cu(OH)2↓(蓝)+Na2SO4,Na2SO4+CuSO4(不反应),(NH4)2SO4+CuSO4(不反应),从而又检验出BaCl2和NaOH;
剩余的为Na2SO4、(NH4)2SO4,可利用NaOH溶液再检验出(NH4)2SO4,因为(NH4)2SO4+2NaOH Na2SO4+2H2O+2NH3↑,会产生有刺激性气味或使湿润的红色石蕊试纸变蓝的气体。
归纳总结
物质检验的基本要求
(1)反应要有明显的现象。
(2)排除干扰物的影响。
返回
物质性质和变化的探究
二
1.实验探究物质的性质和变化
(1)CO2的性质和变化
实验
现象 溶液变成红色 气泡逸出,溶液变成 色
结论 有 物质生成 物质________
紫
酸性
酸性
不稳定
(2)通过实验研究铝的性质
实验操作 主要现象 结论
打磨铝片,观察 打磨后为 色 铝是 色金属,铝在空气中易被氧化,形成一层氧化膜:
____________________
加热未打磨的铝片 铝片内部熔融但不下滴 表层有一层Al2O3,且熔点高于Al
单质
银白
银白
4Al+3O2===2Al2O3
铝片均溶解,且均有气泡产生 Al既能与盐酸反应,又能与NaOH溶液反应:2Al+6HCl===2AlCl3+3H2↑、2Al+2NaOH+2H2O===
2NaAlO2+3H2↑
2.设计实验方案探究影响双氧水分解速率的因素(提示:控制单一变量)
实验序号 实验方案 现象 结论
① 气泡产生较慢 实验①②说明浓度越大,H2O2分解速率 ;
实验①③说明温度越高,H2O2分解速率 ;
实验①④说明在MnO2催化作用下,H2O2分解速率______
② 气泡产生非常慢
③ 气泡产生较快
④ 气泡产生非常快
越快
越快
加快
归纳总结
物质变化往往受到多个因素的影响,在研究化学反应与外界因素之间的关系时,对影响物质变化规律的因素或条件加以人为控制,使其他几个因素不变,集中研究其中一个因素的变化所产生的影响,有利于在研究过程中,迅速寻找到物质变化的规律。
(1)化学实验是探究物质性质和变化的主要方法( )
(2)确定要研究的化学问题之后,提出假设,假设是有化学原理作为依据的,不是凭空臆测( )
(3)将CO2通入水中,滴入几滴紫色石蕊试液,溶液变红色,说明CO2的水溶液显酸性( )
(4)铝是金属,只与酸反应,放出H2( )
(5)MnO2在H2O2的分解反应中起催化剂作用,故加入MnO2能加快H2O2的分解速率( )
√
√
×
√
√
草木灰是草本和木本植物燃烧后的残余物,含有碳酸钾,可用作肥料。现有一份草木灰样品,请设计实验检验其中含有碳酸钾。
答案
实验步骤 实验现象 结论
(1)将草木灰样品溶于蒸馏水中 液体浑浊 -
(2)将(1)得到的浑浊液体过滤 得到澄清滤液 -
(3)将滤液加热浓缩 - -
(4)用铂丝蘸取溶液,在酒精灯火焰上灼烧,透过蓝色钴玻璃观察 火焰呈紫色 溶液中含K+
(5)取适量溶液于一个小烧杯中,倒入足量的CaCl2溶液,过滤取滤渣,加入足量的稀盐酸并在烧杯口盖上涂有澄清石灰水的玻璃片 产生白色沉淀,产生大量无色无味的气体,澄清石灰水变浑浊 溶液中含 ,草木灰中含K2CO3
返回
随堂演练 知识落实
1.下列溶液中离子检验的结论正确的是
A.加稀盐酸产生无色无味气体,将气体通入澄清石灰水,石灰水变浑
浊,原溶液可能含有
B.加入BaCl2溶液有白色沉淀产生,再加盐酸,沉淀不溶解,原溶液
一定含有
C.加入AgNO3溶液有白色沉淀产生,原溶液一定含有Cl-
D.加入Na2CO3溶液有白色沉淀产生,再加盐酸,白色沉淀消失,原溶
液一定含有Ba2+
√
1
2
3
4
1
2
3
4
2.某物质灼烧时,焰色反应为黄色,下列判断正确的是
A.该物质一定是钠的化合物 B.该物质一定含钠元素
C.该物质一定是金属钠 D.该物质中不含钾元素
1
2
3
4
√
焰色反应是元素的性质。焰色反应为黄色,说明该物质一定含钠元素,既可能是金属钠,也可能是钠的化合物,B正确。
3.下列实验可实现鉴别目的的是
A.用稀硫酸鉴别银和铝两种金属
B.用硝酸银溶液鉴别氯化钾溶液和氯化钠溶液
C.用二氧化碳鉴别氢氧化钠溶液和氯化钠溶液
D.用氯化钡溶液鉴别硝酸银溶液和碳酸钠溶液
√
1
2
3
4
1
2
3
4
用稀硫酸能鉴别银(不溶解,无气体产生)和铝(能溶解,产生气体);
用硝酸银溶液不能鉴别氯化钾溶液(产生白色沉淀)和氯化钠溶液(产生白色沉淀);
用二氧化碳不能鉴别氢氧化钠溶液(无明显现象)和氯化钠溶液(无明显现象);
用氯化钡溶液不能鉴别硝酸银溶液(产生白色沉淀)和碳酸钠溶液(产生白色沉淀)。
4.有一包白色粉末,其中可能含有硝酸钡、氯化钙、碳酸钾。
现做以下实验:
①将部分粉末加入水中,振荡,有白色沉淀生成;
②向①的悬浊液中加入过量的稀硝酸,白色沉淀消失,并有气泡产生;
③取少量②的溶液滴入硝酸银溶液中,有白色沉淀生成。
根据上述实验现象,回答下列问题:
(1)原白色粉末中肯定含有______________(填化学式)。
1
2
3
4
K2CO3、CaCl2
(2)写出硝酸钡与碳酸钾反应的化学方程式:______________________
_________________。
(3)写出氯化钙与碳酸钾反应的化学方程式:______________________
________。
(4)写出碳酸钙跟硝酸反应的化学方程式:________________________
_____________。
1
2
3
4
Ba(NO3)2+K2CO3===
CaCl2+K2CO3===CaCO3↓
BaCO3↓+2KNO3
+2KCl
CaCO3+2HNO3===Ca(NO3)2
+H2O+CO2↑
1
2
3
4
返回
①将部分粉末加入水中,振荡,有白色沉淀生成,白色沉淀可能是碳酸钡或碳酸钙,一定含有碳酸钾,其余两种中至少含有一种;
②向①的悬浊液中加入过量稀硝酸,白色沉淀消失,并有气泡产生,证明沉淀是碳酸钙或碳酸钡;
③取少量②的溶液滴入硝酸银溶液,有白色沉淀生成,证明含有氯离子,混合物中一定含有氯化钙;说明白色粉末中一定含有碳酸钾、氯化钙,可能含有硝酸钡。
课时对点练
题组一 常见物质的检验
1.下列检验Cl-的方法正确的是
A.向某溶液中滴加AgNO3溶液,若产生白色沉淀说明该溶液中有Cl-
B.向某溶液中先滴加盐酸,再滴加AgNO3溶液,若产生白色沉淀,说
明溶液中有Cl-
C.向某溶液中先滴加AgNO3溶液,产生白色沉淀,再滴加盐酸,沉淀
不消失,说明溶液中有Cl-
D.向某溶液中滴加用HNO3酸化的AgNO3溶液,若产生白色沉淀,说明
溶液中有Cl-
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
加入盐酸,引入Cl-,B、C错误;
2.检验某溶液中是否含有 ,常用的方法是
A.取样,滴加BaCl2溶液,看是否有白色沉淀生成
B.取样,滴加稀盐酸酸化的BaCl2溶液,看是否有白色沉淀生成
C.取样,滴加稀盐酸,无明显现象,再滴加BaCl2溶液,看是否有白色
沉淀生成
D.取样,滴加稀硫酸,再滴加BaCl2溶液,看是否有白色沉淀生成
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
B项中不能排除Ag+的干扰;
3.可以确定溶液中存在 的实验事实是
A.加入硝酸银溶液,有白色沉淀产生
B.加入盐酸,有无色无味气体产生
C.加入氯化钙溶液,有白色沉淀生成,再加稀盐酸,白色沉淀溶解,
产生可使澄清石灰水变浑浊的无色无味气体
D.加入氢氧化钡溶液,有白色沉淀生成,再加稀盐酸,白色沉淀溶解,
产生可使澄清石灰水变浑浊的无色无味气体
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
4.下列离子检验的方法正确的是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
题组二 焰色反应
5.下列对焰色反应的实验操作注意事项的说法正确的是
①先将铂丝灼烧至无色,再蘸取被检验的物质
②每次实验后,要将铂丝用稀盐酸洗净
③实验时最好选择本身颜色较浅的火焰
④没有铂丝时,也可以用光洁无锈的铁丝代替
A.①②④ B.①②③
C.②③④ D.①②③④
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
实验前必须用稀盐酸洗净铂丝,并且在酒精灯(或煤气灯)火焰上灼烧至无色;火焰本身的颜色浅,便于对金属焰色的观察;铂丝、铁丝本身没有焰色,可用于蘸取试样完成实验。
6.下列有关焰色反应实验的叙述正确的是
A.可用铜丝代替铂丝进行实验
B.观察钾的焰色要透过蓝色钴玻璃
C.实验结束后,要用碳酸钠溶液洗净铂丝
D.焰色反应是指金属在加热灼烧时火焰呈现特殊的颜色,是物质的化
学性质
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
铜丝在灼烧时有颜色,不能用铜丝代替铂丝,A项错误;
实验结束后,用盐酸洗净铂丝,C项错误;
焰色反应是指金属元素在灼烧时火焰呈现特殊的颜色,不是化学性质,D项错误。
7.(2022·太原高一检测)下列说法正确的是
A.某物质的焰色为黄色,说明该物质中含有钠元素
B.某物质的焰色不显紫色,说明该物质中肯定不含钾元素
C.焰色反应不能用于物质的鉴别
D.用于焰色反应的金属丝可以是铜丝、光洁无锈的铁丝
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
钠的焰色为黄色,A项正确;
钾的焰色为紫色(必须透过蓝色钴玻璃观察),B项错误;
焰色反应可用于物质的鉴别,如鉴别钠盐和钾盐,C项错误;
焰色反应的金属丝可以用铂丝、光洁无锈的铁丝,但不可以用铜丝,铜的焰色为绿色,会干扰检测,D项错误。
题组三 物质性质和变化的探究
8.控制变量是科学研究的重要方法。相同质量的铁与足量稀硫酸分别在下列条件下发生反应,其中反应放出气体最快的是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
选项 硫酸 反应温度 铁的状态
A 20% 20 ℃ 块状
B 5% 20 ℃ 粉末状
C 10% 40 ℃ 块状
D 20% 40 ℃ 粉末状
√
9.为了探究温度对化学反应速率的影响,下列实验方案可行的是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
A.
B.
C.
D.
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
探究温度对化学反应速率的影响,要求在催化剂相同,H2O2浓度相同,而温度不同的条件下做对比实验,通过产生气泡的快慢来体现温度对化学反应速率的影响。
10.向四支试管中分别加入少量不同的无色溶液进行如下操作,结论正确的是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
选项 操作 现象 结论
A 滴加BaCl2溶液 生成白色沉淀 原溶液中有
B 先滴加足量稀硝酸,再滴入AgNO3溶液 开始无明显现象,后产生白色沉淀 原溶液中有Cl-
C 用洁净铂丝蘸取溶液进行焰色反应 火焰呈黄色 原溶液中有Na+,无K+
D 滴加稀NaOH溶液,将湿润的红色石蕊试纸置于试管口 试纸不变蓝 原溶液中无
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
与BaCl2溶液反应生成的白色沉淀可能是BaSO4、BaCO3或AgCl,A项错误;
黄色火焰可以覆盖钾的紫色火焰,故检验钾需透过蓝色钴玻璃观察火焰颜色,C项错误;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
11.下列各组溶液不用任何试剂就可以鉴别出来的是
A.HCl、AgNO3、Na2CO3、NaOH
B.NH4Cl、AgNO3、CaCl2、HNO3
C.(NH4)2SO4、Na2SO4、NaCl、NH4Cl
D.MgCl2、Na2SO4、NaCl、NH4Cl
√
对各组溶液,分别采用两两混合法进行鉴别。以A组为例,实验现象记录如下表(“↑”表示产生气体、“↓”表示生成沉淀或微溶物,括号内是气体或沉淀的颜色;“—”表示无明显现象)。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
HCl AgNO3 Na2CO3 NaOH
HCl ↓(白) ↑(无) —
AgNO3 ↓(白) ↓(白) ↓(褐)
Na2CO3 ↑(无) ↓(白) —
NaOH — ↓(褐) —
由此可鉴别出AgNO3溶液和NaOH溶液,Na2CO3溶液和盐酸可用“滴加顺序法”加以鉴别;
B项,NH4Cl和CaCl2遇AgNO3均产生白色沉淀,遇HNO3均无现象,可以鉴别出AgNO3和HNO3,但无法鉴别出NH4Cl和CaCl2;
C项和D项,任意两种溶液混合均无明显现象,无法鉴别。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
12.某同学想用实验证明硫酸铜溶液显蓝色与 无关,进行下列实验无意义的是
A.观察硫酸钠溶液没有颜色
B.向硫酸铜溶液中滴加适量的氯化钡溶液,振荡后静置,溶液蓝色未
消失
C.向硫酸铜溶液中滴加适量的氢氧化钠溶液,振荡后静置,溶液蓝色
消失
D.加水稀释硫酸铜溶液,溶液蓝色变浅
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
A做对照实验;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
A.取少量晶体放入试管中,加热,若试管口上蘸有少量无水硫酸铜粉
末的脱脂棉变蓝,则可证明晶体中含有结晶水
B.取少量晶体溶于水,加入少量NaOH溶液,加热,在试管口用湿润的
蓝色石蕊试纸检验,若变红,则可证明晶体的成分中含有
C.取少量晶体溶于水,加适量稀盐酸,无现象,再滴入几滴BaCl2溶液,
有白色沉淀生成,则可证明晶体的成分中含有
D.取少量晶体溶于水,用洁净的铂丝蘸取少量溶液在酒精灯火焰上灼
烧,火焰呈黄色,不能证明晶体中无K+
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
14.(2021·重庆高一期中)对一份稀溶液作初步分析发现,溶液无色、澄清,其中可能含有 、Cl-、Ca2+等离子中的若干种。然后又做了如下实验,以确认这些离子是否大量存在。
①取少量该溶液加入BaCl2溶液有白色沉淀生成,再加入足量盐酸后,沉淀部分溶解,并有气体生成。
②在实验①的溶液中再加入硝酸银溶液,结果又生成了不溶于稀硝酸的白色沉淀。
③用铂丝蘸取少量该溶液置于无色酒精灯火焰上灼烧,火焰呈黄色。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
回答下列问题:
(1)上述实验可以确定溶液中一定含有__________________,一定没有______。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
Ca2+
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
②不能证明含有氯离子,因前面加入的氯化钡溶液中含氯离子;
③说明含Na+。
(2)从以上操作中,不能判断是否存在的离子是_____,为了检验该离子是否存在,请你写出进一步检验的操作步骤和实验现象:________
__________________________________________________________________________________________________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
Cl-
另取少量
原溶液,先加入足量的Ba(NO3)2溶液,过滤,再向滤液中加入硝酸酸化的AgNO3溶液,若有白色沉淀产生,则存在Cl-
根据以上分析可知氯离子不能确定是否存在,需进一步取原溶液检验氯离子的存在,检验时需先排除硫酸根离子和碳酸根离子的干扰。
(3)有同学认为实验③可以省略,你认为呢?________(填“可以”或“不可以”),并说明理由:___________________________________
________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
可以
溶液显电中性,有阴离子存在必有阳离
子存在
根据溶液呈电中性,有阴离子存在必有阳离子存在,又因为钙离子一定不存在,故钠离子一定存在,因此实验③可以省略。
15.实验室里需要纯净的氯化钠溶液,但手边只有混有硫酸钠的氯化钠。某学生设计了如下方案:
如果此方案正确,那么:
(1)操作①是否可改为加硝
酸钡溶液?____,为什么?
_______________________
_______________________________________。
(2)进行操作①后,如何判断 已除尽,方法是__________________
__________________________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
否
因为改用Ba(NO3)2溶液会
取上层清液加入BaCl2
(3)操作②的目的是________________,为什么不先过滤后再加碳酸钠溶液?理由是________________________________________________
____________________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
除去过量的Ba2+
上一步产生的BaSO4沉淀对加碳酸钠溶液除去Ba2+无影
响,故可以减少一次过滤操作
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
NaCl、Na2SO4均为易溶于水的物质,要得到纯净的氯化钠溶液,可向溶液中加入BaCl2溶液,除去 ,
但此过程中引入了Ba2+,故需在后续过程中把Ba2+除去,可加入Na2CO3溶液。
返回
