2022-2023学年苏教版2019高中化学必修1 专题2 研究物质的基本方法 第二单元 第3课时 化学反应的计算 课件(67张PPT)
文档属性
| 名称 | 2022-2023学年苏教版2019高中化学必修1 专题2 研究物质的基本方法 第二单元 第3课时 化学反应的计算 课件(67张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-07-15 20:06:31 | ||
图片预览











文档简介
(共67张PPT)
第3课时
DISANKESHI
以物质的量为中心的计算 / 依据化学方程式的计算 / 随堂演练 知识落实 / 课时对点练
化学反应的计算
专题2
核心素养
发展目标
1.熟练以物质的量为中心的计算与转换。
2.利用化学方程式找出各物质的量的关系并进行计算。
内容索引
一、以物质的量为中心的计算
二、依据化学方程式的计算
随堂演练 知识落实
课时对点练
以物质的量为中心的计算
一
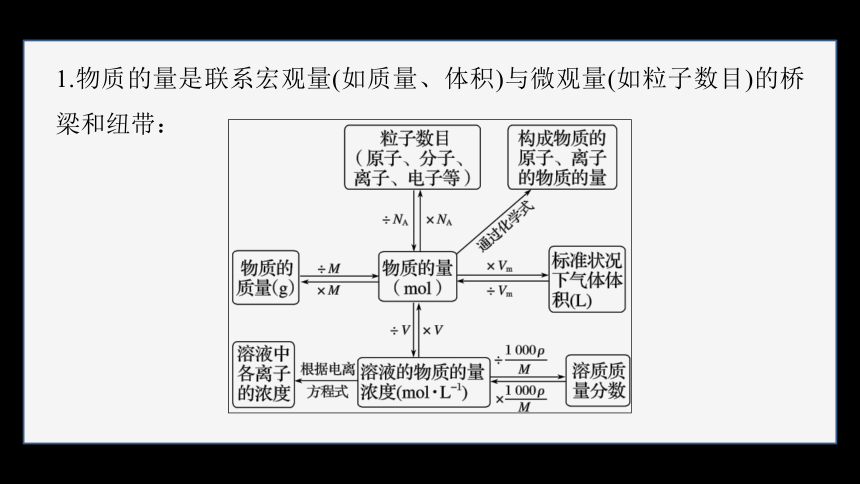
1.物质的量是联系宏观量(如质量、体积)与微观量(如粒子数目)的桥梁和纽带:
2.要紧紧抓住“物质的量”这个计算的核心。牢固建立把“其他物理量转化为物质的量”的这一思维模式,充分利用下列“万能恒等式”及其变形,进行各物理量的相互求算:
3.在解题的过程中,根据条件找出已知量与未知量之间的物质的量关系,就可使复杂的问题简单化、技巧化。其解题方法是依据变化前后某一粒子物质的量保持不变,列出守恒关系求解。
应用体验
1.36.5 g氯化氢溶解在1 L水中(水的密度近似为1 g·mL-1),所得溶液的密度为ρ g·mL-1,质量分数为w,物质的量浓度为c mol·L-1,NA表示阿伏加德罗常数的值,则下列叙述正确的是
A.所得溶液的物质的量浓度为1 mol·L-1
B.36.5 g氯化氢含有NA个原子
C.36.5 g 氯化氢气体占有的体积为22.4 L
D.所得溶液的质量分数w=
√
36.5 g氯化氢物质的量为1 mol,含有2NA个原子,B项错误;
36.5 g氯化氢气体在标准状况下的体积为22.4 L,C项错误;
2.在标准状况下,13 g某气体所含的分子数与14 g CO所含的分子数相等。此气体在标准状况下的密度约为
A.1.25 g·L-1 B.2.32 g·L-1
C.1.65 g·L-1 D.1.16 g·L-1
√
返回
依据化学方程式的计算
二
1.化学反应计算的方法
化学计量数 2 __ __
物质的量 2 mol _____ _____
(1)同一个化学方程式中各物质的化学计量数之比等于其 之比。
(2)对于有气体参加的反应,在同温同压下各气体的化学计量数之比等于其 之比。
1
1 mol
2
2 mol
物质的量
体积
实验室为确定一瓶稀盐酸的浓度,用0.100 mol·L-1 NaOH溶液中和25.00 mL该盐酸,当酸与碱恰好完全反应时,消耗NaOH溶液24.50 mL,试求该盐酸的物质的量浓度。
例1
答案 0.098 mol·L-1
n(NaOH)=2.450×10-2L×0.100 mol·L-1=2.45×10-3mol,则
NaOH + HCl===NaCl+H2O
化学计量数 1 1
物质的量 2.45×10-3 mol n(HCl)
2.依据化学方程式列方程组法
方程组法用于解决两种物质的混合物计算,读题时找到两个已知量时,利用各物质的关系建立二元一次方程组求算未知量。
把1.1 g铁、铝混合物溶于200 mL 5 mol·L-1盐酸中,反应后盐酸的浓度变为4.6 mol·L-1(溶液体积变化忽略不计)。求:
(1)反应中消耗HCl的物质的量;
例2
答案 0.08 mol
消耗HCl的物质的量:0.2 L×5 mol·L-1-0.2 L×4.6 mol·L-1=0.08 mol。
(2)该混合物中铝、铁的物质的量。
答案 n(Al)=0.02 mol,n(Fe)=0.01 mol
设Al、Fe的物质的量分别为x、y。
2Al + 6HCl===2AlCl3+3H2↑
2 6
x 3x
Fe + 2HCl===FeCl2+H2↑
1 2
y 2y
解得x=0.02 mol,y=0.01 mol,
即n(Al)=0.02 mol,n(Fe)=0.01 mol。
3.依据反应前后的差量计算
根据化学反应前后物质的有关物理量发生的变化,找出所谓的“理论差量”,如反应前后的质量差、物质的量差、气体体积差等,该差量与反应物的有关量成正比。差量法就是借助这种比例关系求解的方法。
把铁棒插入CuSO4溶液,一段时间后取出,铁棒质量增加了4 g,参加反应的Fe的质量为 。
例3
Fe+CuSO4===FeSO4+Cu 质量增加Δm
56 g 64 g 64 g-56 g=8 g
m(Fe) 4 g
28 g
返回
随堂演练 知识落实
1.0.56 g氧化钙恰好与20 mL盐酸完全反应,则此盐酸的物质的量浓度是
A.0.10 mol·L-1 B.0.20 mol·L-1
C.0.50 mol·L-1 D.1.00 mol·L-1
1
2
3
4
√
CaO + 2HCl===CaCl2+H2O
56 g 2 mol
0.56 g n(HCl)
2.镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)的关系如图所示,则下列关于反应中镁和铝的叙述正确的是
A.物质的量之比为3∶2
B.质量之比为3∶2
C.摩尔质量之比为2∶3
D.密度之比1∶1
1
2
3
4
√
1
2
3
4
根据题图,Mg、Al产生H2的体积相等,设产生H2的物质的量为n mol,则
Mg+H2SO4===MgSO4+H2↑
n n
2Al+3H2SO4===Al2(SO4)3+3H2↑
n
n(Mg)∶n(Al)=n∶ =3∶2
1
2
3
4
M(Mg)∶M(Al)=24∶27=8∶9
3.2 mol·L-1盐酸和硫酸各100 mL,分别加入等质量的铁粉,反应后生成的气体质量之比为2∶3,则向盐酸中加入的铁粉的物质的量为
A.0.05 mol B.0.075 mol
C.0.15 mol D.0.2 mol
√
1
2
3
4
n(HCl)=0.2 mol,n(H2SO4)=0.2 mol。若酸均不足,即完全反应生成H2的质量之比是1∶2;
若酸均过量,即金属不足,则生成H2的质量之比是1∶1。
现生成H2的质量之比为2∶3,则说明盐酸不足,硫酸过量。
根据盐酸中HCl的物质的量可求出生成H2的物质的量为0.1 mol,则H2SO4反应生成0.15 mol H2,则铁粉为0.15 mol。
1
2
3
4
4.今有11.2 g铁与500 mL的盐酸恰好完全反应。
(1)在标准状况下,生成氢气的体积是多少升?
1
2
3
4
答案 4.48 L
(2)反应前,盐酸的物质的量浓度是多少?
答案 0.8 mol·L-1
1
2
3
4
Fe + 2HCl===FeCl2+H2↑
1 2 1
0.2 mol n(HCl) n(H2)
n(HCl)=0.4 mol,n(H2)=0.2 mol,
V(H2)=0.2 mol×22.4 L·mol-1=4.48 L。
返回
课时对点练
题组一 以物质的量为中心的计算
1.下列各组物质中所含原子数相同的是
A.10 g H2和10 g O2
B.5.6 L N2(标准状况)和11 g CO2
C.9 g H2O和0.75 mol Br2
D.224 mL H2(标准状况)和0.1 mol N2
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
氢气与氧气的摩尔质量不相等,根据n= 可知10 g H2和10 g O2的物质的量不相等,二者均为双原子分子,则含有的原子数目一定不相等,A不符合题意;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
9 g H2O的物质的量为 =0.5 mol,含有原子为0.5 mol×3=
1.5 mol,0.75 mol Br2含有原子为0.75 mol×2=1.5 mol,含有的原子数目相等,C符合题意;
标准状况下,224 mL H2的物质的量n= =0.01 mol,含有原
子为0.01 mol×2=0.02 mol,N2物质的量为0.1 mol,含有的原子为
0.1 mol×2=0.2 mol,含有原子数目不相等,D不符合题意。
2.设阿伏加德罗常数的值为NA,则下列说法正确的是
A.标准状况下,22.4 L CO2含22NA个电子
B.22.4 L O3含3NA个原子
C.标准状况下,0.3 mol SO2中含氧原子数为0.3NA
D.常温下,9.5 g MgCl2固体中含有0.2NA个离子
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
22.4 L O3的物质的量不一定是1 mol,因此不一定含3NA个原子;
标准状况下,0.3 mol SO2中含氧原子数为0.6NA;
常温下,9.5 g MgCl2固体的物质的量是 =0.1 mol,其中含有0.3NA个离子。
3.将足量铁粉放入100 mL 0.1 mol·L-1的CuSO4溶液中,充分反应后析出铜的质量为
A.3.2 g B.6.4 g C.0.64 g D.3.2 g
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
题组二 以化学方程式为依据的计算
4.标准状况下,3.25 g锌与足量的盐酸反应生成x L氢气,下列比例式正确的是
A.Zn+2HCl===ZnCl2+H2↑
1 mol 1 mol
3.25 g x L
C.Zn+2HCl===ZnCl2+H2↑
1 mol 22.4 L
0.05 mol x L
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
B.Zn+2HCl===ZnCl2+H2↑
65 g 1 L
3.25 g x L
D.Zn+2HCl===ZnCl2+H2↑
65 g 1 mol
3.25 g x L
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
比例式应注意单位要“上下一致,左右对应”。
5.实验室利用反应2KClO3 2KCl+3O2↑制取氧气,若24.5 g
KClO3参加反应,则得到标准状况下的氧气的体积是
A.2.24 L B.4.48 L
C.44.8 L D.6.72 L
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
2 mol 3 mol
0.2 mol n(O2)
2 mol∶0.2 mol=3 mol∶n(O2),则n(O2)=0.3 mol,故产生的氧气在标准状况下的体积是0.3 mol×22.4 L·mol-1=6.72 L。
6.在500 mL 的NaOH溶液中加入足量铝粉,反应完全后共收集到标准状况下的气体33.6 L,已知2Al+2NaOH+2H2O===2NaAlO2+3H2↑,该NaOH溶液的物质的量浓度为
A.1.0 mol·L-1 B.2.0 mol·L-1
C.1.5 mol·L-1 D.3.0 mol·L-1
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
2Al+2NaOH+2H2O===2NaAlO2+3H2↑
2 mol 67.2 L
n(NaOH) 33.6 L
7.一定条件下,7 g炭粉与14 g氧气完全反应生成21 g氧化物,则生成物中CO与CO2的物质的量之比是
A.1∶1 B.2∶1
C.2∶3 D.3∶2
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
设生成物中CO与CO2的物质的量分别为x mol 、y mol,
8.将过量的锌片放入500 mL CuSO4溶液中,待充分反应后取出锌片,洗净、称量,发现锌片质量比原来减少了0.5 g,则原CuSO4溶液的物质的量浓度为
A.0.5 mol·L-1 B.1 mol·L-1
C.1.5 mol·L-1 D.2 mol·L-1
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
Zn与CuSO4溶液反应时,置换出来的Cu附着在锌片上。反应的化学方程式如下:
Zn+CuSO4===ZnSO4+Cu Δm
1 mol 1 g
n(CuSO4) 0.5 g
9.下列溶液中Cl-浓度与50 mL 1 mol L-1AlCl3溶液中Cl-浓度相等的是
A.150 mL 1 mol·L-1 NaCl溶液
B.75 mL 2 mol·L-1 NH4Cl溶液
C.150 mL 3 mol·L-1 KCl溶液
D.75 mL 2 mol·L-1 FeCl3溶液
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
50 mL 1 mol·L-1 AlCl3溶液中c(Cl-)=1 mol·L-1×3=3 mol·L-1;
150 mL 1 mol·L-1NaCl溶液中c(Cl-)=1 mol·L-1×1=1 mol·L-1;
75 mL 2 mol·L-1 NH4Cl溶液中c(Cl-)=2 mol·L-1×1=2 mol·L-1;
150 mL 3 mol·L-1KCl溶液中c(Cl-)=3 mol·L-1×1=3 mol·L-1;
75 mL 2 mol·L-1FeCl3溶液中c(Cl-)=2 mol·L-1×3=6 mol·L-1,故选C。
10.有CuO、Fe2O3组成的混合物共10 g,加入500 mL某浓度的盐酸中,混合物完全溶解,当再加入250 mL 2 mol·L-1的NaOH溶液时,得到的沉淀最多,该盐酸的物质的量浓度为
A.0.5 mol·L-1 B.1.0 mol·L-1
C.2.0 mol·L-1 D.3.0 mol·L-1
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
得到的沉淀最多,说明所有的OH-都转化为Cu(OH)2、Fe(OH)3沉淀,则溶液中只剩下NaCl,
根据电荷守恒:n(Cl-)=n(Na+)=0.25 L×2.0 mol·L-1=0.5 mol,则c(HCl)= =1.0 mol·L-1。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
11.(2022·四川高一期末)把V L含有MgSO4和K2SO4的混合溶液分成两等份,一份加入含a mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡;另一份加入含b mol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁。则原混合溶液中钾离子的浓度为
√
根据电荷守恒可得n(K+)=(2a-b)mol,
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
12.若NA表示阿伏加德罗常数的值,下列叙述正确的是
①标准状况下,2.24 L CCl4含碳原子数为0.1NA
②标准状况下,a L氧气和氮气的混合气体含有的分子数约为
③1 mol·L-1 Mg(NO3)2溶液中含有 的数目为2NA
④同温同压下,体积相同的氢气和氩气所含的原子数相等
⑤46 g NO2和N2O4混合气体中含有原子数为3NA
⑥1 L 0.5 mol·L-1 K2SO4溶液中,含有的氧原子总数为2NA
A.②⑥ B.②⑤ C.②③ D.②③⑥
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
标准状况下,CCl4不是气体,故①错误;
溶液的体积未知,不能计算硝酸根离子的数目,故③错误;
氢气是双原子分子,氩气是单原子分子,所含原子数不同,故④错误;
溶剂水中也含有氧原子,所以无法计算溶液中氧原子的数目,故⑥错误。
13.将一定质量的锌、铝混合物与足量的稀硫酸反应,生成2.8 L(标准状况)氢气,原混合物的质量可能是
A.2 g B.1 g
C.8 g D.10 g
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
Zn+H2SO4===ZnSO4+H2↑
65 g 1 mol
x g 0.125 mol
解得x=8.125;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
如果全部由铝生成,设需要铝的质量为y g,则:
2Al+3H2SO4===Al2(SO4)3+3H2↑
54 g 3 mol
y g 0.125 mol
解得y=2.25;
根据平均值原理,如果由锌和铝混合组成,则质量介于2.25~8.125 g之间。
14.化学实验中残余的氯气可以用氢氧化钠溶液吸收,以防污染空气。已知Cl2与NaOH发生反应:Cl2+2NaOH===NaCl+NaClO+H2O。若有3.20 g氢氧化钠发生了化学反应,回答下列问题:
(1)生成NaCl的质量为 g。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
2.34
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
Cl2 + 2NaOH===NaCl + NaClO + H2O
1 mol 2 mol 1 mol 1 mol 1 mol
n(Cl2) 0.08 mol n(NaCl) n(NaClO) n(H2O)
(2)生成NaClO的物质的量为 mol。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
0.04
(3)被吸收的氯气在标准状况下的体积为 L。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
0.896
15.以下是有关金属与酸的反应,请填写下列空白。
(1)分别取W g钠、铁、铝与足量的盐酸反应,在相同条件下产生氢气
的体积之比是 。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
由2Na+2HCl===2NaCl+H2↑、Fe+2HCl===FeCl2+H2↑、2Al+6HCl===2AlCl3+3H2↑可知,
(2)分别取0.1 mol 钠、铁、铝与足量的盐酸反应,在相同条件下产生氢气的体积之比是 。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
1∶2∶3
0.1 mol钠、铁、铝与足量的盐酸反应分别生成0.05 mol、0.10 mol、0.15 mol H2,故产生氢气的体积之比为0.05∶0.10∶0.15=1∶2∶3。
(3)若产生相同物质的量的氢气,所需钠、铁、铝的质量之比是 。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
23∶28∶9
(4)若产生相同体积(同温同压)的氢气,所需钠、铁、铝的物质的量之比是 。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
6∶3∶2
若产生相同体积(同温同压)的氢气,即产生相同物质的量的氢气,则需要钠、铁、铝的物质的量之比是6∶3∶2。
(5)取0.2 mol 的金属钠、铁、铝,分别投入10 mL 1 mol·L-1的盐酸中,标准状况下产生氢气的体积由大到小的顺序是 (钠、铁、铝产生氢气的体积分别用V1、V2、V3表示)。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
V1>V2=V3
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
10 mL 1 mol·L-1的盐酸中n(HCl)=0.010 mol,
由2Na+2HCl===2NaCl+H2↑、2Na+2H2O===2NaOH+H2↑、Fe+2HCl===FeCl2+H2↑、2Al+6HCl===2AlCl3+3H2↑可知,盐酸不足,生成的氢气的量是由盐酸决定的,即盐酸反应生成的n(H2)=0.005 mol;
但钠还能与水反应生成氢气,最终生成氢气的量:V1>V2=V3。
返回
第3课时
DISANKESHI
以物质的量为中心的计算 / 依据化学方程式的计算 / 随堂演练 知识落实 / 课时对点练
化学反应的计算
专题2
核心素养
发展目标
1.熟练以物质的量为中心的计算与转换。
2.利用化学方程式找出各物质的量的关系并进行计算。
内容索引
一、以物质的量为中心的计算
二、依据化学方程式的计算
随堂演练 知识落实
课时对点练
以物质的量为中心的计算
一
1.物质的量是联系宏观量(如质量、体积)与微观量(如粒子数目)的桥梁和纽带:
2.要紧紧抓住“物质的量”这个计算的核心。牢固建立把“其他物理量转化为物质的量”的这一思维模式,充分利用下列“万能恒等式”及其变形,进行各物理量的相互求算:
3.在解题的过程中,根据条件找出已知量与未知量之间的物质的量关系,就可使复杂的问题简单化、技巧化。其解题方法是依据变化前后某一粒子物质的量保持不变,列出守恒关系求解。
应用体验
1.36.5 g氯化氢溶解在1 L水中(水的密度近似为1 g·mL-1),所得溶液的密度为ρ g·mL-1,质量分数为w,物质的量浓度为c mol·L-1,NA表示阿伏加德罗常数的值,则下列叙述正确的是
A.所得溶液的物质的量浓度为1 mol·L-1
B.36.5 g氯化氢含有NA个原子
C.36.5 g 氯化氢气体占有的体积为22.4 L
D.所得溶液的质量分数w=
√
36.5 g氯化氢物质的量为1 mol,含有2NA个原子,B项错误;
36.5 g氯化氢气体在标准状况下的体积为22.4 L,C项错误;
2.在标准状况下,13 g某气体所含的分子数与14 g CO所含的分子数相等。此气体在标准状况下的密度约为
A.1.25 g·L-1 B.2.32 g·L-1
C.1.65 g·L-1 D.1.16 g·L-1
√
返回
依据化学方程式的计算
二
1.化学反应计算的方法
化学计量数 2 __ __
物质的量 2 mol _____ _____
(1)同一个化学方程式中各物质的化学计量数之比等于其 之比。
(2)对于有气体参加的反应,在同温同压下各气体的化学计量数之比等于其 之比。
1
1 mol
2
2 mol
物质的量
体积
实验室为确定一瓶稀盐酸的浓度,用0.100 mol·L-1 NaOH溶液中和25.00 mL该盐酸,当酸与碱恰好完全反应时,消耗NaOH溶液24.50 mL,试求该盐酸的物质的量浓度。
例1
答案 0.098 mol·L-1
n(NaOH)=2.450×10-2L×0.100 mol·L-1=2.45×10-3mol,则
NaOH + HCl===NaCl+H2O
化学计量数 1 1
物质的量 2.45×10-3 mol n(HCl)
2.依据化学方程式列方程组法
方程组法用于解决两种物质的混合物计算,读题时找到两个已知量时,利用各物质的关系建立二元一次方程组求算未知量。
把1.1 g铁、铝混合物溶于200 mL 5 mol·L-1盐酸中,反应后盐酸的浓度变为4.6 mol·L-1(溶液体积变化忽略不计)。求:
(1)反应中消耗HCl的物质的量;
例2
答案 0.08 mol
消耗HCl的物质的量:0.2 L×5 mol·L-1-0.2 L×4.6 mol·L-1=0.08 mol。
(2)该混合物中铝、铁的物质的量。
答案 n(Al)=0.02 mol,n(Fe)=0.01 mol
设Al、Fe的物质的量分别为x、y。
2Al + 6HCl===2AlCl3+3H2↑
2 6
x 3x
Fe + 2HCl===FeCl2+H2↑
1 2
y 2y
解得x=0.02 mol,y=0.01 mol,
即n(Al)=0.02 mol,n(Fe)=0.01 mol。
3.依据反应前后的差量计算
根据化学反应前后物质的有关物理量发生的变化,找出所谓的“理论差量”,如反应前后的质量差、物质的量差、气体体积差等,该差量与反应物的有关量成正比。差量法就是借助这种比例关系求解的方法。
把铁棒插入CuSO4溶液,一段时间后取出,铁棒质量增加了4 g,参加反应的Fe的质量为 。
例3
Fe+CuSO4===FeSO4+Cu 质量增加Δm
56 g 64 g 64 g-56 g=8 g
m(Fe) 4 g
28 g
返回
随堂演练 知识落实
1.0.56 g氧化钙恰好与20 mL盐酸完全反应,则此盐酸的物质的量浓度是
A.0.10 mol·L-1 B.0.20 mol·L-1
C.0.50 mol·L-1 D.1.00 mol·L-1
1
2
3
4
√
CaO + 2HCl===CaCl2+H2O
56 g 2 mol
0.56 g n(HCl)
2.镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积(V)与时间(t)的关系如图所示,则下列关于反应中镁和铝的叙述正确的是
A.物质的量之比为3∶2
B.质量之比为3∶2
C.摩尔质量之比为2∶3
D.密度之比1∶1
1
2
3
4
√
1
2
3
4
根据题图,Mg、Al产生H2的体积相等,设产生H2的物质的量为n mol,则
Mg+H2SO4===MgSO4+H2↑
n n
2Al+3H2SO4===Al2(SO4)3+3H2↑
n
n(Mg)∶n(Al)=n∶ =3∶2
1
2
3
4
M(Mg)∶M(Al)=24∶27=8∶9
3.2 mol·L-1盐酸和硫酸各100 mL,分别加入等质量的铁粉,反应后生成的气体质量之比为2∶3,则向盐酸中加入的铁粉的物质的量为
A.0.05 mol B.0.075 mol
C.0.15 mol D.0.2 mol
√
1
2
3
4
n(HCl)=0.2 mol,n(H2SO4)=0.2 mol。若酸均不足,即完全反应生成H2的质量之比是1∶2;
若酸均过量,即金属不足,则生成H2的质量之比是1∶1。
现生成H2的质量之比为2∶3,则说明盐酸不足,硫酸过量。
根据盐酸中HCl的物质的量可求出生成H2的物质的量为0.1 mol,则H2SO4反应生成0.15 mol H2,则铁粉为0.15 mol。
1
2
3
4
4.今有11.2 g铁与500 mL的盐酸恰好完全反应。
(1)在标准状况下,生成氢气的体积是多少升?
1
2
3
4
答案 4.48 L
(2)反应前,盐酸的物质的量浓度是多少?
答案 0.8 mol·L-1
1
2
3
4
Fe + 2HCl===FeCl2+H2↑
1 2 1
0.2 mol n(HCl) n(H2)
n(HCl)=0.4 mol,n(H2)=0.2 mol,
V(H2)=0.2 mol×22.4 L·mol-1=4.48 L。
返回
课时对点练
题组一 以物质的量为中心的计算
1.下列各组物质中所含原子数相同的是
A.10 g H2和10 g O2
B.5.6 L N2(标准状况)和11 g CO2
C.9 g H2O和0.75 mol Br2
D.224 mL H2(标准状况)和0.1 mol N2
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
氢气与氧气的摩尔质量不相等,根据n= 可知10 g H2和10 g O2的物质的量不相等,二者均为双原子分子,则含有的原子数目一定不相等,A不符合题意;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
9 g H2O的物质的量为 =0.5 mol,含有原子为0.5 mol×3=
1.5 mol,0.75 mol Br2含有原子为0.75 mol×2=1.5 mol,含有的原子数目相等,C符合题意;
标准状况下,224 mL H2的物质的量n= =0.01 mol,含有原
子为0.01 mol×2=0.02 mol,N2物质的量为0.1 mol,含有的原子为
0.1 mol×2=0.2 mol,含有原子数目不相等,D不符合题意。
2.设阿伏加德罗常数的值为NA,则下列说法正确的是
A.标准状况下,22.4 L CO2含22NA个电子
B.22.4 L O3含3NA个原子
C.标准状况下,0.3 mol SO2中含氧原子数为0.3NA
D.常温下,9.5 g MgCl2固体中含有0.2NA个离子
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
22.4 L O3的物质的量不一定是1 mol,因此不一定含3NA个原子;
标准状况下,0.3 mol SO2中含氧原子数为0.6NA;
常温下,9.5 g MgCl2固体的物质的量是 =0.1 mol,其中含有0.3NA个离子。
3.将足量铁粉放入100 mL 0.1 mol·L-1的CuSO4溶液中,充分反应后析出铜的质量为
A.3.2 g B.6.4 g C.0.64 g D.3.2 g
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
题组二 以化学方程式为依据的计算
4.标准状况下,3.25 g锌与足量的盐酸反应生成x L氢气,下列比例式正确的是
A.Zn+2HCl===ZnCl2+H2↑
1 mol 1 mol
3.25 g x L
C.Zn+2HCl===ZnCl2+H2↑
1 mol 22.4 L
0.05 mol x L
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
B.Zn+2HCl===ZnCl2+H2↑
65 g 1 L
3.25 g x L
D.Zn+2HCl===ZnCl2+H2↑
65 g 1 mol
3.25 g x L
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
比例式应注意单位要“上下一致,左右对应”。
5.实验室利用反应2KClO3 2KCl+3O2↑制取氧气,若24.5 g
KClO3参加反应,则得到标准状况下的氧气的体积是
A.2.24 L B.4.48 L
C.44.8 L D.6.72 L
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
2 mol 3 mol
0.2 mol n(O2)
2 mol∶0.2 mol=3 mol∶n(O2),则n(O2)=0.3 mol,故产生的氧气在标准状况下的体积是0.3 mol×22.4 L·mol-1=6.72 L。
6.在500 mL 的NaOH溶液中加入足量铝粉,反应完全后共收集到标准状况下的气体33.6 L,已知2Al+2NaOH+2H2O===2NaAlO2+3H2↑,该NaOH溶液的物质的量浓度为
A.1.0 mol·L-1 B.2.0 mol·L-1
C.1.5 mol·L-1 D.3.0 mol·L-1
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
2Al+2NaOH+2H2O===2NaAlO2+3H2↑
2 mol 67.2 L
n(NaOH) 33.6 L
7.一定条件下,7 g炭粉与14 g氧气完全反应生成21 g氧化物,则生成物中CO与CO2的物质的量之比是
A.1∶1 B.2∶1
C.2∶3 D.3∶2
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
设生成物中CO与CO2的物质的量分别为x mol 、y mol,
8.将过量的锌片放入500 mL CuSO4溶液中,待充分反应后取出锌片,洗净、称量,发现锌片质量比原来减少了0.5 g,则原CuSO4溶液的物质的量浓度为
A.0.5 mol·L-1 B.1 mol·L-1
C.1.5 mol·L-1 D.2 mol·L-1
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
Zn与CuSO4溶液反应时,置换出来的Cu附着在锌片上。反应的化学方程式如下:
Zn+CuSO4===ZnSO4+Cu Δm
1 mol 1 g
n(CuSO4) 0.5 g
9.下列溶液中Cl-浓度与50 mL 1 mol L-1AlCl3溶液中Cl-浓度相等的是
A.150 mL 1 mol·L-1 NaCl溶液
B.75 mL 2 mol·L-1 NH4Cl溶液
C.150 mL 3 mol·L-1 KCl溶液
D.75 mL 2 mol·L-1 FeCl3溶液
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
50 mL 1 mol·L-1 AlCl3溶液中c(Cl-)=1 mol·L-1×3=3 mol·L-1;
150 mL 1 mol·L-1NaCl溶液中c(Cl-)=1 mol·L-1×1=1 mol·L-1;
75 mL 2 mol·L-1 NH4Cl溶液中c(Cl-)=2 mol·L-1×1=2 mol·L-1;
150 mL 3 mol·L-1KCl溶液中c(Cl-)=3 mol·L-1×1=3 mol·L-1;
75 mL 2 mol·L-1FeCl3溶液中c(Cl-)=2 mol·L-1×3=6 mol·L-1,故选C。
10.有CuO、Fe2O3组成的混合物共10 g,加入500 mL某浓度的盐酸中,混合物完全溶解,当再加入250 mL 2 mol·L-1的NaOH溶液时,得到的沉淀最多,该盐酸的物质的量浓度为
A.0.5 mol·L-1 B.1.0 mol·L-1
C.2.0 mol·L-1 D.3.0 mol·L-1
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
得到的沉淀最多,说明所有的OH-都转化为Cu(OH)2、Fe(OH)3沉淀,则溶液中只剩下NaCl,
根据电荷守恒:n(Cl-)=n(Na+)=0.25 L×2.0 mol·L-1=0.5 mol,则c(HCl)= =1.0 mol·L-1。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
11.(2022·四川高一期末)把V L含有MgSO4和K2SO4的混合溶液分成两等份,一份加入含a mol BaCl2的溶液,恰好使硫酸根离子完全沉淀为硫酸钡;另一份加入含b mol NaOH的溶液,恰好使镁离子完全沉淀为氢氧化镁。则原混合溶液中钾离子的浓度为
√
根据电荷守恒可得n(K+)=(2a-b)mol,
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
12.若NA表示阿伏加德罗常数的值,下列叙述正确的是
①标准状况下,2.24 L CCl4含碳原子数为0.1NA
②标准状况下,a L氧气和氮气的混合气体含有的分子数约为
③1 mol·L-1 Mg(NO3)2溶液中含有 的数目为2NA
④同温同压下,体积相同的氢气和氩气所含的原子数相等
⑤46 g NO2和N2O4混合气体中含有原子数为3NA
⑥1 L 0.5 mol·L-1 K2SO4溶液中,含有的氧原子总数为2NA
A.②⑥ B.②⑤ C.②③ D.②③⑥
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
标准状况下,CCl4不是气体,故①错误;
溶液的体积未知,不能计算硝酸根离子的数目,故③错误;
氢气是双原子分子,氩气是单原子分子,所含原子数不同,故④错误;
溶剂水中也含有氧原子,所以无法计算溶液中氧原子的数目,故⑥错误。
13.将一定质量的锌、铝混合物与足量的稀硫酸反应,生成2.8 L(标准状况)氢气,原混合物的质量可能是
A.2 g B.1 g
C.8 g D.10 g
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
Zn+H2SO4===ZnSO4+H2↑
65 g 1 mol
x g 0.125 mol
解得x=8.125;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
如果全部由铝生成,设需要铝的质量为y g,则:
2Al+3H2SO4===Al2(SO4)3+3H2↑
54 g 3 mol
y g 0.125 mol
解得y=2.25;
根据平均值原理,如果由锌和铝混合组成,则质量介于2.25~8.125 g之间。
14.化学实验中残余的氯气可以用氢氧化钠溶液吸收,以防污染空气。已知Cl2与NaOH发生反应:Cl2+2NaOH===NaCl+NaClO+H2O。若有3.20 g氢氧化钠发生了化学反应,回答下列问题:
(1)生成NaCl的质量为 g。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
2.34
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
Cl2 + 2NaOH===NaCl + NaClO + H2O
1 mol 2 mol 1 mol 1 mol 1 mol
n(Cl2) 0.08 mol n(NaCl) n(NaClO) n(H2O)
(2)生成NaClO的物质的量为 mol。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
0.04
(3)被吸收的氯气在标准状况下的体积为 L。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
0.896
15.以下是有关金属与酸的反应,请填写下列空白。
(1)分别取W g钠、铁、铝与足量的盐酸反应,在相同条件下产生氢气
的体积之比是 。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
由2Na+2HCl===2NaCl+H2↑、Fe+2HCl===FeCl2+H2↑、2Al+6HCl===2AlCl3+3H2↑可知,
(2)分别取0.1 mol 钠、铁、铝与足量的盐酸反应,在相同条件下产生氢气的体积之比是 。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
1∶2∶3
0.1 mol钠、铁、铝与足量的盐酸反应分别生成0.05 mol、0.10 mol、0.15 mol H2,故产生氢气的体积之比为0.05∶0.10∶0.15=1∶2∶3。
(3)若产生相同物质的量的氢气,所需钠、铁、铝的质量之比是 。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
23∶28∶9
(4)若产生相同体积(同温同压)的氢气,所需钠、铁、铝的物质的量之比是 。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
6∶3∶2
若产生相同体积(同温同压)的氢气,即产生相同物质的量的氢气,则需要钠、铁、铝的物质的量之比是6∶3∶2。
(5)取0.2 mol 的金属钠、铁、铝,分别投入10 mL 1 mol·L-1的盐酸中,标准状况下产生氢气的体积由大到小的顺序是 (钠、铁、铝产生氢气的体积分别用V1、V2、V3表示)。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
V1>V2=V3
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
10 mL 1 mol·L-1的盐酸中n(HCl)=0.010 mol,
由2Na+2HCl===2NaCl+H2↑、2Na+2H2O===2NaOH+H2↑、Fe+2HCl===FeCl2+H2↑、2Al+6HCl===2AlCl3+3H2↑可知,盐酸不足,生成的氢气的量是由盐酸决定的,即盐酸反应生成的n(H2)=0.005 mol;
但钠还能与水反应生成氢气,最终生成氢气的量:V1>V2=V3。
返回
