2022-2023学年苏教版2019高中化学必修1 专题3 第二单元 微专题三 碳酸钠和碳酸氢钠的除杂和相关计算 课件(18张PPT)
文档属性
| 名称 | 2022-2023学年苏教版2019高中化学必修1 专题3 第二单元 微专题三 碳酸钠和碳酸氢钠的除杂和相关计算 课件(18张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 233.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-07-15 21:31:29 | ||
图片预览





文档简介
(共18张PPT)
微专题三
WEIZHUANTISAN
碳酸钠和碳酸氢钠的除杂和相关计算
专题3
一、常用的除杂方法
1.除杂原则
(1)不影响主要物质;
(2)不引入新杂质;
(3)除杂剂易除去。
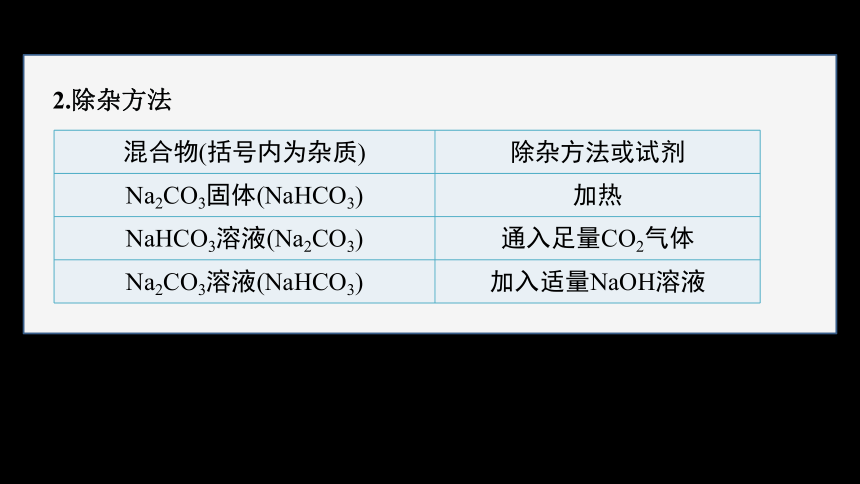
2.除杂方法
混合物(括号内为杂质) 除杂方法或试剂
Na2CO3固体(NaHCO3) 加热
NaHCO3溶液(Na2CO3) 通入足量CO2气体
Na2CO3溶液(NaHCO3) 加入适量NaOH溶液
二、碳酸钠与碳酸氢钠的相关计算
1.质量差量法
在反应前后,物质的质量差和参加该反应的反应物或生成物的质量成正比关系。
当有168 g NaHCO3受热分解后,固体质量减少62 g,实际参与反应的各物质的质量对应成比例。
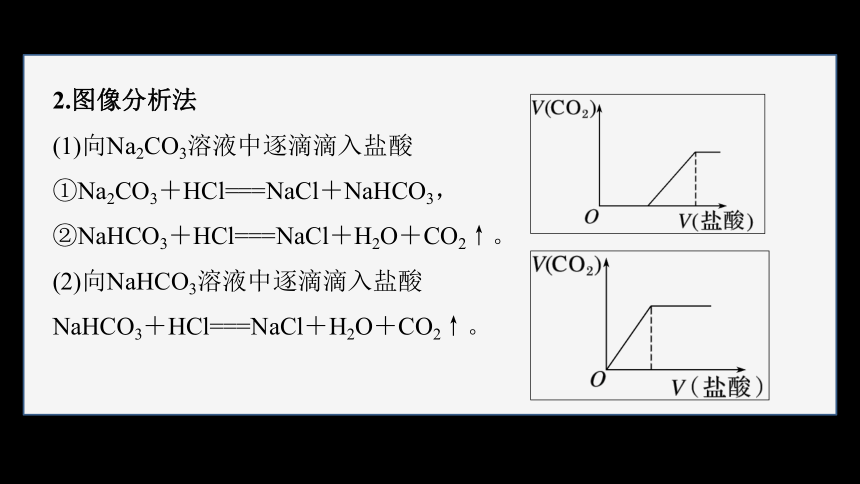
2.图像分析法
(1)向Na2CO3溶液中逐滴滴入盐酸
①Na2CO3+HCl===NaCl+NaHCO3,
②NaHCO3+HCl===NaCl+H2O+CO2↑。
(2)向NaHCO3溶液中逐滴滴入盐酸
NaHCO3+HCl===NaCl+H2O+CO2↑。
(3)向NaOH、Na2CO3混合液中滴加盐酸
①NaOH+HCl===NaCl+H2O,
②Na2CO3+HCl===NaCl+NaHCO3,
③NaHCO3+HCl===NaCl+H2O+CO2↑。
1
2
3
4
1.向NaOH和Na2CO3的混合溶液中滴加3.65 g·L-1稀盐酸,生成CO2的质量与加入盐酸的体积关系如图所示。下列判断正确的是
A.在O~a内,只发生酸碱中和反应
B.ab段发生反应的化学方程式为Na2CO3+
2HCl===2NaCl+CO2↑+H2O
C.a=0.3
D.原混合溶液中NaOH与Na2CO3的物质的量之比为1∶2
5
√
1
2
3
4
5
在O~a内,先发生HCl与NaOH的中和反应,再发
生Na2CO3与HCl生成碳酸氢钠的反应,A项错误;
a点时的溶液为氯化钠和碳酸氢钠的混合溶液,所
以发生的反应应为NaHCO3+HCl===NaCl+CO2↑+H2O,B项错误;
由图像可知生成CO2的物质的量为0.01 mol,根据化学方程式NaHCO3+HCl===NaCl+CO2↑+H2O可知,消耗HCl的物质的量为0.01 mol,故a=0.3,C项正确;
1
2
3
4
5
根据化学方程式和图像可知Na2CO3的物质的量是0.01 mol,所以与NaOH反应的HCl的物质的量为0.03 mol-0.01 mol=0.02 mol,则NaOH的物质的量为0.02 mol,因此原混合液中,NaOH与Na2CO3的物质的量之比为2∶1,D项错误。
1
2
3
4
2.下列可用于判断碳酸氢钠粉末中混有碳酸钠的实验方法及现象是
A.加热时无气体放出
B.滴加盐酸时有气泡放出
C.溶于水后滴加BaCl2稀溶液有白色沉淀生成
D.溶于水后滴加澄清石灰水有白色沉淀生成
5
√
溶于水后滴加澄清石灰水时NaHCO3也会产生白色沉淀,所以可以滴加BaCl2或CaCl2溶液。
3.要除去碳酸氢钠溶液中混有的少量碳酸钠,最好采用
A.加入过量的澄清石灰水
B.通入足量的CO2气体
C.将溶液加热蒸干并灼烧
D.加入适量的氢氧化钠溶液
1
2
3
4
5
√
1
2
3
4
5
澄清石灰水和碳酸钠、碳酸氢钠均发生反应,生成碳酸钙沉淀,故A错误;
可以通入足量的二氧化碳使碳酸钠转化为碳酸氢钠而除去,反应的化学方程式为Na2CO3+CO2+H2O===2NaHCO3,并且二氧化碳和碳酸氢钠之间不会发生反应,故B正确;
将溶液加热蒸干并灼烧,可使碳酸氢钠分解生成碳酸钠,故C错误;
氢氧化钠和碳酸氢钠反应生成碳酸钠和水,但是和碳酸钠之间不会反应,故D错误。
1
2
3
4
4.把Na2CO3和NaHCO3的混合物27.4 g加热到质量不再变化时,得残留固体21.2 g。则原混合物中NaHCO3和Na2CO3的质量之比为
A.53∶84 B.84∶53
C.1∶1 D.42∶53
5
√
1
2
3
4
设NaHCO3的质量为x,则根据化学方程式可知
5
则混合物中碳酸钠的质量是27.4 g-16.8 g=10.6 g,
所以原混合物中NaHCO3与Na2CO3的质量之比为16.8∶10.6=84∶53。
1
2
3
4
5.将一定体积的CO2通入一定浓度的NaOH溶液中,为了测定所得溶液的成分,向该溶液中逐滴加入盐酸,所加盐酸的体积与产生CO2的体积(标准状况)的关系如图所示:
5
1
2
3
4
(1)溶液中所含溶质为________________。
(2)OA段发生反应的化学方程式:______
___________________________________
__________________。AB段发生反应的
化学方程式:__________________________________。
5
NaOH、Na2CO3
HCl+
NaOH===H2O+NaCl、HCl+Na2CO3
===NaHCO3+NaCl
HCl+NaHCO3===CO2↑+H2O+NaCl
1
2
3
4
由图像所示消耗盐酸的体积与产生CO2的体积可知,该溶液的溶质是NaOH和Na2CO3;
若溶质全部是Na2CO3,碳酸根离子转化为碳酸氢根离子和碳酸氢根离子转化为二氧化碳
5
消耗的盐酸是等量的,OA段应该消耗20 mL,所以,前5 mL应该是与氢氧化钠发生的中和反应;
OA段HCl先与NaOH反应生成H2O,待NaOH消耗完,HCl再与Na2CO3反应生成NaHCO3。
本课结束
专题3
微专题三
WEIZHUANTISAN
碳酸钠和碳酸氢钠的除杂和相关计算
专题3
一、常用的除杂方法
1.除杂原则
(1)不影响主要物质;
(2)不引入新杂质;
(3)除杂剂易除去。
2.除杂方法
混合物(括号内为杂质) 除杂方法或试剂
Na2CO3固体(NaHCO3) 加热
NaHCO3溶液(Na2CO3) 通入足量CO2气体
Na2CO3溶液(NaHCO3) 加入适量NaOH溶液
二、碳酸钠与碳酸氢钠的相关计算
1.质量差量法
在反应前后,物质的质量差和参加该反应的反应物或生成物的质量成正比关系。
当有168 g NaHCO3受热分解后,固体质量减少62 g,实际参与反应的各物质的质量对应成比例。
2.图像分析法
(1)向Na2CO3溶液中逐滴滴入盐酸
①Na2CO3+HCl===NaCl+NaHCO3,
②NaHCO3+HCl===NaCl+H2O+CO2↑。
(2)向NaHCO3溶液中逐滴滴入盐酸
NaHCO3+HCl===NaCl+H2O+CO2↑。
(3)向NaOH、Na2CO3混合液中滴加盐酸
①NaOH+HCl===NaCl+H2O,
②Na2CO3+HCl===NaCl+NaHCO3,
③NaHCO3+HCl===NaCl+H2O+CO2↑。
1
2
3
4
1.向NaOH和Na2CO3的混合溶液中滴加3.65 g·L-1稀盐酸,生成CO2的质量与加入盐酸的体积关系如图所示。下列判断正确的是
A.在O~a内,只发生酸碱中和反应
B.ab段发生反应的化学方程式为Na2CO3+
2HCl===2NaCl+CO2↑+H2O
C.a=0.3
D.原混合溶液中NaOH与Na2CO3的物质的量之比为1∶2
5
√
1
2
3
4
5
在O~a内,先发生HCl与NaOH的中和反应,再发
生Na2CO3与HCl生成碳酸氢钠的反应,A项错误;
a点时的溶液为氯化钠和碳酸氢钠的混合溶液,所
以发生的反应应为NaHCO3+HCl===NaCl+CO2↑+H2O,B项错误;
由图像可知生成CO2的物质的量为0.01 mol,根据化学方程式NaHCO3+HCl===NaCl+CO2↑+H2O可知,消耗HCl的物质的量为0.01 mol,故a=0.3,C项正确;
1
2
3
4
5
根据化学方程式和图像可知Na2CO3的物质的量是0.01 mol,所以与NaOH反应的HCl的物质的量为0.03 mol-0.01 mol=0.02 mol,则NaOH的物质的量为0.02 mol,因此原混合液中,NaOH与Na2CO3的物质的量之比为2∶1,D项错误。
1
2
3
4
2.下列可用于判断碳酸氢钠粉末中混有碳酸钠的实验方法及现象是
A.加热时无气体放出
B.滴加盐酸时有气泡放出
C.溶于水后滴加BaCl2稀溶液有白色沉淀生成
D.溶于水后滴加澄清石灰水有白色沉淀生成
5
√
溶于水后滴加澄清石灰水时NaHCO3也会产生白色沉淀,所以可以滴加BaCl2或CaCl2溶液。
3.要除去碳酸氢钠溶液中混有的少量碳酸钠,最好采用
A.加入过量的澄清石灰水
B.通入足量的CO2气体
C.将溶液加热蒸干并灼烧
D.加入适量的氢氧化钠溶液
1
2
3
4
5
√
1
2
3
4
5
澄清石灰水和碳酸钠、碳酸氢钠均发生反应,生成碳酸钙沉淀,故A错误;
可以通入足量的二氧化碳使碳酸钠转化为碳酸氢钠而除去,反应的化学方程式为Na2CO3+CO2+H2O===2NaHCO3,并且二氧化碳和碳酸氢钠之间不会发生反应,故B正确;
将溶液加热蒸干并灼烧,可使碳酸氢钠分解生成碳酸钠,故C错误;
氢氧化钠和碳酸氢钠反应生成碳酸钠和水,但是和碳酸钠之间不会反应,故D错误。
1
2
3
4
4.把Na2CO3和NaHCO3的混合物27.4 g加热到质量不再变化时,得残留固体21.2 g。则原混合物中NaHCO3和Na2CO3的质量之比为
A.53∶84 B.84∶53
C.1∶1 D.42∶53
5
√
1
2
3
4
设NaHCO3的质量为x,则根据化学方程式可知
5
则混合物中碳酸钠的质量是27.4 g-16.8 g=10.6 g,
所以原混合物中NaHCO3与Na2CO3的质量之比为16.8∶10.6=84∶53。
1
2
3
4
5.将一定体积的CO2通入一定浓度的NaOH溶液中,为了测定所得溶液的成分,向该溶液中逐滴加入盐酸,所加盐酸的体积与产生CO2的体积(标准状况)的关系如图所示:
5
1
2
3
4
(1)溶液中所含溶质为________________。
(2)OA段发生反应的化学方程式:______
___________________________________
__________________。AB段发生反应的
化学方程式:__________________________________。
5
NaOH、Na2CO3
HCl+
NaOH===H2O+NaCl、HCl+Na2CO3
===NaHCO3+NaCl
HCl+NaHCO3===CO2↑+H2O+NaCl
1
2
3
4
由图像所示消耗盐酸的体积与产生CO2的体积可知,该溶液的溶质是NaOH和Na2CO3;
若溶质全部是Na2CO3,碳酸根离子转化为碳酸氢根离子和碳酸氢根离子转化为二氧化碳
5
消耗的盐酸是等量的,OA段应该消耗20 mL,所以,前5 mL应该是与氢氧化钠发生的中和反应;
OA段HCl先与NaOH反应生成H2O,待NaOH消耗完,HCl再与Na2CO3反应生成NaHCO3。
本课结束
专题3
