2022-2023学年苏教版2019高中化学必修1 专题3 第三单元 第1课时 粗盐提纯 从海水中提取溴 课件(70张PPT)
文档属性
| 名称 | 2022-2023学年苏教版2019高中化学必修1 专题3 第三单元 第1课时 粗盐提纯 从海水中提取溴 课件(70张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-07-15 21:33:32 | ||
图片预览










文档简介
(共70张PPT)
第1课时
DIYIKESHI
粗盐提纯 / 从海水中提取溴 / 随堂演练 知识落实 / 课时对点练
粗盐提纯 从海水中提取溴
专题3
核心素养
发展目标
1.掌握粗盐的提纯方法,学会利用离子反应进行物质的除杂与提纯。
2.掌握从海水中提取溴的原理和过程。
3.了解溴元素在生产、生活中的应用。
内容索引
一、粗盐提纯
二、从海水中提取溴
随堂演练 知识落实
课时对点练
粗盐提纯
一
1.海洋资源
2.粗盐提纯
粗盐中含有其他一些盐(如CaCl2、MgCl2、Na2SO4)和难溶性杂质。
(1)粗盐中难溶性杂质的去除
通过 、 等实验操作,保留 ,除去难溶性杂质。
溶解
过滤
滤液
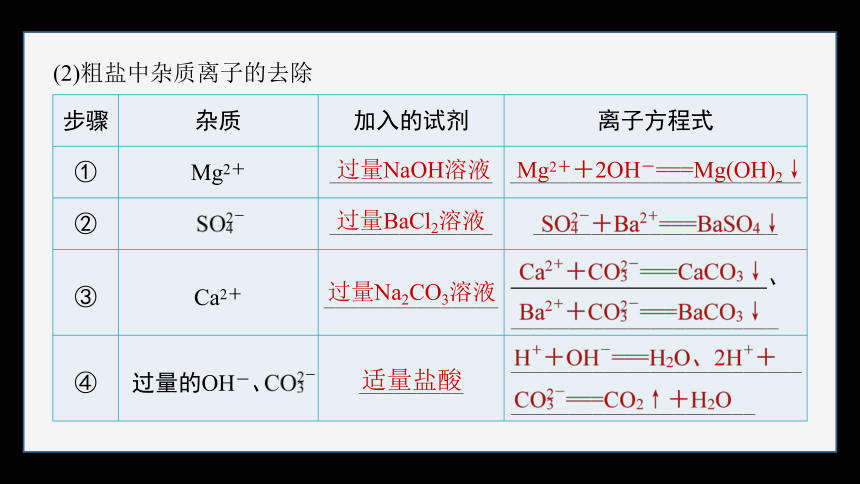
(2)粗盐中杂质离子的去除
步骤 杂质 加入的试剂 离子方程式
① Mg2+ ______________ _________________________
② ______________ _____________________
③ Ca2+ _______________ 、_______________________
④ 过量的OH-、 _________ ______________________________________________
过量NaOH溶液
Mg2++2OH-===Mg(OH)2↓
过量BaCl2溶液
过量Na2CO3溶液
适量盐酸
(1)海水中含有80多种元素,每种元素的总含量都很小( )
(2)粗盐中含有不溶性的泥沙、可溶性的CaCl2、MgCl2、Na2SO4,利用过滤的方法均可除去( )
(3)除去NaCl溶液中的CaCl2杂质,可以加入过量的K2CO3溶液( )
(4)为保证原溶液纯净,加入的除杂试剂应越少越好( )
(5)只要选择好合适的除杂试剂,可以不考虑添加顺序( )
×
×
×
×
×
正误判断
1.下图是某研究性学习小组设计的除去粗食盐中可溶性杂质的流程,思考并解答下列问题:
深度思考
(1)写出第③步反应的离子方程式:_________________________________
。
===BaCO3↓
(2)Na2CO3溶液和BaCl2溶液的顺序是否可以颠倒?为什么?
深度思考
提示 不可以。Na2CO3溶液的作用不仅是除去溶液中的Ca2+,还要除去溶液中过量的Ba2+,因此Na2CO3溶液必须在加入BaCl2溶液之后加入。
(3)如何检验食盐水中杂质离子已除干净?
深度思考
②取少许滤液于试管中,加入NaOH溶液,若无白色沉淀生成,证明Mg2+已除净。
③取少许滤液于试管中,加入Na2CO3溶液,若无白色沉淀生成,证明Ca2+已除净。
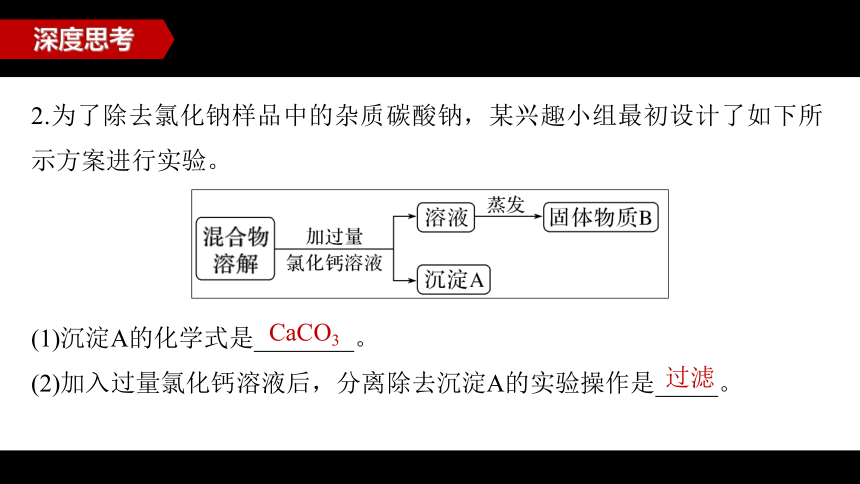
2.为了除去氯化钠样品中的杂质碳酸钠,某兴趣小组最初设计了如下所示方案进行实验。
深度思考
(1)沉淀A的化学式是________。
(2)加入过量氯化钙溶液后,分离除去沉淀A的实验操作是_____。
CaCO3
过滤
深度思考
(3)他们在实验过程中,又发现了新的问题:此方案很容易引入新的杂质。固体物质B的成分为_____________(用化学式表示)。
(4)他们继续探究后又提出了新的方案:将混合物溶解,滴加盐酸至不再产生气泡为止,然后加热煮沸。有关反应的化学方程式为_____________
______________________。
NaCl和CaCl2
Na2CO3+2HCl
===2NaCl+H2O+CO2↑
若用 CaCl2除去碳酸钠,生成碳酸钙沉淀,也会引入新杂质CaCl2,蒸发后所得固体应是NaCl和CaCl2的混合物;
若用盐酸除去碳酸钠,则溶液中只有NaCl和HCl,蒸发结晶时HCl挥发,可得纯净的NaCl。
归纳总结
1.物质除杂和分离的基本原则
(1)不增(不引入新的杂质)。
(2)不减(不减少被提纯的物质)。
(3)易分离(被提纯的物质与杂质易分离)。
(4)易复原(被提纯的物质易复原)。
归纳总结
2.物质除杂和分离注意的问题
(1)除杂试剂要过量。
(2)后续试剂应能除去过量的前一试剂。
(3)尽可能将杂质转化为所需物质。
(4)除去多种杂质时考虑加入试剂的合理顺序。
返回
从海水中提取溴
二
1.海水提溴
世界上99%的溴都蕴藏于大海中,常温下,纯净的溴单质为深红棕色液体,易挥发。一种从海水中提取溴的流程如图:
(1)硫酸酸化的目的: 。
(2)反应②的离子方程式: 。
抑制氯、溴与水的反应
Cl2+2Br-===Br2+2Cl-
特别提醒 粗溴的精制常用SO2水溶液吸收Br2,生成HBr,最后用Cl2氧化得到纯度较高的Br2,最后通过萃取、分液和蒸馏等操作得到高纯度的溴单质。
2.溴元素在生产、生活中的应用
(1)制备药物。如消毒药剂“红药水”、镇静剂、青霉素等药物中都含有溴元素。
(2)制造农业杀虫剂、阻燃剂的原料。
(3)作感光剂。溴化银可用作医疗X射线胶片上的感光剂。
(4)变色玻璃中通常加入适量的溴化银和氧化铜的微小晶粒。其变色原
理用化学方程式表示为① ,②______________
。
2AgBr
深度思考
海水是巨大的资源宝库,可以进行综合利用。从海水中提取淡水、食盐和溴的过程如图:
深度思考
(1)步骤Ⅱ用SO2水溶液吸收Br2,
反应的化学方程式为Br2+SO2+
2H2O===H2SO4+2HBr。在该反
应中,氧化剂是____(填化学式);
若反应中生成2 mol HBr,则消耗__mol SO2。
(2)根据上述反应可判断出SO2、Cl2、Br2三种物质的氧化性由强到弱的顺序是_____________。
(3)写出步骤Ⅲ的化学方程式:_______________________。
Br2
1
Cl2>Br2>SO2
2HBr+Cl2===Br2+2HCl
返回
随堂演练 知识落实
1.下列有关海水提溴的说法错误的是
A.海水晒盐后的卤水是提溴原料
B.可以利用氯气氧化溴离子
C.可用高温水蒸气将溴从溶液中吹出
D.吹出的溴蒸气冷凝后得到纯溴
1
2
3
√
4
1
2
3
4
海水提溴的三个步骤是(1)先将浓缩海水中的Br-用氯气氧化:Cl2+2Br-===Br2+2Cl-。
(3)用氯气将富集的溴离子氧化得到产品溴:Cl2+2Br-===Br2+2Cl-。
2.海盐经溶解、过滤后仍含有Ca2+、Mg2+、 可溶性杂质,为了得到纯净的NaCl,可向滤液中依次加入过量的下列溶液,其中不合理的是
A.BaCl2溶液→NaOH溶液→Na2CO3溶液→过滤→稀盐酸→蒸发结晶
B.Ba(OH)2溶液→Na2CO3溶液→过滤→稀盐酸→蒸发结晶
C.Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤→稀盐酸→蒸发结晶
D.BaCl2溶液→Na2CO3溶液→NaOH溶液→过滤→稀盐酸→蒸发结晶
1
2
3
√
4
1
2
3
4
3.为了除去KCl固体中少量的MgCl2、MgSO4,可选用Ba(OH)2、HCl和K2CO3三种试剂,按下图步骤操作:
1
2
3
4
(1)写出三种试剂的化学式:
A_________,B________,C_____。
Ba(OH)2 K2CO3 HCl
1
2
3
4
(2)①加入过量A的目的是___________________。
②加入过量B的目的是_______________________________。
③加热煮沸的目的是__________。
(3)操作Ⅰ是_____。
除去MgCl2和MgSO4
除去过量的Ba(OH)2和生成的BaCl2
使HCl挥发
过滤
1
2
3
要使杂质一一除去,必须考虑到所加试剂是过量的,而且过量的试剂在后面步骤中必须除去,
4
1
2
3
4
加入的过量Ba(OH)2中的Ba2+可用K2CO3除去,
4.某化学学习小组为了解工业生产中提纯溴的方法,查阅了有关资料:Br2是沸点为59 ℃,微溶于水,有毒性和强腐蚀性的深红棕色液体。他们设计如图所示装置(省略加热和夹持装置)进行溴的提纯,回答下列问题:
1
2
3
4
(1)图中仪器B的名称:_________
______。
(2)整套实验装置中仪器的连接均
不能用橡胶塞和橡胶管,其原因
是____________。
1
2
3
4
(直形)冷
凝管
溴腐蚀橡胶
溴具有腐蚀性,可以腐蚀橡胶,故整套实验装置中仪器的连接均不能用橡胶塞和橡胶管。
(3)实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件:________________________
_____________。
1
2
3
4
控制温度计b的温度,收集59 ℃时的馏分
溴的沸点为59 ℃,可采用水浴加热,并通过温度计b控制温度,收集59 ℃时的馏分。
(4)C中产生的液体颜色为_________。为除去该产物中残留的少量Cl2,可向其中加入NaBr溶液,充分反应后,再进行的分离操作是_____。
1
2
3
4
深红棕色
蒸馏
1
2
3
4
C中液体主要是液溴,颜色为深红棕色。要除去液溴中残留的少量Cl2,可向其中加入NaBr溶液,发生反应:Cl2+2NaBr===2NaCl+Br2,溴的沸点为59 ℃,故可采用水浴加热进行蒸馏得到纯净的液溴。
返回
课时对点练
题组一 粗盐提纯
1.中国食盐产量居世界首位。下列实验室中的操作类似“海水晒盐”原理的是
A.蒸馏 B.蒸发 C.过滤 D.搅拌
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
2.为了除去粗盐中的CaCl2、MgCl2、Na2SO4及泥沙,可将粗盐溶于水,然后进行下列五项操作:①过滤 ②加过量NaOH溶液 ③加适量盐酸 ④加过量Na2CO3溶液 ⑤加过量BaCl2溶液。正确的操作顺序是
A.①④②⑤③ B.④①②⑤③
C.⑤④①②③ D.⑤②④①③
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
粗盐提纯过程中,加NaOH除去MgCl2,加BaCl2除去Na2SO4,加Na2CO3除去CaCl2和过量的BaCl2,故碳酸钠一定要在加入氯化钡之后加入,过滤后加盐酸、蒸发得到 NaCl,则正确的操作顺序为⑤②④①③或②⑤④①③或⑤④②①③。
3.关于粗盐提纯的下列说法正确的是
A.溶解粗盐时,应尽量让溶液稀些,防止食盐不完全溶解
B.将制得的食盐晶体转移到新制过滤器中用大量水进行洗涤
C.当蒸发到剩余少量液体时,停止加热,利用余热将液体蒸干
D.为除去粗盐中的Ca2+、Mg2+、 可依次向溶液中加入足量的碳酸
钠溶液、氢氧化钠溶液、氯化钡溶液、稀盐酸
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
溶解时不是越稀越好,如果溶液太稀,蒸发时就要消耗很长时间才能蒸干,A错误;
食盐晶体应该用少量水洗涤,否则制得的晶体会有很多溶于水,B错误;
蒸发时,当有大量晶体析出时应停止加热,用余热蒸干剩余液体,以免晶体受热后飞溅出来,不仅造成损失,而且可能因此发生意外事故,C正确;
由于过量的钡离子需要用碳酸钠除去,则碳酸钠一定要在加入氯化钡溶液之后加入,D错误。
4.除去粗盐中的杂质MgCl2、CaCl2和Na2SO4的过程如下:
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
下列有关说法不正确的是
A.试剂①②③分别是NaOH、Na2CO3、BaCl2
B.除去Ca2+的主要反应:Ca2++
C.检验 是否除净的方法:取适量滤液,加稀盐酸酸化,再加BaCl2溶液
D.加稀盐酸调节pH后,采用蒸发结晶的方法得到NaCl固体
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
题组二 海水提溴
5.目前从海水中提取的溴约占世界溴年产量的三分之一,从海水中提取溴的主要步骤可表示为
A.氧化→吸收→吹出→氧化
B.氧化→吹出→吸收→氧化
C.吹出→氧化→吸收→氧化
D.吹出→吸收→氧化
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
6.用空气吹出法从海水中提取溴所涉及的化学反应可能有
①Cl2+2Br-===2Cl-+Br2
②Br2+SO2+2H2O===2HBr+H2SO4
③Br2+2I-===I2+2Br-
④2I-+H2O2+2H+===I2+2H2O
A.①② B.②③ C.③④ D.①④
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
7.“空气吹出法”海水提溴的工艺流程如下:
下列说法不正确的是
A.实验室保存溴通常加少量水
B.海水提溴发生的反应均为氧化还原
反应
C.经过吸收塔后,溴元素得到了富集
D.蒸馏塔中只发生了物理变化
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
溴易挥发,加水液封可以减少挥发
损失,A正确;
经过吸收塔后,所得溶液中Br-的
浓度远大于进入吹出塔之前海水中Br-的浓度,因此溴元素得到了富集,C正确;
蒸馏塔中发生的反应为2Br-+Cl2===2Cl-+Br2,D错误。
8.(2021·哈尔滨第三十二中学高一期末)海洋是非常巨大的资源宝库,以下有关海洋资源开发和利用的说法错误的是
A.海水中的元素种类很多,富集程度大
B.海水淡化的方法主要有蒸馏法、电渗析法、离子交换法等
C.海水中含有Cl、Na、K、Mg、Ca、S等多种元素
D.由于与岩石、大气和生物相互作用,海水中溶解和悬浮着大量无机
物和有机物
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
海水中元素种类多,总储量大,但富集程度低,A错误;
海水淡化的主要方法有蒸馏法、电渗析法、离子交换法等,B正确;
在海水中迄今已发现的80多种化学元素中,含量较高的元素除组成水的氢、氧元素外,还有氯、钠、镁、硫、钙、钾、溴等,C正确。
9.从淡化海水中提取溴的流程如下:
下列有关说法不正确的是
A.X试剂可用Na2SO3饱和溶液
B.步骤Ⅲ的离子反应:2Br-+
Cl2===2Cl-+Br2
C.工业上每获得1 mol Br2,需要
消耗44.8 L Cl2
D.步骤Ⅳ包含萃取、分液和蒸馏
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
Na2SO3饱和溶液吸收Br2的反应
为Na2SO3+Br2+H2O===Na2SO4
+2HBr,A正确;
步骤Ⅲ利用氯元素的非金属性
比溴元素强,可以利用置换反应制取Br2,B正确;
未标明氯气所处的温度和压强,无法计算消耗氯气的体积,C错误;
从浓溴水中提取溴,可利用有机溶剂(如苯)萃取溴,然后分液得到溴的有机溶液,再经蒸馏可得到纯净的溴,D正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
10.从海水中可以提取溴,主要反应为2KBr+Cl2===Br2+2KCl,下列说法正确的是
A.溴离子具有氧化性
B.氯气是还原剂
C.该反应属于复分解反应
D.氯气的氧化性比溴单质强
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
Br-中溴元素的化合价处于最低价态,只有还原性,A错;
氯气在反应中作氧化剂,B错;
该反应属于置换反应,C错;
该反应中,氯气为氧化剂,溴为氧化产物,氧化剂的氧化性大于氧化产物的氧化性,D正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
11.在空气吹出法的工艺中,选用纯碱溶液作溴蒸气吸收剂的反应原理为3Na2CO3+3Br2===5NaBr+NaBrO3+3CO2,也有选用SO2作溴蒸气吸收剂的,下列有关说法正确的是
A.两种吸收过程中,Br2只作氧化剂
B.只有SO2吸收过程发生了氧化还原反应
C.用纯碱溶液作吸收剂时,纯碱既不是还原剂也不是氧化剂
D.用纯碱溶液作吸收剂只发生了复分解反应
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
①纯碱溶液作吸收剂的反应为3Na2CO3+3Br2===5NaBr+NaBrO3+3CO2;
②SO2作吸收剂的反应为SO2+Br2+2H2O===H2SO4+2HBr。
分析以上两个反应可知:①中Br2既作氧化剂,又作还原剂,Na2CO3既不是还原剂也不是氧化剂,②中Br2只作氧化剂,①②均属于氧化还原反应。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
12.一种从含Br-废水中提取Br2的过程,包括过滤、氧化、正十二烷(一种难溶于水的有机溶剂)萃取及蒸馏等步骤。已知:
Br2 CCl4 正十二烷
密度/(g·cm-3) 3.119 1.595 0.753
沸点/℃ 58.76 76.8 215~217
下列说法正确的是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
A.用甲装置过滤时,需不断搅拌
B.用乙装置将Br-氧化为Br2
C.丙装置中用正十二烷而不用CCl4,是因为其密度小
D.可用丁装置进行蒸馏,先收集正十二烷再收集Br2
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
过滤时不能搅拌;选用沸点较大的正十二烷,便于萃取后蒸馏,与密度无关;沸点低的物质先蒸馏出来。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
13.海水提溴过程中,将溴吹入吸收塔,使溴蒸气和吸收剂SO2发生作用,以达到富集的目的,化学反应为Br2+SO2+2H2O===2HBr+H2SO4。下列说法正确的是
A.Br2在反应中失去电子
B.SO2在反应中表现还原性
C.H2O在反应中作氧化剂
D.反应过程中共转移了4 mol电子
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
Br元素的化合价由0价降低到-1价,在反应中得到电子,故A错误;
S元素的化合价由+4价升高到+6价,SO2作还原剂,在反应中表现还原性,故B正确;
H2O在反应中元素化合价没有发生变化,所以既不是氧化剂也不是还原剂,故C错误;
1 mol氧化剂在反应中得到1 mol×2×[0-(-1)]=2 mol电子,故D错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
14.通过海水晾晒可得粗盐,粗盐中除含有NaCl外,还含有MgCl2、CaCl2、Na2SO4以及泥沙等杂质。制备精盐的各步操作流程如下:
(1)在第⑦步蒸发过程中要用玻璃棒搅拌,目的是__________________
________________________。
防止液体局部受热温度过高,造成液体飞溅
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
(2)第②④步操作的目的分别是除去粗盐中的Na2SO4和CaCl2,需要加入的试剂依次是________________(填化学式)。
BaCl2、Na2CO3
第②步操作的目的是除去粗盐中的硫酸钠,则需要加入过量BaCl2溶液,第④步操作是为了除去CaCl2及过量的BaCl2,则需要加入过量Na2CO3溶液。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
(3)第⑥步操作中发生反应的化学方程式为_________________________
____________________________________。
NaOH+HCl===NaCl+H2O、Na2CO3+2HCl===2NaCl+H2O+CO2↑
第⑥步操作的目的是除去滤液中过量的氢氧化钠和碳酸钠。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
(4)在第③步操作中,选择的除杂试剂不能是KOH溶液,理由是______
_____________。
(5)第⑤步操作中,需要的玻璃仪器有_____、_____、_______。
会引
入新杂质K+
漏斗 烧杯 玻璃棒
15.海水是巨大的资源宝库,在海水淡化及综合利用方面,天津市位居全国前列。从海水中提取食盐和溴的过程如图:
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
(1)海水淡化的方法有电渗析法、离子交换法和________(写出一种即可)。
蒸馏法
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
(2)将NaCl溶液进行电解,生成H2、Cl2和NaOH,该电解反应的离子方程式为____________________________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
(3)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的为______
_____。
富集溴
元素
这里应抓住“低浓度溴溶液”和“工业溴”两个关键信息进行分析判断。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
(4)步骤Ⅱ用SO2水溶液吸收Br2生成H2SO4和HBr,吸收率可达95%,有关反应的化学方程式为_______________________________。
由此反应可知,除环境保护外,在工业生产中应解决的主要问题是_____________________。
Br2+SO2+2H2O===2HBr+H2SO4
强酸对设备的严重腐蚀
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
SO2有较强的还原性,Br2有强氧化性,根据氧化还原反应规律和质量守恒定律可写出该反应的化学方程式。SO2的水溶液与Br2反应生成酸,工业设备中的很多零部件是不耐酸的。
返回
第1课时
DIYIKESHI
粗盐提纯 / 从海水中提取溴 / 随堂演练 知识落实 / 课时对点练
粗盐提纯 从海水中提取溴
专题3
核心素养
发展目标
1.掌握粗盐的提纯方法,学会利用离子反应进行物质的除杂与提纯。
2.掌握从海水中提取溴的原理和过程。
3.了解溴元素在生产、生活中的应用。
内容索引
一、粗盐提纯
二、从海水中提取溴
随堂演练 知识落实
课时对点练
粗盐提纯
一
1.海洋资源
2.粗盐提纯
粗盐中含有其他一些盐(如CaCl2、MgCl2、Na2SO4)和难溶性杂质。
(1)粗盐中难溶性杂质的去除
通过 、 等实验操作,保留 ,除去难溶性杂质。
溶解
过滤
滤液
(2)粗盐中杂质离子的去除
步骤 杂质 加入的试剂 离子方程式
① Mg2+ ______________ _________________________
② ______________ _____________________
③ Ca2+ _______________ 、_______________________
④ 过量的OH-、 _________ ______________________________________________
过量NaOH溶液
Mg2++2OH-===Mg(OH)2↓
过量BaCl2溶液
过量Na2CO3溶液
适量盐酸
(1)海水中含有80多种元素,每种元素的总含量都很小( )
(2)粗盐中含有不溶性的泥沙、可溶性的CaCl2、MgCl2、Na2SO4,利用过滤的方法均可除去( )
(3)除去NaCl溶液中的CaCl2杂质,可以加入过量的K2CO3溶液( )
(4)为保证原溶液纯净,加入的除杂试剂应越少越好( )
(5)只要选择好合适的除杂试剂,可以不考虑添加顺序( )
×
×
×
×
×
正误判断
1.下图是某研究性学习小组设计的除去粗食盐中可溶性杂质的流程,思考并解答下列问题:
深度思考
(1)写出第③步反应的离子方程式:_________________________________
。
===BaCO3↓
(2)Na2CO3溶液和BaCl2溶液的顺序是否可以颠倒?为什么?
深度思考
提示 不可以。Na2CO3溶液的作用不仅是除去溶液中的Ca2+,还要除去溶液中过量的Ba2+,因此Na2CO3溶液必须在加入BaCl2溶液之后加入。
(3)如何检验食盐水中杂质离子已除干净?
深度思考
②取少许滤液于试管中,加入NaOH溶液,若无白色沉淀生成,证明Mg2+已除净。
③取少许滤液于试管中,加入Na2CO3溶液,若无白色沉淀生成,证明Ca2+已除净。
2.为了除去氯化钠样品中的杂质碳酸钠,某兴趣小组最初设计了如下所示方案进行实验。
深度思考
(1)沉淀A的化学式是________。
(2)加入过量氯化钙溶液后,分离除去沉淀A的实验操作是_____。
CaCO3
过滤
深度思考
(3)他们在实验过程中,又发现了新的问题:此方案很容易引入新的杂质。固体物质B的成分为_____________(用化学式表示)。
(4)他们继续探究后又提出了新的方案:将混合物溶解,滴加盐酸至不再产生气泡为止,然后加热煮沸。有关反应的化学方程式为_____________
______________________。
NaCl和CaCl2
Na2CO3+2HCl
===2NaCl+H2O+CO2↑
若用 CaCl2除去碳酸钠,生成碳酸钙沉淀,也会引入新杂质CaCl2,蒸发后所得固体应是NaCl和CaCl2的混合物;
若用盐酸除去碳酸钠,则溶液中只有NaCl和HCl,蒸发结晶时HCl挥发,可得纯净的NaCl。
归纳总结
1.物质除杂和分离的基本原则
(1)不增(不引入新的杂质)。
(2)不减(不减少被提纯的物质)。
(3)易分离(被提纯的物质与杂质易分离)。
(4)易复原(被提纯的物质易复原)。
归纳总结
2.物质除杂和分离注意的问题
(1)除杂试剂要过量。
(2)后续试剂应能除去过量的前一试剂。
(3)尽可能将杂质转化为所需物质。
(4)除去多种杂质时考虑加入试剂的合理顺序。
返回
从海水中提取溴
二
1.海水提溴
世界上99%的溴都蕴藏于大海中,常温下,纯净的溴单质为深红棕色液体,易挥发。一种从海水中提取溴的流程如图:
(1)硫酸酸化的目的: 。
(2)反应②的离子方程式: 。
抑制氯、溴与水的反应
Cl2+2Br-===Br2+2Cl-
特别提醒 粗溴的精制常用SO2水溶液吸收Br2,生成HBr,最后用Cl2氧化得到纯度较高的Br2,最后通过萃取、分液和蒸馏等操作得到高纯度的溴单质。
2.溴元素在生产、生活中的应用
(1)制备药物。如消毒药剂“红药水”、镇静剂、青霉素等药物中都含有溴元素。
(2)制造农业杀虫剂、阻燃剂的原料。
(3)作感光剂。溴化银可用作医疗X射线胶片上的感光剂。
(4)变色玻璃中通常加入适量的溴化银和氧化铜的微小晶粒。其变色原
理用化学方程式表示为① ,②______________
。
2AgBr
深度思考
海水是巨大的资源宝库,可以进行综合利用。从海水中提取淡水、食盐和溴的过程如图:
深度思考
(1)步骤Ⅱ用SO2水溶液吸收Br2,
反应的化学方程式为Br2+SO2+
2H2O===H2SO4+2HBr。在该反
应中,氧化剂是____(填化学式);
若反应中生成2 mol HBr,则消耗__mol SO2。
(2)根据上述反应可判断出SO2、Cl2、Br2三种物质的氧化性由强到弱的顺序是_____________。
(3)写出步骤Ⅲ的化学方程式:_______________________。
Br2
1
Cl2>Br2>SO2
2HBr+Cl2===Br2+2HCl
返回
随堂演练 知识落实
1.下列有关海水提溴的说法错误的是
A.海水晒盐后的卤水是提溴原料
B.可以利用氯气氧化溴离子
C.可用高温水蒸气将溴从溶液中吹出
D.吹出的溴蒸气冷凝后得到纯溴
1
2
3
√
4
1
2
3
4
海水提溴的三个步骤是(1)先将浓缩海水中的Br-用氯气氧化:Cl2+2Br-===Br2+2Cl-。
(3)用氯气将富集的溴离子氧化得到产品溴:Cl2+2Br-===Br2+2Cl-。
2.海盐经溶解、过滤后仍含有Ca2+、Mg2+、 可溶性杂质,为了得到纯净的NaCl,可向滤液中依次加入过量的下列溶液,其中不合理的是
A.BaCl2溶液→NaOH溶液→Na2CO3溶液→过滤→稀盐酸→蒸发结晶
B.Ba(OH)2溶液→Na2CO3溶液→过滤→稀盐酸→蒸发结晶
C.Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤→稀盐酸→蒸发结晶
D.BaCl2溶液→Na2CO3溶液→NaOH溶液→过滤→稀盐酸→蒸发结晶
1
2
3
√
4
1
2
3
4
3.为了除去KCl固体中少量的MgCl2、MgSO4,可选用Ba(OH)2、HCl和K2CO3三种试剂,按下图步骤操作:
1
2
3
4
(1)写出三种试剂的化学式:
A_________,B________,C_____。
Ba(OH)2 K2CO3 HCl
1
2
3
4
(2)①加入过量A的目的是___________________。
②加入过量B的目的是_______________________________。
③加热煮沸的目的是__________。
(3)操作Ⅰ是_____。
除去MgCl2和MgSO4
除去过量的Ba(OH)2和生成的BaCl2
使HCl挥发
过滤
1
2
3
要使杂质一一除去,必须考虑到所加试剂是过量的,而且过量的试剂在后面步骤中必须除去,
4
1
2
3
4
加入的过量Ba(OH)2中的Ba2+可用K2CO3除去,
4.某化学学习小组为了解工业生产中提纯溴的方法,查阅了有关资料:Br2是沸点为59 ℃,微溶于水,有毒性和强腐蚀性的深红棕色液体。他们设计如图所示装置(省略加热和夹持装置)进行溴的提纯,回答下列问题:
1
2
3
4
(1)图中仪器B的名称:_________
______。
(2)整套实验装置中仪器的连接均
不能用橡胶塞和橡胶管,其原因
是____________。
1
2
3
4
(直形)冷
凝管
溴腐蚀橡胶
溴具有腐蚀性,可以腐蚀橡胶,故整套实验装置中仪器的连接均不能用橡胶塞和橡胶管。
(3)实验装置气密性良好,要达到提纯溴的目的,操作中如何控制关键条件:________________________
_____________。
1
2
3
4
控制温度计b的温度,收集59 ℃时的馏分
溴的沸点为59 ℃,可采用水浴加热,并通过温度计b控制温度,收集59 ℃时的馏分。
(4)C中产生的液体颜色为_________。为除去该产物中残留的少量Cl2,可向其中加入NaBr溶液,充分反应后,再进行的分离操作是_____。
1
2
3
4
深红棕色
蒸馏
1
2
3
4
C中液体主要是液溴,颜色为深红棕色。要除去液溴中残留的少量Cl2,可向其中加入NaBr溶液,发生反应:Cl2+2NaBr===2NaCl+Br2,溴的沸点为59 ℃,故可采用水浴加热进行蒸馏得到纯净的液溴。
返回
课时对点练
题组一 粗盐提纯
1.中国食盐产量居世界首位。下列实验室中的操作类似“海水晒盐”原理的是
A.蒸馏 B.蒸发 C.过滤 D.搅拌
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
2.为了除去粗盐中的CaCl2、MgCl2、Na2SO4及泥沙,可将粗盐溶于水,然后进行下列五项操作:①过滤 ②加过量NaOH溶液 ③加适量盐酸 ④加过量Na2CO3溶液 ⑤加过量BaCl2溶液。正确的操作顺序是
A.①④②⑤③ B.④①②⑤③
C.⑤④①②③ D.⑤②④①③
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
粗盐提纯过程中,加NaOH除去MgCl2,加BaCl2除去Na2SO4,加Na2CO3除去CaCl2和过量的BaCl2,故碳酸钠一定要在加入氯化钡之后加入,过滤后加盐酸、蒸发得到 NaCl,则正确的操作顺序为⑤②④①③或②⑤④①③或⑤④②①③。
3.关于粗盐提纯的下列说法正确的是
A.溶解粗盐时,应尽量让溶液稀些,防止食盐不完全溶解
B.将制得的食盐晶体转移到新制过滤器中用大量水进行洗涤
C.当蒸发到剩余少量液体时,停止加热,利用余热将液体蒸干
D.为除去粗盐中的Ca2+、Mg2+、 可依次向溶液中加入足量的碳酸
钠溶液、氢氧化钠溶液、氯化钡溶液、稀盐酸
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
溶解时不是越稀越好,如果溶液太稀,蒸发时就要消耗很长时间才能蒸干,A错误;
食盐晶体应该用少量水洗涤,否则制得的晶体会有很多溶于水,B错误;
蒸发时,当有大量晶体析出时应停止加热,用余热蒸干剩余液体,以免晶体受热后飞溅出来,不仅造成损失,而且可能因此发生意外事故,C正确;
由于过量的钡离子需要用碳酸钠除去,则碳酸钠一定要在加入氯化钡溶液之后加入,D错误。
4.除去粗盐中的杂质MgCl2、CaCl2和Na2SO4的过程如下:
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
下列有关说法不正确的是
A.试剂①②③分别是NaOH、Na2CO3、BaCl2
B.除去Ca2+的主要反应:Ca2++
C.检验 是否除净的方法:取适量滤液,加稀盐酸酸化,再加BaCl2溶液
D.加稀盐酸调节pH后,采用蒸发结晶的方法得到NaCl固体
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
题组二 海水提溴
5.目前从海水中提取的溴约占世界溴年产量的三分之一,从海水中提取溴的主要步骤可表示为
A.氧化→吸收→吹出→氧化
B.氧化→吹出→吸收→氧化
C.吹出→氧化→吸收→氧化
D.吹出→吸收→氧化
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
6.用空气吹出法从海水中提取溴所涉及的化学反应可能有
①Cl2+2Br-===2Cl-+Br2
②Br2+SO2+2H2O===2HBr+H2SO4
③Br2+2I-===I2+2Br-
④2I-+H2O2+2H+===I2+2H2O
A.①② B.②③ C.③④ D.①④
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
7.“空气吹出法”海水提溴的工艺流程如下:
下列说法不正确的是
A.实验室保存溴通常加少量水
B.海水提溴发生的反应均为氧化还原
反应
C.经过吸收塔后,溴元素得到了富集
D.蒸馏塔中只发生了物理变化
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
溴易挥发,加水液封可以减少挥发
损失,A正确;
经过吸收塔后,所得溶液中Br-的
浓度远大于进入吹出塔之前海水中Br-的浓度,因此溴元素得到了富集,C正确;
蒸馏塔中发生的反应为2Br-+Cl2===2Cl-+Br2,D错误。
8.(2021·哈尔滨第三十二中学高一期末)海洋是非常巨大的资源宝库,以下有关海洋资源开发和利用的说法错误的是
A.海水中的元素种类很多,富集程度大
B.海水淡化的方法主要有蒸馏法、电渗析法、离子交换法等
C.海水中含有Cl、Na、K、Mg、Ca、S等多种元素
D.由于与岩石、大气和生物相互作用,海水中溶解和悬浮着大量无机
物和有机物
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
海水中元素种类多,总储量大,但富集程度低,A错误;
海水淡化的主要方法有蒸馏法、电渗析法、离子交换法等,B正确;
在海水中迄今已发现的80多种化学元素中,含量较高的元素除组成水的氢、氧元素外,还有氯、钠、镁、硫、钙、钾、溴等,C正确。
9.从淡化海水中提取溴的流程如下:
下列有关说法不正确的是
A.X试剂可用Na2SO3饱和溶液
B.步骤Ⅲ的离子反应:2Br-+
Cl2===2Cl-+Br2
C.工业上每获得1 mol Br2,需要
消耗44.8 L Cl2
D.步骤Ⅳ包含萃取、分液和蒸馏
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
Na2SO3饱和溶液吸收Br2的反应
为Na2SO3+Br2+H2O===Na2SO4
+2HBr,A正确;
步骤Ⅲ利用氯元素的非金属性
比溴元素强,可以利用置换反应制取Br2,B正确;
未标明氯气所处的温度和压强,无法计算消耗氯气的体积,C错误;
从浓溴水中提取溴,可利用有机溶剂(如苯)萃取溴,然后分液得到溴的有机溶液,再经蒸馏可得到纯净的溴,D正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
10.从海水中可以提取溴,主要反应为2KBr+Cl2===Br2+2KCl,下列说法正确的是
A.溴离子具有氧化性
B.氯气是还原剂
C.该反应属于复分解反应
D.氯气的氧化性比溴单质强
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
Br-中溴元素的化合价处于最低价态,只有还原性,A错;
氯气在反应中作氧化剂,B错;
该反应属于置换反应,C错;
该反应中,氯气为氧化剂,溴为氧化产物,氧化剂的氧化性大于氧化产物的氧化性,D正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
11.在空气吹出法的工艺中,选用纯碱溶液作溴蒸气吸收剂的反应原理为3Na2CO3+3Br2===5NaBr+NaBrO3+3CO2,也有选用SO2作溴蒸气吸收剂的,下列有关说法正确的是
A.两种吸收过程中,Br2只作氧化剂
B.只有SO2吸收过程发生了氧化还原反应
C.用纯碱溶液作吸收剂时,纯碱既不是还原剂也不是氧化剂
D.用纯碱溶液作吸收剂只发生了复分解反应
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
①纯碱溶液作吸收剂的反应为3Na2CO3+3Br2===5NaBr+NaBrO3+3CO2;
②SO2作吸收剂的反应为SO2+Br2+2H2O===H2SO4+2HBr。
分析以上两个反应可知:①中Br2既作氧化剂,又作还原剂,Na2CO3既不是还原剂也不是氧化剂,②中Br2只作氧化剂,①②均属于氧化还原反应。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
12.一种从含Br-废水中提取Br2的过程,包括过滤、氧化、正十二烷(一种难溶于水的有机溶剂)萃取及蒸馏等步骤。已知:
Br2 CCl4 正十二烷
密度/(g·cm-3) 3.119 1.595 0.753
沸点/℃ 58.76 76.8 215~217
下列说法正确的是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
A.用甲装置过滤时,需不断搅拌
B.用乙装置将Br-氧化为Br2
C.丙装置中用正十二烷而不用CCl4,是因为其密度小
D.可用丁装置进行蒸馏,先收集正十二烷再收集Br2
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
过滤时不能搅拌;选用沸点较大的正十二烷,便于萃取后蒸馏,与密度无关;沸点低的物质先蒸馏出来。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
13.海水提溴过程中,将溴吹入吸收塔,使溴蒸气和吸收剂SO2发生作用,以达到富集的目的,化学反应为Br2+SO2+2H2O===2HBr+H2SO4。下列说法正确的是
A.Br2在反应中失去电子
B.SO2在反应中表现还原性
C.H2O在反应中作氧化剂
D.反应过程中共转移了4 mol电子
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
Br元素的化合价由0价降低到-1价,在反应中得到电子,故A错误;
S元素的化合价由+4价升高到+6价,SO2作还原剂,在反应中表现还原性,故B正确;
H2O在反应中元素化合价没有发生变化,所以既不是氧化剂也不是还原剂,故C错误;
1 mol氧化剂在反应中得到1 mol×2×[0-(-1)]=2 mol电子,故D错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
14.通过海水晾晒可得粗盐,粗盐中除含有NaCl外,还含有MgCl2、CaCl2、Na2SO4以及泥沙等杂质。制备精盐的各步操作流程如下:
(1)在第⑦步蒸发过程中要用玻璃棒搅拌,目的是__________________
________________________。
防止液体局部受热温度过高,造成液体飞溅
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
(2)第②④步操作的目的分别是除去粗盐中的Na2SO4和CaCl2,需要加入的试剂依次是________________(填化学式)。
BaCl2、Na2CO3
第②步操作的目的是除去粗盐中的硫酸钠,则需要加入过量BaCl2溶液,第④步操作是为了除去CaCl2及过量的BaCl2,则需要加入过量Na2CO3溶液。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
(3)第⑥步操作中发生反应的化学方程式为_________________________
____________________________________。
NaOH+HCl===NaCl+H2O、Na2CO3+2HCl===2NaCl+H2O+CO2↑
第⑥步操作的目的是除去滤液中过量的氢氧化钠和碳酸钠。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
(4)在第③步操作中,选择的除杂试剂不能是KOH溶液,理由是______
_____________。
(5)第⑤步操作中,需要的玻璃仪器有_____、_____、_______。
会引
入新杂质K+
漏斗 烧杯 玻璃棒
15.海水是巨大的资源宝库,在海水淡化及综合利用方面,天津市位居全国前列。从海水中提取食盐和溴的过程如图:
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
(1)海水淡化的方法有电渗析法、离子交换法和________(写出一种即可)。
蒸馏法
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
(2)将NaCl溶液进行电解,生成H2、Cl2和NaOH,该电解反应的离子方程式为____________________________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
(3)步骤Ⅰ中已获得Br2,步骤Ⅱ中又将Br2还原为Br-,其目的为______
_____。
富集溴
元素
这里应抓住“低浓度溴溶液”和“工业溴”两个关键信息进行分析判断。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
(4)步骤Ⅱ用SO2水溶液吸收Br2生成H2SO4和HBr,吸收率可达95%,有关反应的化学方程式为_______________________________。
由此反应可知,除环境保护外,在工业生产中应解决的主要问题是_____________________。
Br2+SO2+2H2O===2HBr+H2SO4
强酸对设备的严重腐蚀
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
SO2有较强的还原性,Br2有强氧化性,根据氧化还原反应规律和质量守恒定律可写出该反应的化学方程式。SO2的水溶液与Br2反应生成酸,工业设备中的很多零部件是不耐酸的。
返回
