2022-2023学年苏教版2019高中化学必修1 专题3 第一单元 第2课时 氯气的性质及应用 课件(66张PPT)
文档属性
| 名称 | 2022-2023学年苏教版2019高中化学必修1 专题3 第一单元 第2课时 氯气的性质及应用 课件(66张PPT) |  | |
| 格式 | ppt | ||
| 文件大小 | 2.1MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-07-15 21:38:31 | ||
图片预览










文档简介
(共66张PPT)
第2课时
DIERKESHI
氯气与金属、非金属单质的反应 / 氯水的性质 / 随堂演练 知识落实 / 课时对点练
氯气的性质及应用
专题3
核心素养
发展目标
1.认识氯气与金属和非金属的反应。
2.知道氯水的成分和性质。
3.知道氯气与碱反应制取漂白剂和漂白粉的原理。
内容索引
一、氯气与金属、非金属单质的反应
二、氯水的性质
随堂演练 知识落实
课时对点练
氯气与金属、非金属单质的反应
一
1.氯气的物理性质
氯气是一种 色、密度比空气 ,有 气味的 气体。
在加压的条件下,氯气转化为 (称为 ),可储存于 中,便于运输和使用。
黄绿 大 刺激性 有毒
液态 液氯 钢瓶
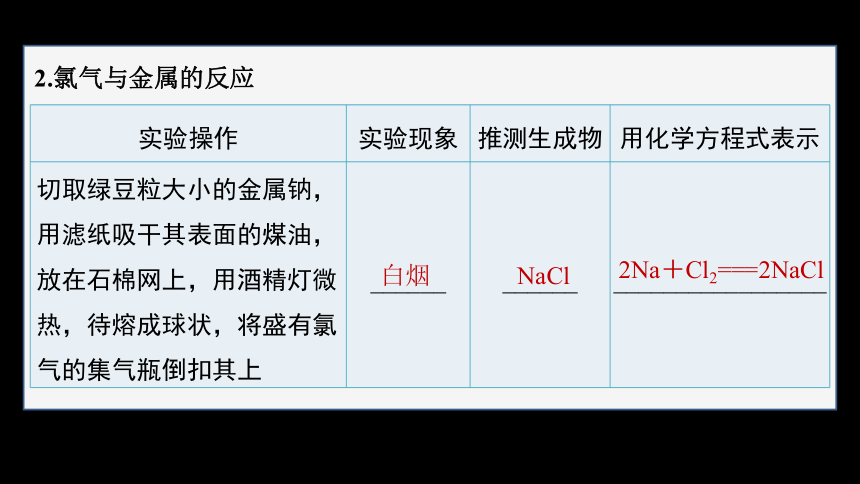
2.氯气与金属的反应
实验操作 实验现象 推测生成物 用化学方程式表示
切取绿豆粒大小的金属钠,用滤纸吸干其表面的煤油,放在石棉网上,用酒精灯微热,待熔成球状,将盛有氯气的集气瓶倒扣其上 ______ ______ _________________
白烟
NaCl
2Na+Cl2===2NaCl
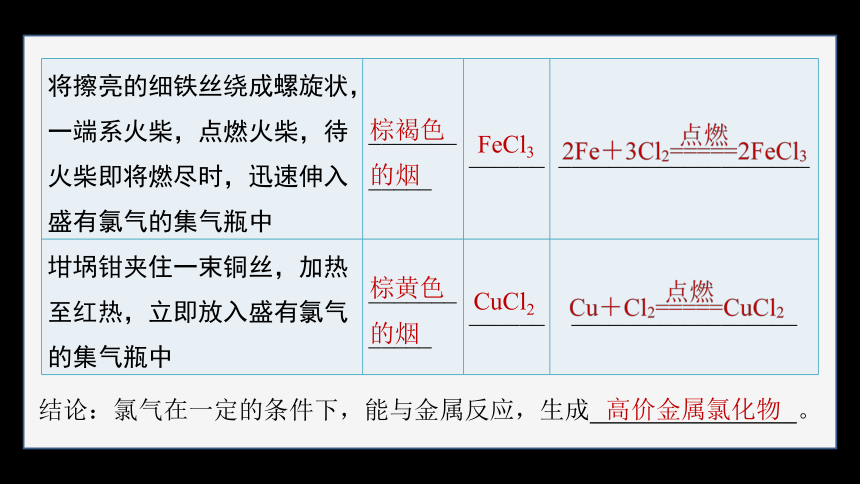
将擦亮的细铁丝绕成螺旋状,一端系火柴,点燃火柴,待火柴即将燃尽时,迅速伸入盛有氯气的集气瓶中 ____________ ______ ____________________
坩埚钳夹住一束铜丝,加热至红热,立即放入盛有氯气的集气瓶中 ____________ ______ __________________
棕褐色
的烟
棕黄色
的烟
FeCl3
CuCl2
结论:氯气在一定的条件下,能与金属反应,生成 。
高价金属氯化物
3.氯气与非金属单质的反应
(1)氢气与氯气在 条件下,化合成 。化学方程式:
。
(2)HCl溶于水得到 ,工业上利用电解饱和食盐水得到的______
和 制取 。
点燃或光照 氯化氢
盐酸
氯气
氢气 盐酸
特别提醒 (1)H2在Cl2中燃烧的火焰为苍白色,集气瓶口产生白雾,HCl极易溶于空气中的水蒸气形成盐酸小液滴。
(2)烟是固体小颗粒,如FeCl3棕褐色烟;雾是小液滴,如HCl气体在空气中形成盐酸小液滴。
(3)燃烧是发光发热的剧烈的氧化反应,燃烧不一定有氧气参与。
(1)虽然氯气有毒,但仍可闻氯气的气味,方法是用手轻轻在集气瓶瓶口扇动,使极少量氯气飘进鼻孔( )
(2)发生氯气泄漏时,污染区的居民应向低洼处转移( )
(3)铁丝在少量的Cl2中燃烧可生成FeCl2( )
(4)Cu在Cl2中燃烧产生棕黄色的烟,若反应后,向集气瓶中加少量水振荡,可得到棕黄色溶液( )
(5)Na在Cl2中燃烧产生的是白烟,而H2在Cl2中燃烧则产生白雾( )
√
×
×
×
√
1.下列实验现象的描述正确的是
A.氢气在氯气中燃烧,发出苍白色火焰,瓶口上方形成白色烟
B.铁丝在氯气中燃烧,产生棕褐色的烟,产物溶于水,溶液呈浅绿色
C.铜丝在氯气中燃烧,产生棕黄色的烟,产物溶于水,溶液呈蓝绿色
D.钠在氯气中燃烧,发出黄色火焰,生成淡黄色固体
√
氢气在氯气中燃烧,发出苍白色火焰,瓶口形成白雾,没有烟,A项错误;
铁与氯气反应生成FeCl3,FeCl3溶液呈黄色,B项错误。
2.下列金属氯化物中,既能由金属和氯气直接反应制得,又能由金属盐酸反应制得的是
A.CuCl2 B.FeCl2
C.FeCl3 D.AlCl3
√
铜与盐酸不反应,A项错误;
铁与氯气反应生成FeCl3,与盐酸反应生成FeCl2,B、C项错误。
返回
氯水的性质
二
1.实验探究氯气溶于水
(1)操作:如图,取一支100 mL的针筒抽取80 mL氯气,再抽取20 mL水,振荡。
(2)现象:刚开始抽进去氯气的时候针管内为 ,抽取水振荡后活塞向里移动,水溶液颜色逐渐变为 ,最终活塞移动至大约60 mL处。
(3)结论:氯气能溶于水,其水溶液叫 ,呈 ,常温常压下,1体积水约能溶解 氯气。
黄绿色
浅黄绿色
氯水 浅黄绿色
2体积
2.氯水的成分探究
(1)探究实验
序号 实验操作 实验现象 实验结论
① 将干燥的有色布条和湿润的有色布条分别放入两瓶干燥的氯气中 干燥的有色布条 ,
湿润的有色布条______ 干燥的氯气无
性,氯
水有 性
不褪色
褪色
漂白
漂白
② 分别用玻璃棒蘸取新制氯水和稀盐酸,滴在pH试纸上 滴有盐酸的试纸变红,滴有氯水的试纸中间变为 ,外圈变__ 氯水中有能使试纸变红的 和能使有色物质
的漂白性物质
③ 向1 mL新制氯水中滴加几滴硝酸银溶液和稀硝酸 产生 沉淀 新制氯水中含有_____
白色
红
白色
酸
褪色
Cl-
综合分析得结论:氯气溶于水得到的氯水显 性,有 作用,氯水中存在 ,干燥的氯气无漂白性。
(2)进一步的实验证明,氯气溶于水得到的氯水具有漂白性是因为溶解在水中的 ,反应的化学方程式是
,氯水能杀菌消毒。
(3)氯水中所含的分子有 ,氯水中所含的离子有
、ClO-、OH-。
酸 漂白
Cl-
部分氯气与H2O反应生成了HClO
Cl2、HClO、H2O
Cl-、H+
特别提醒
①在相同条件下,反应既能向正反应方向进行,也能向逆反应方向进行的化学反应叫作可逆反应。
②氯水中含有Cl2、HClO等分子,也含有H+、Cl-等离子,说明Cl2与H2O不能完全反应,只能进行到一定的限度。Cl2+H2O HCl+HClO为可
逆反应。
3.次氯酸
(1)次氯酸能使染料等 褪色,有 作用,还能 。
(2)次氯酸不稳定,见光易分解,化学方程式: 。
(3)次氯酸是弱酸,其酸性比碳酸还弱。
有机色素 漂白 杀菌消毒
4.次氯酸盐
(1)氯气和氢氧化钠反应制取漂白剂(有效成分为次氯酸钠),其化学方程式为 ,其原理可视为化学方程式①+②+③:
①Cl2+H2O HCl+HClO
②HCl+NaOH===NaCl+H2O
③HClO+NaOH===NaClO+H2O
Cl2+2NaOH===NaCl+NaClO+H2O
(2)氯气和石灰乳反应制取漂白粉(有效成分为次氯酸钙),其化学程式为 。
(3)次氯酸盐溶于水后与空气中的CO2反应生成次氯酸,漂白粉与CO2反应的化学方程式为 。
2Cl2+2Ca(OH)2===Ca(ClO)2+CaCl2+2H2O
Ca(ClO)2+CO2+H2O===CaCO3+2HClO
拓展视野 二氧化氯(ClO2)是一种有刺激性气味的黄绿色气体,在水中的杀菌、消毒能力比氯气强,效果更持久,受水体的pH变化影响小,且使用起来非常方便、安全。
(1)氯气、氯水、液氯是同一种物质,只是状态不同,都属于纯净物( )
(2)湿润的有色布条遇Cl2褪色,说明Cl2具有漂白性( )
(3)Cl2通入到紫色石蕊试液中的现象是先变红后褪色( )
(4)可用pH试纸测定氯水的pH( )
(5)家庭中使用漂白粉时,为了增强漂白能力,可以加入少量的食醋( )
(6)工业上可以用澄清石灰水与Cl2反应制得漂白粉( )
(7)漂白剂、漂白粉的漂白、消毒原理相同,都是在酸性条件下生成具有漂白、消毒作用的次氯酸(HClO)( )
×
×
√
√
×
×
√
1.实验表明:将氯水滴加到蓝色石蕊试纸上,试纸上会出现如图所示的半径慢慢扩大的内外两个圆环,且两环颜色不同,下列有关说法中不正确的是
A.此实验表明氯水具有酸性、漂白性
B.内环呈白色,外环呈红色或浅红色
C.氯水中形成次氯酸的反应为非氧化还原反应
D.内外环上颜色的差异表明此变化过程中,盐酸与指示剂的反应比氧
化还原反应快
√
由氯水的成分可知,该实验能表明氯水具有酸性、
漂白性,A正确;
内环呈白色,外环呈红色或浅红色,内环是HClO
起作用,外环是H+起作用,B正确;
Cl2+H2O HCl+HClO,是氧化还原反应,C错误。
2.下列有关漂白粉和漂白剂的说法正确的是________(填序号)。
①工业上将氯气通入澄清石灰水制取漂白粉
②漂白剂的有效成分是NaClO,漂白粉的有效成分是Ca(ClO)2
③漂白粉和Fe(OH)3胶体都常用于自来水的处理,二者的作用原理不相同
④漂白粉在空气中久置不可能发生氧化还原反应
⑤漂白粉在空气中久置变质,理由是漂白粉中的CaCl2与空气中的CO2反应生成CaCO3
⑥漂白粉在空气中不稳定,所以可用于漂白纸张
②③
①不正确,漂白粉是将Cl2通入石灰乳中制得的混合物,反应的化学方程式为2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O;
②正确,漂白剂的有效成分是NaClO,漂白粉的有效成分是Ca(ClO)2;
③正确,漂白粉用于自来水杀菌消毒,Fe(OH)3胶体用于除去水中的悬浮杂质,二者的作用原理不同;
④不正确,漂白粉在空气中久置的化学方程式为Ca(ClO)2+H2O+CO2===CaCO3+2HClO、2HClO 2HCl+O2↑,有氧化还原反应;
⑤不正确,漂白粉在空气中变质的原因是Ca(ClO)2+H2O+CO2===
CaCO3+2HClO,而CaCl2与H2O和CO2不反应;
⑥不正确,漂白粉能用于漂白纸张,与其强氧化性有关,与其不稳定性无关。
返回
随堂演练 知识落实
1.自来水厂常用氯气对生活用水进行杀菌消毒。市场上有些不法商贩为牟取暴利,用这样的自来水冒充纯净水(离子的浓度非常低)出售,给人们的生活造成了一定的不良影响。在下列化学试剂中,可以用于鉴别这种自来水和纯净水的是
A.酚酞溶液 B.氯化钡溶液
C.氢氧化钠溶液 D.硝酸银溶液
√
1
2
3
4
Cl2消毒过的自来水中含有HCl和HClO,用AgNO3溶液即可鉴别,产生白色沉淀的是自来水,不产生白色沉淀的是纯净水。
5
2.下列关于氯气的说法不正确的是
A.尽管氯气的化学性质很活泼,但是干燥的液氯能用钢瓶贮存
B.氯气和液氯是两种不同的物质
C.可以用浓硫酸除去氯气中的水蒸气
D.Cl2跟变价金属反应生成高价金属氯化物
1
2
3
4
√
氯气和液氯是同一种物质的不同状态,B不正确。
5
3.有关氯气的性质或用途的叙述错误的是
A.工业上用氯气与消石灰反应来制漂白粉
B.自来水常用氯气来消毒杀菌,其有效成分是HClO
C.氯气有毒,制取氯气的尾气要用碱溶液吸收
D.氢气不能在氯气中燃烧
√
1
2
3
4
5
1
2
3
4
工业上利用反应2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O制取漂白粉,A正确;
用Cl2对自来水消毒时,发生的反应为Cl2+H2O HCl+HClO,有效成分为HClO,B正确;
Cl2有毒,可用碱溶液吸收Cl2,C正确;
H2能在Cl2中燃烧生成HCl,D错误。
5
4.漂白粉在生活、生产中用途广泛。已知浓盐酸和次氯酸钙能发生反应:Ca(ClO)2+4HCl(浓)===CaCl2+2Cl2↑+2H2O。用贮存很久的漂白粉与浓盐酸制得的氯气中,可能含有的杂质气体是
①CO2 ②HCl ③H2O ④O2
A.①②③ B.②③④
C.②③ D.①④
1
2
3
4
√
5
1
2
3
4
贮存很久的漂白粉中混有CaCO3[Ca(ClO)2+CO2+H2O===CaCO3+2HClO],与浓盐酸反应时会有CO2气体产生,而反应过程中带出的水及浓盐酸中挥发出的氯化氢,也是不可避免的,所以氯气中会混有CO2、HCl、H2O。
5
5.在第一次世界大战期间,有一次德军与英法联军在比利时对峙,黎明时,英法联军前线战壕的士兵突然看到一股黄绿色气体逐渐袭来,很快数百名英、法联军战士窒息而死。后来人们在打扫战场时发现跑到山坡上的士兵竟幸免于难。
(1)由上述事例可归纳出氯气的性质有____________________________
______。
1
2
3
4
5
黄绿色气体,有毒,密度比空
气大
(2)写出下列反应的化学方程式:
①铁丝在氯气中燃烧:_____________________。
②铁粉溶于盐酸中:________________________。
③少量的铁粉溶于氯水中:_____________________________________
__________。
(3)将新鲜的花瓣放入干燥的氯气中可观察到的现象是_________,原因是_________________________________________________________
_______。
1
2
3
4
5
Fe+2HCl===FeCl2+H2↑
Fe+2HCl===FeCl2+H2↑、2FeCl2+Cl2
===2FeCl3
花瓣褪色
新鲜的花瓣中含有水分,Cl2与水反应会生成HClO,HClO具有漂白性
返回
课时对点练
题组一 氯气的物理性质
1.下列说法正确的是
A.用鼻子对着盛有氯气的瓶口,就可以嗅到氯气的气味
B.用向下排空气法可以收集到纯净的氯气
C.贮氯罐意外泄漏,应沿逆风方向疏散群众
D.氯气车间液氯泄漏时,应弯腰逃离氯气泄漏区域
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
闻气体气味的方法是用手轻轻地在瓶口扇动,仅使少量的气体飘入鼻孔,不能直接用鼻子闻,A不正确;
氯气的密度比空气大,可用向上排空气法收集氯气,B不正确;
氯气是一种有毒的气体,氯气会顺着风向扩散,疏散时应该逆着风向转移,C正确;
氯气的密度比空气大,泄漏时离地面越近氯气浓度越大,应尽量向高处逃生,D不正确。
2.下列气体中,无色有毒气体是
A.N2 B.CO C.Cl2 D.CO2
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
N2、CO2是无色、无毒气体;CO有毒但无色;Cl2是黄绿色且有毒的气体。
题组二 氯气与单质的反应
3.下列有关氯气的叙述不正确的是
A.金属钠可在氯气中剧烈燃烧
B.通常状况下,干燥的氯气能与铁反应
C.光照氯气和氢气的混合物会发生爆炸
D.氯气与水反应生成盐酸和次氯酸
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
4.(2022·陕西渭南市三贤中学高一检测)下列叙述不正确的是
A.红热的铜丝在Cl2中剧烈燃烧,产生棕黄色的烟
B.Cl2是一种很活泼的非金属单质,它具有较强的氧化性
C.过量的Fe在Cl2中燃烧,生成FeCl2
D.纯净的H2在Cl2中安静地燃烧,发出苍白色火焰,集气瓶口呈现雾状
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
红热的铜丝在Cl2中剧烈燃烧,产生大量CuCl2固体小颗粒,在空气中呈现棕黄色的烟,故A正确;
无论铁是少量还是过量,Fe在Cl2中燃烧都生成FeCl3,故C错误;
纯净的H2在Cl2中安静地燃烧,发出苍白色火焰,生成的HCl在集气瓶口呈现雾状,故D正确。
题组三 氯气与水的反应
5.某同学利用含有HCl杂质的Cl2及下列装置探究Cl2能否与水反应,其正确的组装顺序是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
A.c→d→a→b→e B.d→c→a→b→e
C.d→a→c→b→e D.d→c→b→a→e
√
先用饱和食盐水除去杂质HCl,从饱和食盐水中出来的Cl2中含有水蒸气,再用浓硫酸干燥,干燥后的Cl2先通入放有干燥的有色布条的集气瓶中,然后再通入放有湿润的有色布条的集气瓶中,注意b、a的顺序不能颠倒,否则湿润的有色布条中的水蒸气易随Cl2进入放有干燥的有色布条的集气瓶中,最后用NaOH溶液来吸收剩余的Cl2。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
6.下列关于氯水性质及现象的描述和相关解释正确的是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
操作 现象 解释
A 将氯水加入紫色石蕊试液中 石蕊试液先变红色后褪色 氯水中有H+
B 氯水中加入硝酸银溶液 产生白色沉淀 氯水中有Cl-
C 氯水中加入碳酸钠溶液 产生气体 氯水中有HClO
D 氯水中加入有色布条 有色布条褪色 氯水中有Cl2
√
7.实验室为了使用方便,通常将氯气溶解于水中形成氯水或将其降温加压形成液氯来使用。下列有关这两种液体的实验描述都正确的是
A.两种液体都可以使干燥的有色布条褪色
B.两种液体都可以使干燥的蓝色石蕊试纸变红
C.用这两种液体都可给自来水消毒
D.分别向这两种液体中投入几颗金属锌粒均有气泡产生
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
液氯是一种黄绿色的液体,是由氯气分子构成的纯净物,无酸性(不能与锌反应)、无漂白性;
氯水是一种浅黄绿色的溶液,氯水中含有Cl2、H2O、 HClO、H+、Cl-、ClO-等粒子,既有酸性(能与锌反应放出氢气),又有漂白性。
液氯溶于水得氯水,氯水中含有次氯酸,可用于自来水消毒。
题组四 氯气与碱的反应
8.当不慎有大量氯气扩散到周围空间时,处在该环境中的人可以用浸有一定浓度某物质水溶液的毛巾捂住鼻子,以防中毒,最适合采用的是
A.NaOH B.NaCl
C.NaHCO3 D.NH3·H2O
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
该物质可以吸收氯气,不可能为氯化钠;氢氧化钠对皮肤有腐蚀性;氨水易挥发,挥发出的氨气有强烈的刺激性气味。
9.化学来源于生活,也服务于生活,下列有关生活中的化学知识叙述正确的是
A.氯气和活性炭均可作为漂白剂,若同时使用,漂白效果会明显加强
B.氯气与烧碱溶液或石灰乳反应都能得到含氯消毒剂
C.测定溶液pH的实验中,用干燥的pH试纸测定新制氯水的pH对测定结
果无影响
D.洁厕剂不能与“84”消毒液混用,原因是两种溶液混合产生的HClO
易分解
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
活性炭具有吸附性,可以吸附氯气,同时使用时漂白效果不会增强,A项错误;
氯气与烧碱溶液或石灰乳反应均可生成次氯酸盐,B项正确;
氯水中的次氯酸具有漂白性,能漂白pH试纸,C项错误;
洁厕剂与“84”消毒液不能混用的原因是消毒液中的NaClO与洁厕灵中的HCl反应生成Cl2,D项错误。
10.用玻璃棒蘸取新制氯水滴在蓝色石蕊试纸中部,观察到的现象是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
氯水中含有HCl,显酸性可以使蓝色石蕊试纸变红色,又因新制氯水中含有HClO,所以试纸先变红色后又会被漂白为白色,故应选B项。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
11.在氯水中存在多种分子和离子,它们在不同的反应中表现各自的性质,下列关于氯水的说法不正确的是
A.氯水放置数天后pH将变小
B.加入有色布条,布条褪色,说明溶液中有HClO
C.氯水和液氯都是混合物
D.新制氯水可使蓝色石蕊试纸先变红后褪色
√
12.如图所示:若关闭止水夹Ⅰ,打开止水夹Ⅱ,让潮湿的氯气经过甲瓶后,通入乙瓶,布条不褪色;若关闭止水夹Ⅱ,打开止水夹Ⅰ,再通入这种气体,布条褪色。甲瓶中所盛的试剂不可能是
A.浓硫酸
B.氯化钠溶液
C.氢氧化钡溶液
D.氢氧化钠溶液
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
布条不褪色的原因可能有两种:一种是将氯气干燥而不能使红色布条褪色,甲瓶所盛试剂可能是干燥剂(如A中的浓硫酸);另一种是能吸收氯气的试剂(如C、D中的强碱)。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
13.世界卫生组织将ClO2定为A级高效安全灭菌消毒剂,它在食品保鲜、饮用水消毒等方面有广泛应用。消毒效率是用单位质量的消毒剂得电子数来表示的,得电子数等于元素化合价的降低数。ClO2作消毒剂时和氯气一样,产物均为Cl-。下列关于ClO2的说法正确的是
A.ClO2的摩尔质量为67.5
B.从分类上来看,ClO2属于金属氧化物
C.ClO2的消毒效率是氯气的2.63倍
D.ClO2分子中氯元素与氧元素的质量比为1∶2
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
A项错误,摩尔质量应带单位;
B项错误,从分类上来看,ClO2属于非金属氧化物;
D项错误,ClO2分子中氯原子与氧原子的个数比为1∶2,氯元素与氧元素的质量比为35.5∶32。
14.氯气能使湿润的红色布条褪色。对于使红色布条褪色的物质,同学们的看法不一致,认为氯水中存在的几种粒子都有可能。请设计实验,得出正确的结论。(已知:强氧化性的物质往往具有漂白性。)
(1)提出问题:
氯水中的何种物质能使红色布条褪色?
(2)收集资料:
①氯气有强氧化性;
②氯气与水反应生成盐酸和次氯酸;
③次氯酸有强氧化性。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
(3)提出假设:
①___________________;
②_____________________;
③___________________;
④水使红色布条褪色。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
氯气使红色布条褪色
次氯酸使红色布条褪色
盐酸使红色布条褪色
(4)验证假设:
实验①:把干燥的红色布条放入充满氯气的集气瓶中,红色布条不褪色;
实验②:________________________________________________;
实验③:_____________________________________________;
实验④:把干燥的红色布条放在水里,红色布条不褪色。
(5)得出的实验结论是_______________________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
把干燥的红色布条伸入次氯酸溶液中,红色布条褪色
把干燥的红色布条伸入稀盐酸中,红色布条不褪色
氯水中的次氯酸能使红色布条褪色
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
提出假设是根据收集到的资料结合所学知识进行的。
氯气有氧化性,那么假设氯气使红色布条褪色,氯气和水反应生成盐酸和次氯酸,假设盐酸或次氯酸能使红色布条褪色。
氯水中的氯气、稀盐酸、水均不能使红色布条褪色,说明是次氯酸使红色布条褪色。
15.已知反应:NaClO+NaCl+H2SO4 Na2SO4+Cl2↑+H2O,为探究氯气的性质,某同学设计了如图所示的实验装置。
试回答下列问题:
(1)在该实验中,以下可用于制取
氯气的装置是____(填字母)。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
c
(2)装置B、C中依次放入的是干燥
的红色布条和湿润的红色布条,实
验过程中该同学发现装置B中的布
条也褪色,其原因可能是________
_____________,请提出合理的改
进方法:____________________________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
Cl2中混
有少量水蒸气
在A~B之间增设装有浓H2SO4的洗气瓶
干燥的红色布条褪色说明Cl2中混有水蒸气,生成了HClO,故应增设干燥装置。
(3)D中的现象是________________
_____,反应的化学方程式为_____
_______________,分离D中液体的
方法是______。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
下层CCl4层呈紫
红色
Cl2+2KI===I2+2KCl,CCl4将I2萃取出来,分离两种互不相溶的液体可采用分液法。
Cl2+
2KI===I2+2KCl
分液
(4)写出氯气与NaOH溶液反应的化
学方程式:___________________
______________,为验证尾气吸收
后的溶液中存在Cl-,正确的操作
是____________________________
____________________________________________________________________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
Cl2+2NaOH===NaCl
+NaClO+H2O
取少量烧杯内吸收Cl2后的溶液,
加入足量的稀HNO3酸化,再加入AgNO3溶液,若有白色沉淀生成,证明其中含有Cl-
为检验Cl-,应先用稀HNO3酸化中和溶液中的OH-,再加AgNO3溶液,若有AgCl白色沉淀生成,证明含有Cl-。
(5)氯气通入饱和NaHCO3溶液中能
产生无色气体,已知酸性:盐酸>
碳酸>次氯酸,该实验可证明Cl2
与H2O反应的产物中含有_____(填
化学式)。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
HCl
因酸性:HCl>H2CO3>HClO,HCl可与NaHCO3反应:HCl+NaHCO3
===NaCl+H2O+CO2↑,而HClO不与NaHCO3反应,故氯气与H2O反应的产物中含有HCl。
返回
第2课时
DIERKESHI
氯气与金属、非金属单质的反应 / 氯水的性质 / 随堂演练 知识落实 / 课时对点练
氯气的性质及应用
专题3
核心素养
发展目标
1.认识氯气与金属和非金属的反应。
2.知道氯水的成分和性质。
3.知道氯气与碱反应制取漂白剂和漂白粉的原理。
内容索引
一、氯气与金属、非金属单质的反应
二、氯水的性质
随堂演练 知识落实
课时对点练
氯气与金属、非金属单质的反应
一
1.氯气的物理性质
氯气是一种 色、密度比空气 ,有 气味的 气体。
在加压的条件下,氯气转化为 (称为 ),可储存于 中,便于运输和使用。
黄绿 大 刺激性 有毒
液态 液氯 钢瓶
2.氯气与金属的反应
实验操作 实验现象 推测生成物 用化学方程式表示
切取绿豆粒大小的金属钠,用滤纸吸干其表面的煤油,放在石棉网上,用酒精灯微热,待熔成球状,将盛有氯气的集气瓶倒扣其上 ______ ______ _________________
白烟
NaCl
2Na+Cl2===2NaCl
将擦亮的细铁丝绕成螺旋状,一端系火柴,点燃火柴,待火柴即将燃尽时,迅速伸入盛有氯气的集气瓶中 ____________ ______ ____________________
坩埚钳夹住一束铜丝,加热至红热,立即放入盛有氯气的集气瓶中 ____________ ______ __________________
棕褐色
的烟
棕黄色
的烟
FeCl3
CuCl2
结论:氯气在一定的条件下,能与金属反应,生成 。
高价金属氯化物
3.氯气与非金属单质的反应
(1)氢气与氯气在 条件下,化合成 。化学方程式:
。
(2)HCl溶于水得到 ,工业上利用电解饱和食盐水得到的______
和 制取 。
点燃或光照 氯化氢
盐酸
氯气
氢气 盐酸
特别提醒 (1)H2在Cl2中燃烧的火焰为苍白色,集气瓶口产生白雾,HCl极易溶于空气中的水蒸气形成盐酸小液滴。
(2)烟是固体小颗粒,如FeCl3棕褐色烟;雾是小液滴,如HCl气体在空气中形成盐酸小液滴。
(3)燃烧是发光发热的剧烈的氧化反应,燃烧不一定有氧气参与。
(1)虽然氯气有毒,但仍可闻氯气的气味,方法是用手轻轻在集气瓶瓶口扇动,使极少量氯气飘进鼻孔( )
(2)发生氯气泄漏时,污染区的居民应向低洼处转移( )
(3)铁丝在少量的Cl2中燃烧可生成FeCl2( )
(4)Cu在Cl2中燃烧产生棕黄色的烟,若反应后,向集气瓶中加少量水振荡,可得到棕黄色溶液( )
(5)Na在Cl2中燃烧产生的是白烟,而H2在Cl2中燃烧则产生白雾( )
√
×
×
×
√
1.下列实验现象的描述正确的是
A.氢气在氯气中燃烧,发出苍白色火焰,瓶口上方形成白色烟
B.铁丝在氯气中燃烧,产生棕褐色的烟,产物溶于水,溶液呈浅绿色
C.铜丝在氯气中燃烧,产生棕黄色的烟,产物溶于水,溶液呈蓝绿色
D.钠在氯气中燃烧,发出黄色火焰,生成淡黄色固体
√
氢气在氯气中燃烧,发出苍白色火焰,瓶口形成白雾,没有烟,A项错误;
铁与氯气反应生成FeCl3,FeCl3溶液呈黄色,B项错误。
2.下列金属氯化物中,既能由金属和氯气直接反应制得,又能由金属盐酸反应制得的是
A.CuCl2 B.FeCl2
C.FeCl3 D.AlCl3
√
铜与盐酸不反应,A项错误;
铁与氯气反应生成FeCl3,与盐酸反应生成FeCl2,B、C项错误。
返回
氯水的性质
二
1.实验探究氯气溶于水
(1)操作:如图,取一支100 mL的针筒抽取80 mL氯气,再抽取20 mL水,振荡。
(2)现象:刚开始抽进去氯气的时候针管内为 ,抽取水振荡后活塞向里移动,水溶液颜色逐渐变为 ,最终活塞移动至大约60 mL处。
(3)结论:氯气能溶于水,其水溶液叫 ,呈 ,常温常压下,1体积水约能溶解 氯气。
黄绿色
浅黄绿色
氯水 浅黄绿色
2体积
2.氯水的成分探究
(1)探究实验
序号 实验操作 实验现象 实验结论
① 将干燥的有色布条和湿润的有色布条分别放入两瓶干燥的氯气中 干燥的有色布条 ,
湿润的有色布条______ 干燥的氯气无
性,氯
水有 性
不褪色
褪色
漂白
漂白
② 分别用玻璃棒蘸取新制氯水和稀盐酸,滴在pH试纸上 滴有盐酸的试纸变红,滴有氯水的试纸中间变为 ,外圈变__ 氯水中有能使试纸变红的 和能使有色物质
的漂白性物质
③ 向1 mL新制氯水中滴加几滴硝酸银溶液和稀硝酸 产生 沉淀 新制氯水中含有_____
白色
红
白色
酸
褪色
Cl-
综合分析得结论:氯气溶于水得到的氯水显 性,有 作用,氯水中存在 ,干燥的氯气无漂白性。
(2)进一步的实验证明,氯气溶于水得到的氯水具有漂白性是因为溶解在水中的 ,反应的化学方程式是
,氯水能杀菌消毒。
(3)氯水中所含的分子有 ,氯水中所含的离子有
、ClO-、OH-。
酸 漂白
Cl-
部分氯气与H2O反应生成了HClO
Cl2、HClO、H2O
Cl-、H+
特别提醒
①在相同条件下,反应既能向正反应方向进行,也能向逆反应方向进行的化学反应叫作可逆反应。
②氯水中含有Cl2、HClO等分子,也含有H+、Cl-等离子,说明Cl2与H2O不能完全反应,只能进行到一定的限度。Cl2+H2O HCl+HClO为可
逆反应。
3.次氯酸
(1)次氯酸能使染料等 褪色,有 作用,还能 。
(2)次氯酸不稳定,见光易分解,化学方程式: 。
(3)次氯酸是弱酸,其酸性比碳酸还弱。
有机色素 漂白 杀菌消毒
4.次氯酸盐
(1)氯气和氢氧化钠反应制取漂白剂(有效成分为次氯酸钠),其化学方程式为 ,其原理可视为化学方程式①+②+③:
①Cl2+H2O HCl+HClO
②HCl+NaOH===NaCl+H2O
③HClO+NaOH===NaClO+H2O
Cl2+2NaOH===NaCl+NaClO+H2O
(2)氯气和石灰乳反应制取漂白粉(有效成分为次氯酸钙),其化学程式为 。
(3)次氯酸盐溶于水后与空气中的CO2反应生成次氯酸,漂白粉与CO2反应的化学方程式为 。
2Cl2+2Ca(OH)2===Ca(ClO)2+CaCl2+2H2O
Ca(ClO)2+CO2+H2O===CaCO3+2HClO
拓展视野 二氧化氯(ClO2)是一种有刺激性气味的黄绿色气体,在水中的杀菌、消毒能力比氯气强,效果更持久,受水体的pH变化影响小,且使用起来非常方便、安全。
(1)氯气、氯水、液氯是同一种物质,只是状态不同,都属于纯净物( )
(2)湿润的有色布条遇Cl2褪色,说明Cl2具有漂白性( )
(3)Cl2通入到紫色石蕊试液中的现象是先变红后褪色( )
(4)可用pH试纸测定氯水的pH( )
(5)家庭中使用漂白粉时,为了增强漂白能力,可以加入少量的食醋( )
(6)工业上可以用澄清石灰水与Cl2反应制得漂白粉( )
(7)漂白剂、漂白粉的漂白、消毒原理相同,都是在酸性条件下生成具有漂白、消毒作用的次氯酸(HClO)( )
×
×
√
√
×
×
√
1.实验表明:将氯水滴加到蓝色石蕊试纸上,试纸上会出现如图所示的半径慢慢扩大的内外两个圆环,且两环颜色不同,下列有关说法中不正确的是
A.此实验表明氯水具有酸性、漂白性
B.内环呈白色,外环呈红色或浅红色
C.氯水中形成次氯酸的反应为非氧化还原反应
D.内外环上颜色的差异表明此变化过程中,盐酸与指示剂的反应比氧
化还原反应快
√
由氯水的成分可知,该实验能表明氯水具有酸性、
漂白性,A正确;
内环呈白色,外环呈红色或浅红色,内环是HClO
起作用,外环是H+起作用,B正确;
Cl2+H2O HCl+HClO,是氧化还原反应,C错误。
2.下列有关漂白粉和漂白剂的说法正确的是________(填序号)。
①工业上将氯气通入澄清石灰水制取漂白粉
②漂白剂的有效成分是NaClO,漂白粉的有效成分是Ca(ClO)2
③漂白粉和Fe(OH)3胶体都常用于自来水的处理,二者的作用原理不相同
④漂白粉在空气中久置不可能发生氧化还原反应
⑤漂白粉在空气中久置变质,理由是漂白粉中的CaCl2与空气中的CO2反应生成CaCO3
⑥漂白粉在空气中不稳定,所以可用于漂白纸张
②③
①不正确,漂白粉是将Cl2通入石灰乳中制得的混合物,反应的化学方程式为2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O;
②正确,漂白剂的有效成分是NaClO,漂白粉的有效成分是Ca(ClO)2;
③正确,漂白粉用于自来水杀菌消毒,Fe(OH)3胶体用于除去水中的悬浮杂质,二者的作用原理不同;
④不正确,漂白粉在空气中久置的化学方程式为Ca(ClO)2+H2O+CO2===CaCO3+2HClO、2HClO 2HCl+O2↑,有氧化还原反应;
⑤不正确,漂白粉在空气中变质的原因是Ca(ClO)2+H2O+CO2===
CaCO3+2HClO,而CaCl2与H2O和CO2不反应;
⑥不正确,漂白粉能用于漂白纸张,与其强氧化性有关,与其不稳定性无关。
返回
随堂演练 知识落实
1.自来水厂常用氯气对生活用水进行杀菌消毒。市场上有些不法商贩为牟取暴利,用这样的自来水冒充纯净水(离子的浓度非常低)出售,给人们的生活造成了一定的不良影响。在下列化学试剂中,可以用于鉴别这种自来水和纯净水的是
A.酚酞溶液 B.氯化钡溶液
C.氢氧化钠溶液 D.硝酸银溶液
√
1
2
3
4
Cl2消毒过的自来水中含有HCl和HClO,用AgNO3溶液即可鉴别,产生白色沉淀的是自来水,不产生白色沉淀的是纯净水。
5
2.下列关于氯气的说法不正确的是
A.尽管氯气的化学性质很活泼,但是干燥的液氯能用钢瓶贮存
B.氯气和液氯是两种不同的物质
C.可以用浓硫酸除去氯气中的水蒸气
D.Cl2跟变价金属反应生成高价金属氯化物
1
2
3
4
√
氯气和液氯是同一种物质的不同状态,B不正确。
5
3.有关氯气的性质或用途的叙述错误的是
A.工业上用氯气与消石灰反应来制漂白粉
B.自来水常用氯气来消毒杀菌,其有效成分是HClO
C.氯气有毒,制取氯气的尾气要用碱溶液吸收
D.氢气不能在氯气中燃烧
√
1
2
3
4
5
1
2
3
4
工业上利用反应2Cl2+2Ca(OH)2===CaCl2+Ca(ClO)2+2H2O制取漂白粉,A正确;
用Cl2对自来水消毒时,发生的反应为Cl2+H2O HCl+HClO,有效成分为HClO,B正确;
Cl2有毒,可用碱溶液吸收Cl2,C正确;
H2能在Cl2中燃烧生成HCl,D错误。
5
4.漂白粉在生活、生产中用途广泛。已知浓盐酸和次氯酸钙能发生反应:Ca(ClO)2+4HCl(浓)===CaCl2+2Cl2↑+2H2O。用贮存很久的漂白粉与浓盐酸制得的氯气中,可能含有的杂质气体是
①CO2 ②HCl ③H2O ④O2
A.①②③ B.②③④
C.②③ D.①④
1
2
3
4
√
5
1
2
3
4
贮存很久的漂白粉中混有CaCO3[Ca(ClO)2+CO2+H2O===CaCO3+2HClO],与浓盐酸反应时会有CO2气体产生,而反应过程中带出的水及浓盐酸中挥发出的氯化氢,也是不可避免的,所以氯气中会混有CO2、HCl、H2O。
5
5.在第一次世界大战期间,有一次德军与英法联军在比利时对峙,黎明时,英法联军前线战壕的士兵突然看到一股黄绿色气体逐渐袭来,很快数百名英、法联军战士窒息而死。后来人们在打扫战场时发现跑到山坡上的士兵竟幸免于难。
(1)由上述事例可归纳出氯气的性质有____________________________
______。
1
2
3
4
5
黄绿色气体,有毒,密度比空
气大
(2)写出下列反应的化学方程式:
①铁丝在氯气中燃烧:_____________________。
②铁粉溶于盐酸中:________________________。
③少量的铁粉溶于氯水中:_____________________________________
__________。
(3)将新鲜的花瓣放入干燥的氯气中可观察到的现象是_________,原因是_________________________________________________________
_______。
1
2
3
4
5
Fe+2HCl===FeCl2+H2↑
Fe+2HCl===FeCl2+H2↑、2FeCl2+Cl2
===2FeCl3
花瓣褪色
新鲜的花瓣中含有水分,Cl2与水反应会生成HClO,HClO具有漂白性
返回
课时对点练
题组一 氯气的物理性质
1.下列说法正确的是
A.用鼻子对着盛有氯气的瓶口,就可以嗅到氯气的气味
B.用向下排空气法可以收集到纯净的氯气
C.贮氯罐意外泄漏,应沿逆风方向疏散群众
D.氯气车间液氯泄漏时,应弯腰逃离氯气泄漏区域
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
闻气体气味的方法是用手轻轻地在瓶口扇动,仅使少量的气体飘入鼻孔,不能直接用鼻子闻,A不正确;
氯气的密度比空气大,可用向上排空气法收集氯气,B不正确;
氯气是一种有毒的气体,氯气会顺着风向扩散,疏散时应该逆着风向转移,C正确;
氯气的密度比空气大,泄漏时离地面越近氯气浓度越大,应尽量向高处逃生,D不正确。
2.下列气体中,无色有毒气体是
A.N2 B.CO C.Cl2 D.CO2
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
N2、CO2是无色、无毒气体;CO有毒但无色;Cl2是黄绿色且有毒的气体。
题组二 氯气与单质的反应
3.下列有关氯气的叙述不正确的是
A.金属钠可在氯气中剧烈燃烧
B.通常状况下,干燥的氯气能与铁反应
C.光照氯气和氢气的混合物会发生爆炸
D.氯气与水反应生成盐酸和次氯酸
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
4.(2022·陕西渭南市三贤中学高一检测)下列叙述不正确的是
A.红热的铜丝在Cl2中剧烈燃烧,产生棕黄色的烟
B.Cl2是一种很活泼的非金属单质,它具有较强的氧化性
C.过量的Fe在Cl2中燃烧,生成FeCl2
D.纯净的H2在Cl2中安静地燃烧,发出苍白色火焰,集气瓶口呈现雾状
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
红热的铜丝在Cl2中剧烈燃烧,产生大量CuCl2固体小颗粒,在空气中呈现棕黄色的烟,故A正确;
无论铁是少量还是过量,Fe在Cl2中燃烧都生成FeCl3,故C错误;
纯净的H2在Cl2中安静地燃烧,发出苍白色火焰,生成的HCl在集气瓶口呈现雾状,故D正确。
题组三 氯气与水的反应
5.某同学利用含有HCl杂质的Cl2及下列装置探究Cl2能否与水反应,其正确的组装顺序是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
A.c→d→a→b→e B.d→c→a→b→e
C.d→a→c→b→e D.d→c→b→a→e
√
先用饱和食盐水除去杂质HCl,从饱和食盐水中出来的Cl2中含有水蒸气,再用浓硫酸干燥,干燥后的Cl2先通入放有干燥的有色布条的集气瓶中,然后再通入放有湿润的有色布条的集气瓶中,注意b、a的顺序不能颠倒,否则湿润的有色布条中的水蒸气易随Cl2进入放有干燥的有色布条的集气瓶中,最后用NaOH溶液来吸收剩余的Cl2。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
6.下列关于氯水性质及现象的描述和相关解释正确的是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
操作 现象 解释
A 将氯水加入紫色石蕊试液中 石蕊试液先变红色后褪色 氯水中有H+
B 氯水中加入硝酸银溶液 产生白色沉淀 氯水中有Cl-
C 氯水中加入碳酸钠溶液 产生气体 氯水中有HClO
D 氯水中加入有色布条 有色布条褪色 氯水中有Cl2
√
7.实验室为了使用方便,通常将氯气溶解于水中形成氯水或将其降温加压形成液氯来使用。下列有关这两种液体的实验描述都正确的是
A.两种液体都可以使干燥的有色布条褪色
B.两种液体都可以使干燥的蓝色石蕊试纸变红
C.用这两种液体都可给自来水消毒
D.分别向这两种液体中投入几颗金属锌粒均有气泡产生
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
液氯是一种黄绿色的液体,是由氯气分子构成的纯净物,无酸性(不能与锌反应)、无漂白性;
氯水是一种浅黄绿色的溶液,氯水中含有Cl2、H2O、 HClO、H+、Cl-、ClO-等粒子,既有酸性(能与锌反应放出氢气),又有漂白性。
液氯溶于水得氯水,氯水中含有次氯酸,可用于自来水消毒。
题组四 氯气与碱的反应
8.当不慎有大量氯气扩散到周围空间时,处在该环境中的人可以用浸有一定浓度某物质水溶液的毛巾捂住鼻子,以防中毒,最适合采用的是
A.NaOH B.NaCl
C.NaHCO3 D.NH3·H2O
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
该物质可以吸收氯气,不可能为氯化钠;氢氧化钠对皮肤有腐蚀性;氨水易挥发,挥发出的氨气有强烈的刺激性气味。
9.化学来源于生活,也服务于生活,下列有关生活中的化学知识叙述正确的是
A.氯气和活性炭均可作为漂白剂,若同时使用,漂白效果会明显加强
B.氯气与烧碱溶液或石灰乳反应都能得到含氯消毒剂
C.测定溶液pH的实验中,用干燥的pH试纸测定新制氯水的pH对测定结
果无影响
D.洁厕剂不能与“84”消毒液混用,原因是两种溶液混合产生的HClO
易分解
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
活性炭具有吸附性,可以吸附氯气,同时使用时漂白效果不会增强,A项错误;
氯气与烧碱溶液或石灰乳反应均可生成次氯酸盐,B项正确;
氯水中的次氯酸具有漂白性,能漂白pH试纸,C项错误;
洁厕剂与“84”消毒液不能混用的原因是消毒液中的NaClO与洁厕灵中的HCl反应生成Cl2,D项错误。
10.用玻璃棒蘸取新制氯水滴在蓝色石蕊试纸中部,观察到的现象是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
氯水中含有HCl,显酸性可以使蓝色石蕊试纸变红色,又因新制氯水中含有HClO,所以试纸先变红色后又会被漂白为白色,故应选B项。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
11.在氯水中存在多种分子和离子,它们在不同的反应中表现各自的性质,下列关于氯水的说法不正确的是
A.氯水放置数天后pH将变小
B.加入有色布条,布条褪色,说明溶液中有HClO
C.氯水和液氯都是混合物
D.新制氯水可使蓝色石蕊试纸先变红后褪色
√
12.如图所示:若关闭止水夹Ⅰ,打开止水夹Ⅱ,让潮湿的氯气经过甲瓶后,通入乙瓶,布条不褪色;若关闭止水夹Ⅱ,打开止水夹Ⅰ,再通入这种气体,布条褪色。甲瓶中所盛的试剂不可能是
A.浓硫酸
B.氯化钠溶液
C.氢氧化钡溶液
D.氢氧化钠溶液
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
布条不褪色的原因可能有两种:一种是将氯气干燥而不能使红色布条褪色,甲瓶所盛试剂可能是干燥剂(如A中的浓硫酸);另一种是能吸收氯气的试剂(如C、D中的强碱)。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
13.世界卫生组织将ClO2定为A级高效安全灭菌消毒剂,它在食品保鲜、饮用水消毒等方面有广泛应用。消毒效率是用单位质量的消毒剂得电子数来表示的,得电子数等于元素化合价的降低数。ClO2作消毒剂时和氯气一样,产物均为Cl-。下列关于ClO2的说法正确的是
A.ClO2的摩尔质量为67.5
B.从分类上来看,ClO2属于金属氧化物
C.ClO2的消毒效率是氯气的2.63倍
D.ClO2分子中氯元素与氧元素的质量比为1∶2
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
A项错误,摩尔质量应带单位;
B项错误,从分类上来看,ClO2属于非金属氧化物;
D项错误,ClO2分子中氯原子与氧原子的个数比为1∶2,氯元素与氧元素的质量比为35.5∶32。
14.氯气能使湿润的红色布条褪色。对于使红色布条褪色的物质,同学们的看法不一致,认为氯水中存在的几种粒子都有可能。请设计实验,得出正确的结论。(已知:强氧化性的物质往往具有漂白性。)
(1)提出问题:
氯水中的何种物质能使红色布条褪色?
(2)收集资料:
①氯气有强氧化性;
②氯气与水反应生成盐酸和次氯酸;
③次氯酸有强氧化性。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
(3)提出假设:
①___________________;
②_____________________;
③___________________;
④水使红色布条褪色。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
氯气使红色布条褪色
次氯酸使红色布条褪色
盐酸使红色布条褪色
(4)验证假设:
实验①:把干燥的红色布条放入充满氯气的集气瓶中,红色布条不褪色;
实验②:________________________________________________;
实验③:_____________________________________________;
实验④:把干燥的红色布条放在水里,红色布条不褪色。
(5)得出的实验结论是_______________________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
把干燥的红色布条伸入次氯酸溶液中,红色布条褪色
把干燥的红色布条伸入稀盐酸中,红色布条不褪色
氯水中的次氯酸能使红色布条褪色
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
提出假设是根据收集到的资料结合所学知识进行的。
氯气有氧化性,那么假设氯气使红色布条褪色,氯气和水反应生成盐酸和次氯酸,假设盐酸或次氯酸能使红色布条褪色。
氯水中的氯气、稀盐酸、水均不能使红色布条褪色,说明是次氯酸使红色布条褪色。
15.已知反应:NaClO+NaCl+H2SO4 Na2SO4+Cl2↑+H2O,为探究氯气的性质,某同学设计了如图所示的实验装置。
试回答下列问题:
(1)在该实验中,以下可用于制取
氯气的装置是____(填字母)。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
c
(2)装置B、C中依次放入的是干燥
的红色布条和湿润的红色布条,实
验过程中该同学发现装置B中的布
条也褪色,其原因可能是________
_____________,请提出合理的改
进方法:____________________________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
Cl2中混
有少量水蒸气
在A~B之间增设装有浓H2SO4的洗气瓶
干燥的红色布条褪色说明Cl2中混有水蒸气,生成了HClO,故应增设干燥装置。
(3)D中的现象是________________
_____,反应的化学方程式为_____
_______________,分离D中液体的
方法是______。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
下层CCl4层呈紫
红色
Cl2+2KI===I2+2KCl,CCl4将I2萃取出来,分离两种互不相溶的液体可采用分液法。
Cl2+
2KI===I2+2KCl
分液
(4)写出氯气与NaOH溶液反应的化
学方程式:___________________
______________,为验证尾气吸收
后的溶液中存在Cl-,正确的操作
是____________________________
____________________________________________________________________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
Cl2+2NaOH===NaCl
+NaClO+H2O
取少量烧杯内吸收Cl2后的溶液,
加入足量的稀HNO3酸化,再加入AgNO3溶液,若有白色沉淀生成,证明其中含有Cl-
为检验Cl-,应先用稀HNO3酸化中和溶液中的OH-,再加AgNO3溶液,若有AgCl白色沉淀生成,证明含有Cl-。
(5)氯气通入饱和NaHCO3溶液中能
产生无色气体,已知酸性:盐酸>
碳酸>次氯酸,该实验可证明Cl2
与H2O反应的产物中含有_____(填
化学式)。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
HCl
因酸性:HCl>H2CO3>HClO,HCl可与NaHCO3反应:HCl+NaHCO3
===NaCl+H2O+CO2↑,而HClO不与NaHCO3反应,故氯气与H2O反应的产物中含有HCl。
返回
