2022-2023学年苏教版2019高中化学必修1 专题3 从海水中获得的化学物质 知识体系构建与核心素养提升 课件(34张PPT)
文档属性
| 名称 | 2022-2023学年苏教版2019高中化学必修1 专题3 从海水中获得的化学物质 知识体系构建与核心素养提升 课件(34张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-07-15 21:44:47 | ||
图片预览







文档简介
(共34张PPT)
知识体系构建 / 核心素养提升
本专题知识体系构建与核心素养提升
专题3
内容索引
知识体系构建
核心素养提升
知识体系构建
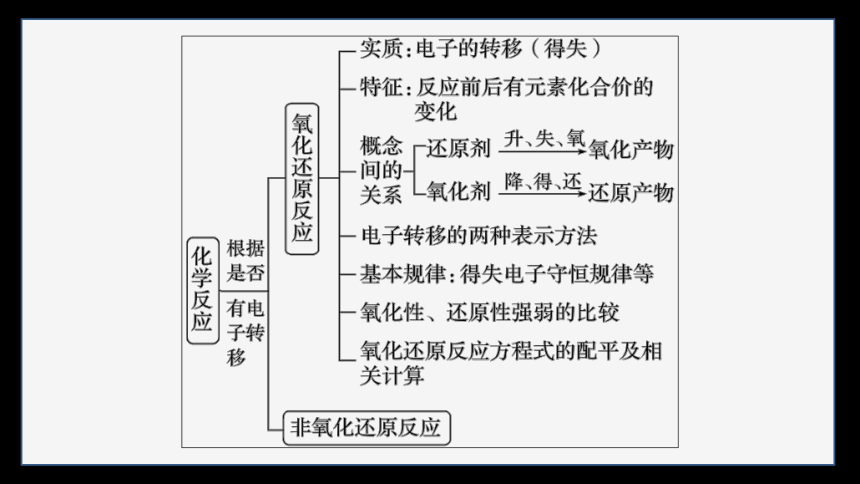
一、化学反应
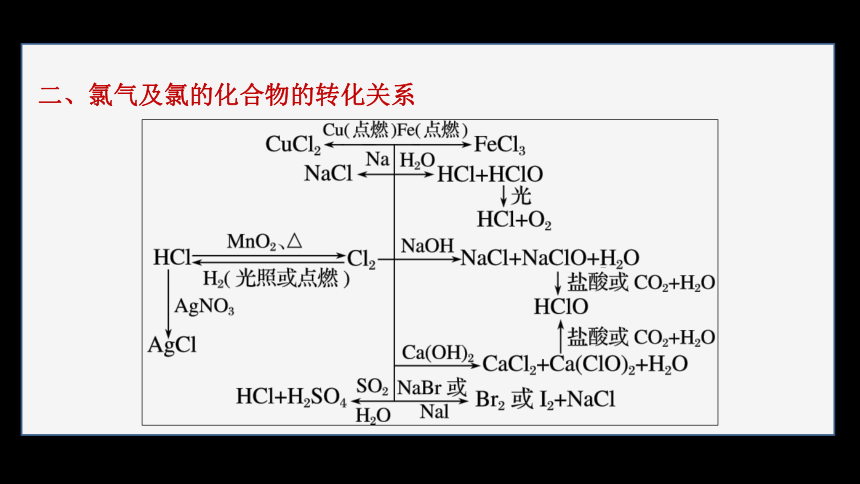
二、氯气及氯的化合物的转化关系
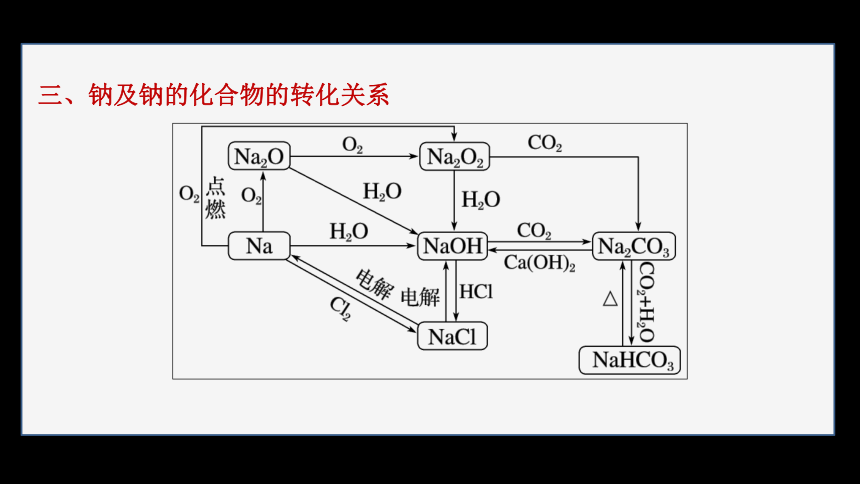
三、钠及钠的化合物的转化关系
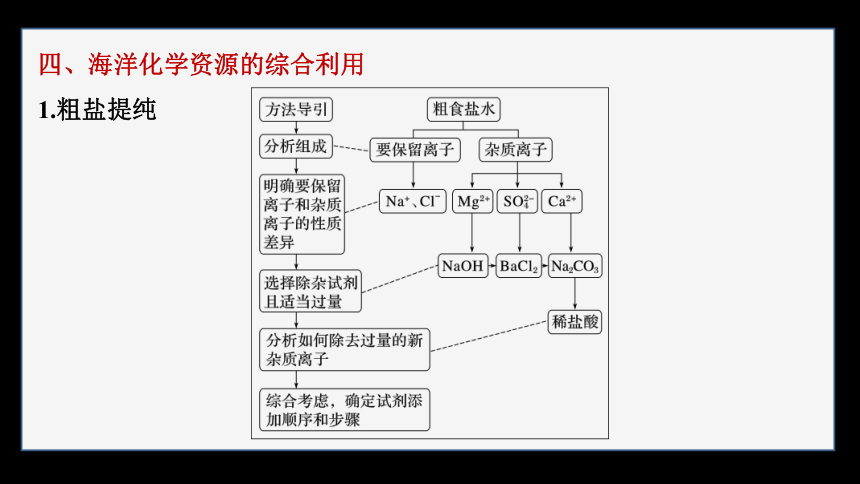
四、海洋化学资源的综合利用
1.粗盐提纯
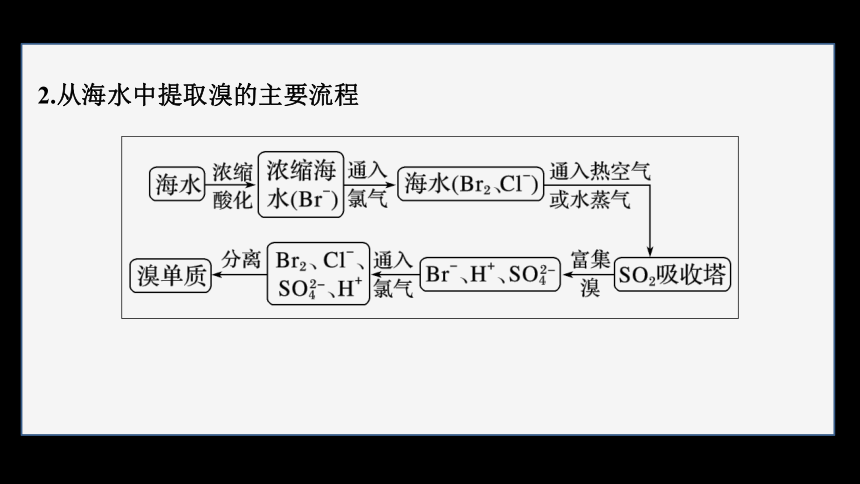
2.从海水中提取溴的主要流程
3.从海水中提取镁的主要流程
4.从海带中提取碘的过程
海带→晒干、灼烧→浸取→过滤→氧化→萃取→碘单质
返回
核心素养提升
通过本专题的学习,初步掌握探究元素及其化合物性质的基本方法,能从氧化还原反应、离子反应的角度理解氯及其重要化合物、钠及其重要化合物的性质,并能用符号正确的表征。了解海洋资源的分布,能依据物质的性质和实验方法设计资源综合利用的方案,建立绿色化学的意识,认识化学科学在开发利用自然资源、制备新物质、环境保护等方面发挥的积极作用。
[方程式再书写]
1.氯及其化合物
写出下列反应的化学方程式,是离子反应的写离子方程式:
(1)Cl2和H2O的反应
;
(2)Cl2和NaOH溶液的反应
;
Cl2+2OH-===Cl-+ClO-+H2O
(3)Cl2和石灰乳的反应
;
(4)将Cl2通入氢硫酸溶液中
;
(5)将浓盐酸和MnO2混合加热
;
(6)HClO见光分解
。
Cl2+Ca(OH)2===Ca2++Cl-+ClO-+H2O
Cl2+H2S===S↓+2H++2Cl-
2.钠及其重要化合物
写出下列反应的化学方程式,是离子反应的写离子方程式:
(1)Na和H2O的反应
;
(2)Na在空气中燃烧
;
2Na+2H2O===2Na++2OH-+H2↑
(3)Na2O2和H2O的反应
;
(4)Na2O2和CO2的反应
;
(5)向Na2CO3溶液中通入CO2
;
2Na2O2+2H2O===4Na++4OH-+O2↑
2Na2O2+2CO2===2Na2CO3+O2
(6)NaHCO3溶液和稀盐酸反应
;
(7)NaHCO3溶液和NaOH溶液反应
;
(8)NaHCO3受热分解
。
小明通过学习知道Na2CO3、NaHCO3均能与盐酸反应,Na2CO3溶液还会与石灰水反应。
【产生疑问】NaHCO3溶液也能与石灰水反应吗?如果能反应,生成物可能是什么?
【进行实验】小明将NaHCO3溶液与石灰水混合,结果产生白色沉淀,已知Ca(HCO3)2能溶于水,碳酸氢盐在碱溶液中会生成碳酸盐。此白色沉淀是________;为了进一步了解生成的含钠化合物有什么,继续探究:
例1
CaCO3
【做出猜想】①只有NaOH
②有Na2CO3和NaOH
③_____________
【实验设计】
步骤1:取少量上述实验后的上层清液于试管中,再滴加足量的CaCl2溶液(中性),观察到产生白色沉淀,由此可知生成的含钠化合物一定含有________;
只有Na2CO3
Na2CO3
步骤2:将步骤1中反应后的混合物过滤,往滤液中先滴加几滴酚酞溶液,再滴加足量的稀盐酸,观察到溶液颜色变化情况为__________________
_______________________,整个实验过程中无气泡产生,由此可知猜想②成立。
【拓展提高】若步骤1中未出现白色沉淀,则此时NaHCO3溶液与Ca(OH)2溶液反应的化学方程式为_________________________________
____________。
色,然后由红色变为无色
溶液先由无色变红
Ca(OH)2+NaHCO3===CaCO3↓+
NaOH+H2O
故将NaHCO3溶液与石灰水混合后,产物除CaCO3外,溶液中还可能有:
①Ca(OH)2过量时,发生反应NaHCO3+Ca(OH)2===CaCO3↓+NaOH+H2O;
②恰好反应时,2NaHCO3+Ca(OH)2===CaCO3↓+Na2CO3+2H2O;
③NaHCO3过量时,产物有CaCO3、Na2CO3,剩余NaHCO3。
依据以上分析可猜想:生成的含钠化合物只能有三种情况:①NaOH、②Na2CO3和NaOH、③Na2CO3。
氯水是实验室需临时配制的一种试剂。图甲所示的是实验室配制氯水时的一种常用装置,图乙是某化学实验小组自行设计的一种配制氯水的装置(图中的鼓气球是一种具有气体单向阀,可用于向瓶中鼓入空气的仪器)(已知常温下KMnO4固体与浓盐酸反应产生氯气)。
例2
(1)氯水中含有七种粒子,其中的分子为_________________(填化学式);需临时配制的原因是______________________(用化学方程式表示)。
Cl2、H2O、HClO
因为次氯酸见光分解生成氧气和盐酸,所以需要临时配制。
(2)图甲所示装置中,烧杯内的液体是__________,烧杯
中发生反应的离子方程式是_______________________
______。
烧杯中的液体是为了吸收多余的氯气,所以使用NaOH溶液。
NaOH溶液
Cl2+2OH-===ClO-+Cl-
+H2O
(3)用图乙所示装置配制氯水时,操作步骤如下:
①关闭活塞2,打开分液漏斗上口的玻璃塞,再打开活
塞1,将少量浓盐酸注入大试管内。
②关闭活塞1,盖上分液漏斗上口玻璃塞。浓盐酸和大
试管内的高锰酸钾粉末反应产生氯气。
③轻轻摇动瓶A,使氯气不断溶入水中。
用图乙所示装置能在较短时间内得到饱和氯水。除了在
摇动过程中增大了气体和水的接触面积以外,另一个重
要原因是________________________________________
_____。
分液漏斗中的浓盐酸应分数次加入试管内。若一次加入太多的浓盐酸,可能引起的后果是_____________________________________________
_______。
氯气在瓶内产生较大压强,增大了氯气的溶
解度
瓶内产生过多的氯气,瓶内压强过大使瓶A的橡胶
塞弹开
(4)配制氯水完成后,不必拆卸装置即可从瓶A中取用少量氯水,方法是_________________________________
_______________。
关闭活塞1,打开活塞2,用鼓气球向瓶A中鼓入空气
海水是巨大的资源宝库,海水淡化及其综合利用具有重要意义。
例3
请回答下列问题:
(1)步骤Ⅰ中,粗盐中含有Ca2+、Mg2+、
等杂质离子,粗盐精制过程中依次
加入过量BaCl2、Na2CO3溶液,请写出加
入Na2CO3溶液后相关反应的离子方程式:
_____________________________________________。
可依次加入过量BaCl2(除去硫酸根离子)、Na2CO3(除去钙离子和多余的钡离子)、NaOH(除去镁离子),过滤后加适量盐酸调节溶液的pH,然后蒸发即可,
(2)海水提溴,制得1 mol Br2至少需要消
耗___ mol Cl2。步骤Ⅱ中需要向母液中
加入稀硫酸酸化,其作用是__________
_________。
步骤Ⅲ若用Na2SO3水溶液吸收Br2,有关
反应的离子方程式为__________________________________。
2
抑制氯、溴
和水反应
流程中海水提溴,先向母液中通入Cl2将Br-氧化为Br2,再用SO2将其还原为Br-,最后再通入Cl2将Br-氧化为Br2,
忽略过程中的损失,制得1 mol Br2至少需要消耗2 mol Cl2。
(3)步骤Ⅳ由Mg(OH)2得到单质Mg,以下方法最合适的是___(填字母)。
D
电解MgCl2溶液得不到单质Mg,氧化镁熔点很高,应电解熔融的MgCl2制取单质Mg,所以D项制取单质镁的方法最适合。
(4)判断Mg(OH)2是否洗涤干净的操作是__________________________________
__________________________________
__________________________________
_______。
取最后一次的洗涤液少量于试管中,向其中加入HNO3酸化的AgNO3溶液,如果没有沉淀产生,证明沉淀已经洗涤干净
判断Mg(OH)2是否洗涤干净,就是检验最后一次洗涤液中是否存在Cl-。
返回
知识体系构建 / 核心素养提升
本专题知识体系构建与核心素养提升
专题3
内容索引
知识体系构建
核心素养提升
知识体系构建
一、化学反应
二、氯气及氯的化合物的转化关系
三、钠及钠的化合物的转化关系
四、海洋化学资源的综合利用
1.粗盐提纯
2.从海水中提取溴的主要流程
3.从海水中提取镁的主要流程
4.从海带中提取碘的过程
海带→晒干、灼烧→浸取→过滤→氧化→萃取→碘单质
返回
核心素养提升
通过本专题的学习,初步掌握探究元素及其化合物性质的基本方法,能从氧化还原反应、离子反应的角度理解氯及其重要化合物、钠及其重要化合物的性质,并能用符号正确的表征。了解海洋资源的分布,能依据物质的性质和实验方法设计资源综合利用的方案,建立绿色化学的意识,认识化学科学在开发利用自然资源、制备新物质、环境保护等方面发挥的积极作用。
[方程式再书写]
1.氯及其化合物
写出下列反应的化学方程式,是离子反应的写离子方程式:
(1)Cl2和H2O的反应
;
(2)Cl2和NaOH溶液的反应
;
Cl2+2OH-===Cl-+ClO-+H2O
(3)Cl2和石灰乳的反应
;
(4)将Cl2通入氢硫酸溶液中
;
(5)将浓盐酸和MnO2混合加热
;
(6)HClO见光分解
。
Cl2+Ca(OH)2===Ca2++Cl-+ClO-+H2O
Cl2+H2S===S↓+2H++2Cl-
2.钠及其重要化合物
写出下列反应的化学方程式,是离子反应的写离子方程式:
(1)Na和H2O的反应
;
(2)Na在空气中燃烧
;
2Na+2H2O===2Na++2OH-+H2↑
(3)Na2O2和H2O的反应
;
(4)Na2O2和CO2的反应
;
(5)向Na2CO3溶液中通入CO2
;
2Na2O2+2H2O===4Na++4OH-+O2↑
2Na2O2+2CO2===2Na2CO3+O2
(6)NaHCO3溶液和稀盐酸反应
;
(7)NaHCO3溶液和NaOH溶液反应
;
(8)NaHCO3受热分解
。
小明通过学习知道Na2CO3、NaHCO3均能与盐酸反应,Na2CO3溶液还会与石灰水反应。
【产生疑问】NaHCO3溶液也能与石灰水反应吗?如果能反应,生成物可能是什么?
【进行实验】小明将NaHCO3溶液与石灰水混合,结果产生白色沉淀,已知Ca(HCO3)2能溶于水,碳酸氢盐在碱溶液中会生成碳酸盐。此白色沉淀是________;为了进一步了解生成的含钠化合物有什么,继续探究:
例1
CaCO3
【做出猜想】①只有NaOH
②有Na2CO3和NaOH
③_____________
【实验设计】
步骤1:取少量上述实验后的上层清液于试管中,再滴加足量的CaCl2溶液(中性),观察到产生白色沉淀,由此可知生成的含钠化合物一定含有________;
只有Na2CO3
Na2CO3
步骤2:将步骤1中反应后的混合物过滤,往滤液中先滴加几滴酚酞溶液,再滴加足量的稀盐酸,观察到溶液颜色变化情况为__________________
_______________________,整个实验过程中无气泡产生,由此可知猜想②成立。
【拓展提高】若步骤1中未出现白色沉淀,则此时NaHCO3溶液与Ca(OH)2溶液反应的化学方程式为_________________________________
____________。
色,然后由红色变为无色
溶液先由无色变红
Ca(OH)2+NaHCO3===CaCO3↓+
NaOH+H2O
故将NaHCO3溶液与石灰水混合后,产物除CaCO3外,溶液中还可能有:
①Ca(OH)2过量时,发生反应NaHCO3+Ca(OH)2===CaCO3↓+NaOH+H2O;
②恰好反应时,2NaHCO3+Ca(OH)2===CaCO3↓+Na2CO3+2H2O;
③NaHCO3过量时,产物有CaCO3、Na2CO3,剩余NaHCO3。
依据以上分析可猜想:生成的含钠化合物只能有三种情况:①NaOH、②Na2CO3和NaOH、③Na2CO3。
氯水是实验室需临时配制的一种试剂。图甲所示的是实验室配制氯水时的一种常用装置,图乙是某化学实验小组自行设计的一种配制氯水的装置(图中的鼓气球是一种具有气体单向阀,可用于向瓶中鼓入空气的仪器)(已知常温下KMnO4固体与浓盐酸反应产生氯气)。
例2
(1)氯水中含有七种粒子,其中的分子为_________________(填化学式);需临时配制的原因是______________________(用化学方程式表示)。
Cl2、H2O、HClO
因为次氯酸见光分解生成氧气和盐酸,所以需要临时配制。
(2)图甲所示装置中,烧杯内的液体是__________,烧杯
中发生反应的离子方程式是_______________________
______。
烧杯中的液体是为了吸收多余的氯气,所以使用NaOH溶液。
NaOH溶液
Cl2+2OH-===ClO-+Cl-
+H2O
(3)用图乙所示装置配制氯水时,操作步骤如下:
①关闭活塞2,打开分液漏斗上口的玻璃塞,再打开活
塞1,将少量浓盐酸注入大试管内。
②关闭活塞1,盖上分液漏斗上口玻璃塞。浓盐酸和大
试管内的高锰酸钾粉末反应产生氯气。
③轻轻摇动瓶A,使氯气不断溶入水中。
用图乙所示装置能在较短时间内得到饱和氯水。除了在
摇动过程中增大了气体和水的接触面积以外,另一个重
要原因是________________________________________
_____。
分液漏斗中的浓盐酸应分数次加入试管内。若一次加入太多的浓盐酸,可能引起的后果是_____________________________________________
_______。
氯气在瓶内产生较大压强,增大了氯气的溶
解度
瓶内产生过多的氯气,瓶内压强过大使瓶A的橡胶
塞弹开
(4)配制氯水完成后,不必拆卸装置即可从瓶A中取用少量氯水,方法是_________________________________
_______________。
关闭活塞1,打开活塞2,用鼓气球向瓶A中鼓入空气
海水是巨大的资源宝库,海水淡化及其综合利用具有重要意义。
例3
请回答下列问题:
(1)步骤Ⅰ中,粗盐中含有Ca2+、Mg2+、
等杂质离子,粗盐精制过程中依次
加入过量BaCl2、Na2CO3溶液,请写出加
入Na2CO3溶液后相关反应的离子方程式:
_____________________________________________。
可依次加入过量BaCl2(除去硫酸根离子)、Na2CO3(除去钙离子和多余的钡离子)、NaOH(除去镁离子),过滤后加适量盐酸调节溶液的pH,然后蒸发即可,
(2)海水提溴,制得1 mol Br2至少需要消
耗___ mol Cl2。步骤Ⅱ中需要向母液中
加入稀硫酸酸化,其作用是__________
_________。
步骤Ⅲ若用Na2SO3水溶液吸收Br2,有关
反应的离子方程式为__________________________________。
2
抑制氯、溴
和水反应
流程中海水提溴,先向母液中通入Cl2将Br-氧化为Br2,再用SO2将其还原为Br-,最后再通入Cl2将Br-氧化为Br2,
忽略过程中的损失,制得1 mol Br2至少需要消耗2 mol Cl2。
(3)步骤Ⅳ由Mg(OH)2得到单质Mg,以下方法最合适的是___(填字母)。
D
电解MgCl2溶液得不到单质Mg,氧化镁熔点很高,应电解熔融的MgCl2制取单质Mg,所以D项制取单质镁的方法最适合。
(4)判断Mg(OH)2是否洗涤干净的操作是__________________________________
__________________________________
__________________________________
_______。
取最后一次的洗涤液少量于试管中,向其中加入HNO3酸化的AgNO3溶液,如果没有沉淀产生,证明沉淀已经洗涤干净
判断Mg(OH)2是否洗涤干净,就是检验最后一次洗涤液中是否存在Cl-。
返回
