2022-2023学年苏教版2019高中化学必修1 专题4 硫与环境保护 知识体系构建与核心素养提升 课件(27张PPT)
文档属性
| 名称 | 2022-2023学年苏教版2019高中化学必修1 专题4 硫与环境保护 知识体系构建与核心素养提升 课件(27张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 596.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-07-16 09:38:02 | ||
图片预览








文档简介
(共27张PPT)
知识体系构建 / 核心素养提升
本专题知识体系构建与核心素养提升
专题4
内容索引
知识体系构建
核心素养提升
知识体系构建
1.含硫化合物的性质
二氧化硫的性质
酸性氧化物的通性
还原性、氧化性
漂白性
硫酸的工业制备和性质
用硫铁矿制硫酸
浓硫酸的吸水性和脱水性
浓硫酸的强氧化性
2.硫及其化合物的相互转化
含硫物质之间的转化
不同价态含硫物质之间的转化
相同价态含硫物质之间的转化
氧化还原反应方程式的配平
3.防治二氧化硫对环境的污染
酸雨及其治理
酸雨的形成和危害
硫酸型酸雨的治理
空气质量评价
空气质量指数
对雾霾的认识
返回
核心素养提升
认识科学探究是进行科学解释和发现、创造和应用的科学实践活动;能发现和提出有探究价值的问题;能从问题和假设出发,确定探究目的,设计探究方案,进行实验探究;在探究中学会合作,面对“异常”现象敢于提出自己的见解。能学会收集各种证据,对物质的性质及其变化提出可能的假设;基于证据进行分析推理、证实或证伪假设;能解释证据与结论之间的关系,确定形成科学结论所需要的证据和寻找证据的途径。形成有序的认知思维方法,建立相关应用的思维模型,
即运用模型解释化学现象,揭示现象的本质和规律。具有严谨求实的科学态度,具有探索未知、崇尚真理的意识;了解化学对社会发展的重大贡献,具有可持续发展意识和绿色化学观念,能对与化学有关的社会热点问题做出正确的价值判断。
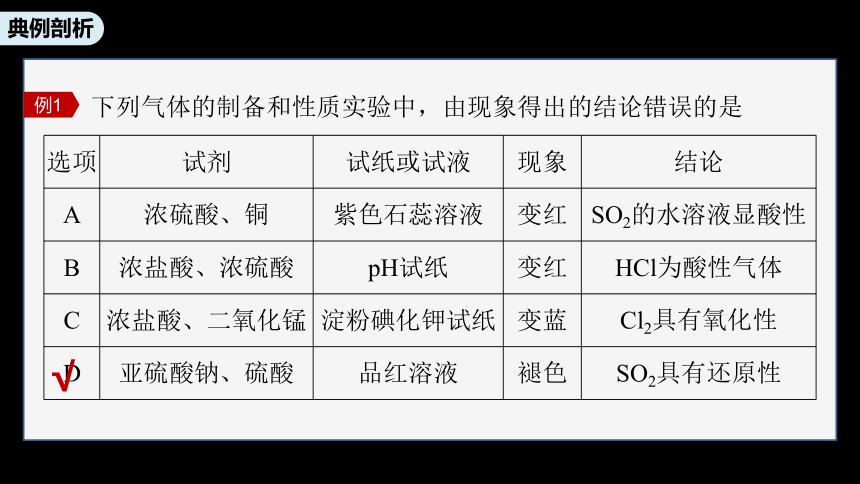
下列气体的制备和性质实验中,由现象得出的结论错误的是
例1
选项 试剂 试纸或试液 现象 结论
A 浓硫酸、铜 紫色石蕊溶液 变红 SO2的水溶液显酸性
B 浓盐酸、浓硫酸 pH试纸 变红 HCl为酸性气体
C 浓盐酸、二氧化锰 淀粉碘化钾试纸 变蓝 Cl2具有氧化性
D 亚硫酸钠、硫酸 品红溶液 褪色 SO2具有还原性
√
B项,利用浓硫酸的高沸点,可以制取HCl,pH试纸变红,则说明气体为酸性气体,正确;
C项,浓盐酸和二氧化锰加热可以制取Cl2,Cl2可以用湿润的淀粉碘化钾试纸检验,试纸变蓝,说明KI转化为I2,则说明Cl2具有强氧化性,正确;
D项,使品红溶液褪色体现的是SO2的漂白性,错误。
某实验小组欲探究SO2和Cl2能否发生反应,设计如图所示的实验装置进行实验。
(1)装置A中的反应为2KMnO4+16HCl(浓)
例2
===2KCl+2MnCl2+5Cl2↑+8H2O,反应中的氧化剂是 ,生成71 g Cl2转移的电子是 mol。装置C中生成SO2,反应的化学方程式是
。
Na2SO3+H2SO4(浓)===Na2SO4+SO2↑+H2O
KMnO4
2
KMnO4与浓盐酸的反应中KMnO4为氧化剂,HCl为还原剂;
(2)装置B中蘸有NaOH溶液的棉花的作用是 。
吸收SO2和Cl2,防止污染空气
SO2、Cl2均是有毒气体,NaOH溶液可以吸收SO2和Cl2,防止污染空气。
(3)打开装置A、C中分液漏斗的旋塞,一段时间后关闭旋塞。待反应完全后,小组同学又继续做如下实验。
①甲同学取适量装置B中的溶液于试管中,
向其中滴加少量AgNO3溶液,有白色沉淀生成。甲同学由此认为SO2和Cl2发生了反应,理由是该反应中生成了 (填离子符号)。
Cl-
滴加少量AgNO3溶液,有白色沉淀生成,说明装置B中溶液含有Cl-。
②乙同学认为甲同学的结论不合理,认为装置A中生成的Cl2中混有杂质,应该在装置A、B间增加一个洗气瓶,然后再按甲同学的方法即可得到正确结论。乙
同学认为Cl2中混有的杂质是 ,洗气瓶中盛有试剂的名称是
。
HCl 饱和食
盐水
浓盐酸具有挥发性,故KMnO4和浓盐酸反应制得的Cl2中含有少量HCl气体,要除去Cl2中混有的HCl气体,可以使气体通过饱和食盐水。
③丙同学则认为甲、乙两位同学的结论均不合理。丙同学取适量装置B中的溶液于试管中,向其中滴加少量溶液X,有白色沉淀生成,则可得出结论,即SO2
与Cl2同时通入水中,可以发生反应。溶液X是 (填字母)。
a.BaCl2溶液 b.Ba(OH)2溶液
c.Ca(OH)2溶液 d.品红溶液
SO2与Cl2同时通入水中反应的化学方程式是
。
a
SO2+Cl2+2H2O===2HCl+
H2SO4
取适量装置B中的溶液于试管中,向其中滴加少量BaCl2溶液,若有白色沉淀生成,说明装置B中溶液含有 ,进而说明SO2与Cl2在水中发生了反应:SO2+Cl2+2H2O===2HCl+H2SO4;
若溶液X为Ba(OH)2溶液,SO2与Ba(OH)2反应可生成BaSO3白色沉淀,不能说明SO2和Cl2在水中发生了反应;
若溶液X是品红溶液,则不会有白色沉淀生成。
酸雨是当今世界面临的一个重大的环境问题,SO2和NO2都能溶于水形成酸雨而破坏环境。请回答下列问题:
(1)酸雨通常是指降水的pH< ,则收集该酸雨,露置于空气中,一段时间后发现pH变小了,试用化学方程式解释: 。
例3
5.6
2H2SO3 +O2===2H2SO4
正常的雨水因为含有碳酸而显酸性,pH约为5.6;
酸雨是指pH<5.6的降水;收集该酸雨并露置于空气中,一段时间后,亚硫酸被空气中的氧气氧化生成了硫酸,硫酸为强酸,溶液的酸性增强,pH减小,反应的化学方程式为2H2SO3 +O2===2H2SO4。
(2)为减少酸雨的产生,有下列措施:①少用煤作燃料;②把工厂的烟囱建高;③在酸化的土壤中加水;④燃料脱硫;⑤开发新能源。其中有效的措施是 (填字母)。
A.①②③ B.①④⑤
C.①③④ D.②③④
B
少用煤作燃料,能减少二氧化硫的排放量,进而减少酸雨的产生,故①选;把工厂的烟囱建高,不能减少二氧化硫的排放量,故②不选;
在酸化的土壤中加水,不能消除二氧化硫,故③不选;
燃料脱硫,能减少二氧化硫的排放量,进而减少酸雨的产生,故④选;
开发新能源,能减少二氧化硫的排放量,进而减少酸雨的产生,故⑤选。
酸阅读下列材料,回答下列问题。
材料一 我国部分城市空气质量周报。
例4
城市 污染指数 首要污染物 空气质量等级
北京 92 TSP Ⅱ
贵阳 69 TSP Ⅱ
(总悬浮物为TSP)
材料二 近年来,随着工业化和城市化进程的加快,北京每年有2 000万
吨煤的燃烧,200万辆机动车的排气,5 000多处建筑工地的扬尘,大大加剧了北京的污染。贵阳曾经被联合国有关组织列为世界十大酸雨污染城市之一,是贵州省酸雨污染的中心,也是酸雨污染最严重的城市。20世纪90年代,贵阳市空气中的二氧化硫的含量超过国家2级标准两倍多,酸雨出现的频率占全年降水的21%。
(1)北京和贵阳的首要污染物分别是 (填字母,下同)。
A.可吸入颗粒物、可吸入颗粒物
B.可吸入颗粒物、二氧化硫
C.二氧化硫、可吸入颗粒物
D.二氧化硫、二氧化硫
A
(2)北京与贵阳主要大气污染物的不同主要体现在 。
A.北京大气污染物中的汽车尾气含量小于贵阳
B.北京大气污染物中的二氧化硫含量大于贵阳
C.贵阳大气污染物中可吸入颗粒物含量最低
D.贵阳大气污染物中二氧化硫的含量大于北京
D
(3)北京与贵阳相比,酸雨危害较重的是 。
A.都一样 B.北京
C.贵阳 D.无法比较
C
(4)贵阳的酸雨除居民生活、工业生产大量使用高硫煤外,可能还与下列哪些因素有关 。
①贵阳地处山间盆地,风小,湿度大,不利于污染物的扩散 ②贵阳大风天气多,比较干燥 ③南方多为酸性土壤,加剧了酸雨危害
④南方降水量大,大气中含有碱性尘沙
A.①② B.①③ C.②④ D.①②③④
B
北京和贵阳的首要污染物均为可吸入颗粒物,北京大气中的SO2含量低于贵阳,因而酸雨危害较重的为贵阳,贵阳酸雨不仅与酸性气体的排放量有关系,还与贵阳的地形以及酸性土壤有关系。
返回
本课结束
专题4
知识体系构建 / 核心素养提升
本专题知识体系构建与核心素养提升
专题4
内容索引
知识体系构建
核心素养提升
知识体系构建
1.含硫化合物的性质
二氧化硫的性质
酸性氧化物的通性
还原性、氧化性
漂白性
硫酸的工业制备和性质
用硫铁矿制硫酸
浓硫酸的吸水性和脱水性
浓硫酸的强氧化性
2.硫及其化合物的相互转化
含硫物质之间的转化
不同价态含硫物质之间的转化
相同价态含硫物质之间的转化
氧化还原反应方程式的配平
3.防治二氧化硫对环境的污染
酸雨及其治理
酸雨的形成和危害
硫酸型酸雨的治理
空气质量评价
空气质量指数
对雾霾的认识
返回
核心素养提升
认识科学探究是进行科学解释和发现、创造和应用的科学实践活动;能发现和提出有探究价值的问题;能从问题和假设出发,确定探究目的,设计探究方案,进行实验探究;在探究中学会合作,面对“异常”现象敢于提出自己的见解。能学会收集各种证据,对物质的性质及其变化提出可能的假设;基于证据进行分析推理、证实或证伪假设;能解释证据与结论之间的关系,确定形成科学结论所需要的证据和寻找证据的途径。形成有序的认知思维方法,建立相关应用的思维模型,
即运用模型解释化学现象,揭示现象的本质和规律。具有严谨求实的科学态度,具有探索未知、崇尚真理的意识;了解化学对社会发展的重大贡献,具有可持续发展意识和绿色化学观念,能对与化学有关的社会热点问题做出正确的价值判断。
下列气体的制备和性质实验中,由现象得出的结论错误的是
例1
选项 试剂 试纸或试液 现象 结论
A 浓硫酸、铜 紫色石蕊溶液 变红 SO2的水溶液显酸性
B 浓盐酸、浓硫酸 pH试纸 变红 HCl为酸性气体
C 浓盐酸、二氧化锰 淀粉碘化钾试纸 变蓝 Cl2具有氧化性
D 亚硫酸钠、硫酸 品红溶液 褪色 SO2具有还原性
√
B项,利用浓硫酸的高沸点,可以制取HCl,pH试纸变红,则说明气体为酸性气体,正确;
C项,浓盐酸和二氧化锰加热可以制取Cl2,Cl2可以用湿润的淀粉碘化钾试纸检验,试纸变蓝,说明KI转化为I2,则说明Cl2具有强氧化性,正确;
D项,使品红溶液褪色体现的是SO2的漂白性,错误。
某实验小组欲探究SO2和Cl2能否发生反应,设计如图所示的实验装置进行实验。
(1)装置A中的反应为2KMnO4+16HCl(浓)
例2
===2KCl+2MnCl2+5Cl2↑+8H2O,反应中的氧化剂是 ,生成71 g Cl2转移的电子是 mol。装置C中生成SO2,反应的化学方程式是
。
Na2SO3+H2SO4(浓)===Na2SO4+SO2↑+H2O
KMnO4
2
KMnO4与浓盐酸的反应中KMnO4为氧化剂,HCl为还原剂;
(2)装置B中蘸有NaOH溶液的棉花的作用是 。
吸收SO2和Cl2,防止污染空气
SO2、Cl2均是有毒气体,NaOH溶液可以吸收SO2和Cl2,防止污染空气。
(3)打开装置A、C中分液漏斗的旋塞,一段时间后关闭旋塞。待反应完全后,小组同学又继续做如下实验。
①甲同学取适量装置B中的溶液于试管中,
向其中滴加少量AgNO3溶液,有白色沉淀生成。甲同学由此认为SO2和Cl2发生了反应,理由是该反应中生成了 (填离子符号)。
Cl-
滴加少量AgNO3溶液,有白色沉淀生成,说明装置B中溶液含有Cl-。
②乙同学认为甲同学的结论不合理,认为装置A中生成的Cl2中混有杂质,应该在装置A、B间增加一个洗气瓶,然后再按甲同学的方法即可得到正确结论。乙
同学认为Cl2中混有的杂质是 ,洗气瓶中盛有试剂的名称是
。
HCl 饱和食
盐水
浓盐酸具有挥发性,故KMnO4和浓盐酸反应制得的Cl2中含有少量HCl气体,要除去Cl2中混有的HCl气体,可以使气体通过饱和食盐水。
③丙同学则认为甲、乙两位同学的结论均不合理。丙同学取适量装置B中的溶液于试管中,向其中滴加少量溶液X,有白色沉淀生成,则可得出结论,即SO2
与Cl2同时通入水中,可以发生反应。溶液X是 (填字母)。
a.BaCl2溶液 b.Ba(OH)2溶液
c.Ca(OH)2溶液 d.品红溶液
SO2与Cl2同时通入水中反应的化学方程式是
。
a
SO2+Cl2+2H2O===2HCl+
H2SO4
取适量装置B中的溶液于试管中,向其中滴加少量BaCl2溶液,若有白色沉淀生成,说明装置B中溶液含有 ,进而说明SO2与Cl2在水中发生了反应:SO2+Cl2+2H2O===2HCl+H2SO4;
若溶液X为Ba(OH)2溶液,SO2与Ba(OH)2反应可生成BaSO3白色沉淀,不能说明SO2和Cl2在水中发生了反应;
若溶液X是品红溶液,则不会有白色沉淀生成。
酸雨是当今世界面临的一个重大的环境问题,SO2和NO2都能溶于水形成酸雨而破坏环境。请回答下列问题:
(1)酸雨通常是指降水的pH< ,则收集该酸雨,露置于空气中,一段时间后发现pH变小了,试用化学方程式解释: 。
例3
5.6
2H2SO3 +O2===2H2SO4
正常的雨水因为含有碳酸而显酸性,pH约为5.6;
酸雨是指pH<5.6的降水;收集该酸雨并露置于空气中,一段时间后,亚硫酸被空气中的氧气氧化生成了硫酸,硫酸为强酸,溶液的酸性增强,pH减小,反应的化学方程式为2H2SO3 +O2===2H2SO4。
(2)为减少酸雨的产生,有下列措施:①少用煤作燃料;②把工厂的烟囱建高;③在酸化的土壤中加水;④燃料脱硫;⑤开发新能源。其中有效的措施是 (填字母)。
A.①②③ B.①④⑤
C.①③④ D.②③④
B
少用煤作燃料,能减少二氧化硫的排放量,进而减少酸雨的产生,故①选;把工厂的烟囱建高,不能减少二氧化硫的排放量,故②不选;
在酸化的土壤中加水,不能消除二氧化硫,故③不选;
燃料脱硫,能减少二氧化硫的排放量,进而减少酸雨的产生,故④选;
开发新能源,能减少二氧化硫的排放量,进而减少酸雨的产生,故⑤选。
酸阅读下列材料,回答下列问题。
材料一 我国部分城市空气质量周报。
例4
城市 污染指数 首要污染物 空气质量等级
北京 92 TSP Ⅱ
贵阳 69 TSP Ⅱ
(总悬浮物为TSP)
材料二 近年来,随着工业化和城市化进程的加快,北京每年有2 000万
吨煤的燃烧,200万辆机动车的排气,5 000多处建筑工地的扬尘,大大加剧了北京的污染。贵阳曾经被联合国有关组织列为世界十大酸雨污染城市之一,是贵州省酸雨污染的中心,也是酸雨污染最严重的城市。20世纪90年代,贵阳市空气中的二氧化硫的含量超过国家2级标准两倍多,酸雨出现的频率占全年降水的21%。
(1)北京和贵阳的首要污染物分别是 (填字母,下同)。
A.可吸入颗粒物、可吸入颗粒物
B.可吸入颗粒物、二氧化硫
C.二氧化硫、可吸入颗粒物
D.二氧化硫、二氧化硫
A
(2)北京与贵阳主要大气污染物的不同主要体现在 。
A.北京大气污染物中的汽车尾气含量小于贵阳
B.北京大气污染物中的二氧化硫含量大于贵阳
C.贵阳大气污染物中可吸入颗粒物含量最低
D.贵阳大气污染物中二氧化硫的含量大于北京
D
(3)北京与贵阳相比,酸雨危害较重的是 。
A.都一样 B.北京
C.贵阳 D.无法比较
C
(4)贵阳的酸雨除居民生活、工业生产大量使用高硫煤外,可能还与下列哪些因素有关 。
①贵阳地处山间盆地,风小,湿度大,不利于污染物的扩散 ②贵阳大风天气多,比较干燥 ③南方多为酸性土壤,加剧了酸雨危害
④南方降水量大,大气中含有碱性尘沙
A.①② B.①③ C.②④ D.①②③④
B
北京和贵阳的首要污染物均为可吸入颗粒物,北京大气中的SO2含量低于贵阳,因而酸雨危害较重的为贵阳,贵阳酸雨不仅与酸性气体的排放量有关系,还与贵阳的地形以及酸性土壤有关系。
返回
本课结束
专题4
