2022-2023学年苏教版2019高中化学必修1 专题4 硫与环境保护 第二单元 第2课时 氧化还原反应方程式的配平 课件(55张PPT)
文档属性
| 名称 | 2022-2023学年苏教版2019高中化学必修1 专题4 硫与环境保护 第二单元 第2课时 氧化还原反应方程式的配平 课件(55张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.5MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-07-16 09:41:37 | ||
图片预览











文档简介
(共55张PPT)
第2课时
DIERKESHI
氧化还原反应方程式的配平 / 新情景下氧化还原反应方程式的书写 / 随堂演练 知识落实 / 课时对点练
氧化还原反应方程式的配平
专题4
核心素养
发展目标
掌握氧化还原反应方程式的配平。
内容索引
一、氧化还原反应方程式的配平
二、新情景下氧化还原反应方程式的书写
随堂演练 知识落实
课时对点练
氧化还原反应方程式的配平
一
1.配平原则
(1)电子守恒:氧化剂和还原剂得失电子总数相等,化合价升高总数=化合价降低总数。
(2)原子守恒:反应前后原子的种类和个数不变。
(3)电荷守恒:离子反应前后,阴、阳离子所带电荷总数相等。
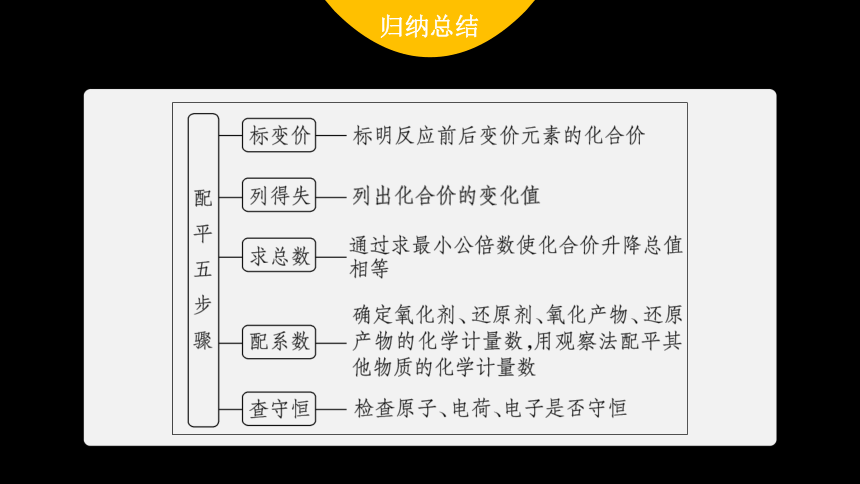
2.配平步骤(以浓硫酸与碳反应生成二氧化碳、二氧化硫和水为例)
(1)写出反应物、生成物的化学式,并在化学方程式中标出化合价发生变化的元素的化合价。
(2)根据化合价的变化标出电子转移的方向和数目。
(3)使得失电子的总数相等。
(4)根据质量守恒定律配平其他物质的化学计量数,并添加气体符号,注明反应条件,将单线改为双线。
(5)查个数,遵守恒:利用守恒三原则,检查是否配平。
应用体验
1.完成下列化学方程式的书写并配平。
(1)二氧化硫和硫化氢(H2S)气体混合,反应生成硫和水:_____________
。
(2)二氧化硫和氯气同时通入少量水中,反应生成硫酸和盐酸:_______
。
SO2+2H2S===
3S↓+2H2O
SO2+
Cl2+2H2O===H2SO4+2HCl
归纳总结
2.配平以下氧化还原反应方程式。
(1)正向配平
①___KI+___KIO3+___H2SO4===___I2+___K2SO4+___H2O
②___ +___H++___Cl-===___Mn2++___Cl2↑+___H2O
(2)逆向配平
①___S+___KOH===___K2S+___K2SO3+___H2O
②___P4+___KOH+___H2O===___K3PO4+___PH3↑
(3)缺项配平
___ClO-+___Fe(OH)3+_______===___Cl-+___ +___H2O
5 1 3 3 3 3
2 16 10 2 5 8
3 6 2 1 3
2 9 3 3 5
3 2 4OH- 3 2 5
归纳总结
氧化还原反应配平技巧
(1)根据得失电子守恒,配平氧化剂和还原剂(或还原产物和氧化产物)。
(2)根据原子守恒,配平变价元素原子。
(3)根据电荷守恒和溶液的环境,常用H+或OH-平衡电荷。
(4)根据原子守恒,配平未变价元素原子。
返回
新情景下氧化还原反应方程式的书写
二
由新情景信息,据反应体系中的物质书写反应方程式。
解题步骤 解题注意事项
第一步:分析物质的氧化性及还原性 根据化合价把元素化合价高的微粒及元素化合价低的微粒分成两类,并比较氧化性微粒的氧化性强弱及还原性微粒的还原性强弱
第二步:书写反应的主体反应物及生成物 依据“两强生两弱原理”,把氧化性强的微粒与还原性强的微粒作为反应物,把氧化性弱的微粒与还原性弱的微粒作为生成物
第三步:配平反应主体物质的化学计量数 根据得失电子守恒配平主体物质的化学计量数
第四步:配平其他物质的化学计量数 根据原子守恒、电荷守恒配平其他物质的化学计量数
应用体验
1.NO被H2O2氧化为 的离子方程式是_________________________
_________。
+2H2O
2.在H2SO4的酸性环境中ClO2与碘化钾反应的离子方程式为_________
_____________________________。
10I-+8H+===2Cl-+5I2+4H2O
2ClO2+
3.常温下,将NO和H2的混合气体通入Ce(SO4)2与Ce2(SO4)3的混合溶液中,其物质转化过程如图所示:
(1)反应Ⅰ中氧化剂与还原剂的物质的量之比为____。
2∶1
根据图示,反应Ⅰ为Ce4++H2―→Ce3++H+,反应中Ce元素的化合价由+4价降至+3价,Ce4+为氧化剂,H元素的化合价由0价升至+1价,H2为还原剂,根据得失电子守恒,n(Ce4+)=2n(H2),n(Ce4+)∶n(H2)=2∶1,即反应Ⅰ中氧化剂与还原剂的物质的量之比为2∶1。
(2)写出该过程的总化学方程式:________________
_________。
根据图示,反应Ⅰ为2Ce4++H2===2Ce3++2H+,
反应Ⅱ为4Ce3++2NO+4H+===4Ce4++N2+2H2O,
将反应Ⅰ×2+反应Ⅱ消去Ce4+、Ce3+,总反应为2H2+2NO
2H2O+N2。
N2+2H2O
返回
随堂演练 知识落实
1.下列各组微粒中,各物质均既有氧化性又有还原性的一组是
A.I2、Br-、H+ B.S、Na+、K
C.I2、NO2、H2O D.I-、Fe3+、HCl
1
2
3
√
4
1
2
3
4
根据氧化还原反应的规律,元素处于最高价时,只有氧化性;元素处于最低价时,只有还原性;元素处于中间价态时,既有氧化性,又有还原性。A中只有I2中I元素处于中间价态;
B中Na元素处于最高价,K元素处于最低价;
D中I元素处于最低价,A、B、D均不符合要求;
C中I、N元素均处于中间价态,H2O既有氧化性,又有还原性。
2.下列氧化还原反应方程式正确的是
A.Fe2++Cl2===Fe3++2Cl-
B.Fe3++Fe===2Fe2+
C.
D.2KMnO4+5H2O2+3H2SO4===K2SO4+2MnSO4+5O2↑+8H2O
1
2
3
4
A、B中电荷不守恒,错误;
C中不同价态的氯元素只能价态相互靠拢,不能交叉,错误。
√
3.已知在碱性溶液中可发生反应:2R(OH)3+3ClO-+4OH-===2 +3Cl-+5H2O,则 中R的化合价是
A.+3 B.+4 C.+5 D.+6
1
2
3
√
4
根据反应前后电荷守恒,可得n=2 ,
4.配平下列化学方程式。
1
2
3
4
返回
3 2 3 2 4
3 8 3 2 4
课时对点练
题组一 氧化还原反应方程式的配平
1.已知aM2++bO2+4H+===cM3++dH2O,则化学计量数c的值为
A.1 B.2 C.3 D.4
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
根据原子守恒可得a=c;
根据电荷守恒可得2a+4=3c,解得c=4。
2.高锰酸钾溶液在酸性条件下可以与硫酸亚铁反应,离子方程式如下(未配平):
+_____Fe2++_____H+===_____Mn2++____Fe3++_____H2O
下列说法正确的是
A. 是氧化剂,Fe3+是还原产物
B.Mn2+的还原性强于Fe2+
C.离子方程式中按物质顺序的化学计量数是1、5、8、1、5、4
D.生成1 mol 水时,转移2.5 mol电子
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
A项,在该反应中, 中Mn元素的化合价为+7,反应后变为+2,化合价降低,得到电子,被还原,作氧化剂;Fe2+反应后变为Fe3+,化合价升高,失去电子,被氧化,作还原剂,Fe3+是氧化产物,错误;
B项,根据在氧化还原反应中还原剂的还原性强于还原产物的还原性,可知Fe2+的还原性强于Mn2+,错误;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
C项,在氧化还原反应中电子得失数目相等,同时还符合电荷守恒及原子守恒,则相应的离子方程式是 +5Fe2++8H+===Mn2++5Fe3++4H2O,正确;
D项,根据C选项的离子方程式可知,每生成4 mol的水,转移电子的物质的量是5 mol,则生成1 mol水时,转移1.25 mol电子,错误。
3.已知在碱性溶液中可发生如下反应:2M(OH)3+10OH-+3Cl2===
2 +6Cl-+8H2O,则 中M的化合价是
A.+4 B.+5
C.+6 D.+7
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
4.某温度下,将氯气通入NaOH溶液中,反应得到NaCl、NaClO和NaClO3的混合溶液,经测定ClO-与 的个数比为1∶3,则氯气与氢氧化钠反应时,被还原的氯原子和被氧化的氯原子的个数比为
A.21∶5 B.11∶3 C.3∶1 D.4∶1
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
由Cl到Cl-得到1个电子,则16个Cl被还原得到16个电子,所以被还原的氯原子与被氧化的氯原子的个数比为16∶(1+3)=4∶1。
题组二 新情景下氧化还原反应方程式的配平
5.把图乙中的物质补充到图甲中,可得到一个完整的氧化还原反应型离子方程式(未配平)
下列关于该氧化还原反应型离子方程式
的说法不正确的是
A. 作氧化剂
B.氧化剂和还原剂的物质的量之比为5∶2
C.若有2 mol Mn2+参加反应时则转移10 mol电子
D.配平后Mn2+、H+的化学计量数分别为2、3
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
根据氧化还原反应规律知该反应的离子
方程式为2Mn2++
+6H+。
若有1 mol Mn2+参加反应时则转移1 mol×(7-2)=5 mol电子,
故有2 mol Mn2+参加反应时转移10 mol电子,故C正确;
配平后Mn2+、H+的化学计量数分别为2、6,故D错误。
6.做实验时不小心使皮肤上沾了一些高锰酸钾,形成的黑斑很久才能消除,如果用草酸(H2C2O4乙二酸)的稀溶液洗涤,黑斑可以迅速褪去,其离子方程式为 ,下列有关叙述不正确的是
A.该反应的氧化剂为KMnO4
B.发生还原反应的是
C.该离子方程式右侧方框内的产物是H2O
D.16 mol H+参加反应时,转移电子10 mol
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
题组三 氧化剂、还原剂及性质判断
7.下列变化需要加入还原剂才能实现的是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
B项,Cl-→Cl2,氯元素化合价由-1升高到0,要加氧化剂才能实现;
D项,NH3→NO,氮元素由-3价升高到+2价,要加氧化剂才能实现。
8.下列物质只能作还原剂的是
A.Fe B.HCl
C.H2O D.KMnO4
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
元素处于最高价态时只有氧化性,元素处于最低价态时只有还原性,元素处于中间价态时既有氧化性又有还原性。Fe的化合价是最低价态,只能作还原剂,A正确。
9.已知常温下在溶液中可发生如下两个离子反应:
Ce4++Fe2+===Fe3++Ce3+
Sn2++2Fe3+===2Fe2++Sn4+
由此可以确定Fe2+、Ce3+、Sn2+三种离子的还原性由强到弱的顺序是
A.Sn2+、Fe2+、Ce3+ B.Sn2+、Ce3+、Fe2+
C.Ce3+、Fe2+、Sn2+ D.Fe2+、Sn2+、Ce3+
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
在氧化还原反应中还原剂的还原性比还原产物的还原性强。由离子方程式可知,还原性:Fe2+ >Ce3+;Sn2+>Fe2+。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
10.O3具有强氧化性,将O3通入KI溶液中发生反应:O3+I-+H+―→I2+O2+H2O(未配平),下列说法正确的是
A.配平后的离子方程式为2O3+2I-+4H+===I2+2O2+H2O
B.每生成1 mol I2转移2 mol电子
C.O2是还原产物之一
D.该反应能说明O2的氧化性强于I2的
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
选项中离子方程式电荷不守恒,电子转移不守恒,配平后的离子方程式为O3+2I-+2H+===I2+O2+H2O,A错误;
反应中氧气和臭氧中氧元素的化合价相同,为0价,氧气不是还原产物,氧元素化合价由O3中0价降低为H2O中-2价,还原产物是H2O,C错误;
根据反应方程式进行的氧化性大小比较是指氧化剂与氧化产物之间的比较,在该反应中不能比较O2和I2的氧化性强弱,D错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
11.有时候,将氧化还原反应方程式拆开写成两个“半反应”。下面是一个“半反应”式:
____ +_____H++____e-===____Mn2++____H2O
该反应方程式配平的化学计量数是
A.1,8,4,1,4 B.2,16,5,2,8
C.1,6,5,1,3 D.1,8,5,1,4
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
反应中氮元素的化合价从+3升高到+5,失去2个电子,被氧化,作还原剂,A不正确;
根据电荷守恒可知,反应前消耗氢离子,B、D不正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
13.被称为万能还原剂的NaBH4(NaBH4中H为-1价)能溶于水并和水发生反应:NaBH4+2H2O===NaBO2+4H2↑,下列有关该反应的说法正确的是
A.NaBH4既是氧化剂又是还原剂
B.NaBH4是氧化剂,H2O是还原剂
C.硼元素被氧化,氢元素被还原
D.被氧化的元素与被还原的元素的质量之比为1∶1
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
NaBH4中氢元素的化合价升高,NaBH4是还原剂,水中氢元素的化合价降低,水是氧化剂,故A、B错误;
反应前后硼元素的化合价不变,故C错误;
氧化剂和还原剂中氢元素的化合价变化数值相同,被氧化的元素与被还原的元素的质量之比为1∶1,故D正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
14.某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。
(1)已知KBrO3在反应中得到电子,则该反应的还原剂是______。
AsH3
KBrO3在反应中得到电子,则另外一种化合价变化的元素在反应中失去电子被氧化,所给物质中砷元素化合价发生了变化,低价态的AsH3是还原剂。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
(2)已知2个KBrO3在反应中得到10个电子生成X,则X的化学式为___。
Br2
2个KBrO3在反应中得到10个电子,说明溴元素在反应中降低了5价,所以X的化学式为Br2。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
(3)根据上述反应可推知____(填字母)。
a.氧化性:KBrO3>H3AsO4
b.氧化性:H3AsO4>KBrO3
c.还原性:AsH3>X
d.还原性:X>AsH3
ac
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
(4)将氧化剂和还原剂的化学式及其配平后的化学计量数填入下列方框中,并标出电子转移的方向和数目:
利用氧化还原反应中得失电子守恒的规律可配平该化学方程式为
+4H2SO4===4K2SO4+4Br2+5H3AsO4+4H2O。
+
15.我国政府为了消除碘缺乏病,规定在食盐中必须加入适量的碘酸钾。检验食盐中是否加碘,可利用如下反应:
KIO3+____KI+____H2SO4===____K2SO4+____I2+____H2O
(1)配平该化学方程式,并且用双线桥法表示该化学方程式中电子转移
的方向与数目:_____________________________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
计算可知最小公倍数为5,然后配平其他元素,得到的化学方程式为KIO3+5KI+3H2SO4===3K2SO4+3I2+3H2O,
双线桥法可表示为 。
(2)该反应中氧化剂和还原剂的物质的量之比为_____。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
1∶5
KIO3中I元素的化合价降低,KIO3作氧化剂,KI中I元素的化合价升高,KI作还原剂,即氧化剂和还原剂的物质的量之比为1∶5。
(3)如果反应中转移0.5 mol电子,则生成I2的物质的量为________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
0.3 mol
根据(1)的分析,转移5 mol电子时,生成3 mol I2,因此转移0.5 mol电子时,生成I2的物质的量为0.3 mol。
返回
第2课时
DIERKESHI
氧化还原反应方程式的配平 / 新情景下氧化还原反应方程式的书写 / 随堂演练 知识落实 / 课时对点练
氧化还原反应方程式的配平
专题4
核心素养
发展目标
掌握氧化还原反应方程式的配平。
内容索引
一、氧化还原反应方程式的配平
二、新情景下氧化还原反应方程式的书写
随堂演练 知识落实
课时对点练
氧化还原反应方程式的配平
一
1.配平原则
(1)电子守恒:氧化剂和还原剂得失电子总数相等,化合价升高总数=化合价降低总数。
(2)原子守恒:反应前后原子的种类和个数不变。
(3)电荷守恒:离子反应前后,阴、阳离子所带电荷总数相等。
2.配平步骤(以浓硫酸与碳反应生成二氧化碳、二氧化硫和水为例)
(1)写出反应物、生成物的化学式,并在化学方程式中标出化合价发生变化的元素的化合价。
(2)根据化合价的变化标出电子转移的方向和数目。
(3)使得失电子的总数相等。
(4)根据质量守恒定律配平其他物质的化学计量数,并添加气体符号,注明反应条件,将单线改为双线。
(5)查个数,遵守恒:利用守恒三原则,检查是否配平。
应用体验
1.完成下列化学方程式的书写并配平。
(1)二氧化硫和硫化氢(H2S)气体混合,反应生成硫和水:_____________
。
(2)二氧化硫和氯气同时通入少量水中,反应生成硫酸和盐酸:_______
。
SO2+2H2S===
3S↓+2H2O
SO2+
Cl2+2H2O===H2SO4+2HCl
归纳总结
2.配平以下氧化还原反应方程式。
(1)正向配平
①___KI+___KIO3+___H2SO4===___I2+___K2SO4+___H2O
②___ +___H++___Cl-===___Mn2++___Cl2↑+___H2O
(2)逆向配平
①___S+___KOH===___K2S+___K2SO3+___H2O
②___P4+___KOH+___H2O===___K3PO4+___PH3↑
(3)缺项配平
___ClO-+___Fe(OH)3+_______===___Cl-+___ +___H2O
5 1 3 3 3 3
2 16 10 2 5 8
3 6 2 1 3
2 9 3 3 5
3 2 4OH- 3 2 5
归纳总结
氧化还原反应配平技巧
(1)根据得失电子守恒,配平氧化剂和还原剂(或还原产物和氧化产物)。
(2)根据原子守恒,配平变价元素原子。
(3)根据电荷守恒和溶液的环境,常用H+或OH-平衡电荷。
(4)根据原子守恒,配平未变价元素原子。
返回
新情景下氧化还原反应方程式的书写
二
由新情景信息,据反应体系中的物质书写反应方程式。
解题步骤 解题注意事项
第一步:分析物质的氧化性及还原性 根据化合价把元素化合价高的微粒及元素化合价低的微粒分成两类,并比较氧化性微粒的氧化性强弱及还原性微粒的还原性强弱
第二步:书写反应的主体反应物及生成物 依据“两强生两弱原理”,把氧化性强的微粒与还原性强的微粒作为反应物,把氧化性弱的微粒与还原性弱的微粒作为生成物
第三步:配平反应主体物质的化学计量数 根据得失电子守恒配平主体物质的化学计量数
第四步:配平其他物质的化学计量数 根据原子守恒、电荷守恒配平其他物质的化学计量数
应用体验
1.NO被H2O2氧化为 的离子方程式是_________________________
_________。
+2H2O
2.在H2SO4的酸性环境中ClO2与碘化钾反应的离子方程式为_________
_____________________________。
10I-+8H+===2Cl-+5I2+4H2O
2ClO2+
3.常温下,将NO和H2的混合气体通入Ce(SO4)2与Ce2(SO4)3的混合溶液中,其物质转化过程如图所示:
(1)反应Ⅰ中氧化剂与还原剂的物质的量之比为____。
2∶1
根据图示,反应Ⅰ为Ce4++H2―→Ce3++H+,反应中Ce元素的化合价由+4价降至+3价,Ce4+为氧化剂,H元素的化合价由0价升至+1价,H2为还原剂,根据得失电子守恒,n(Ce4+)=2n(H2),n(Ce4+)∶n(H2)=2∶1,即反应Ⅰ中氧化剂与还原剂的物质的量之比为2∶1。
(2)写出该过程的总化学方程式:________________
_________。
根据图示,反应Ⅰ为2Ce4++H2===2Ce3++2H+,
反应Ⅱ为4Ce3++2NO+4H+===4Ce4++N2+2H2O,
将反应Ⅰ×2+反应Ⅱ消去Ce4+、Ce3+,总反应为2H2+2NO
2H2O+N2。
N2+2H2O
返回
随堂演练 知识落实
1.下列各组微粒中,各物质均既有氧化性又有还原性的一组是
A.I2、Br-、H+ B.S、Na+、K
C.I2、NO2、H2O D.I-、Fe3+、HCl
1
2
3
√
4
1
2
3
4
根据氧化还原反应的规律,元素处于最高价时,只有氧化性;元素处于最低价时,只有还原性;元素处于中间价态时,既有氧化性,又有还原性。A中只有I2中I元素处于中间价态;
B中Na元素处于最高价,K元素处于最低价;
D中I元素处于最低价,A、B、D均不符合要求;
C中I、N元素均处于中间价态,H2O既有氧化性,又有还原性。
2.下列氧化还原反应方程式正确的是
A.Fe2++Cl2===Fe3++2Cl-
B.Fe3++Fe===2Fe2+
C.
D.2KMnO4+5H2O2+3H2SO4===K2SO4+2MnSO4+5O2↑+8H2O
1
2
3
4
A、B中电荷不守恒,错误;
C中不同价态的氯元素只能价态相互靠拢,不能交叉,错误。
√
3.已知在碱性溶液中可发生反应:2R(OH)3+3ClO-+4OH-===2 +3Cl-+5H2O,则 中R的化合价是
A.+3 B.+4 C.+5 D.+6
1
2
3
√
4
根据反应前后电荷守恒,可得n=2 ,
4.配平下列化学方程式。
1
2
3
4
返回
3 2 3 2 4
3 8 3 2 4
课时对点练
题组一 氧化还原反应方程式的配平
1.已知aM2++bO2+4H+===cM3++dH2O,则化学计量数c的值为
A.1 B.2 C.3 D.4
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
根据原子守恒可得a=c;
根据电荷守恒可得2a+4=3c,解得c=4。
2.高锰酸钾溶液在酸性条件下可以与硫酸亚铁反应,离子方程式如下(未配平):
+_____Fe2++_____H+===_____Mn2++____Fe3++_____H2O
下列说法正确的是
A. 是氧化剂,Fe3+是还原产物
B.Mn2+的还原性强于Fe2+
C.离子方程式中按物质顺序的化学计量数是1、5、8、1、5、4
D.生成1 mol 水时,转移2.5 mol电子
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
A项,在该反应中, 中Mn元素的化合价为+7,反应后变为+2,化合价降低,得到电子,被还原,作氧化剂;Fe2+反应后变为Fe3+,化合价升高,失去电子,被氧化,作还原剂,Fe3+是氧化产物,错误;
B项,根据在氧化还原反应中还原剂的还原性强于还原产物的还原性,可知Fe2+的还原性强于Mn2+,错误;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
C项,在氧化还原反应中电子得失数目相等,同时还符合电荷守恒及原子守恒,则相应的离子方程式是 +5Fe2++8H+===Mn2++5Fe3++4H2O,正确;
D项,根据C选项的离子方程式可知,每生成4 mol的水,转移电子的物质的量是5 mol,则生成1 mol水时,转移1.25 mol电子,错误。
3.已知在碱性溶液中可发生如下反应:2M(OH)3+10OH-+3Cl2===
2 +6Cl-+8H2O,则 中M的化合价是
A.+4 B.+5
C.+6 D.+7
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
4.某温度下,将氯气通入NaOH溶液中,反应得到NaCl、NaClO和NaClO3的混合溶液,经测定ClO-与 的个数比为1∶3,则氯气与氢氧化钠反应时,被还原的氯原子和被氧化的氯原子的个数比为
A.21∶5 B.11∶3 C.3∶1 D.4∶1
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
由Cl到Cl-得到1个电子,则16个Cl被还原得到16个电子,所以被还原的氯原子与被氧化的氯原子的个数比为16∶(1+3)=4∶1。
题组二 新情景下氧化还原反应方程式的配平
5.把图乙中的物质补充到图甲中,可得到一个完整的氧化还原反应型离子方程式(未配平)
下列关于该氧化还原反应型离子方程式
的说法不正确的是
A. 作氧化剂
B.氧化剂和还原剂的物质的量之比为5∶2
C.若有2 mol Mn2+参加反应时则转移10 mol电子
D.配平后Mn2+、H+的化学计量数分别为2、3
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
根据氧化还原反应规律知该反应的离子
方程式为2Mn2++
+6H+。
若有1 mol Mn2+参加反应时则转移1 mol×(7-2)=5 mol电子,
故有2 mol Mn2+参加反应时转移10 mol电子,故C正确;
配平后Mn2+、H+的化学计量数分别为2、6,故D错误。
6.做实验时不小心使皮肤上沾了一些高锰酸钾,形成的黑斑很久才能消除,如果用草酸(H2C2O4乙二酸)的稀溶液洗涤,黑斑可以迅速褪去,其离子方程式为 ,下列有关叙述不正确的是
A.该反应的氧化剂为KMnO4
B.发生还原反应的是
C.该离子方程式右侧方框内的产物是H2O
D.16 mol H+参加反应时,转移电子10 mol
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
题组三 氧化剂、还原剂及性质判断
7.下列变化需要加入还原剂才能实现的是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
B项,Cl-→Cl2,氯元素化合价由-1升高到0,要加氧化剂才能实现;
D项,NH3→NO,氮元素由-3价升高到+2价,要加氧化剂才能实现。
8.下列物质只能作还原剂的是
A.Fe B.HCl
C.H2O D.KMnO4
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
元素处于最高价态时只有氧化性,元素处于最低价态时只有还原性,元素处于中间价态时既有氧化性又有还原性。Fe的化合价是最低价态,只能作还原剂,A正确。
9.已知常温下在溶液中可发生如下两个离子反应:
Ce4++Fe2+===Fe3++Ce3+
Sn2++2Fe3+===2Fe2++Sn4+
由此可以确定Fe2+、Ce3+、Sn2+三种离子的还原性由强到弱的顺序是
A.Sn2+、Fe2+、Ce3+ B.Sn2+、Ce3+、Fe2+
C.Ce3+、Fe2+、Sn2+ D.Fe2+、Sn2+、Ce3+
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
在氧化还原反应中还原剂的还原性比还原产物的还原性强。由离子方程式可知,还原性:Fe2+ >Ce3+;Sn2+>Fe2+。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
10.O3具有强氧化性,将O3通入KI溶液中发生反应:O3+I-+H+―→I2+O2+H2O(未配平),下列说法正确的是
A.配平后的离子方程式为2O3+2I-+4H+===I2+2O2+H2O
B.每生成1 mol I2转移2 mol电子
C.O2是还原产物之一
D.该反应能说明O2的氧化性强于I2的
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
选项中离子方程式电荷不守恒,电子转移不守恒,配平后的离子方程式为O3+2I-+2H+===I2+O2+H2O,A错误;
反应中氧气和臭氧中氧元素的化合价相同,为0价,氧气不是还原产物,氧元素化合价由O3中0价降低为H2O中-2价,还原产物是H2O,C错误;
根据反应方程式进行的氧化性大小比较是指氧化剂与氧化产物之间的比较,在该反应中不能比较O2和I2的氧化性强弱,D错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
11.有时候,将氧化还原反应方程式拆开写成两个“半反应”。下面是一个“半反应”式:
____ +_____H++____e-===____Mn2++____H2O
该反应方程式配平的化学计量数是
A.1,8,4,1,4 B.2,16,5,2,8
C.1,6,5,1,3 D.1,8,5,1,4
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
反应中氮元素的化合价从+3升高到+5,失去2个电子,被氧化,作还原剂,A不正确;
根据电荷守恒可知,反应前消耗氢离子,B、D不正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
13.被称为万能还原剂的NaBH4(NaBH4中H为-1价)能溶于水并和水发生反应:NaBH4+2H2O===NaBO2+4H2↑,下列有关该反应的说法正确的是
A.NaBH4既是氧化剂又是还原剂
B.NaBH4是氧化剂,H2O是还原剂
C.硼元素被氧化,氢元素被还原
D.被氧化的元素与被还原的元素的质量之比为1∶1
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
NaBH4中氢元素的化合价升高,NaBH4是还原剂,水中氢元素的化合价降低,水是氧化剂,故A、B错误;
反应前后硼元素的化合价不变,故C错误;
氧化剂和还原剂中氢元素的化合价变化数值相同,被氧化的元素与被还原的元素的质量之比为1∶1,故D正确。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
14.某反应中反应物与生成物有:AsH3、H2SO4、KBrO3、K2SO4、H3AsO4、H2O和一种未知物质X。
(1)已知KBrO3在反应中得到电子,则该反应的还原剂是______。
AsH3
KBrO3在反应中得到电子,则另外一种化合价变化的元素在反应中失去电子被氧化,所给物质中砷元素化合价发生了变化,低价态的AsH3是还原剂。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
(2)已知2个KBrO3在反应中得到10个电子生成X,则X的化学式为___。
Br2
2个KBrO3在反应中得到10个电子,说明溴元素在反应中降低了5价,所以X的化学式为Br2。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
(3)根据上述反应可推知____(填字母)。
a.氧化性:KBrO3>H3AsO4
b.氧化性:H3AsO4>KBrO3
c.还原性:AsH3>X
d.还原性:X>AsH3
ac
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
(4)将氧化剂和还原剂的化学式及其配平后的化学计量数填入下列方框中,并标出电子转移的方向和数目:
利用氧化还原反应中得失电子守恒的规律可配平该化学方程式为
+4H2SO4===4K2SO4+4Br2+5H3AsO4+4H2O。
+
15.我国政府为了消除碘缺乏病,规定在食盐中必须加入适量的碘酸钾。检验食盐中是否加碘,可利用如下反应:
KIO3+____KI+____H2SO4===____K2SO4+____I2+____H2O
(1)配平该化学方程式,并且用双线桥法表示该化学方程式中电子转移
的方向与数目:_____________________________________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
计算可知最小公倍数为5,然后配平其他元素,得到的化学方程式为KIO3+5KI+3H2SO4===3K2SO4+3I2+3H2O,
双线桥法可表示为 。
(2)该反应中氧化剂和还原剂的物质的量之比为_____。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
1∶5
KIO3中I元素的化合价降低,KIO3作氧化剂,KI中I元素的化合价升高,KI作还原剂,即氧化剂和还原剂的物质的量之比为1∶5。
(3)如果反应中转移0.5 mol电子,则生成I2的物质的量为________。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
0.3 mol
根据(1)的分析,转移5 mol电子时,生成3 mol I2,因此转移0.5 mol电子时,生成I2的物质的量为0.3 mol。
返回
