2022秋沪教版(全国)九年级上册第3章:物质构成的奥秘习题选(word版有答案)
文档属性
| 名称 | 2022秋沪教版(全国)九年级上册第3章:物质构成的奥秘习题选(word版有答案) |
|
|
| 格式 | zip | ||
| 文件大小 | 299.0KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 沪教版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-07-16 00:00:00 | ||
图片预览




文档简介
2022秋沪教版(全国)九年级上册第3章:物质构成的奥秘习题选含答案
沪教版(全国)九上第3章 物质构成的奥秘
一、选择题。
1、化学是在分子原子的层次上研究物质的性质、组成、结构与变化规律的科学,下列关于分子和原子的说法中错误的是( )
A. 物质是由微观粒子构成的。水、苯由分子构成,汞、硅由原子构成
B. 对于由分子构成的物质,分子是保持其化学性质的最小粒子
C. 原子是化学变化中的最小粒子
D. 由同种分子构成的物质是纯净物,所以纯净物一定由同种分子构成
2、下面这些物质属于纯净物的是( )
A. 矿泉水 B. 白酒 C. 洁净的空气 D. 冰水混合物
3、在H2、H2O、H2SO4三种物质中,都含有( )
A.两个氢原子 B.一个氢分子
C.氢元素 D.两个氢元素
4、科学研究发现:氮气不活泼,在3000℃时仅有0.1%的分子分裂。在0℃常压下,向密闭容器M中充入一定量的氮气,而后升高温度(不超过3000℃,压强不变),若该密闭容器的体积增大了一倍,则M内分子变化的示意图合理的是( )
A. B. C. D.
5、化学使世界变得绚丽多彩,科学家为此作出了巨大的贡献。编制元素周期表的科学家是 ( )
A. 门捷列夫 B. 阿伏伽德罗 C. 拉瓦锡 D. 道尔顿
6、元素是化学的重要概念之一,下列有关元素的说法错误的是( )
A. 元素是具有相同核电荷数的一类粒子的总称
B. 物质都是由元素组成的
C. 同种元素的原子核内质子数与中子数不一定相等
D. 在物质发生化学变化时,原子的种类不变,元素的种类也不会改变
7、化学使人类生活更加丰富多彩,如打火机就给人们生活带来了方便,下列有关打火机的主要燃料丁烷(C4H10)的说法不正确的是( )
A.从性质上看:丁烷具有可燃性
B.从变化上看:丁烷完全燃烧只生成水
C.从组成上看:丁烷由碳、氢两种元素组成
D.从结构上看:一个丁烷分子由4个碳原子、10个氢原子构
8、元素周期表是学习和研究化学的重要工具,如图是元素周期表的一部分,其中X、Y、Z代表三种不同的元素。下列说法中正确的是( )
A.原子序数:X>Y B.核外电子数:X=Z
C.Y和Z处于同一周期 D.X和Z的电子层数相同
9、考古学家常利用古生物遗骸中某元素的含量来推断该生物死亡的年代。其中测定碳-14的含量是常用的手段之一。已知碳-14的相对原子质量为14,原子核内质子数为6。则下列关于碳-14的说法正确的是( )
A. 中子数为6 B. 核电荷数为6
C. 电子数为8 D. 质子数和中子数的差为8
10、下列物质一定属于纯净物的是( )
A. 液态空气 B. 稀有气体 C. 自来水 D. 液态氧
11、下列说法不正确的是( )
A.一种元素在不同的化合物中可能表现出不同的化合价
B.单质中元素的化合价为0
C.金属元素在化合物中通常显正价,非金属元素在化合物中总显负价
D.在所有化合物中,正负化合价的代数和为0
12、下列说法中正确的是( )
A.原子核内的质子数与其核电荷数相等
B.原子核中的质子数与中子数一定相等
C.原子核一定由质子和中子构成
D.元素的化学性质取决于原子核内的质子数
13、已知钚原子的原子核内部有130个中子,其原子的相对原子质量为224,则该原子中核外电子数是多少( )
A. 94 B. 130 C. 224 D. 64
14、下列叙述中的“一定”肯定成立的个数有( )
(1)有发光、放热现象发生的变化一定是化学变化;
(2)食盐溶解在水中得到食盐水一定是化合反应;
(3)带火星的木条一定能在含有氧气的集气瓶中复燃;
(4)化学反应前后,催化剂的质量和性质一定都不变;
(5)同种原子构成的物质一定是纯净物
A. 3个 B. 2个 C. 1个 D. 0个
15、下列化学用语与含义相符的是( )
A.:1个镁离子带2个单位正电荷
B.Mn2+:锰元素的化合价为+2价
C.2N:1个氮分子由2个氮原子构成
D.2HgO:2个氧化汞分子
二、填空题。
16、氯是一种重要的“成盐元素”,在海水、盐湖和盐矿中广泛存在。
(1)如图是氯原子结构示意图,氯原子的最外层电子数是________;氯元素在元素周期表中位于第________周期。
(2)含氯元素的物质大多具有消毒杀菌功能。如:a.醋酸氯己定[C22H34Cl2N10O2] b.氯化钠 c.二氧化氯[ClO2] d.次氯酸钠[NaClO]等。
①醋酸氯己定属于________(填“有机”或“无机”)化合物;1个醋酸氯己定分子由________个原子构成。
②b、d物质溶于水都能解离出钠离子,但阴离子不同。写出d中阴离子符号________。
17、形态各异的物质可按一定规律分类.现有A.洁净的空气 B.蒸馏水 C.海水 D.高锰酸钾 E.二氧化碳 F.氧气,请选用各物质名称前的字母序号填写在横线上:
(1)属于混合物的是________;
(2)属于单质的是________;
(3)属于化合物的是________;
(4)属于氧化物的是________.
18、人类文明进步与金属材料的发展关系十分密切,金属在生活生产中有着非常广泛的应用。请回答下列问题:
(1)下图是常用的电源插头,在标示的部件中,属于金属材料的是( )___________________。
(2)铜能制成插头和导线,是利用了金属铜的________性和________性。
(3)微型化录音录像的高性能带中磁粉的主要材料之一是化学组成相当于CoFe2O4的化合物,又知钴(Co)和铁都有+2、+3价,且在上述化合物中每种元素只具有一种化合价,则铁元素的化合价为__________。
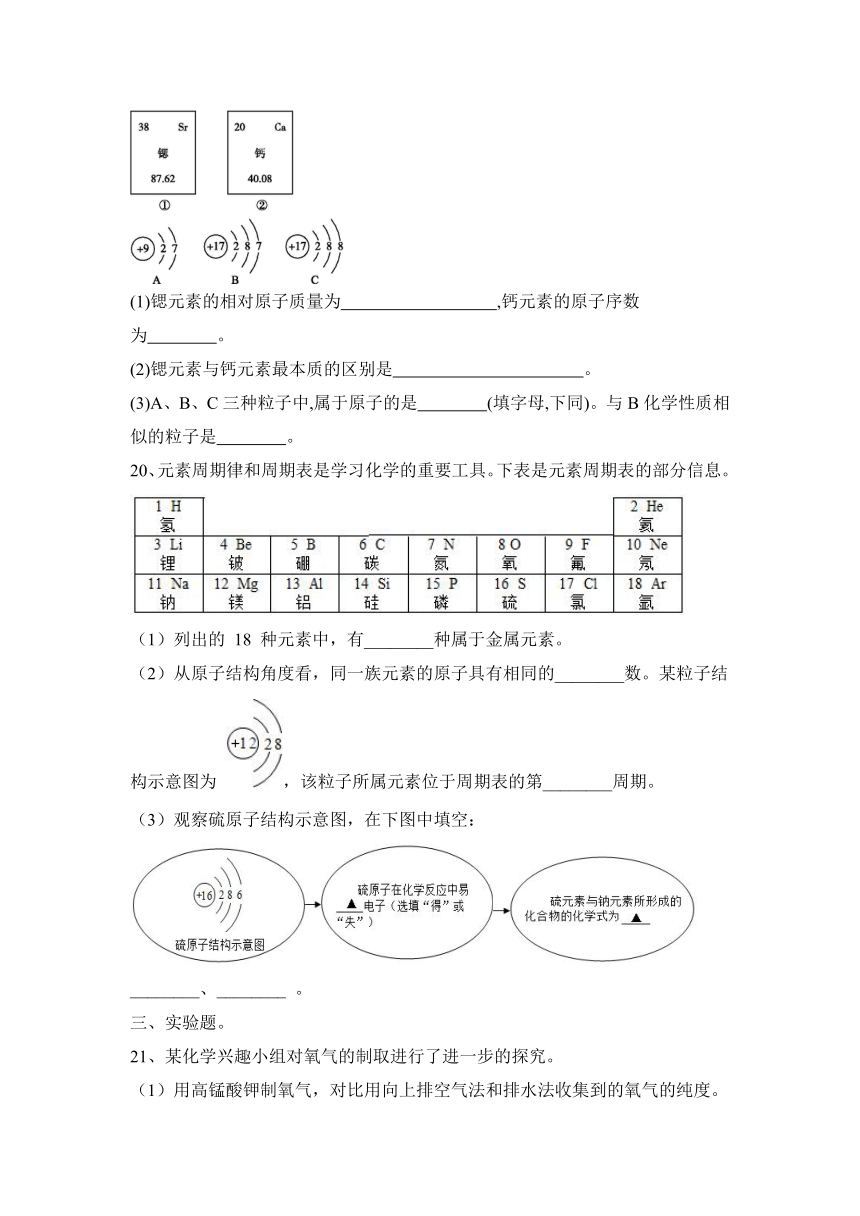
19、图中①、②分别是锶元素、钙元素在元素周期表中的部分信息,A、B、C是三种粒子的结构示意图。请回答下列
问题。
(1)锶元素的相对原子质量为 ,钙元素的原子序数为 。
(2)锶元素与钙元素最本质的区别是 。
(3)A、B、C三种粒子中,属于原子的是 (填字母,下同)。与B化学性质相似的粒子是 。
20、元素周期律和周期表是学习化学的重要工具。下表是元素周期表的部分信息。
(1)列出的 18 种元素中,有________种属于金属元素。
(2)从原子结构角度看,同一族元素的原子具有相同的________数。某粒子结构示意图为 ,该粒子所属元素位于周期表的第________周期。
(3)观察硫原子结构示意图,在下图中填空:
________、________ 。
三、实验题。
21、某化学兴趣小组对氧气的制取进行了进一步的探究。
(1)用高锰酸钾制氧气,对比用向上排空气法和排水法收集到的氧气的纯度。
(进行实验)
①用向上排空气法收集氧气:将带火星的木条放在集气瓶口,当______________________时证明氧气集满,用传感器测定集气瓶中氧气的体积分数。重复该实验 3 次并记录数据。
②用排水法收集氧气,氧气能用排水法收集的原因是______,用传感器测定集气瓶中氧气的体积分 数。重复该实验 3 次并记录数据。
氧气的收集方法 向上排空气法 排水法
氧气的体积分数/% 79.7 79.6 79.9 90.0 89.8 89.3
氧气的平均体积分数/% 79.7 89.7
(实验分析)不考虑操作失误的因素,用排水法也收集不到纯净的氧气,其主要原因是______。
(2)写出实验室用过氧化氢溶液制取氧气的符号表达式______ 。
(3)某同学将如图 1 装置的长颈漏斗换成分液漏斗,这样做的优点是_____。
(4)实验室里制取气体的一般思路和方法:
①选择适当的反应,包括_____ ;
②选择合适的_____ ;
③_____ 。
(5)某化学兴趣小组借助氧气传感器探究微粒的运动,数据处理软件可以实时绘出氧气体积分数随时间变化的曲线。收集一塑料瓶
氧气进行以下三步实验:①敞口放置;② 双手贴在塑料瓶外壁上;③将塑料瓶的瓶口朝下,三步实验中测得氧气的体积分数随时间变化的曲线依次为图 2 中的 MN 段、NP 段和PQ 段。
①能够说明氧气分子不断运动的曲线是______
A MN 段 B NP 段 C PQ 段
②MN 段和 NP 段相比较,说明_____ 。
③随着实验的进行,传感器测出氧气的体积分数约为_____时几乎不再变化。
四、计算类综合题。
22、我国从1994年开始强制食盐加碘,即在食盐中加入碘酸钾(KIO3),以防治碘缺乏病的发生,2010年适当下调现行食盐加碘量,各地需根据本地区实际情况相应调整。深圳率先作出调整,由原来每千克食盐含碘40 mg下调至25 mg。
碘 盐
配料:氯化钠、碘酸钾(KIO3)
含碘量:(20~30)mg/kg
保质期:18个月
食用方法:勿长时间炖炒
贮藏指南:避光、避热、密封防潮
(1)碘酸钾中碘元素、钾元素、氧元素的质量比为 。
(2)碘酸钾中碘元素的质量分数为 (保留至0.1%或用分数表示)。
(3)请为某企业计算:售往深圳的加碘食盐每袋(500 g)应比调整前少加碘酸钾多少毫克
2022秋沪教版(全国)九年级上册第3章:物质构成的奥秘习题选含答案
沪教版(全国)九上第3章 物质构成的奥秘
一、选择题。
1、化学是在分子原子的层次上研究物质的性质、组成、结构与变化规律的科学,下列关于分子和原子的说法中错误的是( )
A. 物质是由微观粒子构成的。水、苯由分子构成,汞、硅由原子构成
B. 对于由分子构成的物质,分子是保持其化学性质的最小粒子
C. 原子是化学变化中的最小粒子
D. 由同种分子构成的物质是纯净物,所以纯净物一定由同种分子构成
【答案】D
2、下面这些物质属于纯净物的是( )
A. 矿泉水 B. 白酒 C. 洁净的空气 D. 冰水混合物
【答案】D
3、在H2、H2O、H2SO4三种物质中,都含有( )
A.两个氢原子 B.一个氢分子
C.氢元素 D.两个氢元素
【答案】C
4、科学研究发现:氮气不活泼,在3000℃时仅有0.1%的分子分裂。在0℃常压下,向密闭容器M中充入一定量的氮气,而后升高温度(不超过3000℃,压强不变),若该密闭容器的体积增大了一倍,则M内分子变化的示意图合理的是( )
A. B. C. D.
【答案】B
5、化学使世界变得绚丽多彩,科学家为此作出了巨大的贡献。编制元素周期表的科学家是 ( )
A. 门捷列夫 B. 阿伏伽德罗 C. 拉瓦锡 D. 道尔顿
【答案】A
6、元素是化学的重要概念之一,下列有关元素的说法错误的是( )
A. 元素是具有相同核电荷数的一类粒子的总称
B. 物质都是由元素组成的
C. 同种元素的原子核内质子数与中子数不一定相等
D. 在物质发生化学变化时,原子的种类不变,元素的种类也不会改变
【答案】A
7、化学使人类生活更加丰富多彩,如打火机就给人们生活带来了方便,下列有关打火机的主要燃料丁烷(C4H10)的说法不正确的是( )
A.从性质上看:丁烷具有可燃性
B.从变化上看:丁烷完全燃烧只生成水
C.从组成上看:丁烷由碳、氢两种元素组成
D.从结构上看:一个丁烷分子由4个碳原子、10个氢原子构
【答案】B
8、元素周期表是学习和研究化学的重要工具,如图是元素周期表的一部分,其中X、Y、Z代表三种不同的元素。下列说法中正确的是( )
A.原子序数:X>Y B.核外电子数:X=Z
C.Y和Z处于同一周期 D.X和Z的电子层数相同
【答案】C
9、考古学家常利用古生物遗骸中某元素的含量来推断该生物死亡的年代。其中测定碳-14的含量是常用的手段之一。已知碳-14的相对原子质量为14,原子核内质子数为6。则下列关于碳-14的说法正确的是( )
A. 中子数为6 B. 核电荷数为6
C. 电子数为8 D. 质子数和中子数的差为8
【答案】B
10、下列物质一定属于纯净物的是( )
A. 液态空气 B. 稀有气体 C. 自来水 D. 液态氧
【答案】D
11、下列说法不正确的是( )
A.一种元素在不同的化合物中可能表现出不同的化合价
B.单质中元素的化合价为0
C.金属元素在化合物中通常显正价,非金属元素在化合物中总显负价
D.在所有化合物中,正负化合价的代数和为0
【答案】C
12、下列说法中正确的是( )
A.原子核内的质子数与其核电荷数相等
B.原子核中的质子数与中子数一定相等
C.原子核一定由质子和中子构成
D.元素的化学性质取决于原子核内的质子数
【答案】A
13、已知钚原子的原子核内部有130个中子,其原子的相对原子质量为224,则该原子中核外电子数是多少( )
A. 94 B. 130 C. 224 D. 64
【答案】A
14、下列叙述中的“一定”肯定成立的个数有( )
(1)有发光、放热现象发生的变化一定是化学变化;
(2)食盐溶解在水中得到食盐水一定是化合反应;
(3)带火星的木条一定能在含有氧气的集气瓶中复燃;
(4)化学反应前后,催化剂的质量和性质一定都不变;
(5)同种原子构成的物质一定是纯净物
A. 3个 B. 2个 C. 1个 D. 0个
【答案】D
15、下列化学用语与含义相符的是( )
A.:1个镁离子带2个单位正电荷
B.Mn2+:锰元素的化合价为+2价
C.2N:1个氮分子由2个氮原子构成
D.2HgO:2个氧化汞分子
【答案】D
二、填空题。
16、氯是一种重要的“成盐元素”,在海水、盐湖和盐矿中广泛存在。
(1)如图是氯原子结构示意图,氯原子的最外层电子数是________;氯元素在元素周期表中位于第________周期。
(2)含氯元素的物质大多具有消毒杀菌功能。如:a.醋酸氯己定[C22H34Cl2N10O2] b.氯化钠 c.二氧化氯[ClO2] d.次氯酸钠[NaClO]等。
①醋酸氯己定属于________(填“有机”或“无机”)化合物;1个醋酸氯己定分子由________个原子构成。
②b、d物质溶于水都能解离出钠离子,但阴离子不同。写出d中阴离子符号________。
【答案】(1)7;三 (2)有机;70;ClO-
17、形态各异的物质可按一定规律分类.现有A.洁净的空气 B.蒸馏水 C.海水 D.高锰酸钾 E.二氧化碳 F.氧气,请选用各物质名称前的字母序号填写在横线上:
(1)属于混合物的是________;
(2)属于单质的是________;
(3)属于化合物的是________;
(4)属于氧化物的是________.
【答案】(1)AC (2)F (3)BDE (4)BE
18、人类文明进步与金属材料的发展关系十分密切,金属在生活生产中有着非常广泛的应用。请回答下列问题:
(1)下图是常用的电源插头,在标示的部件中,属于金属材料的是( )___________________。
(2)铜能制成插头和导线,是利用了金属铜的________性和________性。
(3)微型化录音录像的高性能带中磁粉的主要材料之一是化学组成相当于CoFe2O4的化合物,又知钴(Co)和铁都有+2、+3价,且在上述化合物中每种元素只具有一种化合价,则铁元素的化合价为__________。
【答案】(1)铜质插头、铜芯导线 (2)延展 导电 (3)+3价
19、图中①、②分别是锶元素、钙元素在元素周期表中的部分信息,A、B、C是三种粒子的结构示意图。请回答下列
问题。
(1)锶元素的相对原子质量为 ,钙元素的原子序数为 。
(2)锶元素与钙元素最本质的区别是 。
(3)A、B、C三种粒子中,属于原子的是 (填字母,下同)。与B化学性质相似的粒子是 。
【答案】(1)87.62 20 (2)质子数不同 (3)AB A
20、元素周期律和周期表是学习化学的重要工具。下表是元素周期表的部分信息。
(1)列出的 18 种元素中,有________种属于金属元素。
(2)从原子结构角度看,同一族元素的原子具有相同的________数。某粒子结构示意图为 ,该粒子所属元素位于周期表的第________周期。
(3)观察硫原子结构示意图,在下图中填空:
________、________ 。
【答案】 (1)5 (2)最外层电子;三 (3)得;Na2S
【解析】(1)列出的18种元素中,锂、铍、钠、镁、铝为金属元素,故填“5”’(2)元素周期表中,把最外层电子数相同的原子的元素排成一族,把电子层数相同的原子的元素排在同一周期,所以同一族元素的原子具有相同的最外层电子数;某粒子结构示意图为 ,由图可知,这是12号元素镁元素,由于电子数只有10个,故这是镁离子的结构示意图,镁元素排在元素周期表的第三周期,故填“三”。(3)根据原子结构示意图,硫原子最外层有6个电子,大于4,在化学反应中易得2个电子,形成带两个单位负电荷的硫离子,元素的化合价和原子得失电子的数目是相等的,因此硫元素在化合物中的化合价为-2价,钠元素在化合物中的化合价为+1价,因此硫化钠的化学式为Na2S。
三、实验题。
21、某化学兴趣小组对氧气的制取进行了进一步的探究。
(1)用高锰酸钾制氧气,对比用向上排空气法和排水法收集到的氧气的纯度。
(进行实验)
①用向上排空气法收集氧气:将带火星的木条放在集气瓶口,当______________________时证明氧气集满,用传感器测定集气瓶中氧气的体积分数。重复该实验 3 次并记录数据。
②用排水法收集氧气,氧气能用排水法收集的原因是______,用传感器测定集气瓶中氧气的体积分 数。重复该实验 3 次并记录数据。
氧气的收集方法 向上排空气法 排水法
氧气的体积分数/% 79.7 79.6 79.9 90.0 89.8 89.3
氧气的平均体积分数/% 79.7 89.7
(实验分析)不考虑操作失误的因素,用排水法也收集不到纯净的氧气,其主要原因是______。
(2)写出实验室用过氧化氢溶液制取氧气的符号表达式______ 。
(3)某同学将如图 1 装置的长颈漏斗换成分液漏斗,这样做的优点是_____。
(4)实验室里制取气体的一般思路和方法:
①选择适当的反应,包括_____ ;
②选择合适的_____ ;
③_____ 。
(5)某化学兴趣小组借助氧气传感器探究微粒的运动,数据处理软件可以实时绘出氧气体积分数随时间变化的曲线。收集一塑料瓶
氧气进行以下三步实验:①敞口放置;② 双手贴在塑料瓶外壁上;③将塑料瓶的瓶口朝下,三步实验中测得氧气的体积分数随时间变化的曲线依次为图 2 中的 MN 段、NP 段和PQ 段。
①能够说明氧气分子不断运动的曲线是______
A MN 段 B NP 段 C PQ 段
②MN 段和 NP 段相比较,说明_____ 。
③随着实验的进行,传感器测出氧气的体积分数约为_____时几乎不再变化。
【答案】(1)带火星的木条复燃 常温常压下,氧气不易溶于水且不与水反应 排水法收集的氧气中混有水蒸气
(2)H2O2 H2O+O2
(3)可以控制液体滴加速率,控制反应速率,获得平稳气流
(4)反应物和反应条件 实验装置 验证所制得的气体
(5)A; 相同条件下,温度越高,分子运动速率越大 21%
四、计算类综合题。
22、我国从1994年开始强制食盐加碘,即在食盐中加入碘酸钾(KIO3),以防治碘缺乏病的发生,2010年适当下调现行食盐加碘量,各地需根据本地区实际情况相应调整。深圳率先作出调整,由原来每千克食盐含碘40 mg下调至25 mg。
碘 盐
配料:氯化钠、碘酸钾(KIO3)
含碘量:(20~30)mg/kg
保质期:18个月
食用方法:勿长时间炖炒
贮藏指南:避光、避热、密封防潮
(1)碘酸钾中碘元素、钾元素、氧元素的质量比为 。
(2)碘酸钾中碘元素的质量分数为 (保留至0.1%或用分数表示)。
(3)请为某企业计算:售往深圳的加碘食盐每袋(500 g)应比调整前少加碘酸钾多少毫克
【答案】(1)127∶39∶48 (2)59.3%
(3)解:每500 g食盐中少加碘的质量为(40 mg-25 mg)÷2=7.5 mg,则每500 g食盐中少加碘酸钾的质量为7.5 mg÷59.3%≈12.6 mg。
沪教版(全国)九上第3章 物质构成的奥秘
一、选择题。
1、化学是在分子原子的层次上研究物质的性质、组成、结构与变化规律的科学,下列关于分子和原子的说法中错误的是( )
A. 物质是由微观粒子构成的。水、苯由分子构成,汞、硅由原子构成
B. 对于由分子构成的物质,分子是保持其化学性质的最小粒子
C. 原子是化学变化中的最小粒子
D. 由同种分子构成的物质是纯净物,所以纯净物一定由同种分子构成
2、下面这些物质属于纯净物的是( )
A. 矿泉水 B. 白酒 C. 洁净的空气 D. 冰水混合物
3、在H2、H2O、H2SO4三种物质中,都含有( )
A.两个氢原子 B.一个氢分子
C.氢元素 D.两个氢元素
4、科学研究发现:氮气不活泼,在3000℃时仅有0.1%的分子分裂。在0℃常压下,向密闭容器M中充入一定量的氮气,而后升高温度(不超过3000℃,压强不变),若该密闭容器的体积增大了一倍,则M内分子变化的示意图合理的是( )
A. B. C. D.
5、化学使世界变得绚丽多彩,科学家为此作出了巨大的贡献。编制元素周期表的科学家是 ( )
A. 门捷列夫 B. 阿伏伽德罗 C. 拉瓦锡 D. 道尔顿
6、元素是化学的重要概念之一,下列有关元素的说法错误的是( )
A. 元素是具有相同核电荷数的一类粒子的总称
B. 物质都是由元素组成的
C. 同种元素的原子核内质子数与中子数不一定相等
D. 在物质发生化学变化时,原子的种类不变,元素的种类也不会改变
7、化学使人类生活更加丰富多彩,如打火机就给人们生活带来了方便,下列有关打火机的主要燃料丁烷(C4H10)的说法不正确的是( )
A.从性质上看:丁烷具有可燃性
B.从变化上看:丁烷完全燃烧只生成水
C.从组成上看:丁烷由碳、氢两种元素组成
D.从结构上看:一个丁烷分子由4个碳原子、10个氢原子构
8、元素周期表是学习和研究化学的重要工具,如图是元素周期表的一部分,其中X、Y、Z代表三种不同的元素。下列说法中正确的是( )
A.原子序数:X>Y B.核外电子数:X=Z
C.Y和Z处于同一周期 D.X和Z的电子层数相同
9、考古学家常利用古生物遗骸中某元素的含量来推断该生物死亡的年代。其中测定碳-14的含量是常用的手段之一。已知碳-14的相对原子质量为14,原子核内质子数为6。则下列关于碳-14的说法正确的是( )
A. 中子数为6 B. 核电荷数为6
C. 电子数为8 D. 质子数和中子数的差为8
10、下列物质一定属于纯净物的是( )
A. 液态空气 B. 稀有气体 C. 自来水 D. 液态氧
11、下列说法不正确的是( )
A.一种元素在不同的化合物中可能表现出不同的化合价
B.单质中元素的化合价为0
C.金属元素在化合物中通常显正价,非金属元素在化合物中总显负价
D.在所有化合物中,正负化合价的代数和为0
12、下列说法中正确的是( )
A.原子核内的质子数与其核电荷数相等
B.原子核中的质子数与中子数一定相等
C.原子核一定由质子和中子构成
D.元素的化学性质取决于原子核内的质子数
13、已知钚原子的原子核内部有130个中子,其原子的相对原子质量为224,则该原子中核外电子数是多少( )
A. 94 B. 130 C. 224 D. 64
14、下列叙述中的“一定”肯定成立的个数有( )
(1)有发光、放热现象发生的变化一定是化学变化;
(2)食盐溶解在水中得到食盐水一定是化合反应;
(3)带火星的木条一定能在含有氧气的集气瓶中复燃;
(4)化学反应前后,催化剂的质量和性质一定都不变;
(5)同种原子构成的物质一定是纯净物
A. 3个 B. 2个 C. 1个 D. 0个
15、下列化学用语与含义相符的是( )
A.:1个镁离子带2个单位正电荷
B.Mn2+:锰元素的化合价为+2价
C.2N:1个氮分子由2个氮原子构成
D.2HgO:2个氧化汞分子
二、填空题。
16、氯是一种重要的“成盐元素”,在海水、盐湖和盐矿中广泛存在。
(1)如图是氯原子结构示意图,氯原子的最外层电子数是________;氯元素在元素周期表中位于第________周期。
(2)含氯元素的物质大多具有消毒杀菌功能。如:a.醋酸氯己定[C22H34Cl2N10O2] b.氯化钠 c.二氧化氯[ClO2] d.次氯酸钠[NaClO]等。
①醋酸氯己定属于________(填“有机”或“无机”)化合物;1个醋酸氯己定分子由________个原子构成。
②b、d物质溶于水都能解离出钠离子,但阴离子不同。写出d中阴离子符号________。
17、形态各异的物质可按一定规律分类.现有A.洁净的空气 B.蒸馏水 C.海水 D.高锰酸钾 E.二氧化碳 F.氧气,请选用各物质名称前的字母序号填写在横线上:
(1)属于混合物的是________;
(2)属于单质的是________;
(3)属于化合物的是________;
(4)属于氧化物的是________.
18、人类文明进步与金属材料的发展关系十分密切,金属在生活生产中有着非常广泛的应用。请回答下列问题:
(1)下图是常用的电源插头,在标示的部件中,属于金属材料的是( )___________________。
(2)铜能制成插头和导线,是利用了金属铜的________性和________性。
(3)微型化录音录像的高性能带中磁粉的主要材料之一是化学组成相当于CoFe2O4的化合物,又知钴(Co)和铁都有+2、+3价,且在上述化合物中每种元素只具有一种化合价,则铁元素的化合价为__________。
19、图中①、②分别是锶元素、钙元素在元素周期表中的部分信息,A、B、C是三种粒子的结构示意图。请回答下列
问题。
(1)锶元素的相对原子质量为 ,钙元素的原子序数为 。
(2)锶元素与钙元素最本质的区别是 。
(3)A、B、C三种粒子中,属于原子的是 (填字母,下同)。与B化学性质相似的粒子是 。
20、元素周期律和周期表是学习化学的重要工具。下表是元素周期表的部分信息。
(1)列出的 18 种元素中,有________种属于金属元素。
(2)从原子结构角度看,同一族元素的原子具有相同的________数。某粒子结构示意图为 ,该粒子所属元素位于周期表的第________周期。
(3)观察硫原子结构示意图,在下图中填空:
________、________ 。
三、实验题。
21、某化学兴趣小组对氧气的制取进行了进一步的探究。
(1)用高锰酸钾制氧气,对比用向上排空气法和排水法收集到的氧气的纯度。
(进行实验)
①用向上排空气法收集氧气:将带火星的木条放在集气瓶口,当______________________时证明氧气集满,用传感器测定集气瓶中氧气的体积分数。重复该实验 3 次并记录数据。
②用排水法收集氧气,氧气能用排水法收集的原因是______,用传感器测定集气瓶中氧气的体积分 数。重复该实验 3 次并记录数据。
氧气的收集方法 向上排空气法 排水法
氧气的体积分数/% 79.7 79.6 79.9 90.0 89.8 89.3
氧气的平均体积分数/% 79.7 89.7
(实验分析)不考虑操作失误的因素,用排水法也收集不到纯净的氧气,其主要原因是______。
(2)写出实验室用过氧化氢溶液制取氧气的符号表达式______ 。
(3)某同学将如图 1 装置的长颈漏斗换成分液漏斗,这样做的优点是_____。
(4)实验室里制取气体的一般思路和方法:
①选择适当的反应,包括_____ ;
②选择合适的_____ ;
③_____ 。
(5)某化学兴趣小组借助氧气传感器探究微粒的运动,数据处理软件可以实时绘出氧气体积分数随时间变化的曲线。收集一塑料瓶
氧气进行以下三步实验:①敞口放置;② 双手贴在塑料瓶外壁上;③将塑料瓶的瓶口朝下,三步实验中测得氧气的体积分数随时间变化的曲线依次为图 2 中的 MN 段、NP 段和PQ 段。
①能够说明氧气分子不断运动的曲线是______
A MN 段 B NP 段 C PQ 段
②MN 段和 NP 段相比较,说明_____ 。
③随着实验的进行,传感器测出氧气的体积分数约为_____时几乎不再变化。
四、计算类综合题。
22、我国从1994年开始强制食盐加碘,即在食盐中加入碘酸钾(KIO3),以防治碘缺乏病的发生,2010年适当下调现行食盐加碘量,各地需根据本地区实际情况相应调整。深圳率先作出调整,由原来每千克食盐含碘40 mg下调至25 mg。
碘 盐
配料:氯化钠、碘酸钾(KIO3)
含碘量:(20~30)mg/kg
保质期:18个月
食用方法:勿长时间炖炒
贮藏指南:避光、避热、密封防潮
(1)碘酸钾中碘元素、钾元素、氧元素的质量比为 。
(2)碘酸钾中碘元素的质量分数为 (保留至0.1%或用分数表示)。
(3)请为某企业计算:售往深圳的加碘食盐每袋(500 g)应比调整前少加碘酸钾多少毫克
2022秋沪教版(全国)九年级上册第3章:物质构成的奥秘习题选含答案
沪教版(全国)九上第3章 物质构成的奥秘
一、选择题。
1、化学是在分子原子的层次上研究物质的性质、组成、结构与变化规律的科学,下列关于分子和原子的说法中错误的是( )
A. 物质是由微观粒子构成的。水、苯由分子构成,汞、硅由原子构成
B. 对于由分子构成的物质,分子是保持其化学性质的最小粒子
C. 原子是化学变化中的最小粒子
D. 由同种分子构成的物质是纯净物,所以纯净物一定由同种分子构成
【答案】D
2、下面这些物质属于纯净物的是( )
A. 矿泉水 B. 白酒 C. 洁净的空气 D. 冰水混合物
【答案】D
3、在H2、H2O、H2SO4三种物质中,都含有( )
A.两个氢原子 B.一个氢分子
C.氢元素 D.两个氢元素
【答案】C
4、科学研究发现:氮气不活泼,在3000℃时仅有0.1%的分子分裂。在0℃常压下,向密闭容器M中充入一定量的氮气,而后升高温度(不超过3000℃,压强不变),若该密闭容器的体积增大了一倍,则M内分子变化的示意图合理的是( )
A. B. C. D.
【答案】B
5、化学使世界变得绚丽多彩,科学家为此作出了巨大的贡献。编制元素周期表的科学家是 ( )
A. 门捷列夫 B. 阿伏伽德罗 C. 拉瓦锡 D. 道尔顿
【答案】A
6、元素是化学的重要概念之一,下列有关元素的说法错误的是( )
A. 元素是具有相同核电荷数的一类粒子的总称
B. 物质都是由元素组成的
C. 同种元素的原子核内质子数与中子数不一定相等
D. 在物质发生化学变化时,原子的种类不变,元素的种类也不会改变
【答案】A
7、化学使人类生活更加丰富多彩,如打火机就给人们生活带来了方便,下列有关打火机的主要燃料丁烷(C4H10)的说法不正确的是( )
A.从性质上看:丁烷具有可燃性
B.从变化上看:丁烷完全燃烧只生成水
C.从组成上看:丁烷由碳、氢两种元素组成
D.从结构上看:一个丁烷分子由4个碳原子、10个氢原子构
【答案】B
8、元素周期表是学习和研究化学的重要工具,如图是元素周期表的一部分,其中X、Y、Z代表三种不同的元素。下列说法中正确的是( )
A.原子序数:X>Y B.核外电子数:X=Z
C.Y和Z处于同一周期 D.X和Z的电子层数相同
【答案】C
9、考古学家常利用古生物遗骸中某元素的含量来推断该生物死亡的年代。其中测定碳-14的含量是常用的手段之一。已知碳-14的相对原子质量为14,原子核内质子数为6。则下列关于碳-14的说法正确的是( )
A. 中子数为6 B. 核电荷数为6
C. 电子数为8 D. 质子数和中子数的差为8
【答案】B
10、下列物质一定属于纯净物的是( )
A. 液态空气 B. 稀有气体 C. 自来水 D. 液态氧
【答案】D
11、下列说法不正确的是( )
A.一种元素在不同的化合物中可能表现出不同的化合价
B.单质中元素的化合价为0
C.金属元素在化合物中通常显正价,非金属元素在化合物中总显负价
D.在所有化合物中,正负化合价的代数和为0
【答案】C
12、下列说法中正确的是( )
A.原子核内的质子数与其核电荷数相等
B.原子核中的质子数与中子数一定相等
C.原子核一定由质子和中子构成
D.元素的化学性质取决于原子核内的质子数
【答案】A
13、已知钚原子的原子核内部有130个中子,其原子的相对原子质量为224,则该原子中核外电子数是多少( )
A. 94 B. 130 C. 224 D. 64
【答案】A
14、下列叙述中的“一定”肯定成立的个数有( )
(1)有发光、放热现象发生的变化一定是化学变化;
(2)食盐溶解在水中得到食盐水一定是化合反应;
(3)带火星的木条一定能在含有氧气的集气瓶中复燃;
(4)化学反应前后,催化剂的质量和性质一定都不变;
(5)同种原子构成的物质一定是纯净物
A. 3个 B. 2个 C. 1个 D. 0个
【答案】D
15、下列化学用语与含义相符的是( )
A.:1个镁离子带2个单位正电荷
B.Mn2+:锰元素的化合价为+2价
C.2N:1个氮分子由2个氮原子构成
D.2HgO:2个氧化汞分子
【答案】D
二、填空题。
16、氯是一种重要的“成盐元素”,在海水、盐湖和盐矿中广泛存在。
(1)如图是氯原子结构示意图,氯原子的最外层电子数是________;氯元素在元素周期表中位于第________周期。
(2)含氯元素的物质大多具有消毒杀菌功能。如:a.醋酸氯己定[C22H34Cl2N10O2] b.氯化钠 c.二氧化氯[ClO2] d.次氯酸钠[NaClO]等。
①醋酸氯己定属于________(填“有机”或“无机”)化合物;1个醋酸氯己定分子由________个原子构成。
②b、d物质溶于水都能解离出钠离子,但阴离子不同。写出d中阴离子符号________。
【答案】(1)7;三 (2)有机;70;ClO-
17、形态各异的物质可按一定规律分类.现有A.洁净的空气 B.蒸馏水 C.海水 D.高锰酸钾 E.二氧化碳 F.氧气,请选用各物质名称前的字母序号填写在横线上:
(1)属于混合物的是________;
(2)属于单质的是________;
(3)属于化合物的是________;
(4)属于氧化物的是________.
【答案】(1)AC (2)F (3)BDE (4)BE
18、人类文明进步与金属材料的发展关系十分密切,金属在生活生产中有着非常广泛的应用。请回答下列问题:
(1)下图是常用的电源插头,在标示的部件中,属于金属材料的是( )___________________。
(2)铜能制成插头和导线,是利用了金属铜的________性和________性。
(3)微型化录音录像的高性能带中磁粉的主要材料之一是化学组成相当于CoFe2O4的化合物,又知钴(Co)和铁都有+2、+3价,且在上述化合物中每种元素只具有一种化合价,则铁元素的化合价为__________。
【答案】(1)铜质插头、铜芯导线 (2)延展 导电 (3)+3价
19、图中①、②分别是锶元素、钙元素在元素周期表中的部分信息,A、B、C是三种粒子的结构示意图。请回答下列
问题。
(1)锶元素的相对原子质量为 ,钙元素的原子序数为 。
(2)锶元素与钙元素最本质的区别是 。
(3)A、B、C三种粒子中,属于原子的是 (填字母,下同)。与B化学性质相似的粒子是 。
【答案】(1)87.62 20 (2)质子数不同 (3)AB A
20、元素周期律和周期表是学习化学的重要工具。下表是元素周期表的部分信息。
(1)列出的 18 种元素中,有________种属于金属元素。
(2)从原子结构角度看,同一族元素的原子具有相同的________数。某粒子结构示意图为 ,该粒子所属元素位于周期表的第________周期。
(3)观察硫原子结构示意图,在下图中填空:
________、________ 。
【答案】 (1)5 (2)最外层电子;三 (3)得;Na2S
【解析】(1)列出的18种元素中,锂、铍、钠、镁、铝为金属元素,故填“5”’(2)元素周期表中,把最外层电子数相同的原子的元素排成一族,把电子层数相同的原子的元素排在同一周期,所以同一族元素的原子具有相同的最外层电子数;某粒子结构示意图为 ,由图可知,这是12号元素镁元素,由于电子数只有10个,故这是镁离子的结构示意图,镁元素排在元素周期表的第三周期,故填“三”。(3)根据原子结构示意图,硫原子最外层有6个电子,大于4,在化学反应中易得2个电子,形成带两个单位负电荷的硫离子,元素的化合价和原子得失电子的数目是相等的,因此硫元素在化合物中的化合价为-2价,钠元素在化合物中的化合价为+1价,因此硫化钠的化学式为Na2S。
三、实验题。
21、某化学兴趣小组对氧气的制取进行了进一步的探究。
(1)用高锰酸钾制氧气,对比用向上排空气法和排水法收集到的氧气的纯度。
(进行实验)
①用向上排空气法收集氧气:将带火星的木条放在集气瓶口,当______________________时证明氧气集满,用传感器测定集气瓶中氧气的体积分数。重复该实验 3 次并记录数据。
②用排水法收集氧气,氧气能用排水法收集的原因是______,用传感器测定集气瓶中氧气的体积分 数。重复该实验 3 次并记录数据。
氧气的收集方法 向上排空气法 排水法
氧气的体积分数/% 79.7 79.6 79.9 90.0 89.8 89.3
氧气的平均体积分数/% 79.7 89.7
(实验分析)不考虑操作失误的因素,用排水法也收集不到纯净的氧气,其主要原因是______。
(2)写出实验室用过氧化氢溶液制取氧气的符号表达式______ 。
(3)某同学将如图 1 装置的长颈漏斗换成分液漏斗,这样做的优点是_____。
(4)实验室里制取气体的一般思路和方法:
①选择适当的反应,包括_____ ;
②选择合适的_____ ;
③_____ 。
(5)某化学兴趣小组借助氧气传感器探究微粒的运动,数据处理软件可以实时绘出氧气体积分数随时间变化的曲线。收集一塑料瓶
氧气进行以下三步实验:①敞口放置;② 双手贴在塑料瓶外壁上;③将塑料瓶的瓶口朝下,三步实验中测得氧气的体积分数随时间变化的曲线依次为图 2 中的 MN 段、NP 段和PQ 段。
①能够说明氧气分子不断运动的曲线是______
A MN 段 B NP 段 C PQ 段
②MN 段和 NP 段相比较,说明_____ 。
③随着实验的进行,传感器测出氧气的体积分数约为_____时几乎不再变化。
【答案】(1)带火星的木条复燃 常温常压下,氧气不易溶于水且不与水反应 排水法收集的氧气中混有水蒸气
(2)H2O2 H2O+O2
(3)可以控制液体滴加速率,控制反应速率,获得平稳气流
(4)反应物和反应条件 实验装置 验证所制得的气体
(5)A; 相同条件下,温度越高,分子运动速率越大 21%
四、计算类综合题。
22、我国从1994年开始强制食盐加碘,即在食盐中加入碘酸钾(KIO3),以防治碘缺乏病的发生,2010年适当下调现行食盐加碘量,各地需根据本地区实际情况相应调整。深圳率先作出调整,由原来每千克食盐含碘40 mg下调至25 mg。
碘 盐
配料:氯化钠、碘酸钾(KIO3)
含碘量:(20~30)mg/kg
保质期:18个月
食用方法:勿长时间炖炒
贮藏指南:避光、避热、密封防潮
(1)碘酸钾中碘元素、钾元素、氧元素的质量比为 。
(2)碘酸钾中碘元素的质量分数为 (保留至0.1%或用分数表示)。
(3)请为某企业计算:售往深圳的加碘食盐每袋(500 g)应比调整前少加碘酸钾多少毫克
【答案】(1)127∶39∶48 (2)59.3%
(3)解:每500 g食盐中少加碘的质量为(40 mg-25 mg)÷2=7.5 mg,则每500 g食盐中少加碘酸钾的质量为7.5 mg÷59.3%≈12.6 mg。
同课章节目录
- 第1章 开启化学之门
- 第1节 化学给我们带来什么
- 第2节 化学研究些什么
- 第3节 怎样学习和研究化学
- 第2章 身边的化学物质
- 第1节 性质活泼的氧气
- 第2节 奇妙的二氧化碳
- 第3节 自然界中的水
- 基础实验1 氧气的制取与性质
- 基础实验2 二氧化碳的制取与性质
- 第3章 物质构成的奥秘
- 第1节 构成物质的基本微粒
- 第2节 组成物质的化学元素
- 第3节 物质的组成
- 第4章 认识化学变化
- 第1节 常见的化学反应——燃烧
- 第2节 化学反应中的质量关系
- 第3节 化学方程式的书写与运用
- 基础实验3 物质燃烧的条件
- 第5章 金属的冶炼与利用
- 第1节 金属的性质和利用
- 第2节 金属矿物 铁的冶炼
- 第3节 金属防护和废金属回收
- 基础实验4 常见金属的性质
