2022-2023学年苏教版2019高中化学必修1 专题5 微观结构与物质的多样性 知识体系构建与核心素养提升 课件(22张PPT)
文档属性
| 名称 | 2022-2023学年苏教版2019高中化学必修1 专题5 微观结构与物质的多样性 知识体系构建与核心素养提升 课件(22张PPT) |  | |
| 格式 | pptx | ||
| 文件大小 | 741.9KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 苏教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-07-16 15:25:24 | ||
图片预览








文档简介
(共22张PPT)
知识体系构建 / 核心素养提升
本专题知识体系构建与核心素养提升
专题5
内容索引
知识体系构建
核心素养提升
知识体系构建
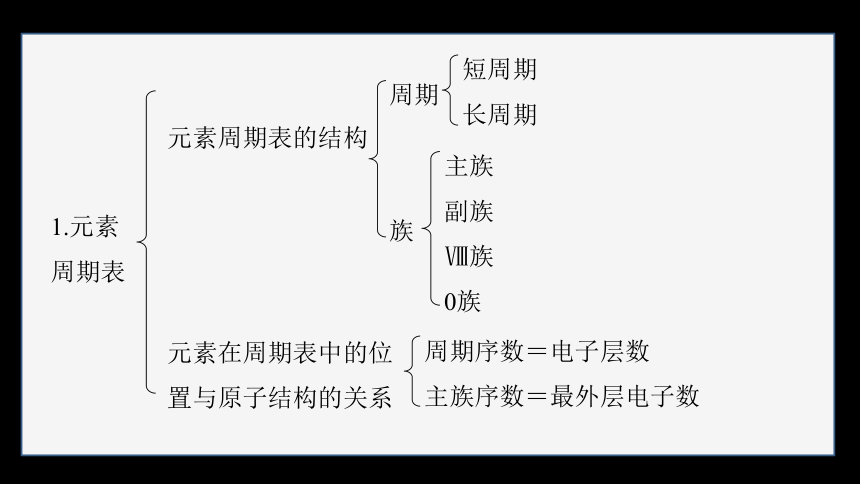
1.元素周期表
元素周期表的结构
周期
元素在周期表中的位置与原子结构的关系
周期序数=电子层数
主族序数=最外层电子数
短周期
长周期
族
主族
副族
Ⅷ族
0族
元素周期表
元素原子结构和性质的递变规律
同周期、同主族元素
原子结构的递变规律
核电荷数
核外电子排布
原子半径
同周期、同主族元
素性质的递变规律
元素主要化合价
元素金属性
元素非金属性
2.微观结构与物质的多样性
微粒间作用力
化学键
离子键
共价键
从微观结构看物质的多样性
同素异形现象
同分异构现象
晶体与非晶体
分子间作用力
3.共价键和离子键的比较
共价键 离子键
成键微粒 原子 阴、阳离子
成键原因 非金属元素的原子最外层电子未达到稳定结构,原子间通过共用电子对形成共价键 活泼金属与活泼非金属化合时易发生电子得失达到稳定结构,形成离子键
成键实质 形成共用电子对 阴、阳离子之间的静电作用
返回
成键元素 非金属元素原子之间、非金属元素原子与不活泼金属元素原子之间 一般是活泼金属元素与活泼非金属元素,如ⅠA族、ⅡA族元素与ⅥA族、ⅦA族元素之间
形成过程
实例 HCl、CO2、H2SO4等 Na2O、NaCl、MgS、CaF2等
核心素养提升
本专题从原子结构的角度认识元素及物质性质与变化规律,从微观角度认识物质的多样性。提升了学生宏观辨识与微观探析的化学核心素养。“位—构—性”关系的应用,微粒半径大小比较等一系列知识,体现了证据推理与模型认知的化学核心素养,利用实验探究元素或物质的性质,培养学生的科学探究与创新意识。
短周期元素a、b、c、d的原子序数依次增大,a的最外层电子数是电子层数的2倍,b的最外层电子数是电子层数的3倍,a、c的最外层电子数之和为6,d的核外电子数等于b的核外电子数加8。下列叙述错误的是
A.a和b可形成气态化合物
B.c的原子半径小于d的原子半径
C.b和c可以形成离子化合物
D.a和d最高价氧化物的水化物均呈酸性
例1
√
由题意可知a为碳,b为氧,c为镁,d为硫。C、O可以形成气态化合物CO、CO2等,A项正确;
Mg、S同周期,原子半径:Mg>S,B项错误;
MgO为离子化合物,C项正确;
C、S的最高价氧化物的水化物分别为H2CO3、H2SO4,均呈酸性,D项正确。
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示。已知Y、W的原子序数之和是Z的3倍,下列说法正确的是
A.原子半径:X<Y<Z
B.气态氢化物的热稳定性:X>Z
C.Z、W均可与Mg形成离子化合物
D.最高价氧化物的水化物的酸性:Y>W
例2
√
由题意可知,X为硅,Y为氮,Z为氧,W为氯。Si为第
三周期元素,N、O为第二周期元素,原子半径:r(Si)>
r(N)>r(O),A项错误;
非金属性:O>Si,则气态氢化物的热稳定性:H2O>SiH4,B项错误;
O、Cl可与Mg形成MgO、MgCl2,均为离子化合物,C项正确;
N、Cl最高价氧化物的水化物分别为HNO3和HClO4,酸性:HClO4>HNO3,D项错误。
已知同周期X、Y、Z三种元素的最高价氧化物的水化物的酸性由强到弱的顺序是HZO4>H2YO4>H3XO4,下列判断正确的是
A.原子半径按X、Y、Z的顺序逐渐减小
B.单质的氧化性按X、Y、Z的顺序减弱
C.三种元素阴离子的还原性按X、Y、Z的顺序增强
D.气态氢化物的热稳定性按X、Y、Z的顺序减弱
例3
√
同周期X、Y、Z三种元素的最高价氧化物的水化物的酸性由强到弱的顺序是HZO4>H2YO4>H3XO4,可知X、Y、Z的原子序数为X<Y<Z。同周期元素从左到右单质的氧化性逐渐增强,阴离子的还原性逐渐减弱,原子半径逐渐减小,气态氢化物的热稳定性逐渐增强。
试分析下列各种情况下粒子间作用力的变化情况(填“离子键”“共价键”或“分子间作用力”)。
(1)NaCl溶于水时破坏_______。
(2)HCl溶于水时破坏_______。
(3)SO2溶于水时破坏_______。
(4)酒精溶于水时破坏_____________。
(5)NaOH和HCl反应时形成_______和_______。
例4
离子键
共价键
共价键
分子间作用力
离子键 共价键
(6)反应2H2+O2===2H2O中,被破坏的是_______,形成的是_______。
(7)CaCl2和Na2CO3反应时,被破坏的化学键有_______,形成的化学键有_______。
(8)Na2O熔化时被破坏的是________。
共价键 共价键
离子键
离子键
离子键
NaCl、HCl、SO2中分别含有离子键、共价键、共价键,溶于水时被破坏相应的化学键;
酒精溶于水时只破坏分子间作用力;
Na2O是离子化合物,熔化时破坏离子键。
如图是几种晶体的结构示意图,它们是NaCl、干冰、金刚石、石墨结构中的一部分。
例5
(1)其中代表金刚石的是___(填字母),金刚石属于_____晶体。
(2)其中代表石墨的是___(填字母),其晶体中碳原子呈平面层状结构排列。
D
B
共价
(3)其中代表NaCl的是___(填字母),晶体中Na+与Cl-之间通过_______结合。
(4)其中代表干冰的是___(填字母),它属于_____晶体,CO2分子间通过______________结合。
(5)A、B、C所代表物质的熔点由高到低的排列顺序为_________(填字母)。
A
离子键
C
分子
分子间作用力
B>A>C
金刚石是共价晶体,碳原子间以共价键结合,B是金刚石的结构模型;
石墨是层状结构,D是石墨的结构模型。
氯化钠是Na+和Cl-按个数比1∶1堆积而成的离子晶体,A是氯化钠的结构模型;
干冰晶体中,CO2分子间依靠分子间作用力结合,C是干冰的结构模型。
一般来说,晶体的熔点:共价晶体>离子晶体>分子晶体。
返回
本课结束
专题5
知识体系构建 / 核心素养提升
本专题知识体系构建与核心素养提升
专题5
内容索引
知识体系构建
核心素养提升
知识体系构建
1.元素周期表
元素周期表的结构
周期
元素在周期表中的位置与原子结构的关系
周期序数=电子层数
主族序数=最外层电子数
短周期
长周期
族
主族
副族
Ⅷ族
0族
元素周期表
元素原子结构和性质的递变规律
同周期、同主族元素
原子结构的递变规律
核电荷数
核外电子排布
原子半径
同周期、同主族元
素性质的递变规律
元素主要化合价
元素金属性
元素非金属性
2.微观结构与物质的多样性
微粒间作用力
化学键
离子键
共价键
从微观结构看物质的多样性
同素异形现象
同分异构现象
晶体与非晶体
分子间作用力
3.共价键和离子键的比较
共价键 离子键
成键微粒 原子 阴、阳离子
成键原因 非金属元素的原子最外层电子未达到稳定结构,原子间通过共用电子对形成共价键 活泼金属与活泼非金属化合时易发生电子得失达到稳定结构,形成离子键
成键实质 形成共用电子对 阴、阳离子之间的静电作用
返回
成键元素 非金属元素原子之间、非金属元素原子与不活泼金属元素原子之间 一般是活泼金属元素与活泼非金属元素,如ⅠA族、ⅡA族元素与ⅥA族、ⅦA族元素之间
形成过程
实例 HCl、CO2、H2SO4等 Na2O、NaCl、MgS、CaF2等
核心素养提升
本专题从原子结构的角度认识元素及物质性质与变化规律,从微观角度认识物质的多样性。提升了学生宏观辨识与微观探析的化学核心素养。“位—构—性”关系的应用,微粒半径大小比较等一系列知识,体现了证据推理与模型认知的化学核心素养,利用实验探究元素或物质的性质,培养学生的科学探究与创新意识。
短周期元素a、b、c、d的原子序数依次增大,a的最外层电子数是电子层数的2倍,b的最外层电子数是电子层数的3倍,a、c的最外层电子数之和为6,d的核外电子数等于b的核外电子数加8。下列叙述错误的是
A.a和b可形成气态化合物
B.c的原子半径小于d的原子半径
C.b和c可以形成离子化合物
D.a和d最高价氧化物的水化物均呈酸性
例1
√
由题意可知a为碳,b为氧,c为镁,d为硫。C、O可以形成气态化合物CO、CO2等,A项正确;
Mg、S同周期,原子半径:Mg>S,B项错误;
MgO为离子化合物,C项正确;
C、S的最高价氧化物的水化物分别为H2CO3、H2SO4,均呈酸性,D项正确。
短周期元素X、Y、Z、W在元素周期表中的相对位置如图所示。已知Y、W的原子序数之和是Z的3倍,下列说法正确的是
A.原子半径:X<Y<Z
B.气态氢化物的热稳定性:X>Z
C.Z、W均可与Mg形成离子化合物
D.最高价氧化物的水化物的酸性:Y>W
例2
√
由题意可知,X为硅,Y为氮,Z为氧,W为氯。Si为第
三周期元素,N、O为第二周期元素,原子半径:r(Si)>
r(N)>r(O),A项错误;
非金属性:O>Si,则气态氢化物的热稳定性:H2O>SiH4,B项错误;
O、Cl可与Mg形成MgO、MgCl2,均为离子化合物,C项正确;
N、Cl最高价氧化物的水化物分别为HNO3和HClO4,酸性:HClO4>HNO3,D项错误。
已知同周期X、Y、Z三种元素的最高价氧化物的水化物的酸性由强到弱的顺序是HZO4>H2YO4>H3XO4,下列判断正确的是
A.原子半径按X、Y、Z的顺序逐渐减小
B.单质的氧化性按X、Y、Z的顺序减弱
C.三种元素阴离子的还原性按X、Y、Z的顺序增强
D.气态氢化物的热稳定性按X、Y、Z的顺序减弱
例3
√
同周期X、Y、Z三种元素的最高价氧化物的水化物的酸性由强到弱的顺序是HZO4>H2YO4>H3XO4,可知X、Y、Z的原子序数为X<Y<Z。同周期元素从左到右单质的氧化性逐渐增强,阴离子的还原性逐渐减弱,原子半径逐渐减小,气态氢化物的热稳定性逐渐增强。
试分析下列各种情况下粒子间作用力的变化情况(填“离子键”“共价键”或“分子间作用力”)。
(1)NaCl溶于水时破坏_______。
(2)HCl溶于水时破坏_______。
(3)SO2溶于水时破坏_______。
(4)酒精溶于水时破坏_____________。
(5)NaOH和HCl反应时形成_______和_______。
例4
离子键
共价键
共价键
分子间作用力
离子键 共价键
(6)反应2H2+O2===2H2O中,被破坏的是_______,形成的是_______。
(7)CaCl2和Na2CO3反应时,被破坏的化学键有_______,形成的化学键有_______。
(8)Na2O熔化时被破坏的是________。
共价键 共价键
离子键
离子键
离子键
NaCl、HCl、SO2中分别含有离子键、共价键、共价键,溶于水时被破坏相应的化学键;
酒精溶于水时只破坏分子间作用力;
Na2O是离子化合物,熔化时破坏离子键。
如图是几种晶体的结构示意图,它们是NaCl、干冰、金刚石、石墨结构中的一部分。
例5
(1)其中代表金刚石的是___(填字母),金刚石属于_____晶体。
(2)其中代表石墨的是___(填字母),其晶体中碳原子呈平面层状结构排列。
D
B
共价
(3)其中代表NaCl的是___(填字母),晶体中Na+与Cl-之间通过_______结合。
(4)其中代表干冰的是___(填字母),它属于_____晶体,CO2分子间通过______________结合。
(5)A、B、C所代表物质的熔点由高到低的排列顺序为_________(填字母)。
A
离子键
C
分子
分子间作用力
B>A>C
金刚石是共价晶体,碳原子间以共价键结合,B是金刚石的结构模型;
石墨是层状结构,D是石墨的结构模型。
氯化钠是Na+和Cl-按个数比1∶1堆积而成的离子晶体,A是氯化钠的结构模型;
干冰晶体中,CO2分子间依靠分子间作用力结合,C是干冰的结构模型。
一般来说,晶体的熔点:共价晶体>离子晶体>分子晶体。
返回
本课结束
专题5
