《第二章 元素与物质世界》PPT课件
图片预览








文档简介
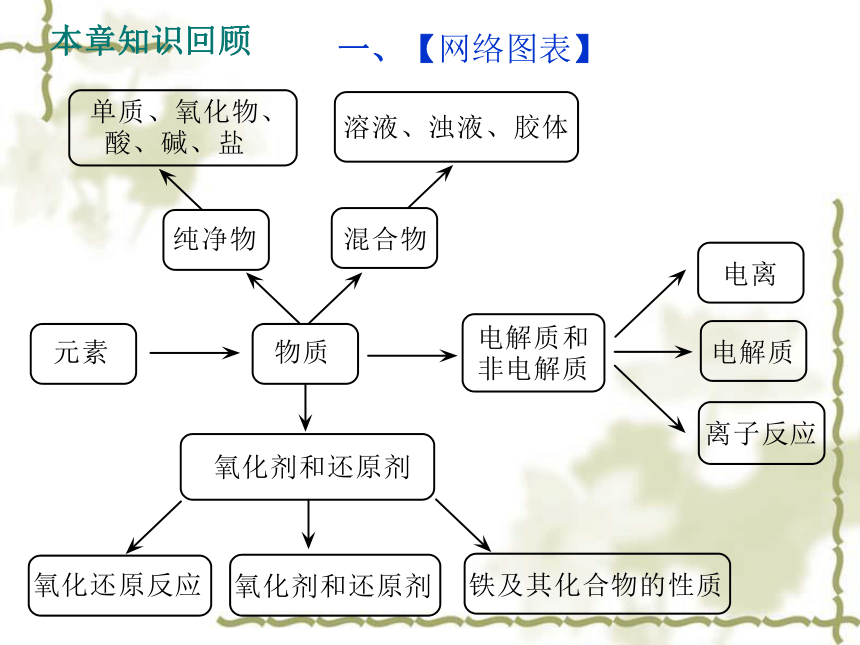
课件22张PPT。第二章复习普通高中课程标准实验教科书 化学1(必修)授课人: 李建玲本章知识回顾 一、【网络图表】二、【知识归纳】 1 、基础知识(1)物质的分类 ①按物质是否由同种物质(分子)组成 纯净物和混合物 ②按组成物质的元素种类分纯净物 单质和化合物 ③化合物的分类 A、性质分类 酸、碱、盐、氧化物等 B、水溶液或在融化状态下是否导电 电解质和非电解质 C、化学反应中的表现 氧化剂和还原剂 ④按混合物中分散质粒子的直径大小可将混合物分类
溶液、胶体和浊液等 (2)化学反应的分类①根据反应形式分 分解反应、化合反应、置换反应和复分解反应 ②根据反应中电子得失分 氧化还原反应和非氧化还原反应 ③根据反应中化学粒子特征 分子反应和离子反应 (3)胶体①本质特征 粒子粒度在1nm~100nm之间 ②重要性质 丁达尔现象、电泳、聚沉 ③胶体的提纯与精制:渗析 (4)离子方程式的书写方法1:写、改、删、查 方法2:写、断、写、查 注意事项:①合事实:离子反应要符合客观事实,不可臆造产物及反应。
②式正确:化学式与离子符号使用正确合理。
③号实际:“↑”“↓”等符号符合实际。
④两守恒:两边原子数、电荷数必须守恒(氧化还原反应离子方程式中氧化剂得电子总数与还原剂失电子总数要相等)。
⑤明类型:依据离子反应原理,分清类型,总结方法技巧。
⑥检查细:结合书写离子方程式过程中易出现的错误,细心检查。 (5)氧化还原反应①特征:化合价升降; ②实质:电子的转移。 ③基本规律 守恒律:化合价升高和降低总数相等,
电子得失总数相等 强弱律:氧化性:氧化剂强于氧化产物;
还原性:还原剂强于还原产物。价态律:元素处于最高价,只有氧化性,
元素处于最低价,只有还原性,
中间价态的元素既有氧化性又有还原性 转化律:邻价转化最易。化合价只靠拢,不交错 2 、基本概念1>胶体 分散质粒度介于1~100nm之间的分散系 2>电解质和非电解质 水溶液里或熔融状态下能够导电的化合物叫电解质 水溶液或熔融状态下都不导电的化合物叫非电解质 3>酸、碱、盐 电离时,生成的阳离子全部是H+的化合物是酸 生成的阴离子全部是OH-的化合物是碱 生成金属阳离子和酸根阴离子的化合物称为盐 4>离子反应 有离子参加的反应 5>离子方程式 用实际参加反应的离子的符号来表示离子反应的式子 6>氧化剂和还原剂 反应中得到电子的反应物是氧化剂
反应中失去电子的反应物是还原剂 7>氧化反应和还原反应 物质失去电子的反应叫做氧化反应
物质得到电子的反应叫做还原反应 8>氧化性和还原性 氧化剂在反应中获得电子的性质,叫做氧化性;
还原剂在反应中失去电子的性质,叫做还原性。9>氧化产物和还原产物 还原剂发生氧化反应后的生成物,叫做氧化产物;
氧化剂发生还原反应后的生成物,叫做还原产物。3 基本关系(1)元素与物质的关系:
元素是物质的基本组成成分,物质都是由元素组成的。 (2)酸、碱、盐与电解质的关系:酸、碱、盐属于电解质,电解质包含酸、碱、盐。 (3)单质、氧化物、酸、碱、盐之间的相互关系(4)氧化还原反应中各个概念间的关系(同一反应中):(5)铁及其化合物的转化关系: Fe Fe3+ Fe2+ 弱氧化剂 强氧化剂 强还原剂 弱还原剂 强氧化剂 强氧化剂 本章专题探究 一、离子共存问题1.由于发生复分解反应,离子不能大量共存 (1)有气体产生。
如CO32-、SO32-、S2-、HCO3-、HSO3-、HS-等易挥发的弱酸的酸根与H+不能大量共存 (2)有沉淀生成。
如Ba2+、Ca2+、Mg2+、Ag+等不能与SO42-、CO32-等大量共存;
Mg2+、Fe2+、Ag+、Al3+、Zn2+、Cu2+、Fe3+等不能与OH-大量共存;
Pb2+与Cl-,Fe2+与S2-、Ca2+与PO43-、Ag+与I-不能大量共存。
(3)有弱电解质生成。
如OH-、CH3COO-、PO43-、HPO42-、H2PO4-、F-、ClO-、SiO32-等与H+不能大量共存;
一些酸式弱酸根如HCO3-、HPO42-、HS-、H2PO4-、HSO3-不能与OH-大量共存;
NH4+与OH-不能大量共存。2.由于发生氧化还原反应,离子不能大量共存。(1)具有较强还原性的离子不能与具有较强氧化性的离子大量共存。
如S2-、HS-、SO32-、I-和Fe3+不能大量共存。 (2)在酸性的介质中由于发生氧化还原反应而不能大量共存。
如MnO4-、Cr2O72-、NO3-、ClO-与S2-、HS-、SO32-、HSO3-、I-、Fe2+等不能大量共存。 1:下列各组中的离子,能在溶液中大量共存的是( )
A.K+、Ag+、NO3-、Cl-
B.Ba2+、Na+、CO32-、OH-
C.Mg2+、Ba2+、OH-、NO3-
D.H+、K+、CO32-、SO42-
E.Al3+、Fe3+、SO42-、Cl-
F.K+、Na+、NH4+、OH-研析:A组中:Ag++Cl-=AgCl↓;
B组中,Ba2++CO32-=BaCO3↓;
C组中,Mg2++2OH-=Mg(OH)2↓;
D组中,2H++CO32-=CO2↑+H2O;
E组中,各种离子能在溶液中大量共存;
F组中,NH4+与OH-能生成难电离的弱电解质NH3·H2O,甚至有气体逸出。 E2.已知常温下,在溶液中发生如下反应
①16H++10Z-+2XO4-=2X2++5Z2+8H2O;
②2A2++B2=2A3++2B-;
③2B-+Z2=B2 + 2Z-
由此判断下列说法错误的是( )
A.反应Z2+2A2+=2A3++2Z-可以进行 B.Z元素在①、③的反应中均被还原
C.氧化性由强到弱的顺序是:XO4-、Z2、B2、A3+ D.还原性由强到弱的顺序是:Z-、B-、A2+、X2+解析:由①可知氧化性XO4->Z2,还原性Z->X2+,
由②可知氧化性B2>A3+,还原性A2+>B-,
由③可知氧化性Z2>B2,还原性B->Z-,故AC正确,D错误。Z元素在①中由-1价升高到0价被氧化,在③中Z元素由0价降低到-1价被还原,故B错误。 B D3.下列离子方程式中,书写错误的是( )
A.碳酸钠溶液跟稀H2SO4:
CO32-+2H+ = H2O+CO2↑
B.硝酸铜溶液中滴加烧碱溶液:
Cu2++2OH- = Cu(OH)2↓
C.醋酸溶液中加入氢氧化钾溶液:
H++OH- = H2O
D.MgSO4溶液中加入BaCl2溶液:
Ba2++SO42- = BaSO4↓解析:书写离子方程式要注意:①反应要符合事实;②微粒书写形式要正确;③方程式要配平。C中醋酸是弱电解质,应写成CH3COOH的形式。 C4.下列关于胶体的说法中正确的是( )
A.胶体外观不均匀 B.胶粒能通过滤纸
C.胶粒是静止的
D.胶体不稳定,静置后容易产生沉淀解析:胶体是分散系的一种,外观均匀,胶粒带相同电荷,且不停的运动,所以胶体是比较稳定的,在通常情况下,不会产生沉淀。滤纸通常用来分离沉淀和溶液,但其孔径大于胶粒粒度,因此胶粒能通过滤纸。 B 谢谢!
溶液、胶体和浊液等 (2)化学反应的分类①根据反应形式分 分解反应、化合反应、置换反应和复分解反应 ②根据反应中电子得失分 氧化还原反应和非氧化还原反应 ③根据反应中化学粒子特征 分子反应和离子反应 (3)胶体①本质特征 粒子粒度在1nm~100nm之间 ②重要性质 丁达尔现象、电泳、聚沉 ③胶体的提纯与精制:渗析 (4)离子方程式的书写方法1:写、改、删、查 方法2:写、断、写、查 注意事项:①合事实:离子反应要符合客观事实,不可臆造产物及反应。
②式正确:化学式与离子符号使用正确合理。
③号实际:“↑”“↓”等符号符合实际。
④两守恒:两边原子数、电荷数必须守恒(氧化还原反应离子方程式中氧化剂得电子总数与还原剂失电子总数要相等)。
⑤明类型:依据离子反应原理,分清类型,总结方法技巧。
⑥检查细:结合书写离子方程式过程中易出现的错误,细心检查。 (5)氧化还原反应①特征:化合价升降; ②实质:电子的转移。 ③基本规律 守恒律:化合价升高和降低总数相等,
电子得失总数相等 强弱律:氧化性:氧化剂强于氧化产物;
还原性:还原剂强于还原产物。价态律:元素处于最高价,只有氧化性,
元素处于最低价,只有还原性,
中间价态的元素既有氧化性又有还原性 转化律:邻价转化最易。化合价只靠拢,不交错 2 、基本概念1>胶体 分散质粒度介于1~100nm之间的分散系 2>电解质和非电解质 水溶液里或熔融状态下能够导电的化合物叫电解质 水溶液或熔融状态下都不导电的化合物叫非电解质 3>酸、碱、盐 电离时,生成的阳离子全部是H+的化合物是酸 生成的阴离子全部是OH-的化合物是碱 生成金属阳离子和酸根阴离子的化合物称为盐 4>离子反应 有离子参加的反应 5>离子方程式 用实际参加反应的离子的符号来表示离子反应的式子 6>氧化剂和还原剂 反应中得到电子的反应物是氧化剂
反应中失去电子的反应物是还原剂 7>氧化反应和还原反应 物质失去电子的反应叫做氧化反应
物质得到电子的反应叫做还原反应 8>氧化性和还原性 氧化剂在反应中获得电子的性质,叫做氧化性;
还原剂在反应中失去电子的性质,叫做还原性。9>氧化产物和还原产物 还原剂发生氧化反应后的生成物,叫做氧化产物;
氧化剂发生还原反应后的生成物,叫做还原产物。3 基本关系(1)元素与物质的关系:
元素是物质的基本组成成分,物质都是由元素组成的。 (2)酸、碱、盐与电解质的关系:酸、碱、盐属于电解质,电解质包含酸、碱、盐。 (3)单质、氧化物、酸、碱、盐之间的相互关系(4)氧化还原反应中各个概念间的关系(同一反应中):(5)铁及其化合物的转化关系: Fe Fe3+ Fe2+ 弱氧化剂 强氧化剂 强还原剂 弱还原剂 强氧化剂 强氧化剂 本章专题探究 一、离子共存问题1.由于发生复分解反应,离子不能大量共存 (1)有气体产生。
如CO32-、SO32-、S2-、HCO3-、HSO3-、HS-等易挥发的弱酸的酸根与H+不能大量共存 (2)有沉淀生成。
如Ba2+、Ca2+、Mg2+、Ag+等不能与SO42-、CO32-等大量共存;
Mg2+、Fe2+、Ag+、Al3+、Zn2+、Cu2+、Fe3+等不能与OH-大量共存;
Pb2+与Cl-,Fe2+与S2-、Ca2+与PO43-、Ag+与I-不能大量共存。
(3)有弱电解质生成。
如OH-、CH3COO-、PO43-、HPO42-、H2PO4-、F-、ClO-、SiO32-等与H+不能大量共存;
一些酸式弱酸根如HCO3-、HPO42-、HS-、H2PO4-、HSO3-不能与OH-大量共存;
NH4+与OH-不能大量共存。2.由于发生氧化还原反应,离子不能大量共存。(1)具有较强还原性的离子不能与具有较强氧化性的离子大量共存。
如S2-、HS-、SO32-、I-和Fe3+不能大量共存。 (2)在酸性的介质中由于发生氧化还原反应而不能大量共存。
如MnO4-、Cr2O72-、NO3-、ClO-与S2-、HS-、SO32-、HSO3-、I-、Fe2+等不能大量共存。 1:下列各组中的离子,能在溶液中大量共存的是( )
A.K+、Ag+、NO3-、Cl-
B.Ba2+、Na+、CO32-、OH-
C.Mg2+、Ba2+、OH-、NO3-
D.H+、K+、CO32-、SO42-
E.Al3+、Fe3+、SO42-、Cl-
F.K+、Na+、NH4+、OH-研析:A组中:Ag++Cl-=AgCl↓;
B组中,Ba2++CO32-=BaCO3↓;
C组中,Mg2++2OH-=Mg(OH)2↓;
D组中,2H++CO32-=CO2↑+H2O;
E组中,各种离子能在溶液中大量共存;
F组中,NH4+与OH-能生成难电离的弱电解质NH3·H2O,甚至有气体逸出。 E2.已知常温下,在溶液中发生如下反应
①16H++10Z-+2XO4-=2X2++5Z2+8H2O;
②2A2++B2=2A3++2B-;
③2B-+Z2=B2 + 2Z-
由此判断下列说法错误的是( )
A.反应Z2+2A2+=2A3++2Z-可以进行 B.Z元素在①、③的反应中均被还原
C.氧化性由强到弱的顺序是:XO4-、Z2、B2、A3+ D.还原性由强到弱的顺序是:Z-、B-、A2+、X2+解析:由①可知氧化性XO4->Z2,还原性Z->X2+,
由②可知氧化性B2>A3+,还原性A2+>B-,
由③可知氧化性Z2>B2,还原性B->Z-,故AC正确,D错误。Z元素在①中由-1价升高到0价被氧化,在③中Z元素由0价降低到-1价被还原,故B错误。 B D3.下列离子方程式中,书写错误的是( )
A.碳酸钠溶液跟稀H2SO4:
CO32-+2H+ = H2O+CO2↑
B.硝酸铜溶液中滴加烧碱溶液:
Cu2++2OH- = Cu(OH)2↓
C.醋酸溶液中加入氢氧化钾溶液:
H++OH- = H2O
D.MgSO4溶液中加入BaCl2溶液:
Ba2++SO42- = BaSO4↓解析:书写离子方程式要注意:①反应要符合事实;②微粒书写形式要正确;③方程式要配平。C中醋酸是弱电解质,应写成CH3COOH的形式。 C4.下列关于胶体的说法中正确的是( )
A.胶体外观不均匀 B.胶粒能通过滤纸
C.胶粒是静止的
D.胶体不稳定,静置后容易产生沉淀解析:胶体是分散系的一种,外观均匀,胶粒带相同电荷,且不停的运动,所以胶体是比较稳定的,在通常情况下,不会产生沉淀。滤纸通常用来分离沉淀和溶液,但其孔径大于胶粒粒度,因此胶粒能通过滤纸。 B 谢谢!
