【高考真题】2022年新高考湖北化学高考试卷(Word版,含答案)
文档属性
| 名称 | 【高考真题】2022年新高考湖北化学高考试卷(Word版,含答案) |  | |
| 格式 | docx | ||
| 文件大小 | 931.6KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 通用版 | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-07-19 15:12:30 | ||
图片预览



文档简介
湖北省2022年普通高中学业水平选择性考试
化学
本试卷共8页,19题。全卷满分100分。考试用时75分钟。
★祝考试顺利★
注意事项:
1.答题前,先将自己的姓名、准考证号、考场号、座位号填写在试卷和答题卡上,并认真核准准考证号条形码上的以上信息,将条形码粘贴在答题卡上的指定位置。
2.请按题号顺序在答题卡上各题目的答题区域内作答,写在试卷、草稿纸和答题卡上的非答题区域均无效。
3.选择题用2B铅笔在答题卡上把所选答案的标号涂黑;非选择题用黑色签字笔在答题卡上作答;字体工整,笔迹清楚。
4.考试结束后,请将试卷和答题卡一并上交。
可能用到的相对原子质量:H 1 Li 7 C 12 O 16 Mg 24 Al 27 Ca 40
本卷涉及的实验均须在专业人士指导和安全得到充分保障的条件下完成。
一、选择题:本题共15小题,每小题3分,共45分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.化学与生活密切相关,下列不涉及化学变化的是( )
A.加入明矾后泥水变澄清 B.北京冬奥会用水快速制冰
C.炖排骨汤时加点醋味道更鲜 D.切开的茄子放置后切面变色
2.莲藕含多酚类物质,其典型结构简式如图所示。下列有关该类物质的说法错误的是( )
A.不能与溴水反应 B.可用作抗氧化剂
C.有特征红外吸收峰 D.能与发生显色反应
3.武当山金殿是铜铸鎏金大殿。传统鎏金工艺是将金溶于汞中制成“金汞漆”,涂在器物表面,然后加火除汞,使金附着在器物表面。下列说法错误的是( )
A.鎏金工艺利用了汞的挥发性 B.鎏金工艺中金发生了化学反应
C.鎏金工艺的原理可用于金的富集 D.用电化学方法也可实现铜上覆金
4.下列各组离子在给定溶液中能大量共存的是( )
A.在氨水中:
B.在氯化钠溶液中:
C.在醋酸溶液中:
D.在硝酸银溶液中:
5.化学物质与生命过程密切相关,下列说法错误的是( )
A.维生素C可以还原活性氧自由基 B.蛋白质只能由蛋白酶催化水解
C.淀粉可用为原料人工合成 D.核酸可视为核苷酸的聚合产物
6.下列实验装置(部分夹持装置略)或现象错误的是( )
A.滴入酚酞溶液 B.吸氧腐蚀 C.钠的燃烧 D.石蜡油的热分解
7.在高温高压下可转变为具有一定导电性、高硬度的非晶态碳玻璃。下列关于该碳玻璃的说法错误的是( )
A.具有自范性 B.与互为同素异形体
C.含有杂化的碳原子 D.化学性质与金刚石有差异
8.硫代碳酸钠能用于处理废水中的重金属离子,可通过如下反应制备:
下列说法正确的是( )
A.不能被氧化 B.溶液显碱性
C.该制备反应是熵减过程 D.的热稳定性比的高
9.某立方卤化物可用于制作光电材料,其晶胞结构如图所示。下列说法错误的是( )
A.的配位数为6 B.与距离最近的是
C.该物质的化学式为 D.若换为,则晶胞棱长将改变
10.和的电荷与半径之比相近,导致两元素性质相似。下列说法错误的是( )
A.与都能在水中与氨形成配合物
B.和的熔点都比的低
C.和均可表现出弱酸性
D.和的氢化物都不能在酸中稳定存在
11.磷酰三叠氮是一种高能分子,结构简式为。下列关于该分子的说法正确的是( )
A.为非极性分子 B.立体构型为正四面体形
C.加热条件下会分解并放出 D.分解产物的电子式为
12.根据酸碱质子理论,给出质子的物质是酸,给出质子的能力越强,酸性越强。
已知:
下列酸性强弱顺序正确的是( )
A. B.
C. D.
13.同位素示踪是研究反应机理的重要手段之一。已知醛与在酸催化下存在如下平衡:。据此推测,对羟基苯甲醛与10倍量的在少量酸催化下反应,达到平衡后,下列化合物中含量最高的是( )
A. B. C. D.
14.含磷有机物应用广泛。电解法可实现由白磷直接制备,过程如图所示(为甲基)。下列说法正确的是( )
A.生成,理论上外电路需要转移电子
B.阴极上的电极反应为:
C.在电解过程中向铂电极移动
D.电解产生的中的氢元素来自于
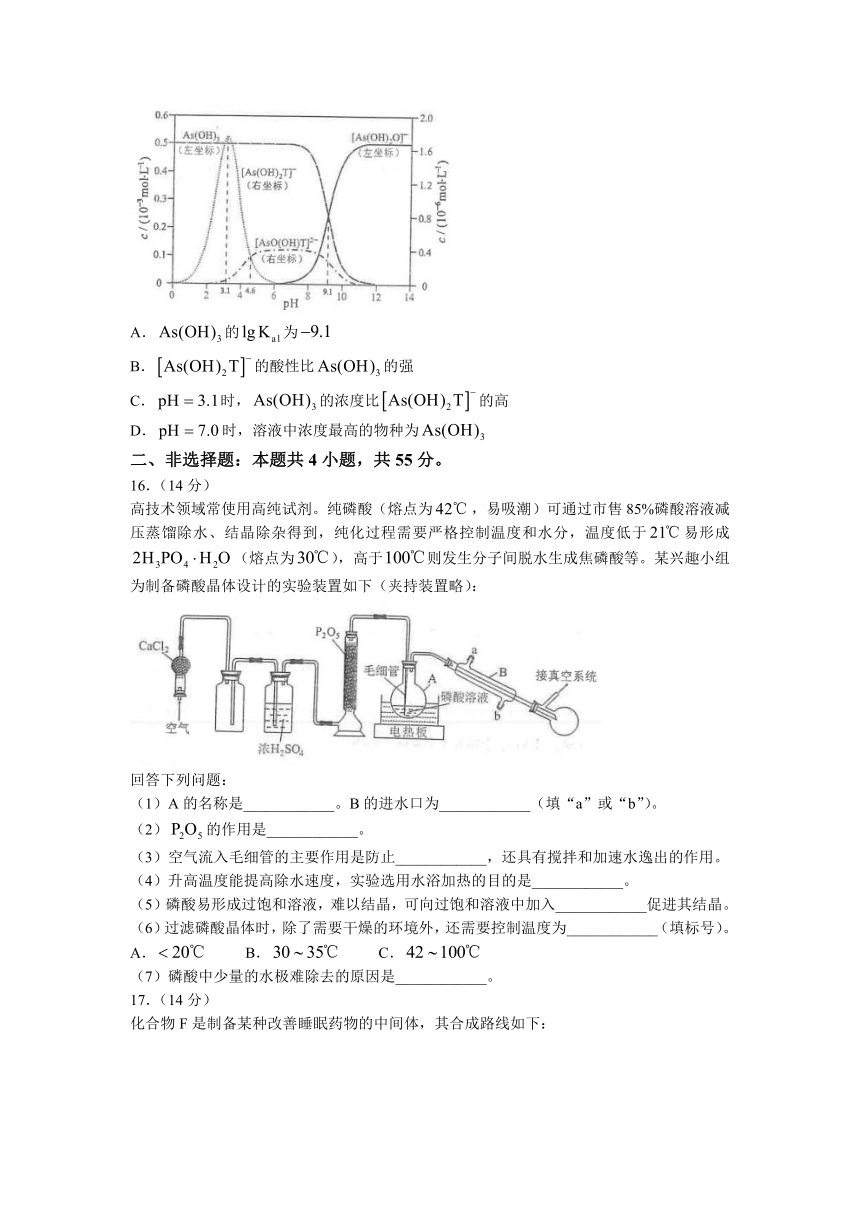
15.下图是亚砷酸和酒石酸混合体系中部分物种的图(浓度:总为,总T为)。下列说法错误的是( )
A.的为
B.的酸性比的强
C.时,的浓度比的高
D.时,溶液中浓度最高的物种为
二、非选择题:本题共4小题,共55分。
16.(14分)
高技术领域常使用高纯试剂。纯磷酸(熔点为,易吸潮)可通过市售85%磷酸溶液减压蒸馏除水、结晶除杂得到,纯化过程需要严格控制温度和水分,温度低于易形成(熔点为),高于则发生分子间脱水生成焦磷酸等。某兴趣小组为制备磷酸晶体设计的实验装置如下(夹持装置略):
回答下列问题:
(1)A的名称是____________。B的进水口为____________(填“a”或“b”)。
(2)的作用是____________。
(3)空气流入毛细管的主要作用是防止____________,还具有搅拌和加速水逸出的作用。
(4)升高温度能提高除水速度,实验选用水浴加热的目的是____________。
(5)磷酸易形成过饱和溶液,难以结晶,可向过饱和溶液中加入____________促进其结晶。
(6)过滤磷酸晶体时,除了需要干燥的环境外,还需要控制温度为____________(填标号)。
A. B. C.
(7)磷酸中少量的水极难除去的原因是____________。
17.(14分)
化合物F是制备某种改善睡眠药物的中间体,其合成路线如下:
回答下列问题:
(1)的反应类型是____________。
(2)化合物B核磁共振氢谱的吸收峰有____________组。
(3)化合物C的结构简式为____________。
(4)的过程中,被还原的官能团是____________,被氧化的官能团是____________。
(5)若只考虑氟的位置异构,则化合物F的同分异构体有____________种。
(6)已知、和的产率分别为70%、82%和80%,则的总产率为____________。
(7)配合物可催化转化中键断裂,也能催化反应①:
反应①:
为探究有机小分子催化反应①的可能性,甲、乙两个研究小组分别合成了有机小分子(结构如下图所示)。在合成的过程中,甲组使用了催化剂,并在纯化过程中用沉淀剂除;乙组未使用金属催化剂。研究结果显示,只有甲组得到的产品能催化反应①。
根据上述信息,甲、乙两组合成的产品催化性能出现差异的原因是____________。
18.(13分)
全球对锂资源的需求不断增长,“盐湖提锂”越来越受到重视。某兴趣小组取盐湖水进行浓缩和初步除杂后,得到浓缩卤水(含有和少量),并设计了以下流程通过制备碳酸锂来提取锂。
时相关物质的参数如下:
的溶解度:
化合物
回答下列问题:
(1)“沉淀1”为____________。
(2)向“滤液1”中加入适量固体的目的是____________。
(3)为提高的析出量和纯度,“操作A”依次为____________、____________、洗涤。
(4)有同学建议用“侯氏制碱法”的原理制备。查阅资料后,发现文献对常温下的有不同的描述:①是白色固体;②尚未从溶液中分离出来。为探究的性质,将饱和溶液与饱和溶液等体积混合,起初无明显变化,随后溶液变浑浊并伴有气泡冒出,最终生成白色沉淀。上述现象说明,在该实验条件下____________(填“稳定”或“不稳定”),有关反应的离子方程式为____________。
(5)他们结合(4)的探究结果,拟将原流程中向“滤液2”加入改为通入。这一改动能否达到相同的效果,作出你的判断并给出理由____________。
19.(14分)
自发热材料在生活中的应用日益广泛。某实验小组为探究“”体系的发热原理,在隔热装置中进行了下表中的五组实验,测得相应实验体系的温度升高值()随时间(t)的变化曲线,如图所示。
实验编号 反应物组成
a 粉末
b 粉
c 粉 饱和石灰水
d 粉 石灰乳
e 粉 粉末
回答下列问题:
(1)已知:
①
②
③
则的____________。
(2)温度为T时,,则饱和溶液中____________(用含x的代数式表示)。
(3)实验a中,后基本不变,原因是____________。
(4)实验b中,的变化说明粉与在该条件下____________(填“反应”或“不反应”)。实验c中,前的有变化,其原因是____________;后基本不变,其原因是____________微粒的量有限。
(5)下列说法不能解释实验d在内温度持续升高的是____________(填标号)。
A.反应②的发生促使反应①平衡右移 B.反应③的发生促使反应②平衡右移
C.气体的逸出促使反应③向右进行 D.温度升高导致反应速率加快
(6)归纳以上实验结果,根据实验e的特征,用文字简述其发热原理____________。
湖北省2022年普通高中学业水平选择性考试
化学参考答案
选择题
1. B 2. A 3. B 4. C 5. B 6. C 7. A 8. B 9. B 10. A 11. C 12. D 13. D 14. D 15. D
二、非选择题
16. (1)①. 圆底烧瓶 ②. b
(2)干燥气体 (3)溶液沿毛细管上升
(4)使溶液受热均匀 (5)磷酸晶体
(6)C (7)磷酸可与水分子间形成氢键
17. (1)取代反应(或酯化反应)
(2)5 (3)
(4) ①. 酯基 ②. 碳碳双键
(5)5 (6)45.92%
(7)甲组使用的Pd催化剂未完全除尽,继续催化反应①
18. (1)Mg(OH)2
(2)将转化成CaCO3沉淀除去,同时不引入新杂质
(3) ①. 蒸发浓缩 ②. 趁热过滤
(4) ①. 不稳定 ②. Li+ + HCO = LiHCO3,2LiHCO3 = Li2CO3↓ + CO2↑+ H2O
(5)能达到相同效果,因为改为通入过量的,则LiOH转化为LiHCO3,结合(4)的探究结果,LiHCO3也会很快分解产生Li2CO3,所以这一改动能达到相同的效果
19. (1)-911.9
(2)mol L-1
(3)Ca(OH)2在水中的溶解度小,反应①达到了平衡状态
(4) ①. 不反应 ②. Al和溶液中的OH-发生了反应 ③. OH- (5)A
(6)实验e中,发生反应①、②和③,反应③中有气体生成,气体的逸出促使反应③向右进行,反应③的发生使得溶液中OH-的浓度减小,促使反应②平衡右移,反应②的发生促使反应①平衡右移,这三步反应都是放热反应,温度升高导致反应速率加快
化学
本试卷共8页,19题。全卷满分100分。考试用时75分钟。
★祝考试顺利★
注意事项:
1.答题前,先将自己的姓名、准考证号、考场号、座位号填写在试卷和答题卡上,并认真核准准考证号条形码上的以上信息,将条形码粘贴在答题卡上的指定位置。
2.请按题号顺序在答题卡上各题目的答题区域内作答,写在试卷、草稿纸和答题卡上的非答题区域均无效。
3.选择题用2B铅笔在答题卡上把所选答案的标号涂黑;非选择题用黑色签字笔在答题卡上作答;字体工整,笔迹清楚。
4.考试结束后,请将试卷和答题卡一并上交。
可能用到的相对原子质量:H 1 Li 7 C 12 O 16 Mg 24 Al 27 Ca 40
本卷涉及的实验均须在专业人士指导和安全得到充分保障的条件下完成。
一、选择题:本题共15小题,每小题3分,共45分。在每小题给出的四个选项中,只有一项是符合题目要求的。
1.化学与生活密切相关,下列不涉及化学变化的是( )
A.加入明矾后泥水变澄清 B.北京冬奥会用水快速制冰
C.炖排骨汤时加点醋味道更鲜 D.切开的茄子放置后切面变色
2.莲藕含多酚类物质,其典型结构简式如图所示。下列有关该类物质的说法错误的是( )
A.不能与溴水反应 B.可用作抗氧化剂
C.有特征红外吸收峰 D.能与发生显色反应
3.武当山金殿是铜铸鎏金大殿。传统鎏金工艺是将金溶于汞中制成“金汞漆”,涂在器物表面,然后加火除汞,使金附着在器物表面。下列说法错误的是( )
A.鎏金工艺利用了汞的挥发性 B.鎏金工艺中金发生了化学反应
C.鎏金工艺的原理可用于金的富集 D.用电化学方法也可实现铜上覆金
4.下列各组离子在给定溶液中能大量共存的是( )
A.在氨水中:
B.在氯化钠溶液中:
C.在醋酸溶液中:
D.在硝酸银溶液中:
5.化学物质与生命过程密切相关,下列说法错误的是( )
A.维生素C可以还原活性氧自由基 B.蛋白质只能由蛋白酶催化水解
C.淀粉可用为原料人工合成 D.核酸可视为核苷酸的聚合产物
6.下列实验装置(部分夹持装置略)或现象错误的是( )
A.滴入酚酞溶液 B.吸氧腐蚀 C.钠的燃烧 D.石蜡油的热分解
7.在高温高压下可转变为具有一定导电性、高硬度的非晶态碳玻璃。下列关于该碳玻璃的说法错误的是( )
A.具有自范性 B.与互为同素异形体
C.含有杂化的碳原子 D.化学性质与金刚石有差异
8.硫代碳酸钠能用于处理废水中的重金属离子,可通过如下反应制备:
下列说法正确的是( )
A.不能被氧化 B.溶液显碱性
C.该制备反应是熵减过程 D.的热稳定性比的高
9.某立方卤化物可用于制作光电材料,其晶胞结构如图所示。下列说法错误的是( )
A.的配位数为6 B.与距离最近的是
C.该物质的化学式为 D.若换为,则晶胞棱长将改变
10.和的电荷与半径之比相近,导致两元素性质相似。下列说法错误的是( )
A.与都能在水中与氨形成配合物
B.和的熔点都比的低
C.和均可表现出弱酸性
D.和的氢化物都不能在酸中稳定存在
11.磷酰三叠氮是一种高能分子,结构简式为。下列关于该分子的说法正确的是( )
A.为非极性分子 B.立体构型为正四面体形
C.加热条件下会分解并放出 D.分解产物的电子式为
12.根据酸碱质子理论,给出质子的物质是酸,给出质子的能力越强,酸性越强。
已知:
下列酸性强弱顺序正确的是( )
A. B.
C. D.
13.同位素示踪是研究反应机理的重要手段之一。已知醛与在酸催化下存在如下平衡:。据此推测,对羟基苯甲醛与10倍量的在少量酸催化下反应,达到平衡后,下列化合物中含量最高的是( )
A. B. C. D.
14.含磷有机物应用广泛。电解法可实现由白磷直接制备,过程如图所示(为甲基)。下列说法正确的是( )
A.生成,理论上外电路需要转移电子
B.阴极上的电极反应为:
C.在电解过程中向铂电极移动
D.电解产生的中的氢元素来自于
15.下图是亚砷酸和酒石酸混合体系中部分物种的图(浓度:总为,总T为)。下列说法错误的是( )
A.的为
B.的酸性比的强
C.时,的浓度比的高
D.时,溶液中浓度最高的物种为
二、非选择题:本题共4小题,共55分。
16.(14分)
高技术领域常使用高纯试剂。纯磷酸(熔点为,易吸潮)可通过市售85%磷酸溶液减压蒸馏除水、结晶除杂得到,纯化过程需要严格控制温度和水分,温度低于易形成(熔点为),高于则发生分子间脱水生成焦磷酸等。某兴趣小组为制备磷酸晶体设计的实验装置如下(夹持装置略):
回答下列问题:
(1)A的名称是____________。B的进水口为____________(填“a”或“b”)。
(2)的作用是____________。
(3)空气流入毛细管的主要作用是防止____________,还具有搅拌和加速水逸出的作用。
(4)升高温度能提高除水速度,实验选用水浴加热的目的是____________。
(5)磷酸易形成过饱和溶液,难以结晶,可向过饱和溶液中加入____________促进其结晶。
(6)过滤磷酸晶体时,除了需要干燥的环境外,还需要控制温度为____________(填标号)。
A. B. C.
(7)磷酸中少量的水极难除去的原因是____________。
17.(14分)
化合物F是制备某种改善睡眠药物的中间体,其合成路线如下:
回答下列问题:
(1)的反应类型是____________。
(2)化合物B核磁共振氢谱的吸收峰有____________组。
(3)化合物C的结构简式为____________。
(4)的过程中,被还原的官能团是____________,被氧化的官能团是____________。
(5)若只考虑氟的位置异构,则化合物F的同分异构体有____________种。
(6)已知、和的产率分别为70%、82%和80%,则的总产率为____________。
(7)配合物可催化转化中键断裂,也能催化反应①:
反应①:
为探究有机小分子催化反应①的可能性,甲、乙两个研究小组分别合成了有机小分子(结构如下图所示)。在合成的过程中,甲组使用了催化剂,并在纯化过程中用沉淀剂除;乙组未使用金属催化剂。研究结果显示,只有甲组得到的产品能催化反应①。
根据上述信息,甲、乙两组合成的产品催化性能出现差异的原因是____________。
18.(13分)
全球对锂资源的需求不断增长,“盐湖提锂”越来越受到重视。某兴趣小组取盐湖水进行浓缩和初步除杂后,得到浓缩卤水(含有和少量),并设计了以下流程通过制备碳酸锂来提取锂。
时相关物质的参数如下:
的溶解度:
化合物
回答下列问题:
(1)“沉淀1”为____________。
(2)向“滤液1”中加入适量固体的目的是____________。
(3)为提高的析出量和纯度,“操作A”依次为____________、____________、洗涤。
(4)有同学建议用“侯氏制碱法”的原理制备。查阅资料后,发现文献对常温下的有不同的描述:①是白色固体;②尚未从溶液中分离出来。为探究的性质,将饱和溶液与饱和溶液等体积混合,起初无明显变化,随后溶液变浑浊并伴有气泡冒出,最终生成白色沉淀。上述现象说明,在该实验条件下____________(填“稳定”或“不稳定”),有关反应的离子方程式为____________。
(5)他们结合(4)的探究结果,拟将原流程中向“滤液2”加入改为通入。这一改动能否达到相同的效果,作出你的判断并给出理由____________。
19.(14分)
自发热材料在生活中的应用日益广泛。某实验小组为探究“”体系的发热原理,在隔热装置中进行了下表中的五组实验,测得相应实验体系的温度升高值()随时间(t)的变化曲线,如图所示。
实验编号 反应物组成
a 粉末
b 粉
c 粉 饱和石灰水
d 粉 石灰乳
e 粉 粉末
回答下列问题:
(1)已知:
①
②
③
则的____________。
(2)温度为T时,,则饱和溶液中____________(用含x的代数式表示)。
(3)实验a中,后基本不变,原因是____________。
(4)实验b中,的变化说明粉与在该条件下____________(填“反应”或“不反应”)。实验c中,前的有变化,其原因是____________;后基本不变,其原因是____________微粒的量有限。
(5)下列说法不能解释实验d在内温度持续升高的是____________(填标号)。
A.反应②的发生促使反应①平衡右移 B.反应③的发生促使反应②平衡右移
C.气体的逸出促使反应③向右进行 D.温度升高导致反应速率加快
(6)归纳以上实验结果,根据实验e的特征,用文字简述其发热原理____________。
湖北省2022年普通高中学业水平选择性考试
化学参考答案
选择题
1. B 2. A 3. B 4. C 5. B 6. C 7. A 8. B 9. B 10. A 11. C 12. D 13. D 14. D 15. D
二、非选择题
16. (1)①. 圆底烧瓶 ②. b
(2)干燥气体 (3)溶液沿毛细管上升
(4)使溶液受热均匀 (5)磷酸晶体
(6)C (7)磷酸可与水分子间形成氢键
17. (1)取代反应(或酯化反应)
(2)5 (3)
(4) ①. 酯基 ②. 碳碳双键
(5)5 (6)45.92%
(7)甲组使用的Pd催化剂未完全除尽,继续催化反应①
18. (1)Mg(OH)2
(2)将转化成CaCO3沉淀除去,同时不引入新杂质
(3) ①. 蒸发浓缩 ②. 趁热过滤
(4) ①. 不稳定 ②. Li+ + HCO = LiHCO3,2LiHCO3 = Li2CO3↓ + CO2↑+ H2O
(5)能达到相同效果,因为改为通入过量的,则LiOH转化为LiHCO3,结合(4)的探究结果,LiHCO3也会很快分解产生Li2CO3,所以这一改动能达到相同的效果
19. (1)-911.9
(2)mol L-1
(3)Ca(OH)2在水中的溶解度小,反应①达到了平衡状态
(4) ①. 不反应 ②. Al和溶液中的OH-发生了反应 ③. OH- (5)A
(6)实验e中,发生反应①、②和③,反应③中有气体生成,气体的逸出促使反应③向右进行,反应③的发生使得溶液中OH-的浓度减小,促使反应②平衡右移,反应②的发生促使反应①平衡右移,这三步反应都是放热反应,温度升高导致反应速率加快
同课章节目录
