高二图象在化学平衡中的应用
文档属性
| 名称 | 高二图象在化学平衡中的应用 |

|
|
| 格式 | zip | ||
| 文件大小 | 182.4KB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(新课程标准) | ||
| 科目 | 化学 | ||
| 更新时间 | 2013-08-06 08:20:44 | ||
图片预览







文档简介
课件53张PPT。图象在化学平衡中的应用可逆反应:
mA(g)+nB(g) pC(g) +qD(g)
在一定条件下建立平衡时, V正=V逆、
c(A)、c(B)、c(C)、c(D)保持不变。
当外界条件改变时:
V正、V逆会发生变化,变化后,
若V正=V逆时 ,平衡不移动;
若V正>V逆时,平衡向右移动;
若当V正<V逆时,平衡向左移动。
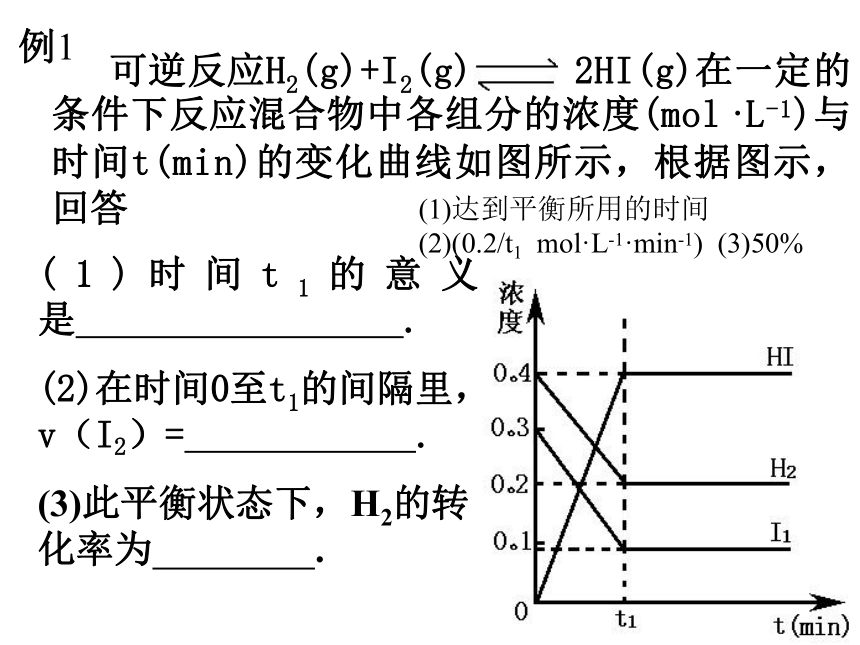
通过比较新的V正、V逆的相对大小,便可确定化学平衡移动的方向。 在化学平衡建立及移动的过程中 有关量会随时间及条件的变化而发生相应的变化,可以用图象将其表示出来。一、n – t 图(物质的量随时间变化的图象) 可逆反应H2(g)+I2(g) 2HI(g)在一定的条件下反应混合物中各组分的浓度(mol·L-1)与时间t(min)的变化曲线如图所示,根据图示,回答 (1)时间t1的意义是 .
(2)在时间0至t1的间隔里,v(I2)= .
(3)此平衡状态下,H2的转化率为 . (1)达到平衡所用的时间 (2)(0.2/t1 mol·L-1·min-1) (3)50% 例1练习1 一定温度下,容器内某一化学反应中M、N
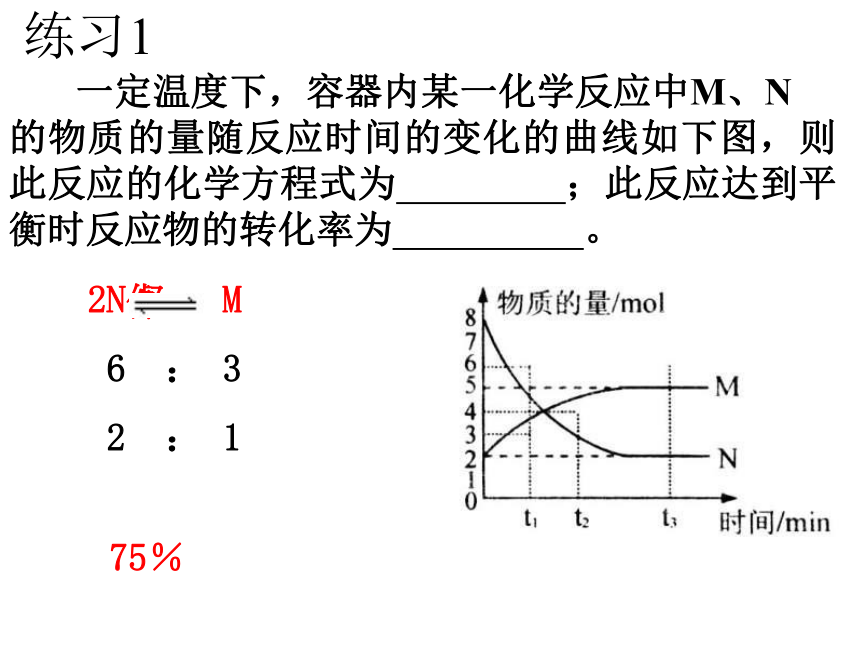
的物质的量随反应时间的变化的曲线如下图,则此反应的化学方程式为 ;此反应达到平衡时反应物的转化率为 。75%2N? M
6 : 3
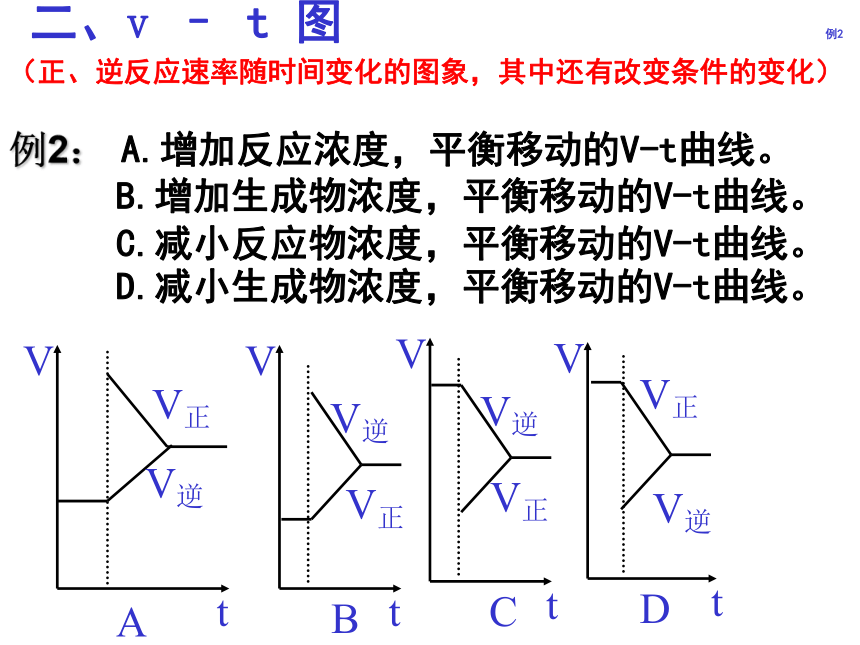
2 : 1二、v – t 图 例2 例2: A.增加反应浓度,平衡移动的V-t曲线。B.增加生成物浓度,平衡移动的V-t曲线。C.减小反应物浓度,平衡移动的V-t曲线。D.减小生成物浓度,平衡移动的V-t曲线。(正、逆反应速率随时间变化的图象,其中还有改变条件的变化)说明 上述图象的特点是有一速率改变,随后正逆反应速率再发生变化,直至两者相等建立新的平衡。是改变某一物质浓度而引起化学平衡移动的特征。二、v – t 图 练习2练习2在密闭容器,一定条件下进行反应,
mA(g)+nB(g) pC(g)+qD(g)
若增大压强或升高温度,重新达到平衡,变化过程均如图所示,则对该反应叙述正确的是( )
A.正反应是吸热反应
B.逆反应是吸热反应
C.m+n>p+q
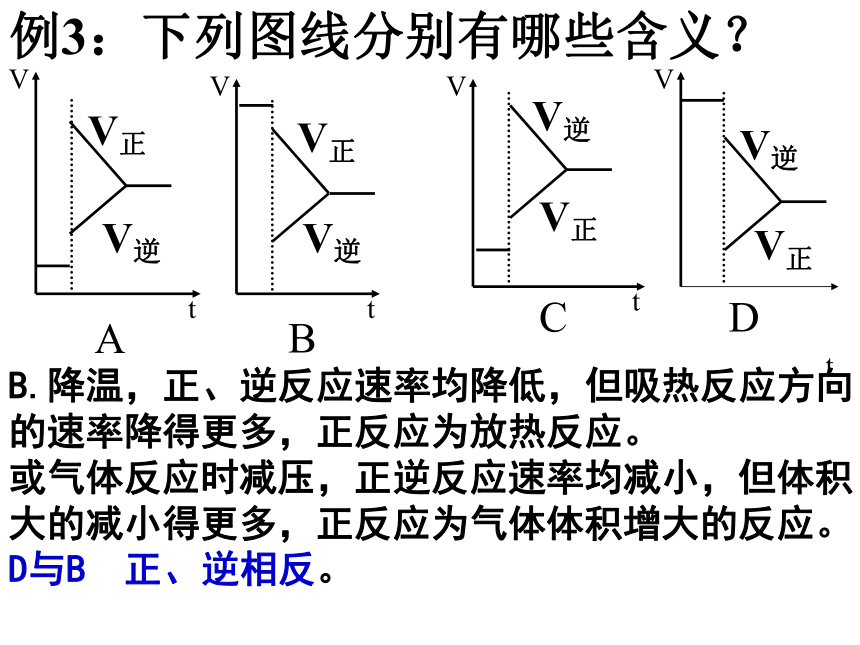
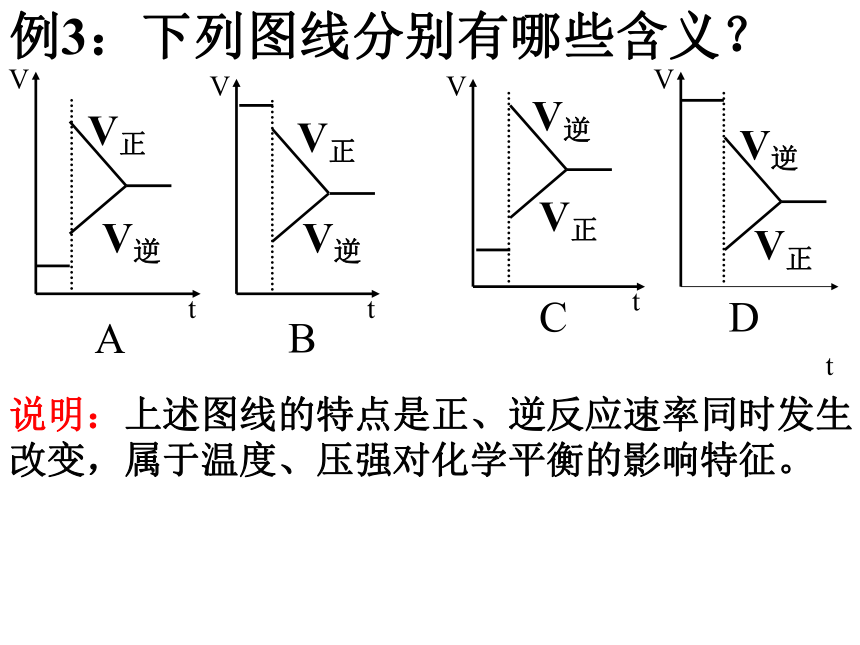
D.m+nBD 例3:下列图线分别有哪些含义?tA.升温时,正、逆反应速率均增大,但吸热反应方向的速率增得更多,正反应为吸热反应;
或气体反应时增压,正逆反应速率均增大,但气体体积大的增大得更多,正反应为气体缩小的反应。
C与A 正、逆相反。例3:下列图线分别有哪些含义?tB.降温,正、逆反应速率均降低,但吸热反应方向的速率降得更多,正反应为放热反应。
或气体反应时减压,正逆反应速率均减小,但体积大的减小得更多,正反应为气体体积增大的反应。
D与B 正、逆相反。例3:下列图线分别有哪些含义?t说明:上述图线的特点是正、逆反应速率同时发生改变,属于温度、压强对化学平衡的影响特征。
例4:请画出压强、催化剂对化学平衡影响的V-t曲线。答案:压强对化学平衡的影响的V-t曲线为:A、B为反应前后气体体积不等时的增压、减压的情况;C、D为反应前后气体体积不变的反应,压强增加、减小时的情况。催化剂对化学平衡不产生影响,但速率会发生变化,,图象与C、D相同,一般选用正催化剂,C图。说明:1.由于压强只对气体的反应速率有影响,所以当反应前后的气体体积不变时,压强对正、逆反应的影响是相同的;当反应前后的气体体积不同时,压强对气体体积大的影响较大,即增加或减少的影响都较大。
2.由于催化剂能够同等程度地增加或降低正、逆反应速率,故而对化学平衡的移动没有影响,不能改变平衡状态反应混合物的组成,仅能改变反应达到平衡所需的时间!所以催化剂对化学平衡无影响。 右图表示在密闭容器中反应:2SO2+O2 2SO3+Q达到平衡时 ,由于条件改变而引起反应速度和化学平衡的变化情况,a?b过程中改变的条件可能是 ;bc过程中改变的条件可能是 ; 若增大压强时,反应速度变化情况画在c—d处. 升温练习3减小[SO3] 三、x% – t 图 x% (或用φ(C) 表示) 可以表示反应物、生成物在反应体系中的物质的量百分数(体积分数)、或表示反应物的转化率等;
t表示时间;
同时还有不同条件(如温度、压强的不同)。例5:答案: A为由反应物向生成物转化并最终形成化学平衡的过程; B为由生成物向反应物转化并最终形成化学平衡的过程; C为先以逆反应为主,后发生化学平衡向正反应的移动; D则相反,先以正反应为主,后化学平衡向逆反应移动。说明:转化率与百分含量的情况恰好相反。例6:某逆反应为:A(g)+B(g) 3C(g),下图中的甲、乙、丙分别表示在不同条件下,生成物C在反应混合物中的体积分数 φ(C)与反应时间t的关系。 ⑴若图甲中的a、b两条曲线分别表示有催化剂和无催化剂的情况,则曲线 表示的是无催化剂时的情况(催化剂一般是指正催化剂)。 ⑵若图乙中的两条曲线分别表示在100℃和200℃时的情况,则可逆反应的正反应是 (填“吸热”或“放热”)反应。T1 ________T2(填“大于”或“小于”) ⑶若图丙中的a、b两条曲线分别表示在不同压强时的情况,则曲线 表示的是压强较大时的情况。b吸热b大于练习4:反应2X(g)+Y(g) 2Z(g)(正反应为放热反应)在不同(T1和T2)温度及不同压强(p1和p2)下,产物Z的物质的量n(Z)与反应时间t的关系如图所示。下述判断正确的是( ) A.T1p2
C.T1>T2,p1>p2
D.T1>T2,p1 T、P分别表示温度、压强。
对于反应 mA(g)+nB(g) pC(g)+qD(g)+Q由下列图象能分析得出什么结论?正反应是吸热反应m+n>p+q正反应是放热反应m+np+q例7:如图所示,反应X(g)+3Y(g) 2Z(g) (正反应为放热反应),在不同温度、不同压强(p1>p2)下达到平衡时,混合气体中Z的体积分数φ(Z)随温度变化的曲线应为( )
C练习6 某可逆反应绘出图像如图,纵坐标为生成物在平衡混合物中的百分含量,下列对该反应的判断正确的是 ( )
A.反应物中一定有气体
B.生成物中一定有气体
C.正反应一定是放热反应
D.正反应一定是吸热反应BD 综合练习 练习7100℃200℃V正V逆CD问题: 如果A%为百分含量,则由图A能否判断:T1与T2,P1与P2,n+m和p+q的相对大小;正反应为放热反应还是吸热反应? 由图B能否判断:P1与P2,n+m和p+q的相对大小及Q是否大于0? 由图C能否判断n+m和p+q的相对大小及正反应是否放热等? 由图D判断n+m和p+q的相对大小?综合练习 练习7100℃200℃V正V逆CDA图可通过看斜率的大小确定反应速率的大小,通常斜率越大,其反应速率也越大,所以A中T2大于T1,P2大于P1;因A%为百分含量,所以n+mp+q;
A%为百分含量, 则由C图知,正反应为放热反应(当压强相同时,升温A%增大,平衡向左移动,见虚线)、 n+m 运用各种图像能直观地反映可逆反应的变化规律及特点,
能从定性和定量两方面来分析和研究变化的因素、方向
和程度。
二.方法:
1)分析图像:
一看面:即看清坐标所代表的量的意义。
二看线:看准线的走向变化趋势,增减性及量的变化 。
(需作辅助线、等温线、等压线等)
三看点:弄懂曲线上点的意义,特别是一些特殊点。
(如起点、交点、转折点、极值点是否过原点等。)
2)联想规律:即联想外界条件对化学反应速率和化学平衡的影响
规律。
3)作出判断:依据题意仔细分析,作出正确定判断。
3.图像的类型
1)反应速率(v)——时间(t)图像
在平衡的某时刻 t1改变某一条件前后, v正、v逆的变化有两种
情况:
a. v正、v逆同时突变——温度、压强、催化剂的影响。
b. v正、v逆之一渐变——一种成份浓度的影响。2)横坐标——时间
纵坐标——某物质浓度、某成分的百分含量、某反应物的转化率3)横坐标——温度、压强
纵坐标——某物质浓度、某成分的百分含量、某反应物的转化率[ 举例 ][ 举例 ][ 举例 ][ 练习 ]例1. 如图是某合成氨反应时的反应速率随时间的变化曲线:
(1) t0时反应从哪方开始?向哪个方向进行?
(2) t1、 t2 、 t3时刻分别改变了什么条件?
平衡移动的方向怎样?例2. 如图所示,a曲线表示一定条件下可逆反应,
X(g) + Y(g) 2Z(g) + W(s) + Q 的反应过程中X的转化率
和时间的关系。若使a曲线变为b曲线,可采取的措施是 ( )
A.加入催化剂 B.增大Y的浓度
C.降低温度 D.增大体系压例3.可逆反应N2 + 3H2 2NH3 (正反应是放热),从反应开始
经t1秒达平衡状态,因条件改变,平衡在t2秒时发生移动,在t3
秒时,又达到新的平衡状态。试根据t2 ~ t3 秒曲线判断,下列
图1、图2所表示的平衡移动方向和变化条件各是什么?例4.在某容积一定的密闭容器中,可逆反应:
A(g) + B(g) XC(g) + Q,符合下列图象(1)所示关系。由此
推断对图象(Ⅱ)的正确说法是 ( )
A.P3>P4,Y轴表示A的转化率
B.P3>P4,Y轴表示B的百分含量
C.P3>P4 ,Y轴表示混合气体的密度
D.P3>P4 ,Y轴表示混合气体的平均相对分子质量 A
B例5.在容积相同的五个密闭容器中分别放人同量的A2和B2,在不同
温度下同时任其发生反应:A2(g) + 3B2(g) 2AB3(g)。分别
在某一同时刻测得其中AB3所占的体积分数变化如图所示,
下列说法中不正确的是 ( ) A.正反应是放热反应
B.E、F二点尚未达到平衡 C.H、I二点尚未达到平衡
D.G、H、I三点可能已达平衡状态例6. mA(固) + nB(g) wC(g) + Q (Q>0)的可逆反应,在恒温的
条件下B的百分含量(B%)与压强P的关系如图所示,有关叙述
正确的是 ( )
A.m + n < w
B.n > w
C.X点时混合物的v正 > v逆
D.X点比Y点混合物的反应速率慢例7. 用来表示可逆反应2A(g) + B(g) 2C(g) + Q ( Q>0 ),
正确图像是图中的 ( ) 等效平衡专题复习一. 等效平衡 在一定条件下(定温、定容或定温、定压),对同一可逆反应,只要起始时加入物质的物质的量不同,而达到化学平衡时,同种物质的百分含量相同,这样的平衡称为等效平衡。 二. 等效平衡的规律 1. 在定温、定容条件下,对于反应前后气体分子数不等的可逆反应,只改变起始时加入物质的物质的量,如通过可逆反应的化学计量数比换算成同一边物质的物质的量与原平衡相同,则两平衡等效。 例1. 在一个固定容积的密闭容器中,加入2molA和1molB,发生反应 2A(g)+B(g) 3C(g)+D(g),达到平衡时,C的浓度为cmol/L,若维持容器的容积和温度不变,按下列4种配比作为起始物质,达到平衡时,C的浓度仍为cmol/L的是( )。 A.4molA+2molB B.1molA+0.5molB+1.5molC+1molDC.2molC+1molD+1molB D.3molC+1molD2. 在定温、定容条件下,对于反应前后气体分子数不变的可逆反应,只要反应物(或生成物)的物质的量比例与原平衡的相同,则两平衡等效。 例2. 将装有1molHI的容器密封并加热,部分HI分解成H2和I2(g)并达到化学平衡。此时I2(g)的体积分数为x%,若在该容器中加入2molHI后密封,加热到相同温度使之达到平衡,设此时I2的体积分数为y%,则x与y的关系为( )。 A.x>y B.xy3. 在定温、定压条件下,改变起始时加入物质的物质的量,只要按化学计量数换算成同一边的物质的量之比与原平衡相同,则达到平衡后与原平衡等效。 1、将2molSO2和2molSO3 气体混合于固定体积的密闭容器中,在一定条件下发生反应:2SO2(气)+O2(气) 2SO3 (气),平衡时SO3为n mol。相同温度下,分别按下列配比在相同体积的密闭容器中加入起始物质,平衡时SO3的物质的量大于n mol的是( )
2mol SO2+1 molO2
B.4molSO2+1molO2
C. 2molSO2+1molO2+2molSO3
D.3molSO2+1molO2+1molSO3C D2、在一定温度下,把2molSO2和1molO2通入一个一定容积的密闭容器里,发生如下反应:2SO2+O2 2SO3,当此反应进行到一定程度时,反应混合物就处于化学平衡状态。现在该容器中,维持温度不变,令a、b、c分别代表初始加入的SO2、O2、SO3的物质的量。如果a、b、c取不同的数值,它们必须满足一定的相互关系,才能保证达到平衡时,反应混合物中三种气体的百分含量仍跟上述平衡时的完全相同。请填写下列空白:
(1)若a=0,b=0,则c=----。(2)若a=0.5,则b=----和c=----。(3)a、b、c取值必须满足的一般条件是(请用两个方程式表示,其中一个只含a 和c,另一个只含b和c): ---------------------.20.251.5a+c=2 2b+c=23、在一个固定容积的密闭容器中,加入m molA,n molB发生下列反应:mA(气)+n B(气) pC(气) 平衡时C的浓度为Wmol/L,若容器体积和温度不变,起始时放入amolA,bmolB,c molC,若要平衡后C的浓度仍为Wmol/L,则a、b、c可以满足的关系是( )。
a:b:c=m:n:p
a:b=m:n, ap/m+c=p
C. mc/p+a=m, nc/p+b=n
D. a=m/3, b=n/3, c=2p/3B C4、一定温度下将a molPCl5通入一个容积不变的反应器中,达到如下平衡:PCl5(g) PCl3(g)+Cl2(g)。测得平衡混合气体的压强为P1,此时反应器中再通入a molPCl5,在温度不变情况下再度达到平衡,测得压强为P2。测得P1和P2的关系是( )
(A)2P1>P2 (B) 2P1=P2 (C)2P1 3A(气)+2B(气) xC(气)+yD(气)
达到平衡时,C的体积分数为m%。若维持温度压强不变,将0.6LA 0.4LB4LC0.8LD作为起始物质充入密闭容器中,达到平衡时C的体积分数仍为m%,则的值分别为
A x=3 y=1 B x=4 y=1
C x=5 y =1 D x=10 y=2 C D6、某温度下,向某密闭容器中加入1molN2和3molH2,使之反应合成NH3,平衡后测得NH3的体积分数为m。若T不变,只改变起始加入量,使之反应平衡后NH3的体积分数仍为m,若N2、H2、NH3的加入量用X、Y、Z表示应满足:
(1)恒定T、V:
[1]若X=0,Y=0,则Z=-----------。
[2]若X=0.75,Y=----------,Z=----------。
[3]X、Y、Z应满足的一般条件是------------------------------。
(2)恒定T、P:
[1]若X=0、Y=0,则Z--------。
[2]若X=0.75,则Y--------------,Z---------。
[3]X、Y、Z应满足的一般条件是----------------。2mol2.25mol0.5molY=3X,X+Y+2Z=4>0=2.25mol>=0Y=3X,Z>=0X+Z/2=1 , Y+3Z/2=37、在一固定容积的密闭容器中充入2molA和1molB,发生反应:2A(气)+B(气) xC(气),达到平衡后,C的体积分数为W%。若维持容器体积和温度不变,按0.6molA、0.3molB和1.4molC为起始物质,达到平衡后,C的体积分数仍为W%,则x值为( )
A、1 B、2 C、3 D、4B C
当外界条件改变时:
V正、V逆会发生变化,变化后,
若V正=V逆时 ,平衡不移动;
若V正>V逆时,平衡向右移动;
若当V正<V逆时,平衡向左移动。
通过比较新的V正、V逆的相对大小,便可确定化学平衡移动的方向。 在化学平衡建立及移动的过程中 有关量会随时间及条件的变化而发生相应的变化,可以用图象将其表示出来。一、n – t 图(物质的量随时间变化的图象) 可逆反应H2(g)+I2(g) 2HI(g)在一定的条件下反应混合物中各组分的浓度(mol·L-1)与时间t(min)的变化曲线如图所示,根据图示,回答 (1)时间t1的意义是 .
(2)在时间0至t1的间隔里,v(I2)= .
(3)此平衡状态下,H2的转化率为 . (1)达到平衡所用的时间 (2)(0.2/t1 mol·L-1·min-1) (3)50% 例1练习1 一定温度下,容器内某一化学反应中M、N
的物质的量随反应时间的变化的曲线如下图,则此反应的化学方程式为 ;此反应达到平衡时反应物的转化率为 。75%2N? M
6 : 3
2 : 1二、v – t 图 例2 例2: A.增加反应浓度,平衡移动的V-t曲线。B.增加生成物浓度,平衡移动的V-t曲线。C.减小反应物浓度,平衡移动的V-t曲线。D.减小生成物浓度,平衡移动的V-t曲线。(正、逆反应速率随时间变化的图象,其中还有改变条件的变化)说明 上述图象的特点是有一速率改变,随后正逆反应速率再发生变化,直至两者相等建立新的平衡。是改变某一物质浓度而引起化学平衡移动的特征。二、v – t 图 练习2练习2在密闭容器,一定条件下进行反应,
mA(g)+nB(g) pC(g)+qD(g)
若增大压强或升高温度,重新达到平衡,变化过程均如图所示,则对该反应叙述正确的是( )
A.正反应是吸热反应
B.逆反应是吸热反应
C.m+n>p+q
D.m+n
或气体反应时增压,正逆反应速率均增大,但气体体积大的增大得更多,正反应为气体缩小的反应。
C与A 正、逆相反。例3:下列图线分别有哪些含义?tB.降温,正、逆反应速率均降低,但吸热反应方向的速率降得更多,正反应为放热反应。
或气体反应时减压,正逆反应速率均减小,但体积大的减小得更多,正反应为气体体积增大的反应。
D与B 正、逆相反。例3:下列图线分别有哪些含义?t说明:上述图线的特点是正、逆反应速率同时发生改变,属于温度、压强对化学平衡的影响特征。
例4:请画出压强、催化剂对化学平衡影响的V-t曲线。答案:压强对化学平衡的影响的V-t曲线为:A、B为反应前后气体体积不等时的增压、减压的情况;C、D为反应前后气体体积不变的反应,压强增加、减小时的情况。催化剂对化学平衡不产生影响,但速率会发生变化,,图象与C、D相同,一般选用正催化剂,C图。说明:1.由于压强只对气体的反应速率有影响,所以当反应前后的气体体积不变时,压强对正、逆反应的影响是相同的;当反应前后的气体体积不同时,压强对气体体积大的影响较大,即增加或减少的影响都较大。
2.由于催化剂能够同等程度地增加或降低正、逆反应速率,故而对化学平衡的移动没有影响,不能改变平衡状态反应混合物的组成,仅能改变反应达到平衡所需的时间!所以催化剂对化学平衡无影响。 右图表示在密闭容器中反应:2SO2+O2 2SO3+Q达到平衡时 ,由于条件改变而引起反应速度和化学平衡的变化情况,a?b过程中改变的条件可能是 ;bc过程中改变的条件可能是 ; 若增大压强时,反应速度变化情况画在c—d处. 升温练习3减小[SO3] 三、x% – t 图 x% (或用φ(C) 表示) 可以表示反应物、生成物在反应体系中的物质的量百分数(体积分数)、或表示反应物的转化率等;
t表示时间;
同时还有不同条件(如温度、压强的不同)。例5:答案: A为由反应物向生成物转化并最终形成化学平衡的过程; B为由生成物向反应物转化并最终形成化学平衡的过程; C为先以逆反应为主,后发生化学平衡向正反应的移动; D则相反,先以正反应为主,后化学平衡向逆反应移动。说明:转化率与百分含量的情况恰好相反。例6:某逆反应为:A(g)+B(g) 3C(g),下图中的甲、乙、丙分别表示在不同条件下,生成物C在反应混合物中的体积分数 φ(C)与反应时间t的关系。 ⑴若图甲中的a、b两条曲线分别表示有催化剂和无催化剂的情况,则曲线 表示的是无催化剂时的情况(催化剂一般是指正催化剂)。 ⑵若图乙中的两条曲线分别表示在100℃和200℃时的情况,则可逆反应的正反应是 (填“吸热”或“放热”)反应。T1 ________T2(填“大于”或“小于”) ⑶若图丙中的a、b两条曲线分别表示在不同压强时的情况,则曲线 表示的是压强较大时的情况。b吸热b大于练习4:反应2X(g)+Y(g) 2Z(g)(正反应为放热反应)在不同(T1和T2)温度及不同压强(p1和p2)下,产物Z的物质的量n(Z)与反应时间t的关系如图所示。下述判断正确的是( ) A.T1
对于反应 mA(g)+nB(g) pC(g)+qD(g)+Q由下列图象能分析得出什么结论?正反应是吸热反应m+n>p+q正反应是放热反应m+n
A.反应物中一定有气体
B.生成物中一定有气体
C.正反应一定是放热反应
D.正反应一定是吸热反应BD 综合练习 练习7100℃200℃V正V逆CD问题: 如果A%为百分含量,则由图A能否判断:T1与T2,P1与P2,n+m和p+q的相对大小;正反应为放热反应还是吸热反应? 由图B能否判断:P1与P2,n+m和p+q的相对大小及Q是否大于0? 由图C能否判断n+m和p+q的相对大小及正反应是否放热等? 由图D判断n+m和p+q的相对大小?综合练习 练习7100℃200℃V正V逆CDA图可通过看斜率的大小确定反应速率的大小,通常斜率越大,其反应速率也越大,所以A中T2大于T1,P2大于P1;因A%为百分含量,所以n+m
能从定性和定量两方面来分析和研究变化的因素、方向
和程度。
二.方法:
1)分析图像:
一看面:即看清坐标所代表的量的意义。
二看线:看准线的走向变化趋势,增减性及量的变化 。
(需作辅助线、等温线、等压线等)
三看点:弄懂曲线上点的意义,特别是一些特殊点。
(如起点、交点、转折点、极值点是否过原点等。)
2)联想规律:即联想外界条件对化学反应速率和化学平衡的影响
规律。
3)作出判断:依据题意仔细分析,作出正确定判断。
3.图像的类型
1)反应速率(v)——时间(t)图像
在平衡的某时刻 t1改变某一条件前后, v正、v逆的变化有两种
情况:
a. v正、v逆同时突变——温度、压强、催化剂的影响。
b. v正、v逆之一渐变——一种成份浓度的影响。2)横坐标——时间
纵坐标——某物质浓度、某成分的百分含量、某反应物的转化率3)横坐标——温度、压强
纵坐标——某物质浓度、某成分的百分含量、某反应物的转化率[ 举例 ][ 举例 ][ 举例 ][ 练习 ]例1. 如图是某合成氨反应时的反应速率随时间的变化曲线:
(1) t0时反应从哪方开始?向哪个方向进行?
(2) t1、 t2 、 t3时刻分别改变了什么条件?
平衡移动的方向怎样?例2. 如图所示,a曲线表示一定条件下可逆反应,
X(g) + Y(g) 2Z(g) + W(s) + Q 的反应过程中X的转化率
和时间的关系。若使a曲线变为b曲线,可采取的措施是 ( )
A.加入催化剂 B.增大Y的浓度
C.降低温度 D.增大体系压例3.可逆反应N2 + 3H2 2NH3 (正反应是放热),从反应开始
经t1秒达平衡状态,因条件改变,平衡在t2秒时发生移动,在t3
秒时,又达到新的平衡状态。试根据t2 ~ t3 秒曲线判断,下列
图1、图2所表示的平衡移动方向和变化条件各是什么?例4.在某容积一定的密闭容器中,可逆反应:
A(g) + B(g) XC(g) + Q,符合下列图象(1)所示关系。由此
推断对图象(Ⅱ)的正确说法是 ( )
A.P3>P4,Y轴表示A的转化率
B.P3>P4,Y轴表示B的百分含量
C.P3>P4 ,Y轴表示混合气体的密度
D.P3>P4 ,Y轴表示混合气体的平均相对分子质量 A
B例5.在容积相同的五个密闭容器中分别放人同量的A2和B2,在不同
温度下同时任其发生反应:A2(g) + 3B2(g) 2AB3(g)。分别
在某一同时刻测得其中AB3所占的体积分数变化如图所示,
下列说法中不正确的是 ( ) A.正反应是放热反应
B.E、F二点尚未达到平衡 C.H、I二点尚未达到平衡
D.G、H、I三点可能已达平衡状态例6. mA(固) + nB(g) wC(g) + Q (Q>0)的可逆反应,在恒温的
条件下B的百分含量(B%)与压强P的关系如图所示,有关叙述
正确的是 ( )
A.m + n < w
B.n > w
C.X点时混合物的v正 > v逆
D.X点比Y点混合物的反应速率慢例7. 用来表示可逆反应2A(g) + B(g) 2C(g) + Q ( Q>0 ),
正确图像是图中的 ( ) 等效平衡专题复习一. 等效平衡 在一定条件下(定温、定容或定温、定压),对同一可逆反应,只要起始时加入物质的物质的量不同,而达到化学平衡时,同种物质的百分含量相同,这样的平衡称为等效平衡。 二. 等效平衡的规律 1. 在定温、定容条件下,对于反应前后气体分子数不等的可逆反应,只改变起始时加入物质的物质的量,如通过可逆反应的化学计量数比换算成同一边物质的物质的量与原平衡相同,则两平衡等效。 例1. 在一个固定容积的密闭容器中,加入2molA和1molB,发生反应 2A(g)+B(g) 3C(g)+D(g),达到平衡时,C的浓度为cmol/L,若维持容器的容积和温度不变,按下列4种配比作为起始物质,达到平衡时,C的浓度仍为cmol/L的是( )。 A.4molA+2molB B.1molA+0.5molB+1.5molC+1molDC.2molC+1molD+1molB D.3molC+1molD2. 在定温、定容条件下,对于反应前后气体分子数不变的可逆反应,只要反应物(或生成物)的物质的量比例与原平衡的相同,则两平衡等效。 例2. 将装有1molHI的容器密封并加热,部分HI分解成H2和I2(g)并达到化学平衡。此时I2(g)的体积分数为x%,若在该容器中加入2molHI后密封,加热到相同温度使之达到平衡,设此时I2的体积分数为y%,则x与y的关系为( )。 A.x>y B.x
2mol SO2+1 molO2
B.4molSO2+1molO2
C. 2molSO2+1molO2+2molSO3
D.3molSO2+1molO2+1molSO3C D2、在一定温度下,把2molSO2和1molO2通入一个一定容积的密闭容器里,发生如下反应:2SO2+O2 2SO3,当此反应进行到一定程度时,反应混合物就处于化学平衡状态。现在该容器中,维持温度不变,令a、b、c分别代表初始加入的SO2、O2、SO3的物质的量。如果a、b、c取不同的数值,它们必须满足一定的相互关系,才能保证达到平衡时,反应混合物中三种气体的百分含量仍跟上述平衡时的完全相同。请填写下列空白:
(1)若a=0,b=0,则c=----。(2)若a=0.5,则b=----和c=----。(3)a、b、c取值必须满足的一般条件是(请用两个方程式表示,其中一个只含a 和c,另一个只含b和c): ---------------------.20.251.5a+c=2 2b+c=23、在一个固定容积的密闭容器中,加入m molA,n molB发生下列反应:mA(气)+n B(气) pC(气) 平衡时C的浓度为Wmol/L,若容器体积和温度不变,起始时放入amolA,bmolB,c molC,若要平衡后C的浓度仍为Wmol/L,则a、b、c可以满足的关系是( )。
a:b:c=m:n:p
a:b=m:n, ap/m+c=p
C. mc/p+a=m, nc/p+b=n
D. a=m/3, b=n/3, c=2p/3B C4、一定温度下将a molPCl5通入一个容积不变的反应器中,达到如下平衡:PCl5(g) PCl3(g)+Cl2(g)。测得平衡混合气体的压强为P1,此时反应器中再通入a molPCl5,在温度不变情况下再度达到平衡,测得压强为P2。测得P1和P2的关系是( )
(A)2P1>P2 (B) 2P1=P2 (C)2P1
达到平衡时,C的体积分数为m%。若维持温度压强不变,将0.6LA 0.4LB4LC0.8LD作为起始物质充入密闭容器中,达到平衡时C的体积分数仍为m%,则的值分别为
A x=3 y=1 B x=4 y=1
C x=5 y =1 D x=10 y=2 C D6、某温度下,向某密闭容器中加入1molN2和3molH2,使之反应合成NH3,平衡后测得NH3的体积分数为m。若T不变,只改变起始加入量,使之反应平衡后NH3的体积分数仍为m,若N2、H2、NH3的加入量用X、Y、Z表示应满足:
(1)恒定T、V:
[1]若X=0,Y=0,则Z=-----------。
[2]若X=0.75,Y=----------,Z=----------。
[3]X、Y、Z应满足的一般条件是------------------------------。
(2)恒定T、P:
[1]若X=0、Y=0,则Z--------。
[2]若X=0.75,则Y--------------,Z---------。
[3]X、Y、Z应满足的一般条件是----------------。2mol2.25mol0.5molY=3X,X+Y+2Z=4>0=2.25mol>=0Y=3X,Z>=0X+Z/2=1 , Y+3Z/2=37、在一固定容积的密闭容器中充入2molA和1molB,发生反应:2A(气)+B(气) xC(气),达到平衡后,C的体积分数为W%。若维持容器体积和温度不变,按0.6molA、0.3molB和1.4molC为起始物质,达到平衡后,C的体积分数仍为W%,则x值为( )
A、1 B、2 C、3 D、4B C
