3.1电离平衡【人教版(2019)】高中化学选修1 同步练习(含答案解析)
文档属性
| 名称 | 3.1电离平衡【人教版(2019)】高中化学选修1 同步练习(含答案解析) |

|
|
| 格式 | docx | ||
| 文件大小 | 886.1KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-07-22 16:06:11 | ||
图片预览




文档简介
中小学教育资源及组卷应用平台
3.1电离平衡人教版(2019)高中化学选择性必修一同步练习
学校:___________姓名:___________班级:___________考号:___________
注意事项:
1.答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡对应题目的答案标号涂黑;如需改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上,写在试卷上无效。
3.考试结束后,本试卷和答题卡一并交回。
第I卷(选择题)
一、单选题(本大题共7小题,共21.0分)
、、和都是强酸,它们的酸性在水溶液中差别不大。以下是某温度下这四种酸在冰醋酸中的电离常数:
酸
下列说法中不正确的是( )
A. 在冰醋酸中这四种酸都没有完全电离
B. 在冰醋酸中是这四种酸中最强的酸
C. 在冰醋酸中的电离方程式为
D. 水不能区分这四种酸的强弱,但冰醋酸可以区分这四种酸的强弱
下列说法正确的是( )
A. 室温下,向的稀氨水中加入氢氧化钠溶液,的电离平衡不移动
B. 向醋酸溶液中加入冰醋酸,醋酸电离度增大,氢离子浓度增大
C. 用等浓度的溶液分别中和等值的、溶液,消耗的体积大,说明酸性
D. 室温下,某溶液,则该溶液一定是酸或强酸弱碱盐溶液
某二元酸在水中的电离方程式为:,时,下列有关说法中正确的是( )
A. 是弱酸
B. 稀释溶液,因电离平衡向右移动而导致增大
C. 在的溶液中,
D. 若溶液中,则的中
下列叙述正确的是( )
A. 用水稀释 的氨水,则溶液中减小
B. 中和等体积、等的盐酸和醋酸,消耗的物质的量相等
C. 在等体积等浓度的盐酸和醋酸中分别加入等质量的相同锌粒,随着反应的进行,醋酸不断电离出,反应速率比盐酸大
D. 两种氨水的分别为和,物质的量浓度分别为 和,则
下列说法正确的是( )
A. 浓度为 溶液,加水稀释,则减小
B. 浓度为 溶液,升高温度,不变,但醋酸的电离程度增大
C. 浓度为 溶液为,则为弱电解质
D. 的浓度越大,的电离程度越大
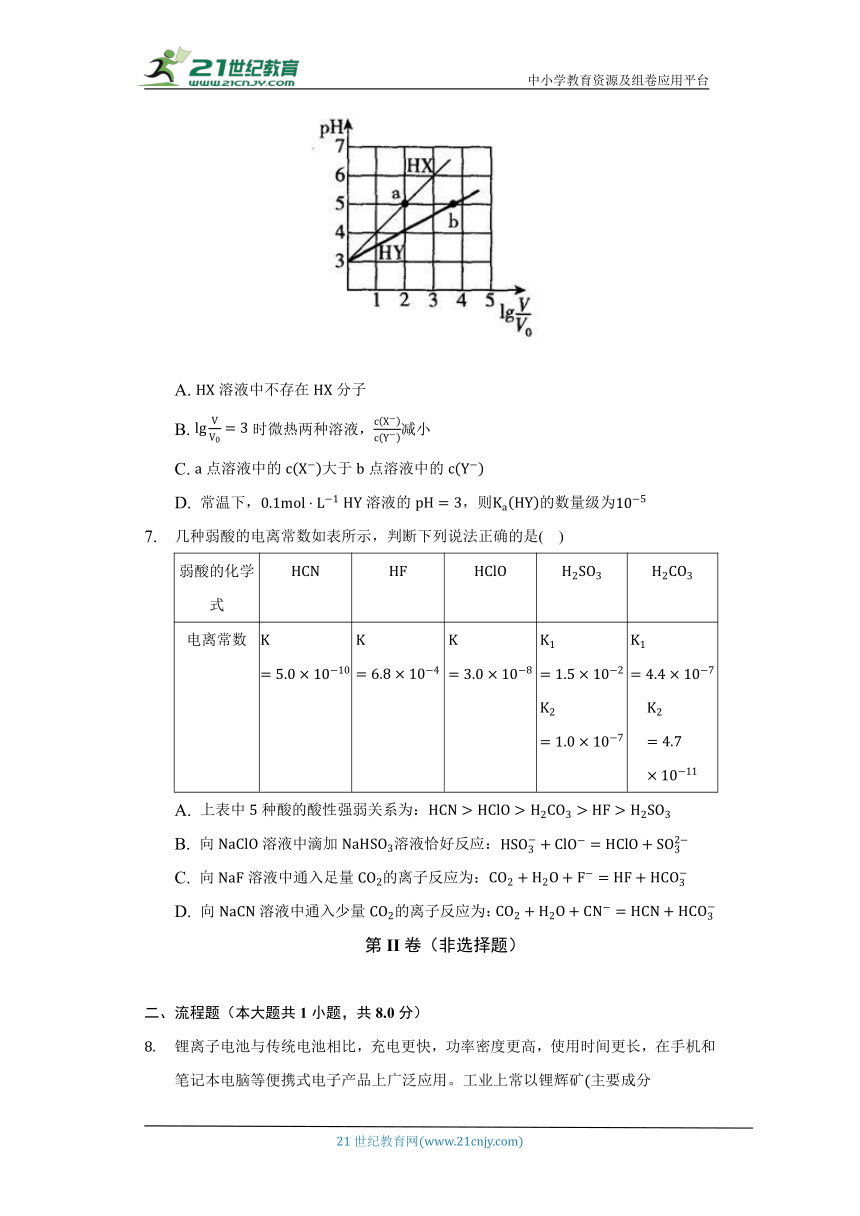
常温下,向体积均为、均为的两种难挥发性酸、溶液加入蒸馏水分别稀释至,稀释后溶液的与关系如图所示。忽略溶液体积变化,下列说法不正确的是( )
A. 溶液中不存在分子
B. 时微热两种溶液,减小
C. 点溶液中的大于点溶液中的
D. 常温下, 溶液的,则的数量级为
几种弱酸的电离常数如表所示,判断下列说法正确的是( )
弱酸的化学式
电离常数
A. 上表中种酸的酸性强弱关系为:
B. 向溶液中滴加溶液恰好反应:
C. 向溶液中通入足量的离子反应为:
D. 向溶液中通入少量的离子反应为:
第II卷(非选择题)
二、流程题(本大题共1小题,共8.0分)
锂离子电池与传统电池相比,充电更快,功率密度更高,使用时间更长,在手机和笔记本电脑等便携式电子产品上广泛应用。工业上常以锂辉矿主要成分为 ,还含有、、等杂质为原料来制取金属锂,其中一种工艺流程如下
已知
部分金属氢氧化物开始沉淀和完全沉淀时的:
氢氧化物 开始沉淀 完全沉淀
的溶解度随温度变化如图所示:
试回答下列问题:
酸浸时,为了提高浸取率可采取升高温度、粉碎矿石、搅拌、过滤后再次浸取等措施还可通过______来提高浸取率。
反应Ⅰ中应调节范围为______,沉淀的成分除、、外,还有______。
反应Ⅱ的离子方程式为______。
“操作Ⅰ“的名称为______;洗涤沉淀要使用______选填“热水”或“冷水”,理由是______。
已知铷是制造光电管的材料,它与锂同主族。将 溶于水配成溶液,向该溶液中滴加 醋酸后,溶液呈中性。则______用含、的式子表示;已知时,电离平衡常数。
三、实验题(本大题共1小题,共10.0分)
某化学兴趣小组装好了如图所示的实验装置,一支胶头滴管盛有盐酸,另一支胶头滴管盛有同体积、同浓度的醋酸。实验时同时完全捏扁、胶头滴管的胶头,观察实验现象。
装置、中用红墨水而不用水的目的是_____________________________________________________________________________________________。
实验开始前两溶液中的大小:盐酸__________填“”“”或“”醋酸,证明________为弱电解质。
实验刚开始时,发现装置中的长导管液面上升得比装置中的要快,则胶头滴管中盛的是_________。
两装置反应刚结束时无固体剩余,装置中的长导管液面比装置中的高,静置后两装置中的长导管液面均有所下降,最终液面高度__________填“相等”“中的高”或“中的高”。
四、简答题(本大题共2小题,共16.0分)
近年研究发现砒霜在治疗白血病、恶性肿瘤等方面有特效。砷有两种常见的酸:砷酸,偏亚砷酸。已知的、、依次为、、。
回答下列问题:
写出砷酸第二步的电离方程式:________________________。
下列实验不能证明的酸性比强的是________________填标号。
A.常温下,测定溶液和溶液的
B.常温下,测定溶液和溶液的
C.常温下,分别用蒸馏水稀释的溶液、溶液倍,测定稀释后溶液的
D.常温下,比较体积均为,浓度均为溶液、溶液分别与质量相等且形状相同的锌粒反应
常温下,加水稀释溶液,下列量会增大的是________填标号。
A.B.. .
向溶液中滴加溶液,加入溶液的体积为时,。
________填“”“”或“”。
此时,混合溶液的________。
写出醋酸的电离方程式:_____________________________________;
向醋酸溶液中加入少量水,电离平衡向 _______移动填“左”或“右”;_______;_______填“增大”、“减小”或“不变”。
醋酸溶液和盐酸溶液与足量粉反应,初始速率___,溶液的导电能力____;完全中和这两种酸,消耗的量___填“”、“”或“”。
已知时部分弱电解质的电离平衡常数数据如表所示:
化学式
电离平衡常数 、
以下说法不正确的是__________。填选项
A.向弱酸溶液中加入少量溶液,电离平衡常数变大
B.多元弱酸的酸性主要由第一步电离决定
C.表中三种酸,酸性最强的是
D.向溶液中通入气体,可以生成
五、推断题(本大题共1小题,共10.0分)
A、、、是四种短周期元素,它们的原子序数依次增大,其中、及,分别是同一主族元素,、元素的原子核中质子数之和是、两元素原子核中质子数之和的两倍,又知的原子中没有中子,请回答:
写出元素的名称:_______.
、、三种元素原子半径由小到大的顺序为:_______用化学符号表示,下同.
、组成的常见化合物,其水溶液呈酸性,主要原因是_______用离子方程式表示.
均含、、、四种元素的两种常见化合物甲和乙,它们在水溶液中相互之间能发生反应,写出该反应的离子方程式_______。
常温下,单质在足量的单质中完全燃烧,放出热量,写出其热化学方程式:_______.
用元素的单质与元素的单质可以制成电池,电池中装有浓溶液,用多孔的金属惰性电极侵入溶液,两极均有特制的防止透过的隔膜,在极通入的单质,极通入的单质,则极是该电池的_______极;极的电极反应式是_______.
答案和解析
1.【答案】
【解析】对,根据电离平衡常数知,在冰醋酸中这几种酸都不完全电离;
对,在冰醋酸中,高氯酸的电离平衡常数最大,所以高氯酸的酸性最强;
错,在冰醋酸中硫酸存在电离平衡,所以其电离方程式为;
对,这四种酸在水中都完全电离,在冰醋酸中电离程度不同,所以水对于这四种酸的强弱没有区分能力,但冰醋酸可以区分这四种酸的强弱。
2.【答案】
【解析】
【分析】
本题主要考查弱电解质的电离及电离平衡的相关应用,注意结合弱电解质与强电解质的对比进行分析解答,题目难度一般。
【解答】
A.室温下,向的稀氨水中加入氢氧化钠溶液,溶液中不变,与同等程度减小,则的电离平衡不移动,故A正确;
B.向醋酸溶液中加入冰醋酸,醋酸的浓度增大,平衡正向移动,氢离子浓度增大,但是电离度反而减小,故B错误;
C.酸的体积不确定,无法直接比较,故C错误;
D.室温下,某溶液,该溶液也可能是酸式盐或弱酸弱碱盐弱酸的电离平衡常数大于弱碱的电离平衡常数,故D错误。
故选A。
3.【答案】
【解析】
【分析】
本题考查了弱电解质的电离,涉及氢离子浓度的计算、电离常数的应用等,注意该二元酸的电离方式,题目难度中等。
【解答】
A.二元酸在水中第一步电离为完全电离,则酸性较强,不是弱酸,故A错误;
B.稀释溶液,电离平衡向右移动,但是减小,故B错误;
C.二元酸在水中的电离方程式为:,,第一步完全电离,第二步部分电离,设电离的为,则:
,解得:所以在的溶液中,,故C错误;
D.若的溶液中,则电离出,的溶液中存在,,第一步电离出的氢离子,抑制了第二步电离,所以,故D正确。
4.【答案】
【解析】
【分析】
本题考查了弱电解质的电离,明确弱电解质的电离是吸热反应、弱电解质的电离程度与浓度的关系即可解答,难度中等。
【解答】
A.加水稀释氨水溶液,促进一水合氨电离,则溶液中氢氧根离子的物质的量浓度减小,氢离子物质的量浓度增大,一水合氨的物质的量浓度减小,所以溶液中减小,故A正确;
B.醋酸是弱酸,发生部分电离,故等的盐酸和醋酸相比醋酸的物质的量浓度远远大于盐酸,则等体积、等的盐酸和醋酸相比,醋酸的物质的量大于盐酸,所以醋酸消耗的氢氧化钠多,故B错误;
C.质量相同的锌粒分别与等体积等浓度的盐酸和醋酸反应,醋酸部分电离,为弱电解质,醋酸产生速率慢始终比盐酸慢,故C错误;
D.两种氨水溶液的物质的量浓度分别为和,分别为和,浓度越大其电离程度越小,所以则 ,故D错误。
5.【答案】
【解析】
【分析】
本题考查了弱电解质的电离平衡及其影响因素,题目难度中等,注意掌握影响弱电解质的电离平衡的因素,明确电离平衡常数只与温度有关,与溶液浓度大小无关。
【解答】
A.浓度为 溶液,加水稀释,则增大,减小,,所以增大,故A错误;
B.电离平衡常数只与温度有关,弱电解质的电离吸热,所以温度升高,增大,醋酸的电离程度也增大,故B错误;
C.浓度为 一元强酸如的为,浓度为 溶液为,说明溶液中是部分电离,所以为弱电解质,故C正确;
D.越大,的电离程度越小,故D错误;
故选:。
6.【答案】
【解析】
【分析】
本题考查弱电解质的电离相关知识。熟练掌握加水稀释会促进弱电解质的电离为解答的关键,难度不大。
【解答】
常温下,向体积均为、均为的两种难挥发性酸、溶液加入蒸馏水分别稀释至,看图得到若稀释倍的增大,说明为强酸,的增大值小于,说明是弱酸。
A.为强酸,溶液中不存在分子,故 A正确;
B.时微热两种溶液,是强酸,浓度不变,是弱酸,加热促进电离,浓度增大,故减小,故 B正确;
C.在常温下,点、点均为,即,则,根据电荷守恒可知、,所以点溶液中的等于点溶液中的 ,故C错误;
D.常温下,溶液的,,则的数量级为 ,故D正确。
故选C。
7.【答案】
【解析】
【分析】
本题主要考查弱电解质的电离,注意结合电离平衡常数大小判断酸性强弱,进行解答,难度一般。
【解答】
A.相同条件下酸的电离平衡常数越大,酸性越强,则上表中种酸的酸性强弱关系为: ,故A错误;
B.溶液有强氧化性,溶液有强还原性,两者混合发生氧化还原反应,故B错误;
C.相同条件下酸的电离平衡常数越大,酸性越强,则的酸性强于,向溶液中通入足量,不能发生反应,故C错误;
D.由表中电离常数可知酸性:,向溶液中通入少量的离子反应为:,故D正确。
故选D。
8.【答案】延长浸取时间、增大浓度
; 、
、
过滤; 热水; 在较高温度下溶解度小,用热水洗涤可减少的损耗
【解析】解:酸浸时,为了提高浸取率可采取升高温度、粉碎矿石、搅拌、过滤后再次浸取等,还可延长浸取时间、增大浓度,可提高浸取效率,
故答案为:延长浸取时间、增大浓度;
反应Ⅰ中应调节,可除去铁离子、镁离子,沉淀的成分除、、外,还有、,由表中数据可知调节应为,
故答案为:;、;
反应Ⅱ加入氢氧化钙,碳酸钠,用于除去镁离子、钙离子,离子方程式为、,
故答案为:、;
操作Ⅰ用于分离固体和液体,为过滤操作,由图象可知洗涤沉淀要使用热水,可减少的损耗,
故答案为:过滤;热水;在较高温度下溶解度小,用热水洗涤可减少的损耗;
将 溶于水配成溶液,向该溶液中滴加 醋酸后,溶液呈中性,则溶液中,,,电离平衡常数,
则,
故答案为:。
锂辉矿主要成分为,还含有、、等杂质为原料来制取金属锂,加入过量硫酸溶解锂辉矿,加入碳酸钙除去过量的硫酸调节溶液,使铁离子和铝离子沉淀完全,加入水洗过滤洗去矿泥,然后加入氢氧化钙和碳酸钠沉淀镁离子和钙离子,过滤得到溶液中主要是锂离子的溶液,蒸发浓缩,加入碳酸钠沉淀锂离子生成碳酸锂,洗涤后加入盐酸溶解得到纯净的氯化锂溶液,加热蒸干得到氯化锂,电解熔融氯化锂得到金属锂,以此解答该题。
本题考查了工业上以锂辉矿制取金属锂的方法,为高考高频考点,侧重考查学生的分析能力和实验能力,题目难度中等,试题涉及了化学式的书写、物质的分离与提纯、离子方程式的书写等知识,合理分析题中工艺流程是解题关键。
9.【答案】便于观察长导管中液面高度的变化
;
盐酸
相等
【解析】
【分析】
本题考查了弱电解质电离的探究,根据实验现象来分析弱电解质的电离特点,从而得出结论,并结合盐类水解来分析解答,难度中等。
【解答】
水是无色的,红墨水是红色的,红色颜色较明显,便于观察,所以装置、中用红墨水而不用水;
两种溶液的物质的量浓度相等,氢离子浓度:盐酸醋酸,说明醋酸是弱电解质;
反应刚开始时,盐酸中氢离子浓度大于醋酸,则盐酸反应速率大于醋酸,则盐酸中长导管液面上升得快,所以中盛放的是盐酸;
酸和锌的反应是放热反应,但醋酸的电离过程是吸热反应,所以两装置反应刚结束时无固体剩余,发现装置中的长导管液面比装置中的高,温度恢复室温时,两装置中的长导管液面均有所下降,盐酸与醋酸同体积、同浓度,二者最终产生的氢气相同,所以最终液面高度相等。
10.【答案】
【解析】砷酸以第一步电离为主,比较相同浓度的、溶液的,利用越弱越水解原理判断和的酸性强弱,项错误。温度不变,、电离常数不变,项不符合题意;加水稀释,促进砷酸的电离,砷酸的电离程度增大,砷酸二氢根离子浓度、氢离子浓度减小,增大,项符合题意,项不符合题意;,减小,则增大,项符合题意。当时,溶液为溶液,,当时,。,。
11.【答案】
右;减小;增大
;;
【解析】
【分析】
本题考查弱电解质电离平衡和电离平衡常数的应用,为高频考点,难度不大。掌握弱电解质电离方程式书写、电离平衡影响因素以及电离平衡常数的应用是解答关键。
【解答】
醋酸是弱酸,部分电离,;
加水稀释,促进弱电解质电离,则电离平衡向右移动,但减小,电离常数,温度不变,电离平衡常数不变,减小,所以增大;
醋酸是弱酸,部分电离,所以中小于中,则初始速率;中离子浓度小,所以导电性;二者都是一元酸,等体积等浓度,则中和消耗的的量相等,;
电离平衡常数只受温度影响,所以加入少量,电离平衡常数不变,故错误;
B.多元弱酸分步电离,以第一步电离为主,故正确;
C.由表格数据可知,的电离平衡常数最大,则其酸性最强,故正确;
D.由电离平衡常数可得酸性,所以向溶液中通入气体,可以生成,故正确。
12.【答案】氢
负;
【解析】
【分析】
本题了元素的推断,整体难度不大,根据已知信息判断题眼是解答本题的关键。
【解答】
根据信息“短周期、同主族、质子数的两倍,的原子中没有中子”等关系推断出、、、分别为、、、。
为氢,故答案为:氢;
、、原子半径大小关系为:,故答案为:;
、组成的化合物为,电离反应为:第一步电离为主,故溶液显酸性,故答案为:;
、、、四种元素组成的两种常见化合物甲和乙,它们在水溶液中相互之间能发生反应,则甲、乙可为硫酸氢钠和亚硫酸氢钠顺序可颠倒,反应的离子方程式为 ,故答案为: ;
为 ,注意应与方程式的化学计量数相对应,则 ,故答案为:;
构成了氢氧燃料电池,电解质为,所以通氢气的为负极;通氧气的为正极,正极反应为: ,故答案为:负;。
第14页,共14页
21世纪教育网(www.21cnjy.com)
3.1电离平衡人教版(2019)高中化学选择性必修一同步练习
学校:___________姓名:___________班级:___________考号:___________
注意事项:
1.答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡对应题目的答案标号涂黑;如需改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上,写在试卷上无效。
3.考试结束后,本试卷和答题卡一并交回。
第I卷(选择题)
一、单选题(本大题共7小题,共21.0分)
、、和都是强酸,它们的酸性在水溶液中差别不大。以下是某温度下这四种酸在冰醋酸中的电离常数:
酸
下列说法中不正确的是( )
A. 在冰醋酸中这四种酸都没有完全电离
B. 在冰醋酸中是这四种酸中最强的酸
C. 在冰醋酸中的电离方程式为
D. 水不能区分这四种酸的强弱,但冰醋酸可以区分这四种酸的强弱
下列说法正确的是( )
A. 室温下,向的稀氨水中加入氢氧化钠溶液,的电离平衡不移动
B. 向醋酸溶液中加入冰醋酸,醋酸电离度增大,氢离子浓度增大
C. 用等浓度的溶液分别中和等值的、溶液,消耗的体积大,说明酸性
D. 室温下,某溶液,则该溶液一定是酸或强酸弱碱盐溶液
某二元酸在水中的电离方程式为:,时,下列有关说法中正确的是( )
A. 是弱酸
B. 稀释溶液,因电离平衡向右移动而导致增大
C. 在的溶液中,
D. 若溶液中,则的中
下列叙述正确的是( )
A. 用水稀释 的氨水,则溶液中减小
B. 中和等体积、等的盐酸和醋酸,消耗的物质的量相等
C. 在等体积等浓度的盐酸和醋酸中分别加入等质量的相同锌粒,随着反应的进行,醋酸不断电离出,反应速率比盐酸大
D. 两种氨水的分别为和,物质的量浓度分别为 和,则
下列说法正确的是( )
A. 浓度为 溶液,加水稀释,则减小
B. 浓度为 溶液,升高温度,不变,但醋酸的电离程度增大
C. 浓度为 溶液为,则为弱电解质
D. 的浓度越大,的电离程度越大
常温下,向体积均为、均为的两种难挥发性酸、溶液加入蒸馏水分别稀释至,稀释后溶液的与关系如图所示。忽略溶液体积变化,下列说法不正确的是( )
A. 溶液中不存在分子
B. 时微热两种溶液,减小
C. 点溶液中的大于点溶液中的
D. 常温下, 溶液的,则的数量级为
几种弱酸的电离常数如表所示,判断下列说法正确的是( )
弱酸的化学式
电离常数
A. 上表中种酸的酸性强弱关系为:
B. 向溶液中滴加溶液恰好反应:
C. 向溶液中通入足量的离子反应为:
D. 向溶液中通入少量的离子反应为:
第II卷(非选择题)
二、流程题(本大题共1小题,共8.0分)
锂离子电池与传统电池相比,充电更快,功率密度更高,使用时间更长,在手机和笔记本电脑等便携式电子产品上广泛应用。工业上常以锂辉矿主要成分为 ,还含有、、等杂质为原料来制取金属锂,其中一种工艺流程如下
已知
部分金属氢氧化物开始沉淀和完全沉淀时的:
氢氧化物 开始沉淀 完全沉淀
的溶解度随温度变化如图所示:
试回答下列问题:
酸浸时,为了提高浸取率可采取升高温度、粉碎矿石、搅拌、过滤后再次浸取等措施还可通过______来提高浸取率。
反应Ⅰ中应调节范围为______,沉淀的成分除、、外,还有______。
反应Ⅱ的离子方程式为______。
“操作Ⅰ“的名称为______;洗涤沉淀要使用______选填“热水”或“冷水”,理由是______。
已知铷是制造光电管的材料,它与锂同主族。将 溶于水配成溶液,向该溶液中滴加 醋酸后,溶液呈中性。则______用含、的式子表示;已知时,电离平衡常数。
三、实验题(本大题共1小题,共10.0分)
某化学兴趣小组装好了如图所示的实验装置,一支胶头滴管盛有盐酸,另一支胶头滴管盛有同体积、同浓度的醋酸。实验时同时完全捏扁、胶头滴管的胶头,观察实验现象。
装置、中用红墨水而不用水的目的是_____________________________________________________________________________________________。
实验开始前两溶液中的大小:盐酸__________填“”“”或“”醋酸,证明________为弱电解质。
实验刚开始时,发现装置中的长导管液面上升得比装置中的要快,则胶头滴管中盛的是_________。
两装置反应刚结束时无固体剩余,装置中的长导管液面比装置中的高,静置后两装置中的长导管液面均有所下降,最终液面高度__________填“相等”“中的高”或“中的高”。
四、简答题(本大题共2小题,共16.0分)
近年研究发现砒霜在治疗白血病、恶性肿瘤等方面有特效。砷有两种常见的酸:砷酸,偏亚砷酸。已知的、、依次为、、。
回答下列问题:
写出砷酸第二步的电离方程式:________________________。
下列实验不能证明的酸性比强的是________________填标号。
A.常温下,测定溶液和溶液的
B.常温下,测定溶液和溶液的
C.常温下,分别用蒸馏水稀释的溶液、溶液倍,测定稀释后溶液的
D.常温下,比较体积均为,浓度均为溶液、溶液分别与质量相等且形状相同的锌粒反应
常温下,加水稀释溶液,下列量会增大的是________填标号。
A.B.. .
向溶液中滴加溶液,加入溶液的体积为时,。
________填“”“”或“”。
此时,混合溶液的________。
写出醋酸的电离方程式:_____________________________________;
向醋酸溶液中加入少量水,电离平衡向 _______移动填“左”或“右”;_______;_______填“增大”、“减小”或“不变”。
醋酸溶液和盐酸溶液与足量粉反应,初始速率___,溶液的导电能力____;完全中和这两种酸,消耗的量___填“”、“”或“”。
已知时部分弱电解质的电离平衡常数数据如表所示:
化学式
电离平衡常数 、
以下说法不正确的是__________。填选项
A.向弱酸溶液中加入少量溶液,电离平衡常数变大
B.多元弱酸的酸性主要由第一步电离决定
C.表中三种酸,酸性最强的是
D.向溶液中通入气体,可以生成
五、推断题(本大题共1小题,共10.0分)
A、、、是四种短周期元素,它们的原子序数依次增大,其中、及,分别是同一主族元素,、元素的原子核中质子数之和是、两元素原子核中质子数之和的两倍,又知的原子中没有中子,请回答:
写出元素的名称:_______.
、、三种元素原子半径由小到大的顺序为:_______用化学符号表示,下同.
、组成的常见化合物,其水溶液呈酸性,主要原因是_______用离子方程式表示.
均含、、、四种元素的两种常见化合物甲和乙,它们在水溶液中相互之间能发生反应,写出该反应的离子方程式_______。
常温下,单质在足量的单质中完全燃烧,放出热量,写出其热化学方程式:_______.
用元素的单质与元素的单质可以制成电池,电池中装有浓溶液,用多孔的金属惰性电极侵入溶液,两极均有特制的防止透过的隔膜,在极通入的单质,极通入的单质,则极是该电池的_______极;极的电极反应式是_______.
答案和解析
1.【答案】
【解析】对,根据电离平衡常数知,在冰醋酸中这几种酸都不完全电离;
对,在冰醋酸中,高氯酸的电离平衡常数最大,所以高氯酸的酸性最强;
错,在冰醋酸中硫酸存在电离平衡,所以其电离方程式为;
对,这四种酸在水中都完全电离,在冰醋酸中电离程度不同,所以水对于这四种酸的强弱没有区分能力,但冰醋酸可以区分这四种酸的强弱。
2.【答案】
【解析】
【分析】
本题主要考查弱电解质的电离及电离平衡的相关应用,注意结合弱电解质与强电解质的对比进行分析解答,题目难度一般。
【解答】
A.室温下,向的稀氨水中加入氢氧化钠溶液,溶液中不变,与同等程度减小,则的电离平衡不移动,故A正确;
B.向醋酸溶液中加入冰醋酸,醋酸的浓度增大,平衡正向移动,氢离子浓度增大,但是电离度反而减小,故B错误;
C.酸的体积不确定,无法直接比较,故C错误;
D.室温下,某溶液,该溶液也可能是酸式盐或弱酸弱碱盐弱酸的电离平衡常数大于弱碱的电离平衡常数,故D错误。
故选A。
3.【答案】
【解析】
【分析】
本题考查了弱电解质的电离,涉及氢离子浓度的计算、电离常数的应用等,注意该二元酸的电离方式,题目难度中等。
【解答】
A.二元酸在水中第一步电离为完全电离,则酸性较强,不是弱酸,故A错误;
B.稀释溶液,电离平衡向右移动,但是减小,故B错误;
C.二元酸在水中的电离方程式为:,,第一步完全电离,第二步部分电离,设电离的为,则:
,解得:所以在的溶液中,,故C错误;
D.若的溶液中,则电离出,的溶液中存在,,第一步电离出的氢离子,抑制了第二步电离,所以,故D正确。
4.【答案】
【解析】
【分析】
本题考查了弱电解质的电离,明确弱电解质的电离是吸热反应、弱电解质的电离程度与浓度的关系即可解答,难度中等。
【解答】
A.加水稀释氨水溶液,促进一水合氨电离,则溶液中氢氧根离子的物质的量浓度减小,氢离子物质的量浓度增大,一水合氨的物质的量浓度减小,所以溶液中减小,故A正确;
B.醋酸是弱酸,发生部分电离,故等的盐酸和醋酸相比醋酸的物质的量浓度远远大于盐酸,则等体积、等的盐酸和醋酸相比,醋酸的物质的量大于盐酸,所以醋酸消耗的氢氧化钠多,故B错误;
C.质量相同的锌粒分别与等体积等浓度的盐酸和醋酸反应,醋酸部分电离,为弱电解质,醋酸产生速率慢始终比盐酸慢,故C错误;
D.两种氨水溶液的物质的量浓度分别为和,分别为和,浓度越大其电离程度越小,所以则 ,故D错误。
5.【答案】
【解析】
【分析】
本题考查了弱电解质的电离平衡及其影响因素,题目难度中等,注意掌握影响弱电解质的电离平衡的因素,明确电离平衡常数只与温度有关,与溶液浓度大小无关。
【解答】
A.浓度为 溶液,加水稀释,则增大,减小,,所以增大,故A错误;
B.电离平衡常数只与温度有关,弱电解质的电离吸热,所以温度升高,增大,醋酸的电离程度也增大,故B错误;
C.浓度为 一元强酸如的为,浓度为 溶液为,说明溶液中是部分电离,所以为弱电解质,故C正确;
D.越大,的电离程度越小,故D错误;
故选:。
6.【答案】
【解析】
【分析】
本题考查弱电解质的电离相关知识。熟练掌握加水稀释会促进弱电解质的电离为解答的关键,难度不大。
【解答】
常温下,向体积均为、均为的两种难挥发性酸、溶液加入蒸馏水分别稀释至,看图得到若稀释倍的增大,说明为强酸,的增大值小于,说明是弱酸。
A.为强酸,溶液中不存在分子,故 A正确;
B.时微热两种溶液,是强酸,浓度不变,是弱酸,加热促进电离,浓度增大,故减小,故 B正确;
C.在常温下,点、点均为,即,则,根据电荷守恒可知、,所以点溶液中的等于点溶液中的 ,故C错误;
D.常温下,溶液的,,则的数量级为 ,故D正确。
故选C。
7.【答案】
【解析】
【分析】
本题主要考查弱电解质的电离,注意结合电离平衡常数大小判断酸性强弱,进行解答,难度一般。
【解答】
A.相同条件下酸的电离平衡常数越大,酸性越强,则上表中种酸的酸性强弱关系为: ,故A错误;
B.溶液有强氧化性,溶液有强还原性,两者混合发生氧化还原反应,故B错误;
C.相同条件下酸的电离平衡常数越大,酸性越强,则的酸性强于,向溶液中通入足量,不能发生反应,故C错误;
D.由表中电离常数可知酸性:,向溶液中通入少量的离子反应为:,故D正确。
故选D。
8.【答案】延长浸取时间、增大浓度
; 、
、
过滤; 热水; 在较高温度下溶解度小,用热水洗涤可减少的损耗
【解析】解:酸浸时,为了提高浸取率可采取升高温度、粉碎矿石、搅拌、过滤后再次浸取等,还可延长浸取时间、增大浓度,可提高浸取效率,
故答案为:延长浸取时间、增大浓度;
反应Ⅰ中应调节,可除去铁离子、镁离子,沉淀的成分除、、外,还有、,由表中数据可知调节应为,
故答案为:;、;
反应Ⅱ加入氢氧化钙,碳酸钠,用于除去镁离子、钙离子,离子方程式为、,
故答案为:、;
操作Ⅰ用于分离固体和液体,为过滤操作,由图象可知洗涤沉淀要使用热水,可减少的损耗,
故答案为:过滤;热水;在较高温度下溶解度小,用热水洗涤可减少的损耗;
将 溶于水配成溶液,向该溶液中滴加 醋酸后,溶液呈中性,则溶液中,,,电离平衡常数,
则,
故答案为:。
锂辉矿主要成分为,还含有、、等杂质为原料来制取金属锂,加入过量硫酸溶解锂辉矿,加入碳酸钙除去过量的硫酸调节溶液,使铁离子和铝离子沉淀完全,加入水洗过滤洗去矿泥,然后加入氢氧化钙和碳酸钠沉淀镁离子和钙离子,过滤得到溶液中主要是锂离子的溶液,蒸发浓缩,加入碳酸钠沉淀锂离子生成碳酸锂,洗涤后加入盐酸溶解得到纯净的氯化锂溶液,加热蒸干得到氯化锂,电解熔融氯化锂得到金属锂,以此解答该题。
本题考查了工业上以锂辉矿制取金属锂的方法,为高考高频考点,侧重考查学生的分析能力和实验能力,题目难度中等,试题涉及了化学式的书写、物质的分离与提纯、离子方程式的书写等知识,合理分析题中工艺流程是解题关键。
9.【答案】便于观察长导管中液面高度的变化
;
盐酸
相等
【解析】
【分析】
本题考查了弱电解质电离的探究,根据实验现象来分析弱电解质的电离特点,从而得出结论,并结合盐类水解来分析解答,难度中等。
【解答】
水是无色的,红墨水是红色的,红色颜色较明显,便于观察,所以装置、中用红墨水而不用水;
两种溶液的物质的量浓度相等,氢离子浓度:盐酸醋酸,说明醋酸是弱电解质;
反应刚开始时,盐酸中氢离子浓度大于醋酸,则盐酸反应速率大于醋酸,则盐酸中长导管液面上升得快,所以中盛放的是盐酸;
酸和锌的反应是放热反应,但醋酸的电离过程是吸热反应,所以两装置反应刚结束时无固体剩余,发现装置中的长导管液面比装置中的高,温度恢复室温时,两装置中的长导管液面均有所下降,盐酸与醋酸同体积、同浓度,二者最终产生的氢气相同,所以最终液面高度相等。
10.【答案】
【解析】砷酸以第一步电离为主,比较相同浓度的、溶液的,利用越弱越水解原理判断和的酸性强弱,项错误。温度不变,、电离常数不变,项不符合题意;加水稀释,促进砷酸的电离,砷酸的电离程度增大,砷酸二氢根离子浓度、氢离子浓度减小,增大,项符合题意,项不符合题意;,减小,则增大,项符合题意。当时,溶液为溶液,,当时,。,。
11.【答案】
右;减小;增大
;;
【解析】
【分析】
本题考查弱电解质电离平衡和电离平衡常数的应用,为高频考点,难度不大。掌握弱电解质电离方程式书写、电离平衡影响因素以及电离平衡常数的应用是解答关键。
【解答】
醋酸是弱酸,部分电离,;
加水稀释,促进弱电解质电离,则电离平衡向右移动,但减小,电离常数,温度不变,电离平衡常数不变,减小,所以增大;
醋酸是弱酸,部分电离,所以中小于中,则初始速率;中离子浓度小,所以导电性;二者都是一元酸,等体积等浓度,则中和消耗的的量相等,;
电离平衡常数只受温度影响,所以加入少量,电离平衡常数不变,故错误;
B.多元弱酸分步电离,以第一步电离为主,故正确;
C.由表格数据可知,的电离平衡常数最大,则其酸性最强,故正确;
D.由电离平衡常数可得酸性,所以向溶液中通入气体,可以生成,故正确。
12.【答案】氢
负;
【解析】
【分析】
本题了元素的推断,整体难度不大,根据已知信息判断题眼是解答本题的关键。
【解答】
根据信息“短周期、同主族、质子数的两倍,的原子中没有中子”等关系推断出、、、分别为、、、。
为氢,故答案为:氢;
、、原子半径大小关系为:,故答案为:;
、组成的化合物为,电离反应为:第一步电离为主,故溶液显酸性,故答案为:;
、、、四种元素组成的两种常见化合物甲和乙,它们在水溶液中相互之间能发生反应,则甲、乙可为硫酸氢钠和亚硫酸氢钠顺序可颠倒,反应的离子方程式为 ,故答案为: ;
为 ,注意应与方程式的化学计量数相对应,则 ,故答案为:;
构成了氢氧燃料电池,电解质为,所以通氢气的为负极;通氧气的为正极,正极反应为: ,故答案为:负;。
第14页,共14页
21世纪教育网(www.21cnjy.com)
