2.4化学反应的调控【人教版(2019)】高中化学选修1 同步练习(含答案解析)
文档属性
| 名称 | 2.4化学反应的调控【人教版(2019)】高中化学选修1 同步练习(含答案解析) |  | |
| 格式 | docx | ||
| 文件大小 | 1.7MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-07-22 17:09:39 | ||
图片预览



文档简介
中小学教育资源及组卷应用平台
2.4化学反应的调控人教版(2019)高中化学选择性必修一同步练习
学校:___________姓名:___________班级:___________考号:___________
注意事项:
1.答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡对应题目的答案标号涂黑;如需改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上,写在试卷上无效。
3.考试结束后,本试卷和答题卡一并交回。
第I卷(选择题)
一、单选题(本大题共7小题,共21.0分)
德国物理化学家哈伯发明了以低成本制造大量氨的方法,从而大大满足了当时日益增长的人口对粮食的需求。下列所示是哈伯法的流程图,其中为提高原料转化率而采取的措施是 ( )
A. B. C. D.
下列关于工业合成氨反应的说法正确的是( )
A. 使用铁做催化剂,可提高合成氨反应的速率和平衡转化率
B. 左右比室温更有利于合成氨的反应,提高的平衡转化率
C. 合成氨采用,因为该压强下铁触媒的活性最高
D. 合成氨工业采用高压,不仅能提高转化率,还能缩短达到平衡的时间
已知反应。在一定温度和压强下于密闭容器中,反应达到平衡。下列叙述正确的是( )
升高温度,减小 减小压强,增加 更换高效催化剂,增大 充入一定量的氮气,不变
A. B. C. D.
二甲醚是一种极具发展潜力的有机化工产品和洁净燃料。加氢制二甲醚的反应体系中,主要反应的热化学方程式为
反应Ⅰ:
反应Ⅱ:
反应Ⅲ:
在,起始投料时,的平衡转化率及、、的平衡体积分数随温度变化如图所示。下列有关说法正确的是( )
A. 图中表示
B. 反应Ⅲ中反应物所含化学键的键能之和大于生成物所含化学键的键能之和
C. 温度从上升至时,反应Ⅰ消耗的少于反应Ⅱ生成的
D. 其他条件不变,将压强增大到,可提高平衡时的体积分数
如图所示的各图中,表示这个可逆反应的正确图像的是表示的质量分数,表示气体压强,表示浓度( )
A. B. C. D.
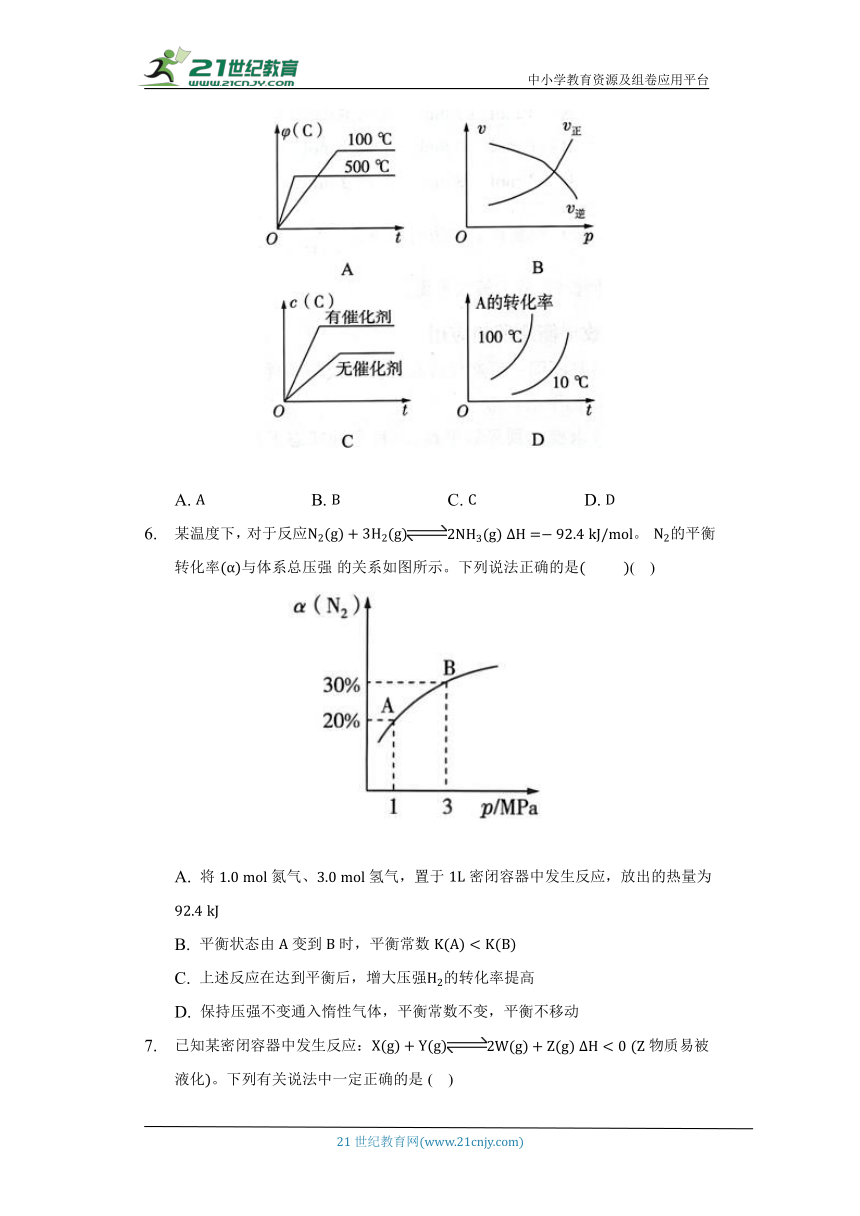
某温度下,对于反应。 的平衡转化率与体系总压强的关系如图所示。下列说法正确的是 ( )
A. 将氮气、氢气,置于密闭容器中发生反应,放出的热量为
B. 平衡状态由变到时,平衡常数
C. 上述反应在达到平衡后,增大压强的转化率提高
D. 保持压强不变通入惰性气体,平衡常数不变,平衡不移动
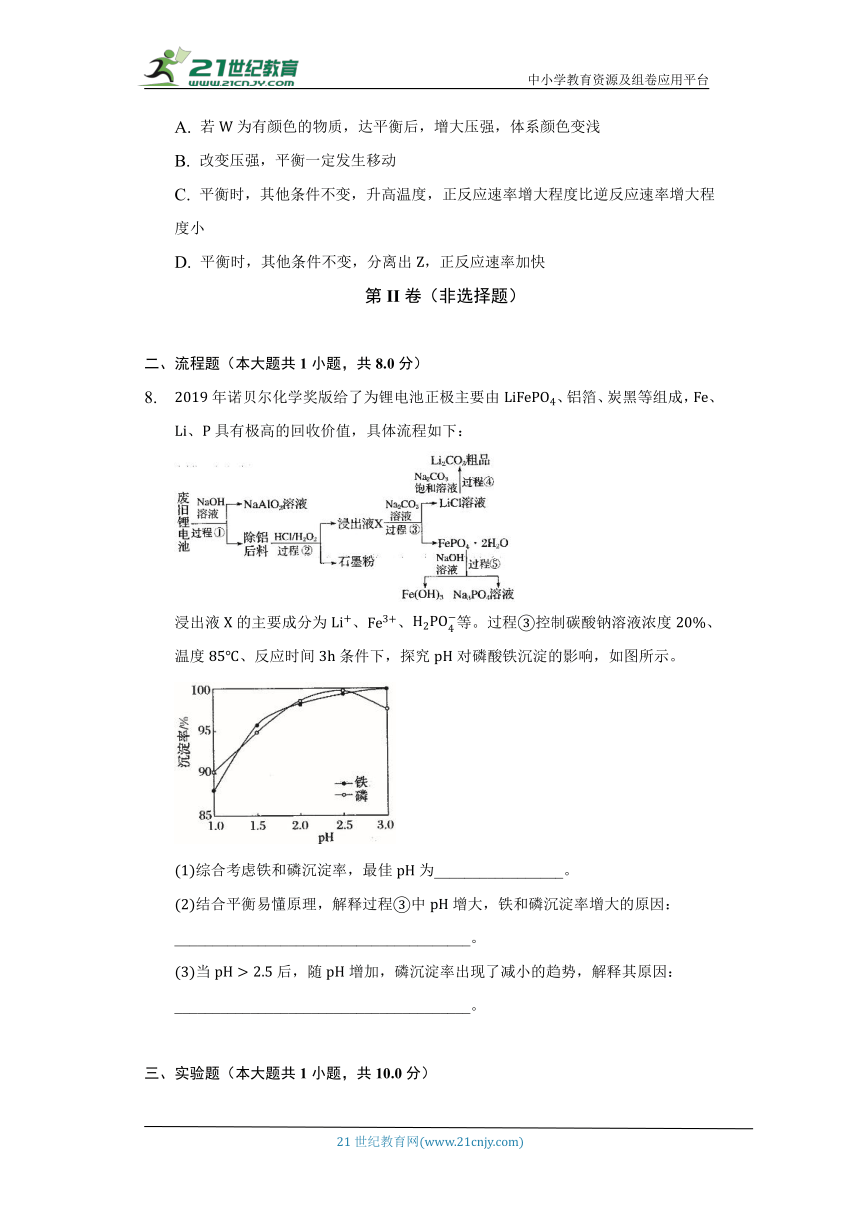
已知某密闭容器中发生反应:物质易被液化。下列有关说法中一定正确的是( )
A. 若为有颜色的物质,达平衡后,增大压强,体系颜色变浅
B. 改变压强,平衡一定发生移动
C. 平衡时,其他条件不变,升高温度,正反应速率增大程度比逆反应速率增大程度小
D. 平衡时,其他条件不变,分离出,正反应速率加快
第II卷(非选择题)
二、流程题(本大题共1小题,共8.0分)
年诺贝尔化学奖版给了为锂电池正极主要由、铝箔、炭黑等组成,、、具有极高的回收价值,具体流程如下:
浸出液的主要成分为、、等。过程控制碳酸钠溶液浓度、温度、反应时间条件下,探究对磷酸铁沉淀的影响,如图所示。
综合考虑铁和磷沉淀率,最佳为_________________。
结合平衡易懂原理,解释过程中增大,铁和磷沉淀率增大的原因:_______________________________________。
当后,随增加,磷沉淀率出现了减小的趋势,解释其原因:_______________________________________。
三、实验题(本大题共1小题,共10.0分)
某同学在实验室进行铁盐与亚铁盐相互转化实验。实验:将转化为
与粉发生反应的离子方程式为 。
为探究白色沉淀产生的原因,设计如下实验。请将此实验方案补充完整。
实验方案 现象 结论
步骤:取 溶液,向其中滴加滴溶液 产生白色沉淀 溶液与溶液反应产生了白色沉淀
步骤:取 无明显现象
已知:的化学性质与相似。
。
与反应的离子方程式为 。
实验:将转化为
实验方案 现象
向溶液中加入稀硝酸 溶液变为棕色,放置一段时间后,棕色消失,溶液变为黄色
查阅资料:棕色。
探究上述现象出现的原因:
用离子方程式解释产生的原因 。
从化学反应速率与限度的角度对体系中存在的反应进行分析:
反应:与足量反应;反应:与反应。
依据实验现象,可推知反应的速率比反应 填“快”或“慢”。
反应是一个不可逆反应,设计实验方案加以证明 。
请用化学平衡移动原理解释溶液由棕色变为黄色的原因 。
四、简答题(本大题共2小题,共16.0分)
合成氨是人类科学技术上的一项重大突破,其反应原理为:
一种工业合成氨的简易流程图如下:
天然气中的杂质常用氨水吸收,产物为。一定条件下向溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式:___________________________。
步骤Ⅱ中制氢气原理如下:
十
对于反应,一定可以提高平衡体系中 百分含量,又能加快反应速率的措施是_____________。
升高温度 增大水蒸气浓度
加入催化剂 降低压强
利用反应,将 进一步转化,可提高产量。若和的混合气体的体积分数为与反应,得到、和的混合气体,则转化率为__________。
图表示、条件下,原料气投料比与平衡时体积分数的关系。根据图中点数据计算的平衡体积分数:_________________。
依据温度对合成氨反应的影响,在图坐标系中,画出一定条件下的密闭容器内,从通入原料气开始,随温度不断升高,物质的量变化的曲线示意图。
上述流程图中,使合成氨放出的能量得到充分利用的主要步骤是填序号_______。简述本流程中提高合成氨原料总转化率的方法:_____________________________________。
乙酸制氢气过程中发生的反应主要有热裂解反应 ,脱羧反应 。
在密闭容器中,利用乙酸制氢气,选择的压强应为________填“较大压强”或“常压”。
一段时间内,该反应体系中温度与气体产率的关系如图所示,约之前,氢气产率低于甲烷产率;约之后氢气产率高于甲烷产率,可能原因是随着温度升高,________________。
保持其他条件不变,在中掺杂一定量,氢气产率显著升高而的产率降低,请分析原因用化学方程式表示:_____________________________________。
五、推断题(本大题共1小题,共10.0分)
将等物质的量的、、、四种物质混合,发生如下反应:,当反应进行一段时间后,测得减少了,减少了,增加了,增加了,此时达到化学平衡状态。
该化学方程式中各物质的化学计量数:________,________,________,________。
若只改变压强,反应速率发生变化,但平衡不发生移动,该反应中各物质的聚集状态:________,________,________。
若只升高温度,反应一段时间后,测得四种物质的物质的量相等,则该反应的正反应为________反应填“放热”或“吸热”。
答案和解析
1.【答案】
【解析】操作均有利于合成氨的化学平衡向正反应方向移动,提高转化率。
2.【答案】
【解析】错,催化剂可提高合成氨反应的速率,但不影响平衡移动。故不影响平衡转化率;
错,合成氨是放热反应,所以低温有利于平衡正向移动,利于提高的平衡转化率,但反应速率跟温度有关,温度越高速率越大,所以温度要既保证一定速率,又保证反应尽量向正反应方向移动,同时还要确保催化剂活性,因为催化剂活性跟温度关系很大,一般合成氨反应是保证催化活性最大,不是为了使化学平衡向正反应方向移动;
错,合成氨的反应是气体分子数减小的反应,高压有利于平衡向正反应方向移动,且能提高正反应速率,跟催化剂无关;
对,合成氨的反应是气体分子数减小的反应,高压有利于平衡向正反应方向移动,且能提高正反应速率,故合成氨工业采用高压,不仅能提高转化率,还能缩短达到平衡的时间。
3.【答案】
【解析】 此反应的正反应是放热反应,升高温度平衡向逆反应方向移动,平衡常数只受温度的影响,即升高温度,减小,正确;反应前后气体化学计量数之和相等,减小压强,平衡不移动,即不变,错误;催化剂对化学平衡无影响,因此的转化率不变,错误;恒压下充入,容器的体积增大,组分浓度降低,但化学反应前后气体化学计量数之和不变,因此化学平衡不移动,不变,正确。
4.【答案】
【解析】已知反应Ⅰ为吸热反应,且只有反应Ⅰ生成了,升高温度,反应Ⅰ平衡正向移动,的体积分数增大,题图中表示,A错误;反应Ⅲ为放热反应,反应物所含化学键的键能之和小于生成物所含化学键的键能之和,B错误;温度从上升至时,的平衡转化率增大,则反应Ⅰ消耗的大于反应Ⅱ生成的,C错误;其他条件不变,将压强增大到,反应Ⅰ平衡不移动,而反应Ⅱ平衡正向移动,甲醇的浓度增大,导致反应Ⅲ平衡正向移动,可提高平衡时的体积分数,D正确。
5.【答案】
【解析】该反应为放热反应,温度升高平衡向逆反应方向移动,的质量分数减小,故A正确;
增大压强平衡向气体体积减小的方向移动,即向正反应方向移动,,且增大压强,正、逆反应速率都增大,故B错误;
催化剂同等程度地改变正、逆反应速率,平衡不发生移动,所以达到平衡时的浓度相同,故C错误;
该反应为放热反应,温度升高平衡向逆反应方向移动,的转化率降低,故D错误。
6.【答案】
【解析】错,根据题意可知当生成时放出能量,但合成氨的反应为可逆反应,氮气和氢气不能完全反应生成氨气,所以放出的热量少于
错,到温度不变,则平衡常数不变;
对,该反应正反应为气体化学计量数之和减小的反应,所以增大压强平衡正向移动,氢气的转化率提高;
错,压强不变通入惰性气体,反应相关物质的分压会减小,平衡逆向移动。
故选:。
7.【答案】
【解析】错,增大压强时,容器的容积缩小,浓度增大,体系颜色变深;
错,物质易被液化,改变压强如果变为液体,反应变成了一个反应前后气体体积不变的可逆反应,改变压强,平衡不发生移动;
对,升温时平衡逆向移动,正、逆反应速率都会加快,但逆反应速率大于正反应速率;
错,分离出时,正反应速率开始不变后逐渐减慢。
故选:。
8.【答案】
,,加入后,结合使减小,促进上述电离平衡正向移动,增大,与结合形成磷酸铁沉淀
时,沉淀中的磷酸铁会有部分开始转变生成,使得部分释放,导致磷沉淀率下降
【解析】略
略
已知,当后,随增加,溶液中增大,开始转变生成,促进溶解平衡正向移动,使得部分释放,导致磷沉淀率下降。
9.【答案】
溶液,向其中滴加滴溶液
慢
取少量反应Ⅰ的溶液于试管中,向其中加入几滴溶液,溶液无明显变化,说明反应Ⅰ是一个不可逆反应
被硝酸氧化为,溶液中浓度降低,导致平衡逆向移动,最终几乎完全转化为,溶液由棕色变为黄色
【解析】与粉发生反应生成和,反应的离子方程式为。
由反应,可知题图得到的溶液中为,为,分别取的硫酸铜溶液、的硫酸亚铁溶液,滴入溶液进行对照实验,故步骤:取 溶液,向其中滴加滴溶液;步骤:取溶液,向其中滴加滴溶液。由已知信息、可知,与反应生成沉淀,同时生成,反应的离子方程式为。
具有还原性,稀硝酸具有强氧化性,两者反应生成、与水,反应的离子方程式为。
溶液先变为棕色,放置一段时间后,棕色消失,溶液变为黄色,反应速率快的反应现象最先表现,故反应Ⅰ的速率比反应Ⅱ的慢。
若反应Ⅰ是一个可逆反应,则反应Ⅰ结束后溶液中含有,否则没有,具体的实验方案是取少量反应Ⅰ的溶液于试管中,向其中加入几滴溶液,溶液无明显变化,说明反应Ⅰ是不可逆反应。
被硝酸氧化为,溶液中浓度降低,导致平衡逆向移动,最终几乎完全转化为,溶液由棕色变为黄色。
10.【答案】
;
Ⅳ; 对、加压;将产物液化分离,减小生成物浓度;将未反应的、循环使用。
【解析】由题给反应信息得出化学方程式为。
增大水蒸气浓度,平衡右移,但平衡体系中百分含量不一定提高;加入催化剂,对平衡无影响,不能提高平衡体系中百分含量;降低压强,反应速率减慢。设达到平衡时转化了 ,则
,,。
方法:设起始 物质的量为 ,物质的量为 ,达到平衡时转化了 ,则
,,故体积分数。
方法:由、按物质的量投料,与又按照物质的量发生反应,故从反应开始到反应平衡,和物质的量之比始终为。体积分数。
在温度达到一定程度时,开始生成,在未达到平衡前,物质的量是增大的,达到平衡后,温度升高,平衡逆向移动,物质的量逐渐减小,变化曲线见答案。
通过热交换步骤Ⅳ,加热进入合成塔的原料气,同时冷却从合成塔出来的平衡混合气。提高原料总转化率的方法有:对、加压;将产物液化分离,减小生成物浓度;将未反应的、循环使用。
11.【答案】常压
热裂解反应的平衡向正反应方向移动,脱羧反应的平衡向逆反应方向移动,故氢气产率高于甲烷产率
【解析】在密闭容器中,发生反应,反应前后气体分子数增大,增大压强,平衡逆向移动,氢气产率降低,故相对于较大压强,常压下氢气的产率较高且能耗低。
热裂解反应的正反应吸热,脱羧反应的正反应放热,约之后升温,热裂解反应的平衡向正反应方向移动,脱羧反应的平衡向逆反应方向移动,故氢气产率高于甲烷产率。
中掺杂的水蒸气与反应生成二氧化碳和氢气,氢气产率显著升高而的产率降低,。
12.【答案】;;;;
气体;固体或液体;气体;
放热。
【解析】
【分析】
本题考查化学平衡的计算,为高频考点,侧重于学生的分析能力的考查,注意把握化学反应速率与化学计量数的关系,把握温度、压强对平衡移动的影响,难度不大。
【解答】
同一化学反应的同一时间段内,参加反应的各物质的物质的量之比等于其计量数之比,所以::: ::: :::,所以、、、分别为、、、;
故答案为:;;;;
压强对化学反应前后气体体积不变的可逆反应的平衡状态无影响,根据题意知,该反应前后气体体积不变,
反应中,已知生成物是固体,要使反应前后气体体积不变即计量数不变,那么只能是、是气体,是液体或固体;
故答案为:气体;固体或液体;气体;
升高温度,平衡向吸热方向移动;根据题意知,开始反应时,、的物质的量减少,、的物质的量增加,所以平衡向正反应方向移动;升高温度,反应一段时间后,测知这四种物质的物质的量相等,说明平衡向逆反应方向移动,所以正反应是放热反应;
故答案为:放热。
第12页,共13页
21世纪教育网(www.21cnjy.com)
2.4化学反应的调控人教版(2019)高中化学选择性必修一同步练习
学校:___________姓名:___________班级:___________考号:___________
注意事项:
1.答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡对应题目的答案标号涂黑;如需改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上,写在试卷上无效。
3.考试结束后,本试卷和答题卡一并交回。
第I卷(选择题)
一、单选题(本大题共7小题,共21.0分)
德国物理化学家哈伯发明了以低成本制造大量氨的方法,从而大大满足了当时日益增长的人口对粮食的需求。下列所示是哈伯法的流程图,其中为提高原料转化率而采取的措施是 ( )
A. B. C. D.
下列关于工业合成氨反应的说法正确的是( )
A. 使用铁做催化剂,可提高合成氨反应的速率和平衡转化率
B. 左右比室温更有利于合成氨的反应,提高的平衡转化率
C. 合成氨采用,因为该压强下铁触媒的活性最高
D. 合成氨工业采用高压,不仅能提高转化率,还能缩短达到平衡的时间
已知反应。在一定温度和压强下于密闭容器中,反应达到平衡。下列叙述正确的是( )
升高温度,减小 减小压强,增加 更换高效催化剂,增大 充入一定量的氮气,不变
A. B. C. D.
二甲醚是一种极具发展潜力的有机化工产品和洁净燃料。加氢制二甲醚的反应体系中,主要反应的热化学方程式为
反应Ⅰ:
反应Ⅱ:
反应Ⅲ:
在,起始投料时,的平衡转化率及、、的平衡体积分数随温度变化如图所示。下列有关说法正确的是( )
A. 图中表示
B. 反应Ⅲ中反应物所含化学键的键能之和大于生成物所含化学键的键能之和
C. 温度从上升至时,反应Ⅰ消耗的少于反应Ⅱ生成的
D. 其他条件不变,将压强增大到,可提高平衡时的体积分数
如图所示的各图中,表示这个可逆反应的正确图像的是表示的质量分数,表示气体压强,表示浓度( )
A. B. C. D.
某温度下,对于反应。 的平衡转化率与体系总压强的关系如图所示。下列说法正确的是 ( )
A. 将氮气、氢气,置于密闭容器中发生反应,放出的热量为
B. 平衡状态由变到时,平衡常数
C. 上述反应在达到平衡后,增大压强的转化率提高
D. 保持压强不变通入惰性气体,平衡常数不变,平衡不移动
已知某密闭容器中发生反应:物质易被液化。下列有关说法中一定正确的是( )
A. 若为有颜色的物质,达平衡后,增大压强,体系颜色变浅
B. 改变压强,平衡一定发生移动
C. 平衡时,其他条件不变,升高温度,正反应速率增大程度比逆反应速率增大程度小
D. 平衡时,其他条件不变,分离出,正反应速率加快
第II卷(非选择题)
二、流程题(本大题共1小题,共8.0分)
年诺贝尔化学奖版给了为锂电池正极主要由、铝箔、炭黑等组成,、、具有极高的回收价值,具体流程如下:
浸出液的主要成分为、、等。过程控制碳酸钠溶液浓度、温度、反应时间条件下,探究对磷酸铁沉淀的影响,如图所示。
综合考虑铁和磷沉淀率,最佳为_________________。
结合平衡易懂原理,解释过程中增大,铁和磷沉淀率增大的原因:_______________________________________。
当后,随增加,磷沉淀率出现了减小的趋势,解释其原因:_______________________________________。
三、实验题(本大题共1小题,共10.0分)
某同学在实验室进行铁盐与亚铁盐相互转化实验。实验:将转化为
与粉发生反应的离子方程式为 。
为探究白色沉淀产生的原因,设计如下实验。请将此实验方案补充完整。
实验方案 现象 结论
步骤:取 溶液,向其中滴加滴溶液 产生白色沉淀 溶液与溶液反应产生了白色沉淀
步骤:取 无明显现象
已知:的化学性质与相似。
。
与反应的离子方程式为 。
实验:将转化为
实验方案 现象
向溶液中加入稀硝酸 溶液变为棕色,放置一段时间后,棕色消失,溶液变为黄色
查阅资料:棕色。
探究上述现象出现的原因:
用离子方程式解释产生的原因 。
从化学反应速率与限度的角度对体系中存在的反应进行分析:
反应:与足量反应;反应:与反应。
依据实验现象,可推知反应的速率比反应 填“快”或“慢”。
反应是一个不可逆反应,设计实验方案加以证明 。
请用化学平衡移动原理解释溶液由棕色变为黄色的原因 。
四、简答题(本大题共2小题,共16.0分)
合成氨是人类科学技术上的一项重大突破,其反应原理为:
一种工业合成氨的简易流程图如下:
天然气中的杂质常用氨水吸收,产物为。一定条件下向溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式:___________________________。
步骤Ⅱ中制氢气原理如下:
十
对于反应,一定可以提高平衡体系中 百分含量,又能加快反应速率的措施是_____________。
升高温度 增大水蒸气浓度
加入催化剂 降低压强
利用反应,将 进一步转化,可提高产量。若和的混合气体的体积分数为与反应,得到、和的混合气体,则转化率为__________。
图表示、条件下,原料气投料比与平衡时体积分数的关系。根据图中点数据计算的平衡体积分数:_________________。
依据温度对合成氨反应的影响,在图坐标系中,画出一定条件下的密闭容器内,从通入原料气开始,随温度不断升高,物质的量变化的曲线示意图。
上述流程图中,使合成氨放出的能量得到充分利用的主要步骤是填序号_______。简述本流程中提高合成氨原料总转化率的方法:_____________________________________。
乙酸制氢气过程中发生的反应主要有热裂解反应 ,脱羧反应 。
在密闭容器中,利用乙酸制氢气,选择的压强应为________填“较大压强”或“常压”。
一段时间内,该反应体系中温度与气体产率的关系如图所示,约之前,氢气产率低于甲烷产率;约之后氢气产率高于甲烷产率,可能原因是随着温度升高,________________。
保持其他条件不变,在中掺杂一定量,氢气产率显著升高而的产率降低,请分析原因用化学方程式表示:_____________________________________。
五、推断题(本大题共1小题,共10.0分)
将等物质的量的、、、四种物质混合,发生如下反应:,当反应进行一段时间后,测得减少了,减少了,增加了,增加了,此时达到化学平衡状态。
该化学方程式中各物质的化学计量数:________,________,________,________。
若只改变压强,反应速率发生变化,但平衡不发生移动,该反应中各物质的聚集状态:________,________,________。
若只升高温度,反应一段时间后,测得四种物质的物质的量相等,则该反应的正反应为________反应填“放热”或“吸热”。
答案和解析
1.【答案】
【解析】操作均有利于合成氨的化学平衡向正反应方向移动,提高转化率。
2.【答案】
【解析】错,催化剂可提高合成氨反应的速率,但不影响平衡移动。故不影响平衡转化率;
错,合成氨是放热反应,所以低温有利于平衡正向移动,利于提高的平衡转化率,但反应速率跟温度有关,温度越高速率越大,所以温度要既保证一定速率,又保证反应尽量向正反应方向移动,同时还要确保催化剂活性,因为催化剂活性跟温度关系很大,一般合成氨反应是保证催化活性最大,不是为了使化学平衡向正反应方向移动;
错,合成氨的反应是气体分子数减小的反应,高压有利于平衡向正反应方向移动,且能提高正反应速率,跟催化剂无关;
对,合成氨的反应是气体分子数减小的反应,高压有利于平衡向正反应方向移动,且能提高正反应速率,故合成氨工业采用高压,不仅能提高转化率,还能缩短达到平衡的时间。
3.【答案】
【解析】 此反应的正反应是放热反应,升高温度平衡向逆反应方向移动,平衡常数只受温度的影响,即升高温度,减小,正确;反应前后气体化学计量数之和相等,减小压强,平衡不移动,即不变,错误;催化剂对化学平衡无影响,因此的转化率不变,错误;恒压下充入,容器的体积增大,组分浓度降低,但化学反应前后气体化学计量数之和不变,因此化学平衡不移动,不变,正确。
4.【答案】
【解析】已知反应Ⅰ为吸热反应,且只有反应Ⅰ生成了,升高温度,反应Ⅰ平衡正向移动,的体积分数增大,题图中表示,A错误;反应Ⅲ为放热反应,反应物所含化学键的键能之和小于生成物所含化学键的键能之和,B错误;温度从上升至时,的平衡转化率增大,则反应Ⅰ消耗的大于反应Ⅱ生成的,C错误;其他条件不变,将压强增大到,反应Ⅰ平衡不移动,而反应Ⅱ平衡正向移动,甲醇的浓度增大,导致反应Ⅲ平衡正向移动,可提高平衡时的体积分数,D正确。
5.【答案】
【解析】该反应为放热反应,温度升高平衡向逆反应方向移动,的质量分数减小,故A正确;
增大压强平衡向气体体积减小的方向移动,即向正反应方向移动,,且增大压强,正、逆反应速率都增大,故B错误;
催化剂同等程度地改变正、逆反应速率,平衡不发生移动,所以达到平衡时的浓度相同,故C错误;
该反应为放热反应,温度升高平衡向逆反应方向移动,的转化率降低,故D错误。
6.【答案】
【解析】错,根据题意可知当生成时放出能量,但合成氨的反应为可逆反应,氮气和氢气不能完全反应生成氨气,所以放出的热量少于
错,到温度不变,则平衡常数不变;
对,该反应正反应为气体化学计量数之和减小的反应,所以增大压强平衡正向移动,氢气的转化率提高;
错,压强不变通入惰性气体,反应相关物质的分压会减小,平衡逆向移动。
故选:。
7.【答案】
【解析】错,增大压强时,容器的容积缩小,浓度增大,体系颜色变深;
错,物质易被液化,改变压强如果变为液体,反应变成了一个反应前后气体体积不变的可逆反应,改变压强,平衡不发生移动;
对,升温时平衡逆向移动,正、逆反应速率都会加快,但逆反应速率大于正反应速率;
错,分离出时,正反应速率开始不变后逐渐减慢。
故选:。
8.【答案】
,,加入后,结合使减小,促进上述电离平衡正向移动,增大,与结合形成磷酸铁沉淀
时,沉淀中的磷酸铁会有部分开始转变生成,使得部分释放,导致磷沉淀率下降
【解析】略
略
已知,当后,随增加,溶液中增大,开始转变生成,促进溶解平衡正向移动,使得部分释放,导致磷沉淀率下降。
9.【答案】
溶液,向其中滴加滴溶液
慢
取少量反应Ⅰ的溶液于试管中,向其中加入几滴溶液,溶液无明显变化,说明反应Ⅰ是一个不可逆反应
被硝酸氧化为,溶液中浓度降低,导致平衡逆向移动,最终几乎完全转化为,溶液由棕色变为黄色
【解析】与粉发生反应生成和,反应的离子方程式为。
由反应,可知题图得到的溶液中为,为,分别取的硫酸铜溶液、的硫酸亚铁溶液,滴入溶液进行对照实验,故步骤:取 溶液,向其中滴加滴溶液;步骤:取溶液,向其中滴加滴溶液。由已知信息、可知,与反应生成沉淀,同时生成,反应的离子方程式为。
具有还原性,稀硝酸具有强氧化性,两者反应生成、与水,反应的离子方程式为。
溶液先变为棕色,放置一段时间后,棕色消失,溶液变为黄色,反应速率快的反应现象最先表现,故反应Ⅰ的速率比反应Ⅱ的慢。
若反应Ⅰ是一个可逆反应,则反应Ⅰ结束后溶液中含有,否则没有,具体的实验方案是取少量反应Ⅰ的溶液于试管中,向其中加入几滴溶液,溶液无明显变化,说明反应Ⅰ是不可逆反应。
被硝酸氧化为,溶液中浓度降低,导致平衡逆向移动,最终几乎完全转化为,溶液由棕色变为黄色。
10.【答案】
;
Ⅳ; 对、加压;将产物液化分离,减小生成物浓度;将未反应的、循环使用。
【解析】由题给反应信息得出化学方程式为。
增大水蒸气浓度,平衡右移,但平衡体系中百分含量不一定提高;加入催化剂,对平衡无影响,不能提高平衡体系中百分含量;降低压强,反应速率减慢。设达到平衡时转化了 ,则
,,。
方法:设起始 物质的量为 ,物质的量为 ,达到平衡时转化了 ,则
,,故体积分数。
方法:由、按物质的量投料,与又按照物质的量发生反应,故从反应开始到反应平衡,和物质的量之比始终为。体积分数。
在温度达到一定程度时,开始生成,在未达到平衡前,物质的量是增大的,达到平衡后,温度升高,平衡逆向移动,物质的量逐渐减小,变化曲线见答案。
通过热交换步骤Ⅳ,加热进入合成塔的原料气,同时冷却从合成塔出来的平衡混合气。提高原料总转化率的方法有:对、加压;将产物液化分离,减小生成物浓度;将未反应的、循环使用。
11.【答案】常压
热裂解反应的平衡向正反应方向移动,脱羧反应的平衡向逆反应方向移动,故氢气产率高于甲烷产率
【解析】在密闭容器中,发生反应,反应前后气体分子数增大,增大压强,平衡逆向移动,氢气产率降低,故相对于较大压强,常压下氢气的产率较高且能耗低。
热裂解反应的正反应吸热,脱羧反应的正反应放热,约之后升温,热裂解反应的平衡向正反应方向移动,脱羧反应的平衡向逆反应方向移动,故氢气产率高于甲烷产率。
中掺杂的水蒸气与反应生成二氧化碳和氢气,氢气产率显著升高而的产率降低,。
12.【答案】;;;;
气体;固体或液体;气体;
放热。
【解析】
【分析】
本题考查化学平衡的计算,为高频考点,侧重于学生的分析能力的考查,注意把握化学反应速率与化学计量数的关系,把握温度、压强对平衡移动的影响,难度不大。
【解答】
同一化学反应的同一时间段内,参加反应的各物质的物质的量之比等于其计量数之比,所以::: ::: :::,所以、、、分别为、、、;
故答案为:;;;;
压强对化学反应前后气体体积不变的可逆反应的平衡状态无影响,根据题意知,该反应前后气体体积不变,
反应中,已知生成物是固体,要使反应前后气体体积不变即计量数不变,那么只能是、是气体,是液体或固体;
故答案为:气体;固体或液体;气体;
升高温度,平衡向吸热方向移动;根据题意知,开始反应时,、的物质的量减少,、的物质的量增加,所以平衡向正反应方向移动;升高温度,反应一段时间后,测知这四种物质的物质的量相等,说明平衡向逆反应方向移动,所以正反应是放热反应;
故答案为:放热。
第12页,共13页
21世纪教育网(www.21cnjy.com)
