1.2反应热的计算【人教版(2019)】高中化学选修1 同步练习(含答案解析)
文档属性
| 名称 | 1.2反应热的计算【人教版(2019)】高中化学选修1 同步练习(含答案解析) |  | |
| 格式 | docx | ||
| 文件大小 | 992.7KB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-07-22 17:09:39 | ||
图片预览




文档简介
中小学教育资源及组卷应用平台
1.2反应热的计算人教版(2019)高中化学选择性必修一同步练习
学校:___________姓名:___________班级:___________考号:___________
注意事项:
1.答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡对应题目的答案标号涂黑;如需改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上,写在试卷上无效。
3.考试结束后,本试卷和答题卡一并交回。
第I卷(选择题)
一、单选题(本大题共7小题,共21.0分)
下列有关热化学方程式的叙述正确的是( )
A. ,则氢气的燃烧热为
B. 已知石墨,金刚石,的,则金刚石比石墨稳定
C. 含的稀溶液与稀盐酸完全中和,放出的热量,则中和热的热化学方程式为
D. 已知 , ,则
已知:燃烧生成一氧化碳放出的热量;氧化亚铜与氧气反应的能量变化如图所示。下列叙述正确的是( )
A. 碳的燃烧热为
B. 分解生成放出的热量
C. 反应的活化能为
D. 足量碳与反应生成的热化学方程式为
已知可分别通过如下两个反应制取氢气:
则下列说法正确的是( )
A. 乙醇的燃烧热
B. 升高反应的反应温度,乙醇的平衡转化率减小
C.
D. 制取等量的氢气,反应吸收的能量更少
已知:
根据以上热化学方程式判断,下列说法正确的是( )
A. 的标准燃烧热为
B. 如图可表示由生成的反应过程和能量关系
C.
D. 与反应放出热量时,电子转移数为
在一定条件下发生如下反应:
反应Ⅰ:
反应Ⅱ:
反应Ⅲ:
下列说法正确的是( )
A. 反应Ⅰ中各物质的化学计量数既可表示物质的量,又可表示分子个数
B. 反应Ⅱ中和的总能量低于的总能量
C. 的数值为
D. 的数值大小与物质的状态无关
已知:
根据以上热化学方程式判断,下列说法正确的是
A. 的燃烧热为
B. 如图可表示由生成的反应过程和能量关系
C.
D. 与反应放出 热量时,电子转移数为
已知、下,,石墨;,金刚石。据此判断,下列说法正确的是( )
A. 石墨的燃烧热为
B. 由石墨制备金刚石是吸热反应,,石墨,金刚石
C. 如果使用催化剂,和都变小
D. 石墨不如金刚石稳定
第II卷(非选择题)
二、流程题(本大题共1小题,共8.0分)
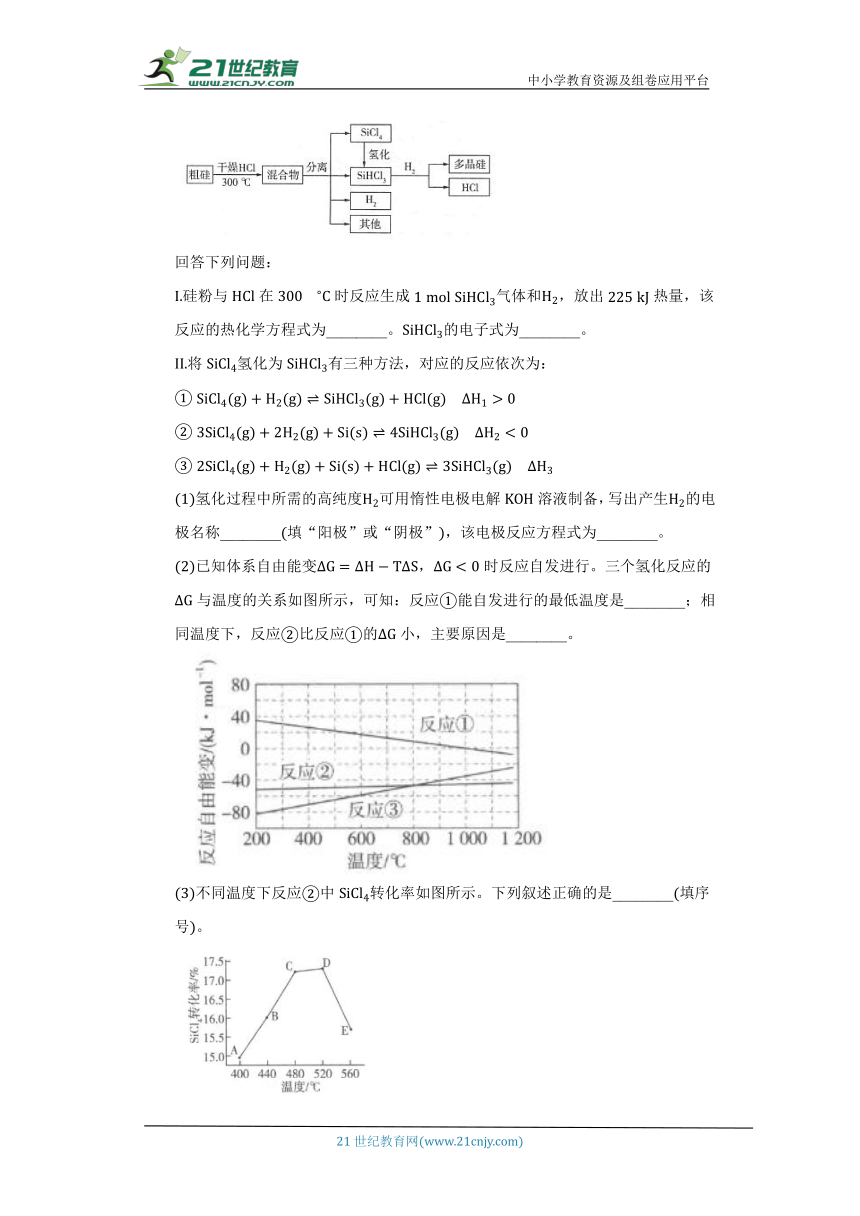
多晶硅是制作光伏电池的关键材料。以下是由粗硅制备多晶硅的简易过程。
回答下列问题:
硅粉与在时反应生成气体和,放出热量,该反应的热化学方程式为________。的电子式为________。
将氢化为有三种方法,对应的反应依次为:
氢化过程中所需的高纯度可用惰性电极电解溶液制备,写出产生的电极名称________填“阳极”或“阴极”,该电极反应方程式为________。
已知体系自由能变,时反应自发进行。三个氢化反应的与温度的关系如图所示,可知:反应能自发进行的最低温度是________;相同温度下,反应比反应的小,主要原因是________。
不同温度下反应中转化率如图所示。下列叙述正确的是________填序号。
点::点点 反应适宜温度:
反应的________用,表示。温度升高,反应的平衡常数________填“增大”“减小”或“不变”。
由粗硅制备多晶硅过程中循环使用的物质除、和外,还有________填分子式。
三、实验题(本大题共1小题,共10.0分)
化学反应原理研究物质转化过程中的规律并在生产生活中有广泛的应用。
汽车排气管内的催化转化器可实现尾气无毒处理。
已知:
则:
反应的______。
在时,将 、 通入固定容积的密闭容器中,后,反应达平衡,测得的浓度为,则的转化率______,反应平衡常数______保留两位有效数字。
若改变下列条件之一,达新平衡时的体积分数一定减小的是______填序号。
增加的量 加入催化剂 降低温度 扩大容器体积
某实验小组在研究“反应条件对化学平衡的影响”时做了如下两个实验。
探究浓度对平衡的影响
已知四氯合钴Ⅱ离子蓝色与六水合钴Ⅱ离子粉红色之间存在如下平衡:。甲同学向某已呈现紫色的氯化钴溶液中通入,发现溶液变为______色;乙同学向溶液中加水,平衡移动方向为______填“向右”、“向左”或“不移动”,说明原因______。
运用数字化实验探究压强对平衡的影响
将一收集满干燥的注射器与色度计、电脑连接,推压活塞可得到如下实验曲线。
由图可知:增大压强,该混合气体的颜色变化为______。
四、简答题(本大题共2小题,共16.0分)
当今,世界多国相继规划了碳达峰、碳中和的时间节点。因此,研发二氧化碳利用技术,降低空气中二氧化碳含量成为研究热点。
大气中的二氧化碳主要来自于煤、石油及其他含碳化合物的燃烧。已知时,相关物质的燃烧热数据如表:
物质 石墨,
燃烧热
则时和石墨,生成的热化学方程式为 。
探究合成反应化学平衡的影响因素,有利于提高的产率。以、为原料合成涉及的主要反应如下:
Ⅰ
Ⅱ
Ⅲ
_______
天然气的主要成分为,一般还含有等烃类,是重要的燃料和化工原料。乙烷在一定条件可发生如下反应:,相关物质的燃烧热数据如下表所示:
物质
燃烧热
_______
硫酸是一种重要的基本化工产品。接触法制硫酸生产中的关键工序是的催化氧化:。钒催化剂参与反应的能量变化如图所示,与反应生成和的热化学方程式为________________________________。
五、推断题(本大题共1小题,共10.0分)
短周期元素、、、在周期表中位置如图所示,其中元素原子最外层有个电子。
与氢元素可以形成很多化合物,在这些化合物中都含有______选填“共价”或“离子”键;与相邻且最外层电子比少个的离子结构示意图为_________。、、形成的离子的半径由大到小依次为_________填相应的离子符号。
元素的气态氢化物和氧气在溶液中可构成燃料电池,该电池工作时负极的电极反应式为__________________,电池工作时,移向电池的___________极。当电池放电转移电子时,至少消耗燃料___________.
由与形成的液态化合物在中完全燃烧,生成两种气态氧化物,时放出热量。该反应的热化学方程式为 。
已知时,
;
;
写出单质和反应的热化学方程式是_______________________________________。
答案和解析
1.【答案】
【解析】A.表示氢气燃烧热时产物中的水应该为液态,故A错误;
B.已知石墨,金刚石,的,则石墨能量较低,更稳定,故B错误;
C.含即的稀溶液与稀盐酸完全中和,放出的热量,则中和热的热化学方程式为 ,故C错误;
D.已知 , ,完全燃烧时放出的热量多,故,故D正确。
2.【答案】
【解析】根据题意, ,而的燃烧热是指完全燃烧生成时所放出的热量,项错误;
根据图示, ,则分解生成吸收的热量为,项错误;
的反应热为,活化能为,项错误;
, ,根据盖斯定律,由,可得:,项正确。
3.【答案】
【解析】根据题意,无法得知乙醇的燃烧热,项错误;
升高反应的反应温度,平衡正向移动,乙醇的平衡转化率增大,项错误;
根据盖斯定律,由反应反应得 ,项错误;制取等量的氢气,反应吸收的能量低于反应,项正确。
4.【答案】
【解析】
【分析】
本题旨在考查学生对热化学方程式、燃烧热、盖斯定律及有关计算的综合应用,是高考常考知识点,难度一般。关键是掌握利用盖斯定律计算的方法,侧重知识、能力的考查。
【解答】
A. ,燃烧热是可燃物完全燃烧生成稳定氧化物时放出的热量,则一氧化碳的燃烧热为,单位不对,故A错误;
B.依据热化学方程式 ,图象中一氧化碳和氧气物质的量的比为:,不符合热化学方程式中反应物的物质的量,故B错误;
C. ,变成气体是吸热过程,所以 ,故C错误;
D., ,依据盖斯定律得 ,则与反应放出热量时消耗,转移了电子,电子转移数为,故D正确。
故选D。
5.【答案】
【解析】错,反应Ⅰ中各物质的化学计量数只能表示物质的量,不能表示分子个数;
错,反应Ⅱ是放热反应,则反应中和的总能量高于的总能量;
对,根据盖斯定律可知反应Ⅰ反应Ⅱ即得到反应Ⅲ的逆反应,所以的数值为;
错,物质的聚集状态不同,含有的能量不同,的数值大小与物质的状态有关系。
6.【答案】
【解析】
【分析】
本题旨在考查学生对热化学方程式、燃烧热、盖斯定律及有关计算的综合应用,是高考常考知识点,难度一般。关键是掌握利用盖斯定律计算的方法,侧重知识、能力的考查。
【解答】
A. ,燃烧热是指纯物质完全燃烧生成稳定氧化物时放出的热量,则一氧化碳的燃烧热为,单位不对,故A错误;
B.依据热化学方程式 ,图象中一氧化碳和氧气物质的量的比为:,不符合热化学方程式中反应物的物质的量,故B错误;
C. ,变成气体是吸热过程,所以该反应放出的热量就少于,焓变为负值,,即 ,故C正确;
D., ,依据盖斯定律得 ,则与反应放出热量时消耗,转移了电子,电子转移数为,故D错误。
故选C。
7.【答案】
【解析】错,石墨燃烧生成放出的热量为,但是燃烧热是指燃烧生成时放出的热量;
对,已知,石墨,,金刚石,由盖斯定律可得,石墨,金刚石的,焓变大于,为吸热反应;
错,催化剂只改变反应速率,不影响热效应;
错,石墨生成金刚石为吸热反应,说明石墨的能量更低,更稳定。
8.【答案】I. ;
Ⅱ阴极;
;,导致反应的小
、
;减小
、
【解析】I.该反应的热化学方程式为 。
的结构式为,故电子式为。
Ⅱ用惰性电极电解溶液,实质为电解水,阴极上产生氢气,电极反应式为。
时,反应能自发进行,故反应自发进行的最低温度为。由于,反应的,而反应的,,,因此相同温度下反应比反应的小的主要原因为。
项,同一点比较正逆反应速率看反应进行方向,点反应正向进行,所以,正确;
项,不同点比较正逆反应速率看反应条件,点温度低于点温度,所以:点点,错误;
项,根据题图知,温度在时,转化率高,为反应适宜温度,正确。
根据盖斯定律,由反应反应,可得反应,则。由,知,反应为放热反应,升高温度,平衡逆向移动,平衡常数减小。
根据由粗硅制备多晶硅的过程可知,循环使用的物质还有和。
9.【答案】;;;;
蓝;向右;向溶液加水稀释时,溶液中离子浓度均成比例减少,;先变深后变浅,但比原来颜色深
【解析】
【分析】
本题考查了热化学方程式书写、化学平衡常数的计算应用、影响化学平衡因素分析判断,掌握基础是解题关键,题目难度中等。
【解答】
已知:Ⅰ、
Ⅱ、
Ⅲ、
盖斯定律计算:ⅢⅡⅠ得到反应:,
得到:,
故答案为:;
在时,将、通入固定容积的密闭容器中,后,反应达平衡,测得的浓度为,
起始量
变化量
平衡量
则的转化率,
平衡常数,
故答案为:;;
若改变下列条件之一,达新平衡时的体积分数一定减小,说明改变条件平衡正向进行,
增加的量,平衡正向进行,体积分数减小,故正确;
加入催化剂改变反应速率不改变化学平衡,体积分数不变,故错误;
反应为放热反应,降低温度,平衡正向进行,体积分数减小,故正确;
扩大容器体积,压强减小,平衡逆向进行,体积分数增大,故错误;
故答案为:;
已知四氯合钴Ⅱ离子蓝色与六水合钴Ⅱ离子粉红色之间存在如下平衡:。甲同学向某已呈现紫色的氯化钴溶液中通入,氯离子浓度增大,平衡逆向进行,溶液显蓝色,加水平衡向右进行,溶液显粉红色,向溶液加水稀释时,溶液中离子浓度均成比例减少,,
故答案为:蓝;向右;向溶液加水稀释时,溶液中离子浓度均成比例减少,;
容器中存在化学平衡,增大压强,体积缩小,二氧化氮浓度增大,气体颜色变深,压强增大平衡向气体体积减小的方向进行,但由透过率曲线可知平衡时颜色仍比原来深,则增大压强,该混合气体的颜色变化为:先变深后变浅,但比原来颜色深,
故答案为:先变深后变浅,但比原来颜色深。
10.【答案】
【解析】根据表格中燃烧热数据可知,存在反应 , , ,根据盖斯定律,得反应: 。
11.【答案】
【解析】根据盖斯定律,反应ⅠⅡⅢ,则。
由表中燃烧热数值可知:;;;根据盖斯定律,得,则。
根据盖斯定律,将反应得,则,所以该反应的热化学方程式为。
12.【答案】共价;;
;负极;
;
【解析】
【分析】
本题考查学生元素周期表的结构和应用知识,注意物质的性质的灵活应用以及热化学方程式的书写,是解题的关键,难度中等。
【解答】
根据短周期元素、、、在周期表中位置,元素原子最外层有个电子,则可以推出是,是,是,是。
碳元素的氢化物中只含有共价键;与相邻且最外层电子数比少个元素的离子为,其离子结构示意图为;电子层越多,离子半径越大,电子层数相同,核电荷数越多,离子半径越小,所以;
和氧气在溶液中可构成燃料电池,负极发生失电子的氧化反应,碱性条件下电极反应式 ;根据原电池工作原理,阴离子移向负极,则移向负极;根据电极反应式,当电池放电转移电子时,有燃料被消耗,质量;
在中完全燃烧,生成两种气态氧化物为二氧化碳和二氧化硫,时放出热量,则二硫化碳完全燃烧生成稳定氧化物放出的热量为,则热化学反应方程式为;
,
,根据盖斯定律,得到:,,
故答案为:。
第12页,共16页
21世纪教育网(www.21cnjy.com)
1.2反应热的计算人教版(2019)高中化学选择性必修一同步练习
学校:___________姓名:___________班级:___________考号:___________
注意事项:
1.答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡对应题目的答案标号涂黑;如需改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上,写在试卷上无效。
3.考试结束后,本试卷和答题卡一并交回。
第I卷(选择题)
一、单选题(本大题共7小题,共21.0分)
下列有关热化学方程式的叙述正确的是( )
A. ,则氢气的燃烧热为
B. 已知石墨,金刚石,的,则金刚石比石墨稳定
C. 含的稀溶液与稀盐酸完全中和,放出的热量,则中和热的热化学方程式为
D. 已知 , ,则
已知:燃烧生成一氧化碳放出的热量;氧化亚铜与氧气反应的能量变化如图所示。下列叙述正确的是( )
A. 碳的燃烧热为
B. 分解生成放出的热量
C. 反应的活化能为
D. 足量碳与反应生成的热化学方程式为
已知可分别通过如下两个反应制取氢气:
则下列说法正确的是( )
A. 乙醇的燃烧热
B. 升高反应的反应温度,乙醇的平衡转化率减小
C.
D. 制取等量的氢气,反应吸收的能量更少
已知:
根据以上热化学方程式判断,下列说法正确的是( )
A. 的标准燃烧热为
B. 如图可表示由生成的反应过程和能量关系
C.
D. 与反应放出热量时,电子转移数为
在一定条件下发生如下反应:
反应Ⅰ:
反应Ⅱ:
反应Ⅲ:
下列说法正确的是( )
A. 反应Ⅰ中各物质的化学计量数既可表示物质的量,又可表示分子个数
B. 反应Ⅱ中和的总能量低于的总能量
C. 的数值为
D. 的数值大小与物质的状态无关
已知:
根据以上热化学方程式判断,下列说法正确的是
A. 的燃烧热为
B. 如图可表示由生成的反应过程和能量关系
C.
D. 与反应放出 热量时,电子转移数为
已知、下,,石墨;,金刚石。据此判断,下列说法正确的是( )
A. 石墨的燃烧热为
B. 由石墨制备金刚石是吸热反应,,石墨,金刚石
C. 如果使用催化剂,和都变小
D. 石墨不如金刚石稳定
第II卷(非选择题)
二、流程题(本大题共1小题,共8.0分)
多晶硅是制作光伏电池的关键材料。以下是由粗硅制备多晶硅的简易过程。
回答下列问题:
硅粉与在时反应生成气体和,放出热量,该反应的热化学方程式为________。的电子式为________。
将氢化为有三种方法,对应的反应依次为:
氢化过程中所需的高纯度可用惰性电极电解溶液制备,写出产生的电极名称________填“阳极”或“阴极”,该电极反应方程式为________。
已知体系自由能变,时反应自发进行。三个氢化反应的与温度的关系如图所示,可知:反应能自发进行的最低温度是________;相同温度下,反应比反应的小,主要原因是________。
不同温度下反应中转化率如图所示。下列叙述正确的是________填序号。
点::点点 反应适宜温度:
反应的________用,表示。温度升高,反应的平衡常数________填“增大”“减小”或“不变”。
由粗硅制备多晶硅过程中循环使用的物质除、和外,还有________填分子式。
三、实验题(本大题共1小题,共10.0分)
化学反应原理研究物质转化过程中的规律并在生产生活中有广泛的应用。
汽车排气管内的催化转化器可实现尾气无毒处理。
已知:
则:
反应的______。
在时,将 、 通入固定容积的密闭容器中,后,反应达平衡,测得的浓度为,则的转化率______,反应平衡常数______保留两位有效数字。
若改变下列条件之一,达新平衡时的体积分数一定减小的是______填序号。
增加的量 加入催化剂 降低温度 扩大容器体积
某实验小组在研究“反应条件对化学平衡的影响”时做了如下两个实验。
探究浓度对平衡的影响
已知四氯合钴Ⅱ离子蓝色与六水合钴Ⅱ离子粉红色之间存在如下平衡:。甲同学向某已呈现紫色的氯化钴溶液中通入,发现溶液变为______色;乙同学向溶液中加水,平衡移动方向为______填“向右”、“向左”或“不移动”,说明原因______。
运用数字化实验探究压强对平衡的影响
将一收集满干燥的注射器与色度计、电脑连接,推压活塞可得到如下实验曲线。
由图可知:增大压强,该混合气体的颜色变化为______。
四、简答题(本大题共2小题,共16.0分)
当今,世界多国相继规划了碳达峰、碳中和的时间节点。因此,研发二氧化碳利用技术,降低空气中二氧化碳含量成为研究热点。
大气中的二氧化碳主要来自于煤、石油及其他含碳化合物的燃烧。已知时,相关物质的燃烧热数据如表:
物质 石墨,
燃烧热
则时和石墨,生成的热化学方程式为 。
探究合成反应化学平衡的影响因素,有利于提高的产率。以、为原料合成涉及的主要反应如下:
Ⅰ
Ⅱ
Ⅲ
_______
天然气的主要成分为,一般还含有等烃类,是重要的燃料和化工原料。乙烷在一定条件可发生如下反应:,相关物质的燃烧热数据如下表所示:
物质
燃烧热
_______
硫酸是一种重要的基本化工产品。接触法制硫酸生产中的关键工序是的催化氧化:。钒催化剂参与反应的能量变化如图所示,与反应生成和的热化学方程式为________________________________。
五、推断题(本大题共1小题,共10.0分)
短周期元素、、、在周期表中位置如图所示,其中元素原子最外层有个电子。
与氢元素可以形成很多化合物,在这些化合物中都含有______选填“共价”或“离子”键;与相邻且最外层电子比少个的离子结构示意图为_________。、、形成的离子的半径由大到小依次为_________填相应的离子符号。
元素的气态氢化物和氧气在溶液中可构成燃料电池,该电池工作时负极的电极反应式为__________________,电池工作时,移向电池的___________极。当电池放电转移电子时,至少消耗燃料___________.
由与形成的液态化合物在中完全燃烧,生成两种气态氧化物,时放出热量。该反应的热化学方程式为 。
已知时,
;
;
写出单质和反应的热化学方程式是_______________________________________。
答案和解析
1.【答案】
【解析】A.表示氢气燃烧热时产物中的水应该为液态,故A错误;
B.已知石墨,金刚石,的,则石墨能量较低,更稳定,故B错误;
C.含即的稀溶液与稀盐酸完全中和,放出的热量,则中和热的热化学方程式为 ,故C错误;
D.已知 , ,完全燃烧时放出的热量多,故,故D正确。
2.【答案】
【解析】根据题意, ,而的燃烧热是指完全燃烧生成时所放出的热量,项错误;
根据图示, ,则分解生成吸收的热量为,项错误;
的反应热为,活化能为,项错误;
, ,根据盖斯定律,由,可得:,项正确。
3.【答案】
【解析】根据题意,无法得知乙醇的燃烧热,项错误;
升高反应的反应温度,平衡正向移动,乙醇的平衡转化率增大,项错误;
根据盖斯定律,由反应反应得 ,项错误;制取等量的氢气,反应吸收的能量低于反应,项正确。
4.【答案】
【解析】
【分析】
本题旨在考查学生对热化学方程式、燃烧热、盖斯定律及有关计算的综合应用,是高考常考知识点,难度一般。关键是掌握利用盖斯定律计算的方法,侧重知识、能力的考查。
【解答】
A. ,燃烧热是可燃物完全燃烧生成稳定氧化物时放出的热量,则一氧化碳的燃烧热为,单位不对,故A错误;
B.依据热化学方程式 ,图象中一氧化碳和氧气物质的量的比为:,不符合热化学方程式中反应物的物质的量,故B错误;
C. ,变成气体是吸热过程,所以 ,故C错误;
D., ,依据盖斯定律得 ,则与反应放出热量时消耗,转移了电子,电子转移数为,故D正确。
故选D。
5.【答案】
【解析】错,反应Ⅰ中各物质的化学计量数只能表示物质的量,不能表示分子个数;
错,反应Ⅱ是放热反应,则反应中和的总能量高于的总能量;
对,根据盖斯定律可知反应Ⅰ反应Ⅱ即得到反应Ⅲ的逆反应,所以的数值为;
错,物质的聚集状态不同,含有的能量不同,的数值大小与物质的状态有关系。
6.【答案】
【解析】
【分析】
本题旨在考查学生对热化学方程式、燃烧热、盖斯定律及有关计算的综合应用,是高考常考知识点,难度一般。关键是掌握利用盖斯定律计算的方法,侧重知识、能力的考查。
【解答】
A. ,燃烧热是指纯物质完全燃烧生成稳定氧化物时放出的热量,则一氧化碳的燃烧热为,单位不对,故A错误;
B.依据热化学方程式 ,图象中一氧化碳和氧气物质的量的比为:,不符合热化学方程式中反应物的物质的量,故B错误;
C. ,变成气体是吸热过程,所以该反应放出的热量就少于,焓变为负值,,即 ,故C正确;
D., ,依据盖斯定律得 ,则与反应放出热量时消耗,转移了电子,电子转移数为,故D错误。
故选C。
7.【答案】
【解析】错,石墨燃烧生成放出的热量为,但是燃烧热是指燃烧生成时放出的热量;
对,已知,石墨,,金刚石,由盖斯定律可得,石墨,金刚石的,焓变大于,为吸热反应;
错,催化剂只改变反应速率,不影响热效应;
错,石墨生成金刚石为吸热反应,说明石墨的能量更低,更稳定。
8.【答案】I. ;
Ⅱ阴极;
;,导致反应的小
、
;减小
、
【解析】I.该反应的热化学方程式为 。
的结构式为,故电子式为。
Ⅱ用惰性电极电解溶液,实质为电解水,阴极上产生氢气,电极反应式为。
时,反应能自发进行,故反应自发进行的最低温度为。由于,反应的,而反应的,,,因此相同温度下反应比反应的小的主要原因为。
项,同一点比较正逆反应速率看反应进行方向,点反应正向进行,所以,正确;
项,不同点比较正逆反应速率看反应条件,点温度低于点温度,所以:点点,错误;
项,根据题图知,温度在时,转化率高,为反应适宜温度,正确。
根据盖斯定律,由反应反应,可得反应,则。由,知,反应为放热反应,升高温度,平衡逆向移动,平衡常数减小。
根据由粗硅制备多晶硅的过程可知,循环使用的物质还有和。
9.【答案】;;;;
蓝;向右;向溶液加水稀释时,溶液中离子浓度均成比例减少,;先变深后变浅,但比原来颜色深
【解析】
【分析】
本题考查了热化学方程式书写、化学平衡常数的计算应用、影响化学平衡因素分析判断,掌握基础是解题关键,题目难度中等。
【解答】
已知:Ⅰ、
Ⅱ、
Ⅲ、
盖斯定律计算:ⅢⅡⅠ得到反应:,
得到:,
故答案为:;
在时,将、通入固定容积的密闭容器中,后,反应达平衡,测得的浓度为,
起始量
变化量
平衡量
则的转化率,
平衡常数,
故答案为:;;
若改变下列条件之一,达新平衡时的体积分数一定减小,说明改变条件平衡正向进行,
增加的量,平衡正向进行,体积分数减小,故正确;
加入催化剂改变反应速率不改变化学平衡,体积分数不变,故错误;
反应为放热反应,降低温度,平衡正向进行,体积分数减小,故正确;
扩大容器体积,压强减小,平衡逆向进行,体积分数增大,故错误;
故答案为:;
已知四氯合钴Ⅱ离子蓝色与六水合钴Ⅱ离子粉红色之间存在如下平衡:。甲同学向某已呈现紫色的氯化钴溶液中通入,氯离子浓度增大,平衡逆向进行,溶液显蓝色,加水平衡向右进行,溶液显粉红色,向溶液加水稀释时,溶液中离子浓度均成比例减少,,
故答案为:蓝;向右;向溶液加水稀释时,溶液中离子浓度均成比例减少,;
容器中存在化学平衡,增大压强,体积缩小,二氧化氮浓度增大,气体颜色变深,压强增大平衡向气体体积减小的方向进行,但由透过率曲线可知平衡时颜色仍比原来深,则增大压强,该混合气体的颜色变化为:先变深后变浅,但比原来颜色深,
故答案为:先变深后变浅,但比原来颜色深。
10.【答案】
【解析】根据表格中燃烧热数据可知,存在反应 , , ,根据盖斯定律,得反应: 。
11.【答案】
【解析】根据盖斯定律,反应ⅠⅡⅢ,则。
由表中燃烧热数值可知:;;;根据盖斯定律,得,则。
根据盖斯定律,将反应得,则,所以该反应的热化学方程式为。
12.【答案】共价;;
;负极;
;
【解析】
【分析】
本题考查学生元素周期表的结构和应用知识,注意物质的性质的灵活应用以及热化学方程式的书写,是解题的关键,难度中等。
【解答】
根据短周期元素、、、在周期表中位置,元素原子最外层有个电子,则可以推出是,是,是,是。
碳元素的氢化物中只含有共价键;与相邻且最外层电子数比少个元素的离子为,其离子结构示意图为;电子层越多,离子半径越大,电子层数相同,核电荷数越多,离子半径越小,所以;
和氧气在溶液中可构成燃料电池,负极发生失电子的氧化反应,碱性条件下电极反应式 ;根据原电池工作原理,阴离子移向负极,则移向负极;根据电极反应式,当电池放电转移电子时,有燃料被消耗,质量;
在中完全燃烧,生成两种气态氧化物为二氧化碳和二氧化硫,时放出热量,则二硫化碳完全燃烧生成稳定氧化物放出的热量为,则热化学反应方程式为;
,
,根据盖斯定律,得到:,,
故答案为:。
第12页,共16页
21世纪教育网(www.21cnjy.com)
