2.2化学平衡【人教版(2019)】高中化学选修1 同步练习(含答案解析)
文档属性
| 名称 | 2.2化学平衡【人教版(2019)】高中化学选修1 同步练习(含答案解析) |  | |
| 格式 | docx | ||
| 文件大小 | 1.4MB | ||
| 资源类型 | 试卷 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-07-22 17:09:39 | ||
图片预览




文档简介
中小学教育资源及组卷应用平台
2.2化学平衡人教版(2019)高中化学选择性必修一同步练习
学校:___________姓名:___________班级:___________考号:___________
注意事项:
1.答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡对应题目的答案标号涂黑;如需改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上,写在试卷上无效。
3.考试结束后,本试卷和答题卡一并交回。
第I卷(选择题)
一、单选题(本大题共7小题,共21.0分)
在恒容绝热的容器中投入和进行反应: 。下列说法正确的是( )
A. 该反应的
B. 容器中压强不变,表明反应达到平衡状态
C. 反应达到平衡后增加的浓度,再次平衡时的体积分数减小
D. 反应达到平衡状态后增加的量,容器内的温度会升高
在二氧化碳加氢制甲烷的反应体系中,主要发生反应的热化学方程式为:
反应Ⅰ:
反应Ⅱ:
反应Ⅲ:
向恒压、密闭容器中通入和,平衡时、、的物质的量随温度的变化如图所示。下列说法正确的是( )
A. 反应的平衡常数可表示为
B. 图中曲线表示的物质的量随温度的变化
C. 提高转化为的转化率,需要研发在低温区高效的催化剂
D. 的
一定温度下,密闭容器中进行反应:。测得随反应时间的变化如图所示。下列有关说法正确的是。( )
A. 时改变的条件:只加入一定量的
B. 、、时刻对应的平衡常数不相同
C. 时平衡混合气的大于时平衡混合气的
D. 时平衡混合气中的体积分数等于时平衡混合气中的体积分数
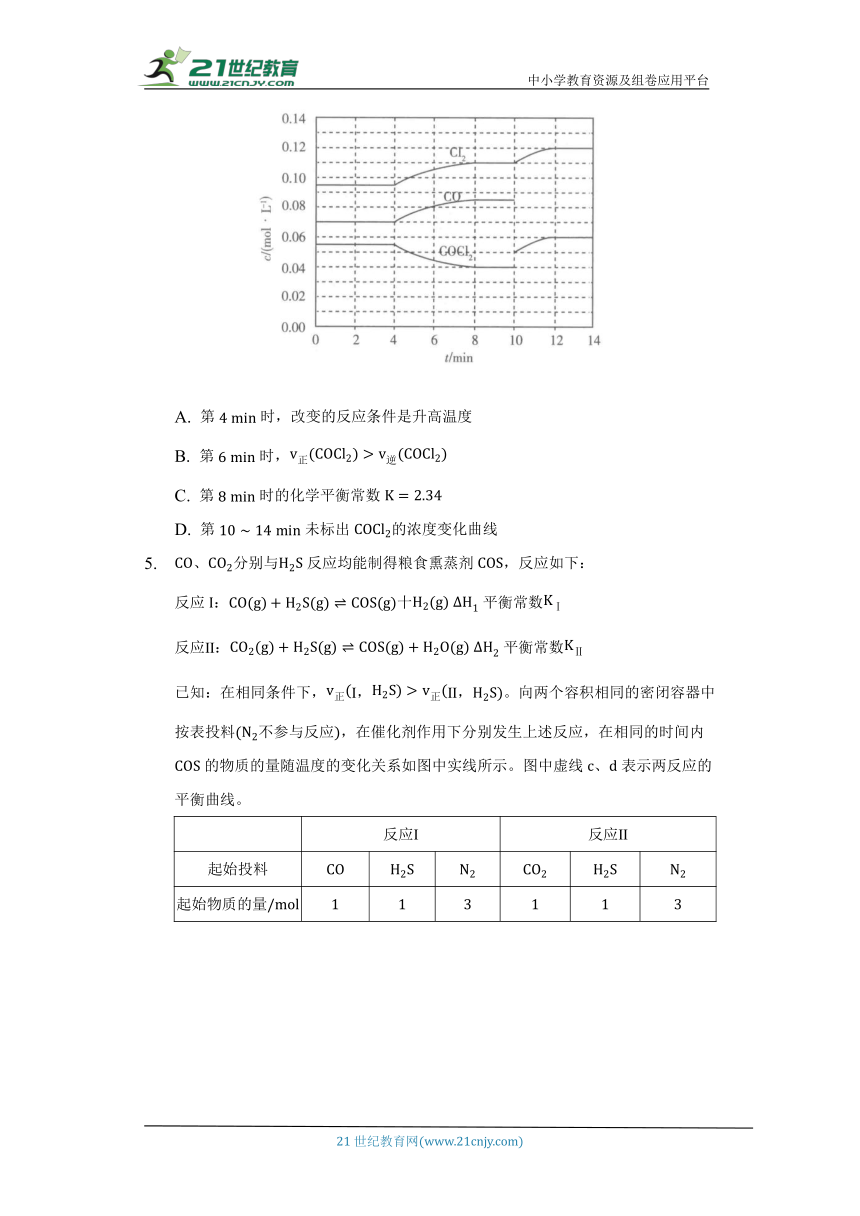
的分解反应为。某科研小组研究反应体系达到平衡后改变外界条件,各物质的浓度在不同条件下的变化状况,结果如图所示。下列有关判断不正确的是( )
A. 第时,改变的反应条件是升高温度
B. 第时,
C. 第时的化学平衡常数
D. 第未标出的浓度变化曲线
、分别与反应均能制得粮食熏蒸剂,反应如下:
反应:十平衡常数
反应Ⅱ:平衡常数
已知:在相同条件下,Ⅰ,Ⅱ,。向两个容积相同的密闭容器中按表投料不参与反应,在催化剂作用下分别发生上述反应,在相同的时间内的物质的量随温度的变化关系如图中实线所示。图中虚线、表示两反应的平衡曲线。
反应Ⅰ 反应Ⅱ
起始投料
起始物质的量
下列有关说法正确的是( )
A. ,曲线为反应Ⅱ的平衡曲线
B. 时,平衡常数
C. 相同条件下,延长反应时间能使反应体系中点的量达到点
D. 恒温恒容下,向 点表示的反应体系中增大的物质的量,能提高的转化率
高温下,某反应达到平衡,平衡常数,恒容时,温度升高,浓度减小。下列说法正确的是( )
A. 该反应的焓变为正值
B. 恒温恒容下,增大压强,浓度一定减小
C. 升高温度,逆反应速率减小
D. 该反应的化学方程式为
溶液与溶液发生反应:,达到平衡。下列说法不正确的是( )
A. 加入苯,振荡,平衡正向移动
B. 经苯次萃取分离后,在水溶液中加入,溶液呈红色,表明该化学反应存在限度
C. 加入固体,平衡逆向移动
D. 该反应的平衡常数
第II卷(非选择题)
二、流程题(本大题共1小题,共8.0分)
以硅藻土为载体的五氧化二钒是接触法生产硫酸的催化剂。从废钒催化剂中回收既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:
物质
质量分数
以下是一种废钒催化剂回收工艺路线:
回答下列问题:
“酸浸”时转化为,反应的离子方程式为________,同时转化成。“废渣”的主要成分是________。
“中和”作用之一是使钒以形式存在于溶液中。“废渣”中含有________。
“离子交换”和“洗脱”可简单表示为:强碱性阴离子交换树脂。为了提高洗脱效率,淋洗液应该呈________性填“酸”“碱”或“中”。
“流出液”中阳离子最多的是________。
“沉钒”得到偏钒酸铵沉淀,写出“煅烧”中发生反应的化学方程式________。
三、实验题(本大题共1小题,共10.0分)
化学反应原理研究物质转化过程中的规律并在生产生活中有广泛的应用。
汽车排气管内的催化转化器可实现尾气无毒处理。
已知:
则:
反应的______。
在时,将 、 通入固定容积的密闭容器中,后,反应达平衡,测得的浓度为,则的转化率______,反应平衡常数______保留两位有效数字。
若改变下列条件之一,达新平衡时的体积分数一定减小的是______填序号。
增加的量 加入催化剂 降低温度 扩大容器体积
某实验小组在研究“反应条件对化学平衡的影响”时做了如下两个实验。
探究浓度对平衡的影响
已知四氯合钴Ⅱ离子蓝色与六水合钴Ⅱ离子粉红色之间存在如下平衡:。甲同学向某已呈现紫色的氯化钴溶液中通入,发现溶液变为______色;乙同学向溶液中加水,平衡移动方向为______填“向右”、“向左”或“不移动”,说明原因______。
运用数字化实验探究压强对平衡的影响
将一收集满干燥的注射器与色度计、电脑连接,推压活塞可得到如下实验曲线。
由图可知:增大压强,该混合气体的颜色变化为______。
四、简答题(本大题共2小题,共16.0分)
二氧化碳催化加氢制甲醇,有利于减少温室气体二氧化碳。二氧化碳加氢制甲醇的总反应可表示为:
合成总反应在起始物时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为,在下的、在下的如图所示。
用各物质的平衡分压表示总反应的平衡常数,表达式________________;
图中对应等压过程的曲线是________,判断的理由是________________________;
当时,的平衡转化率________,反应条件可能为________或________。
探究的合成反应平衡的影响因素,有利于提高的产率。以、为原料合成涉及的主要反应如下:
Ⅰ
Ⅱ
已知反应Ⅱ逆反应活化能为,则反应Ⅱ的正反应活化能为_____________。
在一装有压强传感器的恒温恒容密闭容器中,加入足量的和一定量的,发生上述反应,测得压强变化如下表:
时间
压强
随着反应的进行,压强变化越来越慢,原因是________________________________________。
反应达平衡后,____________,已知该温度下,反应压强平衡常数,则反应Ⅱ压强平衡常数Ⅱ_____________。
不同压强下,投入足量和一定量,实验测定的平衡转化率和的平衡产率随温度的变化关系如图所示。
其中纵坐标表示的平衡转化率的是图_________填“甲”或“乙”;压强、、由大到小的顺序为__________________;图乙中温度时,三条曲线几乎交于一点的原因是_______________
五、推断题(本大题共1小题,共10.0分)
奥昔布宁是具有解痉和抗胆碱作用的药物。其合成路线如图:
已知:
是芳香族化合物,分子中含氧官能团是________。
的反应类型是________。
的结构简式是________。
的化学方程式是_____________________。
已知:、和奥昔布宁的沸点均高于,和发生反应合成奥昔布宁时,通过在左右蒸出________填物质名称来促进反应。
奥昔布宁的结构简式是________。
答案和解析
1.【答案】
【解析】A.固体的浓度为常数,不能列入的表达式中,该反应的,A错误;
B.该反应中是固体,反应前后气体分子数不变,混合气体总物质的量始终不变,反应正向进行,在恒容绝热容器中放出热量,建立平衡的过程中温度逐渐升高,压强逐渐增大,容器中压强不变时表明反应达到平衡状态,B正确;
C.增加的浓度,平衡逆向移动,但只是减弱这种改变,再次平衡时的体积分数仍增大,故C错误;
D.由于是固体,反应达到平衡状态后增加的量,平衡不移动,对容器内的温度无影响,故D错误。
2.【答案】
【解析】化学平衡常数是生成物浓度幂之积与反应物浓度幂之积的比值,反应Ⅰ的平衡常数,A错误;
反应物的量逐渐减小,故图中曲线表示的物质的量变化曲线,由反应Ⅱ和Ⅲ可知,温度升高反应Ⅱ正向移动,反应Ⅲ逆向移动,的物质的量增大,故曲线为的物质的量变化曲线,则曲线为的物质的量变化曲线,B错误;
反应Ⅰ为放热反应,反应Ⅱ为吸热反应,降低温度有利于反应Ⅰ正向移动、反应Ⅱ逆向移动,即可提高转化为的转化率,所以需要研发在低温区高效的催化剂,C正确;
反应Ⅱ反应Ⅲ得到目标反应,则的,D错误。
3.【答案】
【解析】时,突然增大,且达到平衡后速率恢复至原来的速率,如果只加入一定量的,达到新的平衡后,速率大于原来的速率,项错误;平衡常数只与温度有关,一定温度下,值不变,项错误;平衡状态相同,各物质的百分含量相同,平均摩尔质量相同,故C项错误,项正确。
4.【答案】
【解析】A.从题图可以看出,第瞬间各物质浓度不变,则改变的条件不可能为压强、浓度,随后、浓度逐渐增大,浓度逐渐减小,说明改变条件后平衡向正反应方向移动,因为该反应的正反应为吸热反应,所以第时,改变的反应条件是升高温度,项正确;
B.第时,反应正向进行,,项正确;
C.由题图可知,第时的平衡浓度为,的平衡浓度为,的平衡浓度为,故该温度下的化学平衡常数,项错误;
D.从题图可以看出,第瞬间浓度不变,然后浓度逐渐增大,说明平衡右移,则反应物的浓度应呈减小趋势直至重新平衡,故题图上另一条曲线表示的浓度变化曲线,第时减小了的浓度,造成平衡右移,第末标出的浓度变化曲线,项正确。
5.【答案】
【解析】 已知相同条件下,反应Ⅰ速率比反应Ⅱ快,、表示两反应的平衡曲线,从题图可知,曲线的生成物的物质的量大,则曲线、表示反应Ⅰ,曲线、表示反应Ⅱ,、均随温度的升高生成物的物质的量减小,则反应Ⅰ、Ⅱ均为放热反应,A错误;时,反应Ⅰ、Ⅱ的初始量相同,平衡时反应Ⅰ的生成物的物质的量大,容器的容积相同,则反应Ⅰ中生成物的浓度大于反应Ⅱ中的,平衡常数,B正确;曲线反应未达到平衡状态,相同条件下,延长反应时间能使反应体系中点的量达到点,C错误;恒温恒容下,向点表示的反应体系中增大的物质的量,对反应体系中各物质的浓度无影响,不能提高的转化率,D错误。
6.【答案】
【解析】A.升高温度平衡正向移动,焓变为正值,故A正确;
B.恒温恒容下,充入惰性气体,增大压强,浓度不变,故B错误;
C.升高温度,逆反应速率增大,故C错误;
D.为生成物浓度幂之积与反应物浓度幂之积的比,则反应为,故D错误;
故选:。
7.【答案】
【解析】对,加入苯,振荡,苯将萃取到苯层,水溶液中减小,平衡正向移动;
对,将 溶液与 溶液混合,参与反应的与物质的量之比为,反应后过量,经苯次萃取分离后,在水溶液中加入,溶液呈红色,说明水溶液中仍含有,即没有完全消耗,表明该化学反应存在限度;
对,加入固体,溶于水电离出,增大,平衡逆向移动;
错,该反应的平衡常数。
故选:。
8.【答案】;
和
碱
【解析】反应过程中的化合价不变,所以是复分解反应。注意在离子方程式中不能拆开;废钒催化剂中,只有二氧化硅不溶于硫酸,成为废渣的主要成分。 中和时,、分别转化为难溶的和,成为废渣的主要成分。
为提高洗脱效率,需要使题中所述平衡逆向移动。根据平衡移动原理,碱性越强越有利于平衡逆向移动,所以淋洗液应该呈碱性。
经过“离子交换”,钒以形式存在,而铁、铝则在“中和”过程中转化为沉淀,所以“流出液”中最多的阳离子是钾离子。
由转化为,的化合价未发生变化,该反应为非氧化还原反应,所以该化学方程式为
9.【答案】;;;;
蓝;向右;向溶液加水稀释时,溶液中离子浓度均成比例减少,;先变深后变浅,但比原来颜色深
【解析】
【分析】
本题考查了热化学方程式书写、化学平衡常数的计算应用、影响化学平衡因素分析判断,掌握基础是解题关键,题目难度中等。
【解答】
已知:Ⅰ、
Ⅱ、
Ⅲ、
盖斯定律计算:ⅢⅡⅠ得到反应:,
得到:,
故答案为:;
在时,将、通入固定容积的密闭容器中,后,反应达平衡,测得的浓度为,
起始量
变化量
平衡量
则的转化率,
平衡常数,
故答案为:;;
若改变下列条件之一,达新平衡时的体积分数一定减小,说明改变条件平衡正向进行,
增加的量,平衡正向进行,体积分数减小,故正确;
加入催化剂改变反应速率不改变化学平衡,体积分数不变,故错误;
反应为放热反应,降低温度,平衡正向进行,体积分数减小,故正确;
扩大容器体积,压强减小,平衡逆向进行,体积分数增大,故错误;
故答案为:;
已知四氯合钴Ⅱ离子蓝色与六水合钴Ⅱ离子粉红色之间存在如下平衡:。甲同学向某已呈现紫色的氯化钴溶液中通入,氯离子浓度增大,平衡逆向进行,溶液显蓝色,加水平衡向右进行,溶液显粉红色,向溶液加水稀释时,溶液中离子浓度均成比例减少,,
故答案为:蓝;向右;向溶液加水稀释时,溶液中离子浓度均成比例减少,;
容器中存在化学平衡,增大压强,体积缩小,二氧化氮浓度增大,气体颜色变深,压强增大平衡向气体体积减小的方向进行,但由透过率曲线可知平衡时颜色仍比原来深,则增大压强,该混合气体的颜色变化为:先变深后变浅,但比原来颜色深,
故答案为:先变深后变浅,但比原来颜色深。
10.【答案】
;总反应,升高温度时平衡向逆反应方向移动,甲醇的物质的量分数减小
; ,; ,
【解析】略
11.【答案】
随着反应进行,下降,反应Ⅰ速率下降,压强变化减慢
甲 该温度下,以反应Ⅱ为主,压强对反应Ⅱ没有影响
【解析】解题思路 反应Ⅱ的正反应的活化能逆反应的活化能,故正反应的活化能逆反应的活化能。
和发生反应Ⅰ和Ⅱ,由题表知总压强变化了,对于反应Ⅰ:
起始量
转化量
对于反应Ⅱ:
起始量
转化量
反应Ⅱ的发生并不能引起压强的变化,则压强改变全部由反应Ⅰ引起 ,反应达平衡后, ,则Ⅰ ,解得,Ⅱ 。
反应Ⅰ为吸热反应,升高温度,平衡正向移动,的平衡转化率升高,故表示的平衡转化率的为图甲;反应Ⅰ为气体体积增大的反应,反应Ⅱ的气体体积不变,增大压强,反应Ⅰ平衡逆向移动,反应Ⅱ平衡不移动,则的平衡产率降低,故压强:;题图乙中温度为时,三条曲线交于一点,说明该温度下以反应Ⅱ为主,反应Ⅱ反应前后气体分子数相等,压强对反应Ⅱ没有影响。
12.【答案】酚羟基
取代反应
乙酸甲酯
【解析】是芳香族化合物,分子式为,为苯酚,结构简式为,苯酚和氢气发生加成反应制得,为环己醇,结构简式为,环己醇可以和氯化氢在加热的条件下反应生成,为,由信息可知,可以和、乙醚反应制得,为,和生成,根据的结构简式可知,的结构简式为,与浓硫酸和试剂在加热的条件下反应制得,且的分子式为,可得的结构简式为;由的结构简式逆推可知的结构简式为。
是芳香族化合物,分子式为,为苯酚,结构简式为,分子中含氧官能团是酚羟基。
环己醇可以和氯化氢在加热的条件下反应生成,的反应类型是取代反应。
由上述分析可知,的结构简式为
是与乙酸在浓硫酸、加热条件下发生酯化反应制得,反应的化学方程式是。
、和奥昔布宁的沸点均高于,和发生反应合成奥昔布宁时,是可逆反应,反应过程中生成乙酸甲酯,通过在左右将其蒸出来,生成物浓度减小,促进反应正向进行。
和发生反应合成奥昔布宁,奧昔布宁的结构简式为。
第14页,共15页
21世纪教育网(www.21cnjy.com)
2.2化学平衡人教版(2019)高中化学选择性必修一同步练习
学校:___________姓名:___________班级:___________考号:___________
注意事项:
1.答卷前,考生务必将自己的姓名、准考证号填写在答题卡上。
2.回答选择题时,选出每小题答案后,用铅笔把答题卡对应题目的答案标号涂黑;如需改动,用橡皮擦干净后,再选涂其他答案标号。回答非选择题时,将答案写在答题卡上,写在试卷上无效。
3.考试结束后,本试卷和答题卡一并交回。
第I卷(选择题)
一、单选题(本大题共7小题,共21.0分)
在恒容绝热的容器中投入和进行反应: 。下列说法正确的是( )
A. 该反应的
B. 容器中压强不变,表明反应达到平衡状态
C. 反应达到平衡后增加的浓度,再次平衡时的体积分数减小
D. 反应达到平衡状态后增加的量,容器内的温度会升高
在二氧化碳加氢制甲烷的反应体系中,主要发生反应的热化学方程式为:
反应Ⅰ:
反应Ⅱ:
反应Ⅲ:
向恒压、密闭容器中通入和,平衡时、、的物质的量随温度的变化如图所示。下列说法正确的是( )
A. 反应的平衡常数可表示为
B. 图中曲线表示的物质的量随温度的变化
C. 提高转化为的转化率,需要研发在低温区高效的催化剂
D. 的
一定温度下,密闭容器中进行反应:。测得随反应时间的变化如图所示。下列有关说法正确的是。( )
A. 时改变的条件:只加入一定量的
B. 、、时刻对应的平衡常数不相同
C. 时平衡混合气的大于时平衡混合气的
D. 时平衡混合气中的体积分数等于时平衡混合气中的体积分数
的分解反应为。某科研小组研究反应体系达到平衡后改变外界条件,各物质的浓度在不同条件下的变化状况,结果如图所示。下列有关判断不正确的是( )
A. 第时,改变的反应条件是升高温度
B. 第时,
C. 第时的化学平衡常数
D. 第未标出的浓度变化曲线
、分别与反应均能制得粮食熏蒸剂,反应如下:
反应:十平衡常数
反应Ⅱ:平衡常数
已知:在相同条件下,Ⅰ,Ⅱ,。向两个容积相同的密闭容器中按表投料不参与反应,在催化剂作用下分别发生上述反应,在相同的时间内的物质的量随温度的变化关系如图中实线所示。图中虚线、表示两反应的平衡曲线。
反应Ⅰ 反应Ⅱ
起始投料
起始物质的量
下列有关说法正确的是( )
A. ,曲线为反应Ⅱ的平衡曲线
B. 时,平衡常数
C. 相同条件下,延长反应时间能使反应体系中点的量达到点
D. 恒温恒容下,向 点表示的反应体系中增大的物质的量,能提高的转化率
高温下,某反应达到平衡,平衡常数,恒容时,温度升高,浓度减小。下列说法正确的是( )
A. 该反应的焓变为正值
B. 恒温恒容下,增大压强,浓度一定减小
C. 升高温度,逆反应速率减小
D. 该反应的化学方程式为
溶液与溶液发生反应:,达到平衡。下列说法不正确的是( )
A. 加入苯,振荡,平衡正向移动
B. 经苯次萃取分离后,在水溶液中加入,溶液呈红色,表明该化学反应存在限度
C. 加入固体,平衡逆向移动
D. 该反应的平衡常数
第II卷(非选择题)
二、流程题(本大题共1小题,共8.0分)
以硅藻土为载体的五氧化二钒是接触法生产硫酸的催化剂。从废钒催化剂中回收既避免污染环境又有利于资源综合利用。废钒催化剂的主要成分为:
物质
质量分数
以下是一种废钒催化剂回收工艺路线:
回答下列问题:
“酸浸”时转化为,反应的离子方程式为________,同时转化成。“废渣”的主要成分是________。
“中和”作用之一是使钒以形式存在于溶液中。“废渣”中含有________。
“离子交换”和“洗脱”可简单表示为:强碱性阴离子交换树脂。为了提高洗脱效率,淋洗液应该呈________性填“酸”“碱”或“中”。
“流出液”中阳离子最多的是________。
“沉钒”得到偏钒酸铵沉淀,写出“煅烧”中发生反应的化学方程式________。
三、实验题(本大题共1小题,共10.0分)
化学反应原理研究物质转化过程中的规律并在生产生活中有广泛的应用。
汽车排气管内的催化转化器可实现尾气无毒处理。
已知:
则:
反应的______。
在时,将 、 通入固定容积的密闭容器中,后,反应达平衡,测得的浓度为,则的转化率______,反应平衡常数______保留两位有效数字。
若改变下列条件之一,达新平衡时的体积分数一定减小的是______填序号。
增加的量 加入催化剂 降低温度 扩大容器体积
某实验小组在研究“反应条件对化学平衡的影响”时做了如下两个实验。
探究浓度对平衡的影响
已知四氯合钴Ⅱ离子蓝色与六水合钴Ⅱ离子粉红色之间存在如下平衡:。甲同学向某已呈现紫色的氯化钴溶液中通入,发现溶液变为______色;乙同学向溶液中加水,平衡移动方向为______填“向右”、“向左”或“不移动”,说明原因______。
运用数字化实验探究压强对平衡的影响
将一收集满干燥的注射器与色度计、电脑连接,推压活塞可得到如下实验曲线。
由图可知:增大压强,该混合气体的颜色变化为______。
四、简答题(本大题共2小题,共16.0分)
二氧化碳催化加氢制甲醇,有利于减少温室气体二氧化碳。二氧化碳加氢制甲醇的总反应可表示为:
合成总反应在起始物时,在不同条件下达到平衡,设体系中甲醇的物质的量分数为,在下的、在下的如图所示。
用各物质的平衡分压表示总反应的平衡常数,表达式________________;
图中对应等压过程的曲线是________,判断的理由是________________________;
当时,的平衡转化率________,反应条件可能为________或________。
探究的合成反应平衡的影响因素,有利于提高的产率。以、为原料合成涉及的主要反应如下:
Ⅰ
Ⅱ
已知反应Ⅱ逆反应活化能为,则反应Ⅱ的正反应活化能为_____________。
在一装有压强传感器的恒温恒容密闭容器中,加入足量的和一定量的,发生上述反应,测得压强变化如下表:
时间
压强
随着反应的进行,压强变化越来越慢,原因是________________________________________。
反应达平衡后,____________,已知该温度下,反应压强平衡常数,则反应Ⅱ压强平衡常数Ⅱ_____________。
不同压强下,投入足量和一定量,实验测定的平衡转化率和的平衡产率随温度的变化关系如图所示。
其中纵坐标表示的平衡转化率的是图_________填“甲”或“乙”;压强、、由大到小的顺序为__________________;图乙中温度时,三条曲线几乎交于一点的原因是_______________
五、推断题(本大题共1小题,共10.0分)
奥昔布宁是具有解痉和抗胆碱作用的药物。其合成路线如图:
已知:
是芳香族化合物,分子中含氧官能团是________。
的反应类型是________。
的结构简式是________。
的化学方程式是_____________________。
已知:、和奥昔布宁的沸点均高于,和发生反应合成奥昔布宁时,通过在左右蒸出________填物质名称来促进反应。
奥昔布宁的结构简式是________。
答案和解析
1.【答案】
【解析】A.固体的浓度为常数,不能列入的表达式中,该反应的,A错误;
B.该反应中是固体,反应前后气体分子数不变,混合气体总物质的量始终不变,反应正向进行,在恒容绝热容器中放出热量,建立平衡的过程中温度逐渐升高,压强逐渐增大,容器中压强不变时表明反应达到平衡状态,B正确;
C.增加的浓度,平衡逆向移动,但只是减弱这种改变,再次平衡时的体积分数仍增大,故C错误;
D.由于是固体,反应达到平衡状态后增加的量,平衡不移动,对容器内的温度无影响,故D错误。
2.【答案】
【解析】化学平衡常数是生成物浓度幂之积与反应物浓度幂之积的比值,反应Ⅰ的平衡常数,A错误;
反应物的量逐渐减小,故图中曲线表示的物质的量变化曲线,由反应Ⅱ和Ⅲ可知,温度升高反应Ⅱ正向移动,反应Ⅲ逆向移动,的物质的量增大,故曲线为的物质的量变化曲线,则曲线为的物质的量变化曲线,B错误;
反应Ⅰ为放热反应,反应Ⅱ为吸热反应,降低温度有利于反应Ⅰ正向移动、反应Ⅱ逆向移动,即可提高转化为的转化率,所以需要研发在低温区高效的催化剂,C正确;
反应Ⅱ反应Ⅲ得到目标反应,则的,D错误。
3.【答案】
【解析】时,突然增大,且达到平衡后速率恢复至原来的速率,如果只加入一定量的,达到新的平衡后,速率大于原来的速率,项错误;平衡常数只与温度有关,一定温度下,值不变,项错误;平衡状态相同,各物质的百分含量相同,平均摩尔质量相同,故C项错误,项正确。
4.【答案】
【解析】A.从题图可以看出,第瞬间各物质浓度不变,则改变的条件不可能为压强、浓度,随后、浓度逐渐增大,浓度逐渐减小,说明改变条件后平衡向正反应方向移动,因为该反应的正反应为吸热反应,所以第时,改变的反应条件是升高温度,项正确;
B.第时,反应正向进行,,项正确;
C.由题图可知,第时的平衡浓度为,的平衡浓度为,的平衡浓度为,故该温度下的化学平衡常数,项错误;
D.从题图可以看出,第瞬间浓度不变,然后浓度逐渐增大,说明平衡右移,则反应物的浓度应呈减小趋势直至重新平衡,故题图上另一条曲线表示的浓度变化曲线,第时减小了的浓度,造成平衡右移,第末标出的浓度变化曲线,项正确。
5.【答案】
【解析】 已知相同条件下,反应Ⅰ速率比反应Ⅱ快,、表示两反应的平衡曲线,从题图可知,曲线的生成物的物质的量大,则曲线、表示反应Ⅰ,曲线、表示反应Ⅱ,、均随温度的升高生成物的物质的量减小,则反应Ⅰ、Ⅱ均为放热反应,A错误;时,反应Ⅰ、Ⅱ的初始量相同,平衡时反应Ⅰ的生成物的物质的量大,容器的容积相同,则反应Ⅰ中生成物的浓度大于反应Ⅱ中的,平衡常数,B正确;曲线反应未达到平衡状态,相同条件下,延长反应时间能使反应体系中点的量达到点,C错误;恒温恒容下,向点表示的反应体系中增大的物质的量,对反应体系中各物质的浓度无影响,不能提高的转化率,D错误。
6.【答案】
【解析】A.升高温度平衡正向移动,焓变为正值,故A正确;
B.恒温恒容下,充入惰性气体,增大压强,浓度不变,故B错误;
C.升高温度,逆反应速率增大,故C错误;
D.为生成物浓度幂之积与反应物浓度幂之积的比,则反应为,故D错误;
故选:。
7.【答案】
【解析】对,加入苯,振荡,苯将萃取到苯层,水溶液中减小,平衡正向移动;
对,将 溶液与 溶液混合,参与反应的与物质的量之比为,反应后过量,经苯次萃取分离后,在水溶液中加入,溶液呈红色,说明水溶液中仍含有,即没有完全消耗,表明该化学反应存在限度;
对,加入固体,溶于水电离出,增大,平衡逆向移动;
错,该反应的平衡常数。
故选:。
8.【答案】;
和
碱
【解析】反应过程中的化合价不变,所以是复分解反应。注意在离子方程式中不能拆开;废钒催化剂中,只有二氧化硅不溶于硫酸,成为废渣的主要成分。 中和时,、分别转化为难溶的和,成为废渣的主要成分。
为提高洗脱效率,需要使题中所述平衡逆向移动。根据平衡移动原理,碱性越强越有利于平衡逆向移动,所以淋洗液应该呈碱性。
经过“离子交换”,钒以形式存在,而铁、铝则在“中和”过程中转化为沉淀,所以“流出液”中最多的阳离子是钾离子。
由转化为,的化合价未发生变化,该反应为非氧化还原反应,所以该化学方程式为
9.【答案】;;;;
蓝;向右;向溶液加水稀释时,溶液中离子浓度均成比例减少,;先变深后变浅,但比原来颜色深
【解析】
【分析】
本题考查了热化学方程式书写、化学平衡常数的计算应用、影响化学平衡因素分析判断,掌握基础是解题关键,题目难度中等。
【解答】
已知:Ⅰ、
Ⅱ、
Ⅲ、
盖斯定律计算:ⅢⅡⅠ得到反应:,
得到:,
故答案为:;
在时,将、通入固定容积的密闭容器中,后,反应达平衡,测得的浓度为,
起始量
变化量
平衡量
则的转化率,
平衡常数,
故答案为:;;
若改变下列条件之一,达新平衡时的体积分数一定减小,说明改变条件平衡正向进行,
增加的量,平衡正向进行,体积分数减小,故正确;
加入催化剂改变反应速率不改变化学平衡,体积分数不变,故错误;
反应为放热反应,降低温度,平衡正向进行,体积分数减小,故正确;
扩大容器体积,压强减小,平衡逆向进行,体积分数增大,故错误;
故答案为:;
已知四氯合钴Ⅱ离子蓝色与六水合钴Ⅱ离子粉红色之间存在如下平衡:。甲同学向某已呈现紫色的氯化钴溶液中通入,氯离子浓度增大,平衡逆向进行,溶液显蓝色,加水平衡向右进行,溶液显粉红色,向溶液加水稀释时,溶液中离子浓度均成比例减少,,
故答案为:蓝;向右;向溶液加水稀释时,溶液中离子浓度均成比例减少,;
容器中存在化学平衡,增大压强,体积缩小,二氧化氮浓度增大,气体颜色变深,压强增大平衡向气体体积减小的方向进行,但由透过率曲线可知平衡时颜色仍比原来深,则增大压强,该混合气体的颜色变化为:先变深后变浅,但比原来颜色深,
故答案为:先变深后变浅,但比原来颜色深。
10.【答案】
;总反应,升高温度时平衡向逆反应方向移动,甲醇的物质的量分数减小
; ,; ,
【解析】略
11.【答案】
随着反应进行,下降,反应Ⅰ速率下降,压强变化减慢
甲 该温度下,以反应Ⅱ为主,压强对反应Ⅱ没有影响
【解析】解题思路 反应Ⅱ的正反应的活化能逆反应的活化能,故正反应的活化能逆反应的活化能。
和发生反应Ⅰ和Ⅱ,由题表知总压强变化了,对于反应Ⅰ:
起始量
转化量
对于反应Ⅱ:
起始量
转化量
反应Ⅱ的发生并不能引起压强的变化,则压强改变全部由反应Ⅰ引起 ,反应达平衡后, ,则Ⅰ ,解得,Ⅱ 。
反应Ⅰ为吸热反应,升高温度,平衡正向移动,的平衡转化率升高,故表示的平衡转化率的为图甲;反应Ⅰ为气体体积增大的反应,反应Ⅱ的气体体积不变,增大压强,反应Ⅰ平衡逆向移动,反应Ⅱ平衡不移动,则的平衡产率降低,故压强:;题图乙中温度为时,三条曲线交于一点,说明该温度下以反应Ⅱ为主,反应Ⅱ反应前后气体分子数相等,压强对反应Ⅱ没有影响。
12.【答案】酚羟基
取代反应
乙酸甲酯
【解析】是芳香族化合物,分子式为,为苯酚,结构简式为,苯酚和氢气发生加成反应制得,为环己醇,结构简式为,环己醇可以和氯化氢在加热的条件下反应生成,为,由信息可知,可以和、乙醚反应制得,为,和生成,根据的结构简式可知,的结构简式为,与浓硫酸和试剂在加热的条件下反应制得,且的分子式为,可得的结构简式为;由的结构简式逆推可知的结构简式为。
是芳香族化合物,分子式为,为苯酚,结构简式为,分子中含氧官能团是酚羟基。
环己醇可以和氯化氢在加热的条件下反应生成,的反应类型是取代反应。
由上述分析可知,的结构简式为
是与乙酸在浓硫酸、加热条件下发生酯化反应制得,反应的化学方程式是。
、和奥昔布宁的沸点均高于,和发生反应合成奥昔布宁时,是可逆反应,反应过程中生成乙酸甲酯,通过在左右将其蒸出来,生成物浓度减小,促进反应正向进行。
和发生反应合成奥昔布宁,奧昔布宁的结构简式为。
第14页,共15页
21世纪教育网(www.21cnjy.com)
