2022-2023学年人教版2019高中化学必修1 第一章 物质及其变化 第三节 第1课时 氧化还原反应 课件(69张PPT)
文档属性
| 名称 | 2022-2023学年人教版2019高中化学必修1 第一章 物质及其变化 第三节 第1课时 氧化还原反应 课件(69张PPT) |

|
|
| 格式 | pptx | ||
| 文件大小 | 1.8MB | ||
| 资源类型 | 教案 | ||
| 版本资源 | 人教版(2019) | ||
| 科目 | 化学 | ||
| 更新时间 | 2022-07-22 00:00:00 | ||
图片预览










文档简介
(共69张PPT)
第1课时
DIYIKESHI
多角度认识氧化还原反应 /氧化还原反应中电子转移的表示方法 / 随堂演练 知识落实 / 课时对点练
氧化还原反应
第一章
核心素养
发展目标
1.从化合价变化和电子转移的角度认识并判断氧化还原反应。
2.能从宏观和微观相结合的角度理解氧化还原反应与四种基本反应类型的关系。
3.认识元素在物质中可以具有不同价态,可通过氧化还原反应实现含有不同价态同种元素的物质的相互转化。
内容索引
一、多角度认识氧化还原反应
二、氧化还原反应中电子转移的表示方法
随堂演练 知识落实
课时对点练
多角度认识氧化还原反应
一
1.从得失氧的角度认识氧化还原反应
(1)氧化铜 氧,发生 反应,被碳 。
(2)碳 氧,发生 反应,被氧化铜 。
(3)结论:在化学反应中,一种物质得到氧发生 反应,必然有一种物质失去氧发生 反应。氧化反应和还原反应是在一个反应中同时发生的,这样的反应称为氧化还原反应。
失去
还原
还原
得到
氧化
氧化
氧化
还原
2.从元素化合价变化的角度认识氧化还原反应
①铜元素化合价 ,发生 反应。
②碳元素化合价 ,发生 反应。
(2)对于无氧得失的反应Fe+CuSO4===FeSO4+Cu
①铜元素化合价 ,发生 反应。
②铁元素化合价 ,发生 反应。
降低
还原
升高
氧化
降低
还原
升高
氧化
(3)结论:①反应前后有元素化合价变化(升降)的反应称为氧化还原反应。
②物质所含元素化合价 的反应是氧化反应,物质所含元素化合价 的反应是还原反应。
③氧化还原反应的特征:反应前后有元素 的变化(升降)。
升高
降低
化合价
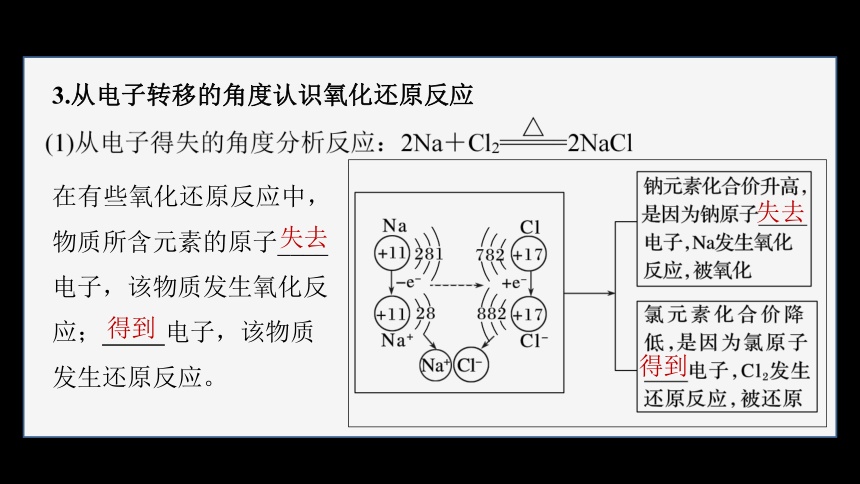
3.从电子转移的角度认识氧化还原反应
在有些氧化还原反应中,物质所含元素的原子____
电子,该物质发生氧化反应; 电子,该物质发生还原反应。
失去
得到
失去
得到
偏离
偏向
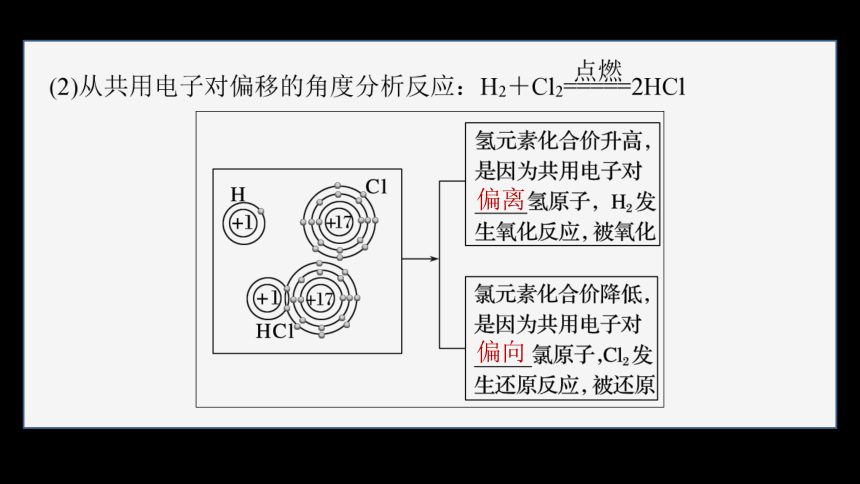
在有些氧化还原反应中,元素的原子间有共用电子对的偏移(偏离和偏向)。
共用电子对 的物质发生氧化反应,共用电子对 的物质发生还原反应。
偏离
偏向
(3)结论:①有电子转移(电子得失或共用电子对偏移)的反应是氧化还原反应。
②元素的原子失去电子(或电子对偏离),则元素的化合价 ,物质被 ,发生 反应;元素的原子得到电子(或电子对偏向),则元素的化合价 ,物质被 ,发生 反应。
③氧化还原反应的本质是 。
升高
氧化
氧化
降低
还原
还原
电子转移
(1)氧化还原反应中一定有氧元素的得失( )
(2)氧化还原反应中得电子的物质发生还原反应( )
(3)氧化还原反应中所有元素的化合价都一定发生变化( )
(4)氧化还原反应中一种元素的化合价升高,必定另一种元素的化合价降低( )
(5)氧化还原反应中得失电子总数一定相等( )
×
√
×
√
正误判断
×
1.化学反应按照不同的分类方法,可以分为化合反应、分解反应、置换反应、复分解反应,也可以分为氧化还原反应和非氧化还原反应。回答下列问题:
深度思考
(1)既是氧化还原反应又是化合反应的为___(填序号,下同)。
(2)属于非氧化还原反应的为________。
(3)不属于四种基本反应类型的为____。
(4)属于置换反应的为____。
深度思考
①
②⑤⑥
⑦
③
2.有单质参加的反应一定是氧化还原反应吗?试举例说明。
深度思考
归纳总结
氧化还原反应与四种基本反应类型之间的关系
3.完成下列填空:
深度思考
(3)2H2S+SO2===3S↓+2H2O中被还原的物质是_____,被氧化的物质是______,被氧化的元素是____,被还原的元素是___。
C
H
O Cl
S
SO2
H2S
S
深度思考
Mn
HCl
MnO2
Cl
返回
氧化还原反应中电子转移的表示方法
二
1.双线桥法
表示反应前后 由反应物转化为生成物时电子转移的情况。
(1)基本步骤
同一元素
(2)注意事项
①箭头、箭尾必须对应化合价变化的同种元素的原子;
②必须注明“得到”或“失去”;
③电子转移数用a×be-形式表示,a表示发生氧化反应或还原反应的原子个数,b表示每个原子得到或失去的电子数,当a=1或b=1时,要省略;
④被还原的物质和被氧化的物质得失电子数守恒。
2.单线桥法
(1)表示反应过程中 原子间的电子转移情况,用箭头标明
的方向。
(2)单线桥表示法的特点
①箭头由反应物中 原子指向 原子,箭头的指向即电子转移的方向。
不同元素
电子转移
失电子元素
得电子元素
② 标明“得到”或“失去”,只标明电子转移 。
如氧化铁与氢气的反应用单线桥表示电子转移的数目如下:
不需要
数目
应用体验
1.下列化学方程式中,表示电子转移的方向和数目都正确的是
√
2.标出变价元素的化合价,用双线桥标出电子转移情况,其中④同时用单线桥标出电子转移情况。
答案
答案
③Cl2+2NaOH===NaCl+NaClO+H2O
答案
④2H2S+SO2===3S↓+2H2O
答案
返回
随堂演练 知识落实
1.(2022·贵州黔东南高一检测)诗词是中华民族的文化瑰宝。下列诗词中不涉及氧化还原反应的是
A.爆竹声中一岁除 B.吹尽狂沙始到金
C.野火烧不尽 D.蜡炬成灰泪始干
√
1
2
3
4
爆竹声中一岁除,涉及元素化合价变化,属于氧化还原反应,A错误;
吹尽狂沙始到金,为物理法淘金,不涉及氧化还原反应,B正确;
野火烧不尽,蜡炬成灰泪始干,存在燃烧现象,燃烧属于氧化还原反应,C、D错误。
2.(2021·四川绵阳江油中学高一月考)下列反应属于氧化还原反应的是
A.SO3+H2O===H2SO4
B.NH4Cl NH3↑+HCl↑
C.Fe+2HCl===FeCl2+H2↑
D.NaOH+HNO3===NaNO3+H2O
1
2
3
4
√
反应SO3+H2O===H2SO4中,各元素化合价不变,不属于氧化还原反应,故A不选;
在反应NH4Cl NH3↑+HCl↑中,各元素化合价不变,不属于氧化还原反应,故B不选;
反应Fe+2HCl===FeCl2+H2↑中,Fe元素化合价由0价升高到+2价、氢元素化合价由+1价降低到0价,有电子转移,属于氧化还原反应,故C选;
反应NaOH+HNO3===NaNO3+H2O中,各元素化合价不变,不属于氧化还原反应,故D不选
1
2
3
4
3.氧化还原反应与四种基本反应类型的关系如图所示,下列化学反应属于阴影区域的是
1
2
3
4
√
1
2
3
4
阴影区域的反应必须属于氧化还原反应,且
不属于化合、分解、置换反应。
A项,该反应既属于分解反应,又属于氧化
还原反应;
B项,该反应属于分解反应,不属于氧化还原
反应;
C项,该反应既属于化合反应,又属于氧化还原反应;
D项,该反应属于氧化还原反应,但不属于化合、分解、置换反应中的任意一种,故属于阴影区域。
4.完成下列填空。
(1)3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O
①被氧化的元素是____(填元素符号,下同),被还原的元素是___。
②发生氧化反应的物质是____(填化学式,下同),发生还原反应的物质是______。
③用单线桥表示反应电子得失的方向和数目:______________________
_________________________。
1
2
3
4
Cu
N
HNO3
Cu
3Cu(NO3)2+2NO↑+4H2O
①碳元素被_____,硫元素被_____,氮元素被_____,氧元素既没被氧化也没被还原。
②发生氧化反应的物质是___,发生还原反应的物质是__________。
1
2
3
4
氧化
还原
S和KNO3
C
还原
返回
课时对点练
题组一 氧化还原反应的概念及判断
1.下列说法正确的是
A.有电子转移是氧化还原反应的实质,有元素化合价的变化是氧化还原反应
的外观表现
B.一种物质被氧化,必然有另一种物质被还原
C.被氧化的物质得到电子或电子对偏向,被还原的物质失去电子或电子对偏离
D.氧化反应就是得到电子或电子对偏向的反应,还原反应就是失去电子或电
子对偏离的反应
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
氧化还原反应的发生,是发生电子转移的结果,有电子转移,元素的化合价就发生了变化;被氧化和被还原的物质可能是同一种物质;一种物质得到电子或电子对偏向,这种物质就被还原或者说发生了还原反应,其中某种元素的化合价就会降低;一种物质失去电子或电子对偏离,这种物质就被氧化或者说发生了氧化反应,其中某种元素的化合价就会升高。
2.(2022·厦门高一检测)下列铜及其化合物的性质实验中,涉及到的反应不属于氧化还原反应的是
A.铜丝在空气中加热
B.用氢气还原氧化铜
C.将铁丝插入CuSO4溶液中
D.向CuSO4溶液中滴加NaOH溶液
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
铜丝在空气中加热与氧气反应生成氧化铜,反应前后有元素化合价的变化,属于氧化还原反应,故A不符合题意;
用氢气还原氧化铜为加热条件下氢气与氧化铜反应生成铜和水,反应前后有元素化合价的变化,属于氧化还原反应,故B不符合题意;
将铁丝插入硫酸铜溶液中,铁与硫酸铜溶液反应生成硫酸亚铁和铜,反应前后有元素化合价的变化,属于氧化还原反应,故C不符合题意;
向硫酸铜溶液中滴加氢氧化钠溶液,硫酸铜与氢氧化钠反应生成氢氧化铜沉淀和硫酸钠,反应前后没有元素化合价的变化,不属于氧化还原反应,故D符合题意。
3.从元素化合价变化的角度分析,下列反应中,画线的物质发生氧化反应的是
A.SO2+2NaOH===Na2SO3 +H2O B.2CuO+C 2Cu +CO2↑
C.2FeCl3+Fe===3FeCl2 D.Zn+2HCl===ZnCl2+H2↑
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
该反应不是氧化还原反应,A错误;
CuO―→Cu,铜元素由+2价降低到0价,发生还原反应,B错误;
Fe―→FeCl2,铁元素由0价升高到+2价,发生氧化反应,C正确;
HCl―→H2,氢元素由+1价降低到0价,发生还原反应,D错误。
4.(2022·安庆高一检测)2021年6月17日,搭载神舟十二号载人飞船的长征二号F遥十二运载火箭,在酒泉卫星发射中心点火发射,火箭的第一、二级发动机中使用的燃料是偏二甲肼(C2H8N2中氮元素的化合价为-2价)和四氧化二氮(N2O4),燃烧时发生反应的化学方程式为C2H8N2+2N2O4===2CO2↑+3N2↑+4H2O。有关该反应的说法正确的是
A.该反应是分解反应 B.该反应是非氧化还原反应
C.N2O4发生还原反应 D.反应中碳元素的化合价降低
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
由化学方程式可知,该反应的反应物为偏二甲肼和四氧化二氮,不是分解反应,故A错误;
反应中有元素化合价变化,属于氧化还原反应,故B错误;
四氧化二氮中氮元素的化合价降低,被还原,故C正确;
偏二甲肼中碳元素和氮元素的化合价升高,被氧化,故D错误。
5.(2021·南京中华中学高一月考)反应2Al+MoO3 Mo+Al2O3可用于制备金属钼(Mo)。下列关于该反应的说法正确的是
A.Al被还原 B.Mo被氧化
C.Al失去电子 D.MoO3发生氧化反应
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
6.下列变化过程一定属于还原反应的是
A.HCl→MgCl2 B.Na→Na+
C.CO→CO2 D.Fe3+→Fe2+
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
A项中氯元素化合价未变;
B项中钠元素的化合价升高,属于氧化反应;
C项中碳元素的化合价升高,属于氧化反应;
D项中铁元素的化合价降低,属于还原反应。
题组二 氧化还原反应与四种基本反应类型的关系
7.下列反应中,不属于四种基本反应类型,但属于氧化还原反应的是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
A项是置换反应,不符合题意;
B项不属于四种基本反应类型,但属于氧化还原反应,符合题意;
C项是分解反应,不符合题意;
D项是复分解反应,不符合题意。
8.人们常用图示的方法表示不同反应类型之间的关系,如分解反应和氧化还原反应的关系可用图甲表示,图乙表示离子反应、氧化还原反应和置换反应三者之间的关系,则C表示
A.离子反应
B.氧化还原反应
C.置换反应
D.三者中的任一反应
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
置换反应全部属于氧化还原反应,部分属于离子反应,图乙中A表示氧化还原反应,B表示置换反应,C表示离子反应。
题组三 氧化还原反应中的电子转移
9.下列氧化还原反应中电子转移数目及方向都正确的是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
A项,Cl得到电子,O失去电子,该反应转移12e-,图中电子转移数目不正确,错误;
B项,Fe得到电子,I失去电子,该反应转移2e-,正确;
C项,F得到电子,O失去电子,该反应转移4e-,图中箭头的方向标反,错误;
D项,Br得到电子,S失去电子,该反应转移2e-,图中箭头的方向标反,错误。
10.(2022·无锡高一检测)下列化学反应中电子转移的表示方法正确的是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
H元素失电子,Cu元素得电子,应是 ,A错误;
I元素失电子,Br元素得电子,B正确;
Na元素失电子,S元素得电子,应是 ,C错误;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
该双线桥未标出电子的得或失,应是 ,D错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
11.下列科技成果所涉及物质的应用过程中,发生的不是氧化还原反应的是
A.“熬胆矾铁釜,久之亦化为铜”,该过程中发生的反应
B.偏二甲肼用作发射“天宫”二号的火箭燃料,在发射过程中的反应
C.“青蒿一握,以水二升渍,绞取汁”中体现屠呦呦对青蒿素的提取
过程中的反应
D.开采可燃冰,将其作为能源使用过程中的反应
√
C项中描述的提取青蒿素的过程,属于物理变化,不是氧化还原反应。
12.下列化学反应中溴元素仅被氧化的是
A.2NaBr+Cl2===2NaCl+Br2
B.Br2+2NaI===2NaBr+I2
C.3Br2+6NaOH 5NaBr+NaBrO3+3H2O
D.HBr+NaOH===NaBr+H2O
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
溴化钠中溴元素化合价升高,被氧化,选项A符合题意;
溴单质中溴元素化合价降低,被还原,选项B不符合题意;
溴单质既被氧化生成溴酸钠,又被还原生成溴化钠,选项C不符合题意;
反应属于中和反应,各元素化合价不变,不属于氧化还原反应,选项D不符合题意。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
13.化学实验中若使某步中的有害生成物作为另一步的反应物,形成一个循环,则可不再向环境排放该种有害物质。在如图所示有编号的反应中,属于氧化还原反应的有
A.3个 B.4个
C.5个 D.6个
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
Na2Cr2O7中Cr显+6价,CrCl3中Cr显+3价,Cr的化合价降低,反应①属于氧化还原反应;
CrCl3和Cr(OH)3中Cr的化合价都显+3价,化合价没有发生变化,反应②不属于氧化还原反应;
Cr(OH)3和NaCrO2中Cr的化合价都显+3价,没有化合价的改变,反应③不属于氧化还原反应;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
CrCl3中Cr显+3价,Na2CrO4中Cr显+6价,化合价发生改变,反应④属于氧化还原反应;
Na2Cr2O7和Na2CrO4中Cr的化合价都是+6价,没有化合价的变化,反应⑤不属于氧化还原反应;
Na2CrO4中Cr显+6价,NaCrO2中Cr显+3价,化合价降低,反应⑥属于氧化还原反应,因此属于氧化还原反应的是①④⑥,故选项A正确。
14.(2021·新疆师范大学附属中学高一阶段检测)歌曲《青花瓷》中唱到“帘外芭蕉惹骤雨,门环惹铜绿”,其中“铜绿”的化学成分是碱式碳酸铜。铜在潮湿的空气中生锈的化学反应:2Cu+O2+CO2+H2O===
Cu2(OH)2CO3。下列有关该反应说法不正确的是
A.该反应是氧化还原反应,发生化合价变化的有两种元素
B.O2得电子,发生的是还原反应
C.铜的化合价升高,被氧化
D.碱式碳酸铜中铜元素的化合价是+1价
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
在该反应中,铜元素的化合价从0价升高到+2价,氧元素的化合价从0价降低到-2价,碳元素和氢元素的化合价没有发生变化,发生化合价变化的有两种元素,故A正确;
氧气中氧元素的化合价从0价降低到-2价,得到电子,发生还原反应,故B正确;
铜的化合价升高,被氧化,故C正确;
碱式碳酸铜中铜元素的化合价为+2价,故D错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
15.我国近代炼丹家、医学家葛洪所著《抱朴子》一书中记载有“丹砂烧之成水银,积变又还成丹砂”。这句话所涉及的反应有:①HgS+O2===Hg+SO2;②Hg+S===HgS。下列有关说法错误的是
A.反应①②均为氧化还原反应
B.反应①中Hg、O两种元素被还原
C.反应①中每生成1个SO2分子转移4个电子
D.反应②中Hg元素被氧化、S元素被还原
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
①中氧气中氧元素的化合价降低,HgS中S元素的化合价升高,Hg元素的化合价降低,因此①属于氧化还原反应,②中Hg元素的化合价升高,S元素的化合价降低,②属于氧化还原反应,故A、B说法正确;
反应①中HgS中Hg的化合价由+2→0,化合价降低2,S的化合价由-2→+4,化合价升高6,O2中氧元素化合价由0→-2,化合价降低4,因此每生成1个SO2分子转移6个电子,故C说法错误;
反应②中Hg的化合价由0→+2,化合价升高,被氧化,S的化合价由0→-2,化合价降低,被还原,故D说法正确。
16.二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂,而且与Cl2相比不会产生对人体有潜在危害的有机氯代物。下列两种方法可制备ClO2:
方法一:2NaClO3+4HCl===2ClO2↑+Cl2↑+2NaCl+2H2O
方法二:2NaClO3+H2O2+H2SO4===2ClO2↑+O2↑+Na2SO4+2H2O
(1)方法一的离子方程式:__________________________________________;
其中被氧化的氯元素与被还原的氯元素的个数比为______。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
1∶1
(2)方法二中被氧化的物质是_______(填化学式,下同);发生还原反应的物质是________。若反应中消耗2个硫酸,则反应中转移的电子数为____。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
4
H2O2
NaClO3
返回
第一章
本课结束
第1课时
DIYIKESHI
多角度认识氧化还原反应 /氧化还原反应中电子转移的表示方法 / 随堂演练 知识落实 / 课时对点练
氧化还原反应
第一章
核心素养
发展目标
1.从化合价变化和电子转移的角度认识并判断氧化还原反应。
2.能从宏观和微观相结合的角度理解氧化还原反应与四种基本反应类型的关系。
3.认识元素在物质中可以具有不同价态,可通过氧化还原反应实现含有不同价态同种元素的物质的相互转化。
内容索引
一、多角度认识氧化还原反应
二、氧化还原反应中电子转移的表示方法
随堂演练 知识落实
课时对点练
多角度认识氧化还原反应
一
1.从得失氧的角度认识氧化还原反应
(1)氧化铜 氧,发生 反应,被碳 。
(2)碳 氧,发生 反应,被氧化铜 。
(3)结论:在化学反应中,一种物质得到氧发生 反应,必然有一种物质失去氧发生 反应。氧化反应和还原反应是在一个反应中同时发生的,这样的反应称为氧化还原反应。
失去
还原
还原
得到
氧化
氧化
氧化
还原
2.从元素化合价变化的角度认识氧化还原反应
①铜元素化合价 ,发生 反应。
②碳元素化合价 ,发生 反应。
(2)对于无氧得失的反应Fe+CuSO4===FeSO4+Cu
①铜元素化合价 ,发生 反应。
②铁元素化合价 ,发生 反应。
降低
还原
升高
氧化
降低
还原
升高
氧化
(3)结论:①反应前后有元素化合价变化(升降)的反应称为氧化还原反应。
②物质所含元素化合价 的反应是氧化反应,物质所含元素化合价 的反应是还原反应。
③氧化还原反应的特征:反应前后有元素 的变化(升降)。
升高
降低
化合价
3.从电子转移的角度认识氧化还原反应
在有些氧化还原反应中,物质所含元素的原子____
电子,该物质发生氧化反应; 电子,该物质发生还原反应。
失去
得到
失去
得到
偏离
偏向
在有些氧化还原反应中,元素的原子间有共用电子对的偏移(偏离和偏向)。
共用电子对 的物质发生氧化反应,共用电子对 的物质发生还原反应。
偏离
偏向
(3)结论:①有电子转移(电子得失或共用电子对偏移)的反应是氧化还原反应。
②元素的原子失去电子(或电子对偏离),则元素的化合价 ,物质被 ,发生 反应;元素的原子得到电子(或电子对偏向),则元素的化合价 ,物质被 ,发生 反应。
③氧化还原反应的本质是 。
升高
氧化
氧化
降低
还原
还原
电子转移
(1)氧化还原反应中一定有氧元素的得失( )
(2)氧化还原反应中得电子的物质发生还原反应( )
(3)氧化还原反应中所有元素的化合价都一定发生变化( )
(4)氧化还原反应中一种元素的化合价升高,必定另一种元素的化合价降低( )
(5)氧化还原反应中得失电子总数一定相等( )
×
√
×
√
正误判断
×
1.化学反应按照不同的分类方法,可以分为化合反应、分解反应、置换反应、复分解反应,也可以分为氧化还原反应和非氧化还原反应。回答下列问题:
深度思考
(1)既是氧化还原反应又是化合反应的为___(填序号,下同)。
(2)属于非氧化还原反应的为________。
(3)不属于四种基本反应类型的为____。
(4)属于置换反应的为____。
深度思考
①
②⑤⑥
⑦
③
2.有单质参加的反应一定是氧化还原反应吗?试举例说明。
深度思考
归纳总结
氧化还原反应与四种基本反应类型之间的关系
3.完成下列填空:
深度思考
(3)2H2S+SO2===3S↓+2H2O中被还原的物质是_____,被氧化的物质是______,被氧化的元素是____,被还原的元素是___。
C
H
O Cl
S
SO2
H2S
S
深度思考
Mn
HCl
MnO2
Cl
返回
氧化还原反应中电子转移的表示方法
二
1.双线桥法
表示反应前后 由反应物转化为生成物时电子转移的情况。
(1)基本步骤
同一元素
(2)注意事项
①箭头、箭尾必须对应化合价变化的同种元素的原子;
②必须注明“得到”或“失去”;
③电子转移数用a×be-形式表示,a表示发生氧化反应或还原反应的原子个数,b表示每个原子得到或失去的电子数,当a=1或b=1时,要省略;
④被还原的物质和被氧化的物质得失电子数守恒。
2.单线桥法
(1)表示反应过程中 原子间的电子转移情况,用箭头标明
的方向。
(2)单线桥表示法的特点
①箭头由反应物中 原子指向 原子,箭头的指向即电子转移的方向。
不同元素
电子转移
失电子元素
得电子元素
② 标明“得到”或“失去”,只标明电子转移 。
如氧化铁与氢气的反应用单线桥表示电子转移的数目如下:
不需要
数目
应用体验
1.下列化学方程式中,表示电子转移的方向和数目都正确的是
√
2.标出变价元素的化合价,用双线桥标出电子转移情况,其中④同时用单线桥标出电子转移情况。
答案
答案
③Cl2+2NaOH===NaCl+NaClO+H2O
答案
④2H2S+SO2===3S↓+2H2O
答案
返回
随堂演练 知识落实
1.(2022·贵州黔东南高一检测)诗词是中华民族的文化瑰宝。下列诗词中不涉及氧化还原反应的是
A.爆竹声中一岁除 B.吹尽狂沙始到金
C.野火烧不尽 D.蜡炬成灰泪始干
√
1
2
3
4
爆竹声中一岁除,涉及元素化合价变化,属于氧化还原反应,A错误;
吹尽狂沙始到金,为物理法淘金,不涉及氧化还原反应,B正确;
野火烧不尽,蜡炬成灰泪始干,存在燃烧现象,燃烧属于氧化还原反应,C、D错误。
2.(2021·四川绵阳江油中学高一月考)下列反应属于氧化还原反应的是
A.SO3+H2O===H2SO4
B.NH4Cl NH3↑+HCl↑
C.Fe+2HCl===FeCl2+H2↑
D.NaOH+HNO3===NaNO3+H2O
1
2
3
4
√
反应SO3+H2O===H2SO4中,各元素化合价不变,不属于氧化还原反应,故A不选;
在反应NH4Cl NH3↑+HCl↑中,各元素化合价不变,不属于氧化还原反应,故B不选;
反应Fe+2HCl===FeCl2+H2↑中,Fe元素化合价由0价升高到+2价、氢元素化合价由+1价降低到0价,有电子转移,属于氧化还原反应,故C选;
反应NaOH+HNO3===NaNO3+H2O中,各元素化合价不变,不属于氧化还原反应,故D不选
1
2
3
4
3.氧化还原反应与四种基本反应类型的关系如图所示,下列化学反应属于阴影区域的是
1
2
3
4
√
1
2
3
4
阴影区域的反应必须属于氧化还原反应,且
不属于化合、分解、置换反应。
A项,该反应既属于分解反应,又属于氧化
还原反应;
B项,该反应属于分解反应,不属于氧化还原
反应;
C项,该反应既属于化合反应,又属于氧化还原反应;
D项,该反应属于氧化还原反应,但不属于化合、分解、置换反应中的任意一种,故属于阴影区域。
4.完成下列填空。
(1)3Cu+8HNO3(稀)===3Cu(NO3)2+2NO↑+4H2O
①被氧化的元素是____(填元素符号,下同),被还原的元素是___。
②发生氧化反应的物质是____(填化学式,下同),发生还原反应的物质是______。
③用单线桥表示反应电子得失的方向和数目:______________________
_________________________。
1
2
3
4
Cu
N
HNO3
Cu
3Cu(NO3)2+2NO↑+4H2O
①碳元素被_____,硫元素被_____,氮元素被_____,氧元素既没被氧化也没被还原。
②发生氧化反应的物质是___,发生还原反应的物质是__________。
1
2
3
4
氧化
还原
S和KNO3
C
还原
返回
课时对点练
题组一 氧化还原反应的概念及判断
1.下列说法正确的是
A.有电子转移是氧化还原反应的实质,有元素化合价的变化是氧化还原反应
的外观表现
B.一种物质被氧化,必然有另一种物质被还原
C.被氧化的物质得到电子或电子对偏向,被还原的物质失去电子或电子对偏离
D.氧化反应就是得到电子或电子对偏向的反应,还原反应就是失去电子或电
子对偏离的反应
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
氧化还原反应的发生,是发生电子转移的结果,有电子转移,元素的化合价就发生了变化;被氧化和被还原的物质可能是同一种物质;一种物质得到电子或电子对偏向,这种物质就被还原或者说发生了还原反应,其中某种元素的化合价就会降低;一种物质失去电子或电子对偏离,这种物质就被氧化或者说发生了氧化反应,其中某种元素的化合价就会升高。
2.(2022·厦门高一检测)下列铜及其化合物的性质实验中,涉及到的反应不属于氧化还原反应的是
A.铜丝在空气中加热
B.用氢气还原氧化铜
C.将铁丝插入CuSO4溶液中
D.向CuSO4溶液中滴加NaOH溶液
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
铜丝在空气中加热与氧气反应生成氧化铜,反应前后有元素化合价的变化,属于氧化还原反应,故A不符合题意;
用氢气还原氧化铜为加热条件下氢气与氧化铜反应生成铜和水,反应前后有元素化合价的变化,属于氧化还原反应,故B不符合题意;
将铁丝插入硫酸铜溶液中,铁与硫酸铜溶液反应生成硫酸亚铁和铜,反应前后有元素化合价的变化,属于氧化还原反应,故C不符合题意;
向硫酸铜溶液中滴加氢氧化钠溶液,硫酸铜与氢氧化钠反应生成氢氧化铜沉淀和硫酸钠,反应前后没有元素化合价的变化,不属于氧化还原反应,故D符合题意。
3.从元素化合价变化的角度分析,下列反应中,画线的物质发生氧化反应的是
A.SO2+2NaOH===Na2SO3 +H2O B.2CuO+C 2Cu +CO2↑
C.2FeCl3+Fe===3FeCl2 D.Zn+2HCl===ZnCl2+H2↑
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
该反应不是氧化还原反应,A错误;
CuO―→Cu,铜元素由+2价降低到0价,发生还原反应,B错误;
Fe―→FeCl2,铁元素由0价升高到+2价,发生氧化反应,C正确;
HCl―→H2,氢元素由+1价降低到0价,发生还原反应,D错误。
4.(2022·安庆高一检测)2021年6月17日,搭载神舟十二号载人飞船的长征二号F遥十二运载火箭,在酒泉卫星发射中心点火发射,火箭的第一、二级发动机中使用的燃料是偏二甲肼(C2H8N2中氮元素的化合价为-2价)和四氧化二氮(N2O4),燃烧时发生反应的化学方程式为C2H8N2+2N2O4===2CO2↑+3N2↑+4H2O。有关该反应的说法正确的是
A.该反应是分解反应 B.该反应是非氧化还原反应
C.N2O4发生还原反应 D.反应中碳元素的化合价降低
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
由化学方程式可知,该反应的反应物为偏二甲肼和四氧化二氮,不是分解反应,故A错误;
反应中有元素化合价变化,属于氧化还原反应,故B错误;
四氧化二氮中氮元素的化合价降低,被还原,故C正确;
偏二甲肼中碳元素和氮元素的化合价升高,被氧化,故D错误。
5.(2021·南京中华中学高一月考)反应2Al+MoO3 Mo+Al2O3可用于制备金属钼(Mo)。下列关于该反应的说法正确的是
A.Al被还原 B.Mo被氧化
C.Al失去电子 D.MoO3发生氧化反应
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
6.下列变化过程一定属于还原反应的是
A.HCl→MgCl2 B.Na→Na+
C.CO→CO2 D.Fe3+→Fe2+
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
A项中氯元素化合价未变;
B项中钠元素的化合价升高,属于氧化反应;
C项中碳元素的化合价升高,属于氧化反应;
D项中铁元素的化合价降低,属于还原反应。
题组二 氧化还原反应与四种基本反应类型的关系
7.下列反应中,不属于四种基本反应类型,但属于氧化还原反应的是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
A项是置换反应,不符合题意;
B项不属于四种基本反应类型,但属于氧化还原反应,符合题意;
C项是分解反应,不符合题意;
D项是复分解反应,不符合题意。
8.人们常用图示的方法表示不同反应类型之间的关系,如分解反应和氧化还原反应的关系可用图甲表示,图乙表示离子反应、氧化还原反应和置换反应三者之间的关系,则C表示
A.离子反应
B.氧化还原反应
C.置换反应
D.三者中的任一反应
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
置换反应全部属于氧化还原反应,部分属于离子反应,图乙中A表示氧化还原反应,B表示置换反应,C表示离子反应。
题组三 氧化还原反应中的电子转移
9.下列氧化还原反应中电子转移数目及方向都正确的是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
A项,Cl得到电子,O失去电子,该反应转移12e-,图中电子转移数目不正确,错误;
B项,Fe得到电子,I失去电子,该反应转移2e-,正确;
C项,F得到电子,O失去电子,该反应转移4e-,图中箭头的方向标反,错误;
D项,Br得到电子,S失去电子,该反应转移2e-,图中箭头的方向标反,错误。
10.(2022·无锡高一检测)下列化学反应中电子转移的表示方法正确的是
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
H元素失电子,Cu元素得电子,应是 ,A错误;
I元素失电子,Br元素得电子,B正确;
Na元素失电子,S元素得电子,应是 ,C错误;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
该双线桥未标出电子的得或失,应是 ,D错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
11.下列科技成果所涉及物质的应用过程中,发生的不是氧化还原反应的是
A.“熬胆矾铁釜,久之亦化为铜”,该过程中发生的反应
B.偏二甲肼用作发射“天宫”二号的火箭燃料,在发射过程中的反应
C.“青蒿一握,以水二升渍,绞取汁”中体现屠呦呦对青蒿素的提取
过程中的反应
D.开采可燃冰,将其作为能源使用过程中的反应
√
C项中描述的提取青蒿素的过程,属于物理变化,不是氧化还原反应。
12.下列化学反应中溴元素仅被氧化的是
A.2NaBr+Cl2===2NaCl+Br2
B.Br2+2NaI===2NaBr+I2
C.3Br2+6NaOH 5NaBr+NaBrO3+3H2O
D.HBr+NaOH===NaBr+H2O
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
溴化钠中溴元素化合价升高,被氧化,选项A符合题意;
溴单质中溴元素化合价降低,被还原,选项B不符合题意;
溴单质既被氧化生成溴酸钠,又被还原生成溴化钠,选项C不符合题意;
反应属于中和反应,各元素化合价不变,不属于氧化还原反应,选项D不符合题意。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
13.化学实验中若使某步中的有害生成物作为另一步的反应物,形成一个循环,则可不再向环境排放该种有害物质。在如图所示有编号的反应中,属于氧化还原反应的有
A.3个 B.4个
C.5个 D.6个
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
Na2Cr2O7中Cr显+6价,CrCl3中Cr显+3价,Cr的化合价降低,反应①属于氧化还原反应;
CrCl3和Cr(OH)3中Cr的化合价都显+3价,化合价没有发生变化,反应②不属于氧化还原反应;
Cr(OH)3和NaCrO2中Cr的化合价都显+3价,没有化合价的改变,反应③不属于氧化还原反应;
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
CrCl3中Cr显+3价,Na2CrO4中Cr显+6价,化合价发生改变,反应④属于氧化还原反应;
Na2Cr2O7和Na2CrO4中Cr的化合价都是+6价,没有化合价的变化,反应⑤不属于氧化还原反应;
Na2CrO4中Cr显+6价,NaCrO2中Cr显+3价,化合价降低,反应⑥属于氧化还原反应,因此属于氧化还原反应的是①④⑥,故选项A正确。
14.(2021·新疆师范大学附属中学高一阶段检测)歌曲《青花瓷》中唱到“帘外芭蕉惹骤雨,门环惹铜绿”,其中“铜绿”的化学成分是碱式碳酸铜。铜在潮湿的空气中生锈的化学反应:2Cu+O2+CO2+H2O===
Cu2(OH)2CO3。下列有关该反应说法不正确的是
A.该反应是氧化还原反应,发生化合价变化的有两种元素
B.O2得电子,发生的是还原反应
C.铜的化合价升高,被氧化
D.碱式碳酸铜中铜元素的化合价是+1价
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
在该反应中,铜元素的化合价从0价升高到+2价,氧元素的化合价从0价降低到-2价,碳元素和氢元素的化合价没有发生变化,发生化合价变化的有两种元素,故A正确;
氧气中氧元素的化合价从0价降低到-2价,得到电子,发生还原反应,故B正确;
铜的化合价升高,被氧化,故C正确;
碱式碳酸铜中铜元素的化合价为+2价,故D错误。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
15.我国近代炼丹家、医学家葛洪所著《抱朴子》一书中记载有“丹砂烧之成水银,积变又还成丹砂”。这句话所涉及的反应有:①HgS+O2===Hg+SO2;②Hg+S===HgS。下列有关说法错误的是
A.反应①②均为氧化还原反应
B.反应①中Hg、O两种元素被还原
C.反应①中每生成1个SO2分子转移4个电子
D.反应②中Hg元素被氧化、S元素被还原
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
√
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
①中氧气中氧元素的化合价降低,HgS中S元素的化合价升高,Hg元素的化合价降低,因此①属于氧化还原反应,②中Hg元素的化合价升高,S元素的化合价降低,②属于氧化还原反应,故A、B说法正确;
反应①中HgS中Hg的化合价由+2→0,化合价降低2,S的化合价由-2→+4,化合价升高6,O2中氧元素化合价由0→-2,化合价降低4,因此每生成1个SO2分子转移6个电子,故C说法错误;
反应②中Hg的化合价由0→+2,化合价升高,被氧化,S的化合价由0→-2,化合价降低,被还原,故D说法正确。
16.二氧化氯(ClO2)是一种在水处理等方面有广泛应用的高效安全消毒剂,而且与Cl2相比不会产生对人体有潜在危害的有机氯代物。下列两种方法可制备ClO2:
方法一:2NaClO3+4HCl===2ClO2↑+Cl2↑+2NaCl+2H2O
方法二:2NaClO3+H2O2+H2SO4===2ClO2↑+O2↑+Na2SO4+2H2O
(1)方法一的离子方程式:__________________________________________;
其中被氧化的氯元素与被还原的氯元素的个数比为______。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
1∶1
(2)方法二中被氧化的物质是_______(填化学式,下同);发生还原反应的物质是________。若反应中消耗2个硫酸,则反应中转移的电子数为____。
1
2
3
4
5
6
7
8
9
10
11
12
13
14
15
16
4
H2O2
NaClO3
返回
第一章
本课结束
